文章信息
- 王乐, 陈辉, 胡霞, 马超
- Wang Le, Chen Hui, Hu Xia, Ma Chao
- 秦岭细粘束孢产漆酶的培养条件
- Laccase Activity of Leptographium qinlingensis under Different Culture Conditions
- 林业科学, 2012, 48(5): 164-167.
- Scientia Silvae Sinicae, 2012, 48(5): 164-167.
-
文章历史
- 收稿日期:2010-09-07
- 修回日期:2010-11-24
-
作者相关文章
漆酶(Laccase, EC 1.10.3.2)属于蓝色氧化酶家族的一种多酚氧化酶,是重要的木质纤维(lingo-cellulose)降解酶之一(Bertrand et al., 2002)。漆酶能催化降解多种芳香族化合物特别是酚类物质(Solomon et al., 1996)。由于漆酶具有430~790 mV氧化还原电位(Shleev et al., 2003),能够将分子氧直接还原为水,在没有H2O2和其他次级代谢产物存在下,只要存在溶解氧,就可直接氧化底物(韩晓磊等,2005)。因此,漆酶广泛用于生物制浆、生物漂白、废水处理等工业过程中(曾涛等,2009)。目前在工业应用中提高酶活力、降低酶成本仍然是研究热点。研究表明担子菌等某些高等真菌能够分泌漆酶,通过真菌发酵产漆酶受到多方面因素的影响(如培养基中碳源、氮源的选择及诱导物、底物的浓度等),因此培养条件的研究变得极为重要。
秦岭细粘束孢(Leptographium qinlingensis)是华山松大小蠹(Dendroctonus armandi)成虫贮菌器携带的一种共生真菌,在华山松大小蠹入侵健康寄主华山松(Pinus armandii)时接种于树木韧皮部和木质部边材组织内,共同危害寄主树木,同时分解利用寄主树木的营养(陈辉等,2000),秦岭细粘束孢除具有胞外分泌纤维素酶、酯酶、蛋白酶和淀粉酶的能力外,还能够在寄主华山松木质素的诱导下分泌漆酶(陈辉等,2004)。
1 材料与方法 1.1 供试菌种供试菌种秦岭细粘束孢分离于秦岭火地塘林区海拔2 000~2 200 m处被华山松大小蠹危害的华山松蓝变韧皮部和木质部边材组织。
1.2 试验方法1) 培养基 (1)麦芽汁培养基(malt extract agar):2 g麦芽浸粉、琼脂20 g、蒸馏水1 000 mL,121 ℃高压湿热灭菌30 min,再按0.3%加入灭菌的浓乳酸调pH值到5.0(Kuroda, 2005),用于菌种的活化培养。(2)发酵产酶培养基:在1 L 0.01 mol·L-1、pH为5.8的HAc-NaAc缓冲液中,加入无水CaC120.1 g、KH2PO4 2 g、MgSO4.7H2O 0.5 g、葡萄糖20 g、酒石酸铵0.2 g、1 g·L-1的VB1 1 mL、微量元素混合液10 mL(Arora et al., 2000)。(3)微量元素混合液: MnSO4 0.37 g·L-1、NaCl 1 g·L-1、ZnSO4 0.178 g·L-1、FeSO4·7H2O 0.1 g·L-1、CuSO4·5H2O 10 mg·L-1、KAl(SO4)2·12H2O 18.36 mg·L-1、HBO3 10 mg·L-1、COC12·6H2O 0.154 g·L-1、Na2MoO4·2H2O 11.75 mg·L-1(Arora et al., 2000)。
2) 发酵产酶 250 mL三角瓶中分别装入各试验用的培养基50 mL,接入25 ℃麦芽汁培养基培养7天的平板菌种3片(用打孔器打成直径6 mm的菌片),130 r·min-1、28 ℃恒温振荡培养5天,每处理设3个重复(王宜磊等,2001)。
3) 处理设定 在其他培养条件相同的条件下,设定不同碳源、氮源、Cu2+浓度和底物浓度的发酵产酶培养基,培养5天后每隔1天测定漆酶活性,绘制漆酶活性随时间推移的变化曲线,并进行差异分析,筛出最佳碳源、氮源、Cu2+浓度和底物浓度,研究不同碳源、氮源、Cu2+浓度和底物浓度对秦岭细粘束孢产漆酶活性的影响。
碳源分别设为麦芽糖、蔗糖、葡萄糖(质量浓度均为20 g·L-1); 氮源分别设为酵母、蛋白胨、酒石酸铵(质量浓度均为0.25 g·L-1); Cu2+设为0,0.3,0.6,0.9 mmol·L-1; 底物(华山松韧皮部)浓度设为0,3,6 g·L-1。
4) 粗酶液制备 发酵液经8层纱布过滤,4 ℃,8 000 r·min-1; 离心30 min,取上清液,稀释后用于酶活测定(邵强等,2005)。
5) 漆酶活性测定 3.9 mL醋酸盐缓冲液(10 mmol·L-1,pH5.0)中加入1 mL愈创木酚(1.76 mmol·L-1)以及0.1 mL粗酶液,混匀后置25 ℃恒温水浴准确反应2 h,450 nm比色(Arora et al., 1985),以愈创木酚用醋酸盐缓冲液代替的作为空白对照,重复3次。一个酶活单位(U)定义为1 min内氧化1 μmol愈创木酚所需要的酶量,在450 nm处愈创木酚的消光系数ε450=12 100 mol·L-1 cm-1 (Nyanhongo et al., 2006)。
6) 数据处理 采用SAS(V8.1)软件进行单因素方差分析,并用Sigmaplot(10.0)软件绘图。
2 结果与分析 2.1 碳源对秦岭细粘束孢漆酶分泌的影响在培养基中分别添加不同的碳源(10 g·L-1),结果表明麦芽糖作为碳源,在第13天比葡萄糖和蔗糖作为碳源的漆酶活性分别高出约2~3倍。蔗糖和葡萄糖明显不利于漆酶的分泌; 在培养第9天漆酶活性出现迅速下降。3种不同的碳源培养基培养的第7,9,13天,秦岭细粘束孢产漆酶的活性存在显著差异(P < 0.05),但在培养的第5天3种碳源条件的漆酶活性差异不显著(P>0.05)。从不同碳源对秦岭细粘束孢生长和生物量的对比,可以看出麦芽糖作为碳源,秦岭细粘束孢生长最好,产菌丝量大,而在蔗糖和葡萄糖条件下,该菌长势很弱,漆酶活性相对较低(图 1)。
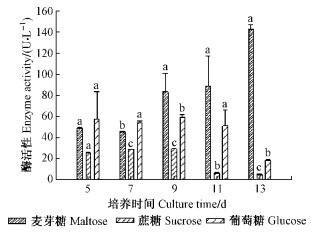
|
图 1 不同碳源对秦岭细粘束孢产漆酶活性的影响 Fig.1 Effect of carbon source on laccase activity of L.qinlingensis |
从不同氮源对漆酶活性的影响可以看出:以酵母为氮源在培养第5天秦岭细粘束孢产漆酶的活性为28.87 U·L-1,随着培养时间的增加,酶活迅速上升,直到第9天,漆酶活性变化趋于平缓,13天漆酶活性达到191.86 U·L-1。以蛋白胨为氮源秦岭细粘束孢产漆酶的活性第5天为64.74 U·L-1,第11天达到85.51 U·L-1,第13天漆酶活性下降到17.22 U·L-1。以酒石酸铵为氮源秦岭细粘束孢产漆酶的活性第5天为53.03 U·L-1,第13天漆酶活性达到135.56 U·L-1。在酵母碳源与蛋白胨和酒石酸铵碳源培养的第5,9,11天,秦岭细粘束孢漆酶活性存在显著差异(P< 0.05),而蛋白胨与酒石酸铵碳源间漆酶活性差异不显著(P>0.05),说明这2种氮源的作用效果基本相同(图 2),酵母为秦岭细粘束孢产漆酶的最佳氮源。
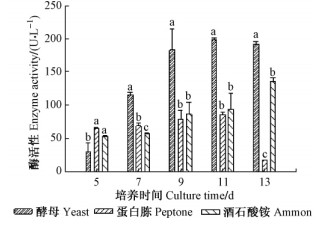
|
图 2 不同氮源对秦岭细粘束孢产漆酶活性的影响 Fig.2 Effect of nitrogen source on laccase activity of L. qinlingensis |
通过对漆酶蛋白质晶体结构的研究,发现漆酶具有3个铜离子结合位点,共结合有4个铜离子(Sakurai et al., 1997),在催化氧化反应中起决定性作用。铜离子对酶活性的影响会随着浓度的不同表现抑制或激活的作用(王习文等,2003)。通过对不同Cu2+浓度下秦岭细粘束孢产漆酶活性的差异分析(图 3),可以看出随着Cu2+浓度的升高,秦岭细粘束孢产漆酶的活性有明显上升趋势,不同培养时间(5,7,11,13天)不同浓度Cu2+对漆酶活性的影响差异显著(P< 0.05)。在Cu2+浓度为0.6 mmol·L-1时,培养的11天,酶活达到289.14 U·L-1,而Cu2+浓度为0.9 mmol·L-1时,对秦岭细粘束孢产漆酶有明显的抑制作用,在培养的第13天,0.9 mmol·L-1下的酶活突然升高到216.48 U·L-1,分析原因可能是产酶过程中Cu2+不断消耗,培养基中游离的Cu2+减少,导致Cu2+浓度下降,抑制作用减弱。因此,Cu2+作为漆酶分泌的诱导剂,随着浓度的升高,诱导作用加强,当浓度升高到一定值,反而起抑制作用。
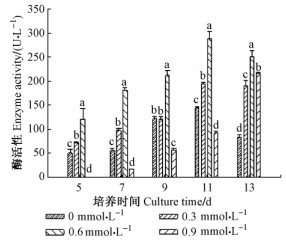
|
图 3 Cu2+浓度对秦岭细粘束孢产漆酶活性的影响 Fig.3 Effect of Cu2+ on laccase activity of L.qinlingensis |
以麦芽糖和酵母为碳氮源,Cu2+浓度为0.6 mmol·L-1条件下,分别添加0,3,6 g·L-1华山松韧皮部组织(图 4),结果表明:不同含量寄主华山松韧皮部组织对秦岭细粘束孢产漆酶的活性产生明显的影响。在培养的5,7,9,11天,添加寄主华山松韧皮部组织0与3 g·L-1的差异不显著(P>0.05);而当添加量为6 g·L-1,与前2种添加量下的酶活性呈极显著差异(P< 0.05),秦岭细粘束孢产漆酶活性达到681.82 U·L-1,这说明底物对秦岭细粘束孢产漆酶活性的影响与添加量存在密切关系。研究发现木质素降解后的碎片可诱导漆酶的产生并且显著提高漆酶的产量(王祎宁等,2009),秦岭细粘束孢对寄主华山松营养具有高度的选择性(蒲晓娟等,2008)。本研究进一步证实了华山松大小蠹共生蓝变真菌秦岭细粘束孢产漆酶的活性具有明显的底物诱导性或者具有对寄主树木营养的选择性,这也与华山松大小蠹共生真菌有效克服寄主华山松抗性和充分利用木质素等营养有密切的关系。
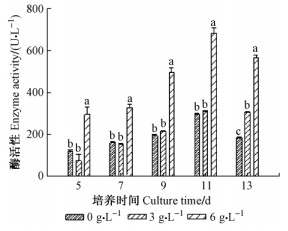
|
图 4 底物对秦岭细粘束孢产漆酶活性的影响 Fig.4 Effect of substrate on laccase activity of L.qinlingensis |
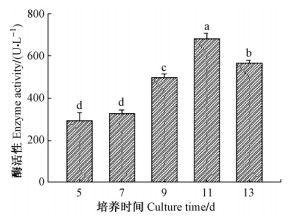
以麦芽糖和酵母为碳氮源,Cu2+浓度为0.6 mmol·L-1下,添加6 g·L-1华山松韧皮部组织(图 5),结果表明第5,7天差异不显著(P>0.05),第9,11,13天均呈极显著差异(P < 0.05),随着培养天数的增加,酶活性呈上升趋势,在11天左右出现峰值,此后,酶活迅速下降,这与培养后期营养物质逐渐被利用,菌丝生长缓慢或逐渐停止有关。
|
图 5 培养时间对秦岭细粘束孢产漆酶活性的影响 Fig.5 Effect of culture time on laccase activity of L.qinlingensis |
本试验提供的3种碳源基本都能满足秦岭细粘束孢生长发育,但通过对漆酶活性的测定,可以看出在3种碳源条件下秦岭细粘束孢分泌漆酶的活性存在较大的差别,其中麦芽糖作为碳源秦岭细粘束孢合成和分泌漆酶能力最强,并随时间的推移漆酶活性大幅度上升,第13天达142.22 U·L-1,而蔗糖和葡萄糖为碳源,产酶量在第9天后呈现下降趋势,这可能是由于秦岭细粘束孢的生长较弱,随着时间的推移不能维持产酶需要有关。蒲晓娟等(2008)研究发现:秦岭细粘束孢在麦芽汁培养基中生长最好,产孢量最大,这进一步说明麦芽糖碳源不仅能够明显地提高秦岭细粘束孢的生长发育,而且能够有效促进秦岭细粘束孢漆酶的合成与分泌。酵母为秦岭细粘束孢最佳漆酶产酶氮源,漆酶活性达到191.86 U·L-1,明显高于蛋白胨和酒石酸铵。不同浓度的Cu2+对秦岭细粘束孢漆酶的活性有较大的影响,随着Cu2+浓度的升高,秦岭细粘束孢漆酶活性有明显先上升后下降的趋势,这与Galhaup等(2001)的发现相一致; 当Cu2+浓度为0.6 mmol·L-1时,漆酶活性达到最大值289.14 U·L-1。张玉等(2006)研究发现:当Cu2+浓度达到5 mmol·L-1时,抑制香菇漆酶的产生,而本研究表明Cu2+浓度为0.9 mmol·L-1时,就会明显抑制秦岭细粘束孢漆酶的产生,这可能是由于秦岭细粘束孢耐铜力较弱有关。另一方面,研究发现秦岭细粘束孢漆酶的分泌具有底物诱导性,随着华山松韧皮部组织添加量的增加,对漆酶分泌的诱导作用越明显,当添加量为6 g·L-1时漆酶活性达到681.82 U·L-1。
本文应用单因素试验方法对华山松大小蠹共生真菌秦岭细粘束孢发酵产漆酶条件进行了研究,结果表明麦芽糖、酵母分别为最佳碳氮源; 在0.3~0.6 mmol·L-1范围内Cu2+可明显诱导产漆酶,寄主华山松韧皮部有利于漆酶的分泌。这对进一步研究揭示华山松大小蠹和共生真菌入侵健康华山松,导致寄主树木迅速死亡的机制,以及华山松大小蠹共生蓝变真菌分解利用寄主树木韧皮部和木质部营养具有重要的意义和价值。
| [] | 陈辉, 袁锋. 2000. 华山松大小蠹带菌部位及贮菌器结构研究. 林业科学, 36(1): 53–57. DOI:10.11707/j.1001-7488.20000109 |
| [] | 陈辉, 唐明, 朱长俊, 等. 2004. 华山松大小蠹和共生真菌分泌酶组成分析. 林业科学, 40(5): 123–126. DOI:10.11707/j.1001-7488.20040520 |
| [] | 韩晓磊, 严莲荷, 周申范. 2005. 漆酶分泌及活性影响因素综述. 化学与生物工程, 22(7): 10–13. |
| [] | 蒲晓娟, 陈辉. 2008. 华山松蓝变真菌(Leptographium qinlingensis)的生物学特性研究. 西北农林科技大学学报:自然科学版, 36(5): 130–134. |
| [] | 邵强, 郭伟云, 姚朝阳, 等. 2005. 碳源氮源对白腐真菌漆酶合成的影响. 河南师范大学学报:自然科学版, 33(2): 94–96. |
| [] | 王祎宁, 赵国柱, 谢响明, 等. 2009. 漆酶及其应用的研究进展. 生物技术通报(5): 35–38. |
| [] | 王习文, 詹怀宇, 何为. 2003. 铜(Ⅱ)对漆酶活性的影响. 纸和造纸(4): 43–44. |
| [] | 王宜磊, 刘兴坦. 2001. 彩绒革盖菌漆酶产酶条件研究. 植物学通报, 18(1): 110–112. |
| [] | 曾涛, 陈汉清, 曾会才. 2009. 木质素酶及其生产菌的筛选育种. 基因组学与应用生物学, 28(3): 578–582. |
| [] | 张玉, 洪枫. 2006. 优化培养条件对提高香菇漆酶产量的研究. 林产化学与工业, 26(2): 74–78. |
| [] | Arora D S, Gill P K. 2000. Laccase production by some white rot fungi under different nutritional conditions. Bioresource Technology, 73(3): 283–285. DOI:10.1016/S0960-8524(99)00141-8 |
| [] | Arora D S, Sandhu D K. 1985. Laccase production and wood degradation by a white-rot fungus Daedalea flavida. Enzyme and Microbial Technology, 7(8): 405–408. DOI:10.1016/0141-0229(85)90131-0 |
| [] | Bertrand T, Jolivalt C, Caminade E, et al. 2002. Purification and preliminary crystallographic study of Trametes versicolor laccase in its native form. Acta Crystallographica Section D, Biolological Crystallography, 58(2): 319–321. DOI:10.1107/S0907444901019898 |
| [] | Galhaup C, Haltrich D. 2001. Enhanced formation of laccase activity by the white-rot fungus Trametes pubescens in the presence of copper. Appl Microbiol Biotechnol, 56(1/2): 225–232. |
| [] | Kuroda K. 2005. Xylem dysfunction in Yezo spruce (Picea jezoensis) after inoculation with the blue-stain fungus Ceratocystis polonica. Forest Pathology, 35(5): 346–358. DOI:10.1111/efp.2005.35.issue-5 |
| [] | Sakurai T, Suzuki S. 1997. Spectroscopy of cucumber ascorbate oxidase and fungal laccase. Multi-copper Oxidases.Singapore, World Scientific Publishing: 225-250. |
| [] | Shleev S V, Zaitseva E A, Gorshina E S, et al. 2003. Yaropolov. Spectral and electrochemical study of laccases from basidiomycetes.Moscow University Chem Bull, 44(1): 35–39. |
| [] | Solomon E I, Sundaram U M, Machonkin T E. 1996. Multicopper oxidases and oxygenases. Chemical Reviews, 96(7): 2563–2605. DOI:10.1021/cr950046o |
| [] | Nyanhongo G S, Couto S R, Guebitz G M. 2006. Coupling of 2, 4, 6-trinitrotoluene (TNT) metabolites onto humic monomers by a new laccase from Trametes modesta. Chemosphere, 64(3): 359–370. DOI:10.1016/j.chemosphere.2005.12.034 |
 2012, Vol. 48
2012, Vol. 48

