文章信息
- 王怀玉, 杨万勤
- Wang Huaiyu, Yang Wanqin
- 季节性冻融对亚高山冷杉林土壤微生物数量的影响*
- Effects of Seasonal Freeze-Thaw Cycles on Quantity of Soil Microbes in the Subalpine Fir Forest
- 林业科学, 2012, 48(5): 88-94.
- Scientia Silvae Sinicae, 2012, 48(5): 88-94.
-
文章历史
- 收稿日期:2011-01-25
- 修回日期:2011-11-03
-
作者相关文章
2. 四川农业大学生态林业研究所 温江 611130
2. Institute of Ecological Forestry, Sichuan Agricultural University Wenjiang 611130
季节性冻融是全球中高纬度和高海拔地区普遍存在的自然现象(郭东信, 1990;Jing et al., 2000)。土壤微生物是森林生态系统结构和功能的重要组成部分,积极参与土壤的形成和发育、有机物质的分解以及营养物质的转化等过程,推动着整个生物地球化学循环的运行(杜涛等, 2003;冯瑞芳等, 2007)。土壤细菌、真菌、放线菌是对土壤生态系统贡献最大的微生物类群(Jackinson et al., 1981),其数量和比例受土壤成分、土壤酸碱度和植被种类等多种生物和非生物因素的影响。研究表明:季节性冻融能显著改变土壤微生物群落结构的多样性(刘利等, 2010)和生物量(Larsen et al., 2002;Liu et al., 2010),影响土壤酶活性(Yergeau et al., 2008),影响森林凋落物的分解(Wu et al., 2010), 进而对全球C,N循环产生重大影响。全球变暖增加了春秋季节的温度波动和冻融循环(Kattsov et al., 2005), 因而全球变暖引起的季节性冻融变化必然直接或间接作用于森林生态系统,从而对土壤微生物群落结构和数量、土壤酶活性(熊雪晶,2009)施加影响。目前,全球变暖导致的季节性冻融变化的改变在亚北极地区及北方森林(boreal forest)相对明显,因此相关研究报道较多(Groffman et al., 2001;Poutou et al., 2004),然而有关全球变暖背景下季节性冻融变化对亚高山森林土壤微生物群落结构和数量的影响以及微生物对季节性冻融变化的响应与适应机制方面的研究则鲜见报道,这很难满足全球气候变化背景下高寒森林生态系统过程研究的需要。
川西亚高山森林生态系统位于青藏高原东缘、长江上游地区,是全球气候变化的敏感地带(吴宁等, 2000)。受青藏高原隆起以及东南季风和西南季风的影响,亚高山针叶林普遍分布于高山峡谷区,地形地貌复杂,气候分异明显;同时,土壤冻结时间长达5—6个月,具有较厚的土壤有机层和腐殖质层及较高的有机碳含量和密度(冯瑞芳等, 2007),这为开展季节性冻融过程对土壤微生物数量变化的影响研究提供了理想条件。本研究以川西亚高山地区分布范围最广和面积最大的岷江冷杉(Abies faxoniana)林为研究对象,采用室内冻融循环对照处理试验和自然环境条件下动态采样分析相结合的研究手段,对比研究冻融强度、冻融时间及其频率变化对高寒森林土壤微生物群落结构的影响,以期为深入揭示季节性冻融对高寒森林生态系统过程的影响提供科学依据。
1 研究地区与研究方法 1.1 研究区域概况研究区域位于阿坝自治州理县境内毕棚沟自然保护区(102°32′—103°30′E, 30°54′—31°2′N, 海拔2 400~4 500 m),地处四川盆地外围山向西部高山高原过渡地带。年降雨量为801~835 mm,降雨集中在5—8月,受季风的影响,区域内干湿季节差异显著;年平均温度为1.5~3 ℃,>10 ℃的积温约为1 069 ℃(最高温度为27.6 ℃,最低温度为-20.8 ℃),冬季较低的气温导致土壤的季节性冻融,冻融期大于150天,冻结深度大于40 cm,对森林群落内的物质循环具有显著的影响。研究区域内的森林类型主要包括云杉(Picea meyeri)原始林、冷杉林、针阔混交林以及桦木(Betula spp.)林等,此外高山柳(Salix cupularis)灌丛、沙棘(Hippophae rhamnoides)灌丛以及草地和草甸在区域内也占有很大的比例;从低海拔到高海拔依次分布有山地棕壤、山地暗棕壤、亚高山草甸土、高山草甸土、高山流石滩荒漠土。
1.2 样地描述在毕棚沟自然保护区内选取了3个具有代表性的森林群落:冷杉原始林、冷杉和红桦(Betula albo-sinensis)混交林、冷杉次生林,分别设置1个30 m×30 m的定位研究样地。样地基本情况见表 1。
|
|
室内冻融试验于2007年10月中旬开始,即土壤冻结前于3 582 m的冷杉原始林下采集21个原状土柱(直径10 cm,高40 cm),装入保鲜箱后迅速带回实验室,进行室内控制模拟试验。共设置2个冻融交替处理和1个对照。2个冻融交替处理分别为-2 ℃/4 ℃冻融交替和-5 ℃/4 ℃冻融交替。首先,将原状土柱分别置于-2 ℃和-5 ℃的恒温培养箱中培养5天,4 ℃下融化1天,作为1个冻融周期,4 ℃下无冻融交替处理作为(CK)。每种处理和对照3次重复;原状土壤剖面水分控制根据重量法,在各冻融周期后喷洒蒸馏水以保持恒定土壤水分含量。在各处理进行3次、6次及9次冻融循环(FTC)周期后,分腐殖质层(AL)、淀积层(BL)和母质层(CL)采集土壤样品,立即进行土壤微生物数量的测定。
季节性冻融试验于2007年10月中旬开始,土壤冻结前于3 582 m的冷杉原始林下采集27个原状土柱(直径10 cm,高40 cm),在3 582,3 298和3 023 m的样地内分别埋9个原状土柱进行季节性冻融循环试验。经过一个自然的季节冻融后,于2008年4月初至2008年5月中旬分冻融初、冻融中期和冻融后期分层取样,即每15天采集定位监测样地内土壤样品,用布袋装好、密封,迅速带回实验室进行土壤样品分析。在2007年10月中旬采集原状土柱的同时,分层采集新鲜土样,作为冻融前期土壤分析样品。
1.4 测定方法土壤微生物数量采用《中华人民共和国林业行业标准》(1999)的稀释平板计数法测定,细菌采用牛肉膏蛋白胨培养基;放线菌采用改良高氏一号合成培养基,临用时在已融化的培养基中每300 mL培养基加3%重铬酸钾1 mL培养;真菌采用PDA培养基,临用时每100 mL培养基加1%链霉素液0.3 mL,结果以每g鲜土所含微生物菌落形成单位数量(colony forming unit per gram fresh soil,cfu·g-1)表示。
1.5 数据分析试验数据处理和图表绘制采用Excel软件;用ANOVA分析比较处理间均值的差异性,并作Duncan多重比较(SPSS10.0)。
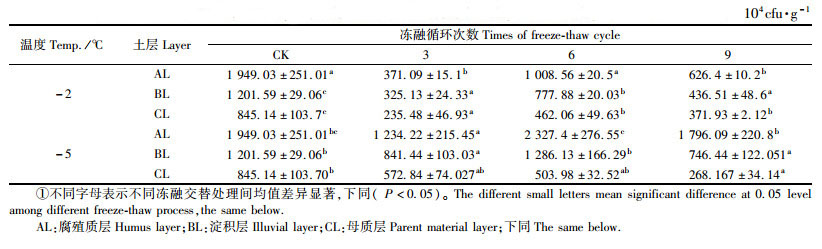
2 结果与分析 2.1 室内冻融交替对土壤微生物数量的影响土壤冻融交替处理降低了土壤细菌的数量,交替处理频次也影响了土壤细菌数量(表 2)。细菌数量随着冻融频次的增加呈先降低后升高的变化趋势,在3次冻融循环后细菌数量显著降低,然后随冻融频次的增加有一个升高的过程,在第9次冻融交替作用后,土壤细菌数量均低于对照土壤细菌数量(表 2)。冻融交替处理对BL和CL土层细菌数量的影响较AL大,在-2 ℃和-5 ℃的土壤冻结强度下经过9次冻融循环后,细菌数量显著降低(P<0.05)。
|
|
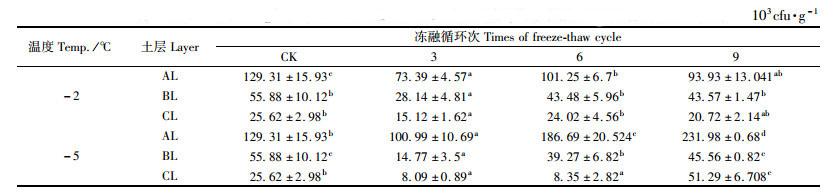
冻融交替对土壤真菌数量有显著影响。随着冻融交替处理次数的增加,土壤真菌数量基本呈现先降低后增加的变化趋势(表 3)。但不同土壤冻结强度和冻融交替次数对土壤真菌数量影响的变化趋势随不同土层而异。在-2 ℃的冻融强度下,各土层经过9次冻融循环后,土壤真菌数量均低于对照土壤,方差分析结果表明:AL和CL的差异显著(P<0.05),而BL的差异不显著(P > 0.05)。在-5 ℃的土壤冻结强度下,AL和CL经过9次冻融循环后,土壤真菌数量显著高于对照(P<0.05)(表 3)。这表明,冻融交替不同程度地影响了土层土壤真菌数量,对AL和CL土层真菌数量影响显著,而对BL土层真菌数量无显著影响。
|
|
AL和BL在-2 ℃的冻融强度下放线菌数量随冻融频次的增加呈先降后升的变化规律,但在第9次冻融循环后放线菌数量急剧下降,显著低于对照(P<0.05)。在-5 ℃的冻融强度下,各土层放线菌数量呈先升后降的变化趋势,但不同冻融频次对土壤放线菌数量影响的变化趋势随不同土层而异。AL和BL土层放线菌数量在第9次冻融循环后显著低于对照(P<0.05),而CL土层放线菌数量随冻融频次的增加呈持续的上升趋势(表 4)。
|
|
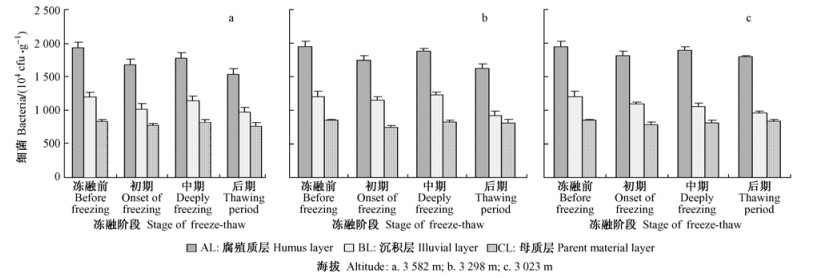
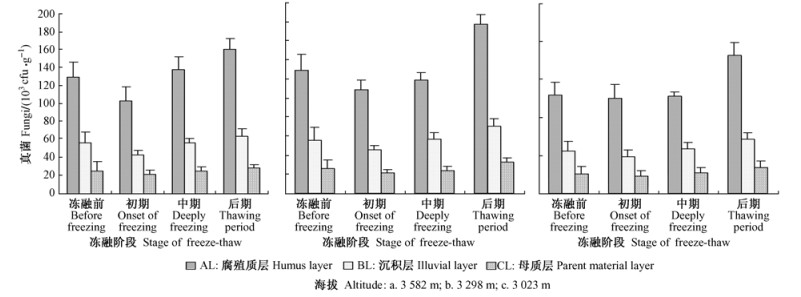
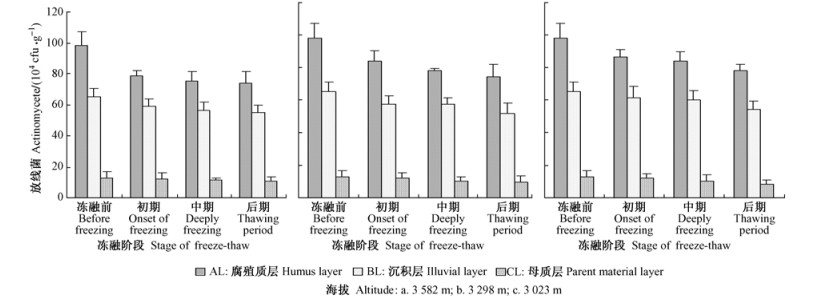
由海拔降低所引起季节性冻融循环的改变会引起土壤微生物数量变化。随海拔的降低土壤细菌基本呈升高的变化规律(图 1)。3 298 m样地内原状土柱AL和CL土层细菌数量分别比3 582 m样地内的原状土柱增加4.2%和7.0%,BL土层细菌数量降低了0.6%;而3 023 m样地内原状土柱AL,BL和CL土层细菌数量分别比3 298 m样地内的原状土柱增加11.5%,3.5%和2.1%。随海拔的降低土壤真菌数量呈升高的变化规律(图 2)。3 298 m样地内原状土柱AL、BL和CL土层真菌数量分别比3 582 m样地内的原状土柱增加10.5%,10.3%和16.4%;而3 023 m样地内原状土柱AL,BL和CL土层真菌数量分别比3 298 m样地内的原状土柱增加2.4%,1.7%和3.5%。由海拔降低所引起季节性冻融循环的改变会影响土壤放线菌数量(图 3)。3 298 m样地内原状土柱AL土层放线菌数量比3 582 m样地内的原状土柱增加0.7%,而BL和CL土层放线菌数量分别降低5.9%和13.9%;3 023 m样地内原状土柱AL和BL土层放线菌数量分别比3 298 m样地内的原状土柱增加5.2%和5.2%,CL土层放线菌数量降低12.4%。
|
图 1 季节性冻融循环后土壤细菌数量动态变化 Fig.1 Dynamic changes of bacterial populations under seasonal freezing and thawing cycles in soil layers |
|
图 2 季节性冻融循环后土壤真菌数量动态变化 Fig.2 Dynamic changes of fungal populations under seasonal freezing and thawing cycles in soil layers |
|
图 3 季节性冻融循环后土壤放线菌数量动态变化 Fig.3 Dynamic changes of actinomycetes populations under seasonal freezing and thawing cycles in soil layers |
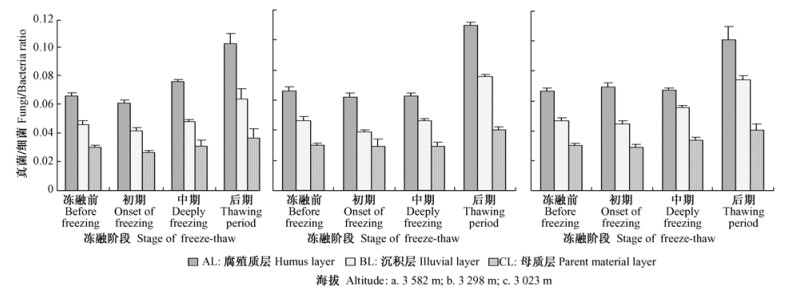
由海拔降低所引起季节性冻融循环的改变会影响土壤真菌/细菌的比率(图 4)。3 298 m样地内原状土柱AL,BL和CL土层真菌/细菌比率分别比3 582 m样地内的原状土柱增加6%,17.9%和8.7%;而3 023 m样地内原状土柱Al和BL土层真菌/细菌比率分别比3 298 m样地内的原状土柱增加8.4%和1.8%,CL土层真菌/细菌比率降低1.2%。
|
图 4 季节性冻融循环后土壤真菌/细菌比率的动态变化 Fig.4 Dynamic changes in ratio of bacterial and fungal population under seasonal freezing and thawing cycles in soil layers |
冻融交替是因气温的升降,使土壤反复出现冻结和融化状况(朴河春等, 1995)。冻融交替不仅使土温发生明显变化,且显著改变水分状态和分布、团聚体结构,直接或间接改变土壤的物理化学性质,导致土壤微生物繁殖及其群落结构的改变。微生物生长繁殖快,对环境变化适应迅速,能敏感地反映土壤生态系统受冻融干扰过程中的细微变化(王恩姮等, 2010;刘利等, 2010)。因此,研究冻融交替对土壤微生物群落的作用是反映土壤胁迫对土壤生态系统过程影响的重要指标之一,也是亚高山森林土壤生态系统结构和功能以及森林生态系统过程研究中必不可少的内容。虽然川西亚高山森林土壤生态系统因受高海拔、低温及森林凋落物质量的限制,其研究越来越受到科学家们的重视(邓仁菊等, 2007;孙辉等, 2007),但过去的研究更多关注于生长季节内土壤微生物对环境变化的响应,缺乏有关高寒森林生态系统重要生态过程之一的冻融交替作用对土壤微生物群落影响的研究报道,这很难满足高寒森林土壤生态系统过程和全球变化与区域响应的需要。细菌是土壤微生物中数量最多的一个类群,它的存在对土壤有机物质的分解转化和腐殖质的合成有密切关系,并且极易受到冻融交替作用等土壤扰乱的影响。本项研究表明:季节性冻融循环后土壤细菌数量有所降低,室内冻融模拟试验也得出相似结论。并且,在不同冻结强度下,土壤细菌数量均随冻融频次的增加呈先降低后升高的变化趋势,在9次冻融交替作用后,土壤细菌数量明显低于对照土壤细菌数量,这说明冻融交替作用会降低土壤细菌数量,这与Skogland等(1998)的研究结果一致,认为冻融交替作用会显著降低土壤细菌数量(Shanley et al., 1999;Lipson et al., 2002)。这可能是因为土壤初期冻结,冰晶快速生成导致土壤细菌的大量死亡,使细菌的数量急剧降低,然后,土壤冻结时死亡的微生物细胞,在土壤融化时为幸存微生物释放可利用的养分物质,刺激残余微生物的生长(Walker et al., 2006),因而随冻融频次的增加土壤细菌数量又有一升高的过程。本研究还发现:不同土层细菌数量变化对冻融交替作用的响应不一致。AL土层在-2 ℃的冻结强度下经过9次冻融循环后,细菌数量与对照土壤相比有所降低,但差异不显著;而BL和CL土层在-2℃和-5 ℃的土壤冻结强度下经过9次冻融循环后,细菌数量显著降低。这可能是因为轻微的土壤冻结强度,对土壤细菌的影响较小;同时AL土层土壤腐殖化程度越高,冰冻时土壤膨胀越强烈,土壤有机胶体的破裂程度大,小分子游离氨基酸等养分释放量增加(Ivarson, 1970),刺激残余微生物的生长,使得-2 ℃的土壤冻结强度对AL土层细菌数量影响不显著。
真菌在土壤中以菌丝体和孢子的形式存在,能引起土壤中植物残体的主要成分纤维素、木质素和果胶的分解,也能分解含氮的蛋白质类化合物而释放出氨,是参与土壤中有机质分解过程的主要成员之一。本研究表明:季节性冻融作用与室内模拟冻融交替作用均会增加土壤真菌数量。随着冻融交替处理次数的增加,土壤真菌数量基本呈现先降低后增加的变化趋势。同时,土壤真菌数量对不同土壤冻结强度的响应也存在差异。在-2 ℃的冻融循环后AL土层和CL土层真菌数量均低于对照土壤;而在-5 ℃的冻融循环后AL土层和CL土层经过9次冻融循环后,土壤真菌数量显著高于对照。这说明较温和的冻融会降低土壤真菌数量,而强烈的冻融循环会增加土壤真菌数量。该结果和Schadt等(2003)、Sulkava等(2003)的研究结论一致,强冻融循环提高了土壤微生物类群比率(真菌/细菌)、增强土壤真菌的优势,这可能是因为,土壤真菌菌体通过自身生理活动对胞内环境及新陈代谢的调节,更能适应冻融交替作用所造成的土壤水热状态等物理化学特性的改变。
季节性冻融作用可能通过引起真菌/细菌的改变影响生态系统中土壤微生物群落生态功能的实现。本研究表明:在土壤融冻期土壤真菌/细菌比值呈先降低后升高的变化趋势;同时供试原状土柱真菌/细菌比值也随海拔的降低而升高,这可能是因为,真菌对低温的抗性高于细菌,因而冬季具有较高的真菌/细菌比例(Schadt et al., 2003)。而真菌/细菌比值较高的微生物群落可驱动土壤内源碳底物进一步矿化,提高土壤生态系统的稳定性(Thiet et al., 2006;Vries et al., 2006),这意味着由全球变暖引起的季节性冻融变化可能通过改变土壤微生物类群比率(真菌/细菌)来增强土壤真菌的优势,进而改变土壤微生物群落的生态功能,提高高寒森林生态系统的稳定性。
放线菌是介于细菌与丝状真菌之间而又接近于细菌的一类丝状原核生物,菌落呈放射状,也是土壤中有机化合物分解作用的积极参与者。本研究表明:季节性冻融作用与室内模拟冻融交替作用均会对土壤放线菌数量产生一定影响。在融冻期,土壤放线菌呈持续降低的变化趋势;在室内冻融模拟条件下,土壤放线菌数量对不同土壤冻结强度的响应存在差异。-2 ℃的冻融强度下土壤放线菌数量在9次冻融循环后低于对照,差异不显著;-5 ℃的冻融强度下土壤放线菌数量在9次冻融循环后低于对照,差异显著。这说明较温和的冻融循环对土壤放线菌数量影响不大,而强烈的冻融循环会显著降低土壤放线菌数量。
| [] | 邓仁菊, 杨万勤, 张健, 等. 2007. 川西亚高山森林土壤有机层碳-氮-磷储量特征. 应用与环境生物学报, 13(4): 492–496. |
| [] | 杜涛, 黄小毛. 2003. 从土壤中提取DNA用于PCR扩增. 微生物学通报, 30(6): 1–5. |
| [] | 冯瑞芳, 杨万勤, 张健, 等. 2007. 模拟大气CO2浓度和温度升高对亚高山冷杉林土壤酶活性的影响. 生态学报, 27(10): 4019–4026. DOI:10.3321/j.issn:1000-0933.2007.10.009 |
| [] | 郭东信. 1990. 中国冻土. 兰州, 甘肃教育出版社. |
| [] | 刘利, 吴福忠, 杨万勤, 等. 2010. 季节性冻结初期川西亚高山/高山森林土壤细菌多样性. 生态学报, 30(20): 5687–5694. |
| [] | 朴河春, 刘广深, 洪业汤. 1995. 全球冻融地球土壤是重要N2O释放源的综合分析. 地球科学进展, 10(3): 283–288. |
| [] | 孙辉, 吴秀臣, 秦纪洪, 等. 2007. 川西亚高山森林土壤过氧化氢酶活性对升高温度和CO2浓度的响应. 土壤学报, 38(5): 891–894. |
| [] | 王恩姮, 赵雨森, 陈祥伟. 2010. 季节性冻融对典型黑土区土壤团聚体特征的影响. 应用生态学报, 21(4): 889–894. |
| [] | 吴宁, 刘庆. 2000. 长江上游地区的生态环境与可持续发展战略. 世界科技研究与发展, 21(3): 70–73. |
| [] | 熊雪晶. 2009. 季节性冻融对亚高山冷杉林土壤微生物活性的影响. 四川农业大学硕士学位论文. |
| [] | Groffman P M, Driscoll C T, Fahey T J, et al. 2001. Colder soils in a warmer world:A snow manipulation study in a northern hardwood forest ecosystem. Biogeochemistry, 56(2): 135–150. DOI:10.1023/A:1013039830323 |
| [] | Ivarson K C. 1970. Effect of frost action and storage of soil at freezing temperatures on the free amino acids, free sugrus and respiratory activity of soil. Canadian Journal of Soil Science, 50: 191–198. DOI:10.4141/cjss70-027 |
| [] | Jackinson D S, Ladd J N. 1981. Microbial Bialmass in Soil, Measurement and Turnover in Soil Biochemistry. NewYork:Marcel Dekker INC: 445–471. |
| [] | Jing H, Li S, Cheng G. 2000. Permafrost and climatic change in China. Global Plant Change, 26(4): 387–404. DOI:10.1016/S0921-8181(00)00051-5 |
| [] | Kattsov V M, Källén E, Cattle H, et al. 2005. Future climate change:modeling and scenarios for the Arctic. Arctic Climate Impact Assessment. Cambridge University Press, New York, x: 445–150. |
| [] | Larsen K S, Jonasson S, Michelsen A. 2002. Repeated freeze-thaw cycles and their effects on biological processes in two arctic ecosystem types. Appl Soil Ecol, 21: 187–195. DOI:10.1016/S0929-1393(02)00093-8 |
| [] | Lipson D A, Schadt C W, Schmidt S K. 2002. Changes in soil microbial community structure and function in an alpine dry meadow following spring snow melt. Microbial Ecology, 43(3): 307–314. DOI:10.1007/s00248-001-1057-x |
| [] | Liu Lin, Wu Yan, Wu Ning, et al. 2010. Effects of freezing and freeze-thaw cycles on soil microbial biomass and nutrient dynamics under different snow gradients in an alpine meadow(Tibetan plateau). Polish Journal of Ecology, 58: 717–728. |
| [] | Poutou E, Krinner G, Genthon C, et al. 2004. Role of soil freezing in future boreal climate change . Climate Change, 23(6): 621–639. |
| [] | Schadt C W, Martin A P, Lipson D A, et al. 2003. Seasonal dynamics of previously unknown fungal lineages in tundra soils. Science, 301: 1359–1361. DOI:10.1126/science.1086940 |
| [] | Skogland T, Lomeland S, Goksøyr J. 1998. Respiratory burst after freezing and thawing of soil: experiments with soil bacteria. Soil Biology & Biochemistry, 20(6): 851–856. |
| [] | Shanley J B, Chalmers A. 1999. The effect of frozen soil on snowmelt runoff at Sleepers River Verrmont. Hydrology Proceedings, 13(12/13): 1843–1858. |
| [] | Sulkava P, Huhta V. 2003. Effects of hard frost and freeze-thaw cycles on decomposer communities and N mineralisation in boreal forest soil. Appl Soil Ecol, 22(3): 225–239. DOI:10.1016/S0929-1393(02)00155-5 |
| [] | Thiet R K, Frey S D, Six J. 2006. Do growth yield efficiencies differ between soil microbial communities differing in fungal:bacterial ratios? Reality check and methodological issues. Soil Biology & Biochemistry, 38: 837–844. |
| [] | Vries F T, Hoffland E, Eekeren N V, et al. 2006. Fungal/bacterial ratios in grasslands with contrasting nitrogen management. Soil Biology & Biochemistry, 38(8): 2092–2103. |
| [] | Walker V K, Palmer G R, Voordouw G. 2006. Freeze-thaw tolerance and clues to the winter survival of a soil community. Applied and Environmental Microbiology, 72(3): 1784–1792. DOI:10.1128/AEM.72.3.1784-1792.2006 |
| [] | Wu Fuzhong, Yang Wanqin, Zhang Jian, et al. 2010. Litter decomposition in two subalpine forests during the freezee-thaw season. Acta Oecologica, 36(1): 135–140. DOI:10.1016/j.actao.2009.11.002 |
| [] | Yergeau W, Kowalchuk G A. 2008. Responses of antarctic soil microbial communities and associated functions to temperature and freeze-thaw cycle frequency. Environmental Microbiology, 10(9): 2223–2235. DOI:10.1111/emi.2008.10.issue-9 |
 2012, Vol. 48
2012, Vol. 48