文章信息
- 魏绍冲, 姜远茂
- Wei Shaochong, Jiang Yuanmao
- 冬枣果实中1个ETR2类乙烯受体基因的克隆及其表达
- Cloning and Expression of a cDNA Encoding ETR2-Type Ethylene Receptor in 'Dongzao' Jujube
- 林业科学, 2012, 48(4): 138-142.
- Scientia Silvae Sinicae, 2012, 48(4): 138-142.
-
文章历史
- 收稿日期:2011-08-15
- 修回日期:2011-10-20
-
作者相关文章
冬枣(Ziziphus jujuba ‘Dongzao’)是我国的特色鲜食果品之一,果实富含维生素C和环磷酸腺苷等成分,具有较高的营养和药用价值。冬枣采后贮藏过程中极易失水、皱缩、酒软或霉烂等,致使其供应期甚短。
乙烯的生理作用是由位于细胞内质网上乙烯受体识别乙烯开始,通过一系列信号转导过程实现(Adams-Phillips et al., 2004;Guo et al., 2004)。Chang等(1993)利用染色体步移和定位克隆方法首次分离了拟南芥(Arabidopsis thaliana)乙烯受体编码基因ETR1,并获得其完整的基因序列,此后相继从拟南芥中分离了其他几个乙烯受体编码基因成员。根据蛋白结构特征不同可把乙烯受体分为2个亚族:即ETR1家族和ETR2家族。ETR1家族包括拟南芥AtETR1和AtERS1及番茄(Lycopersicon esculentum) LeETR1,LeETR2和NR(LeETR3)等成员,含有组氨酸激酶(histidine kinase)活性所需要的所有氨基酸残基;ETR2家族包括拟南芥AtEIN4,AtETR2和AtERS2及番茄LeETR4,LeETR5和LeETR6等成员,含有一个歧化的组氨酸激酶结构域,具有丝/苏氨酸激酶活性,但没有组氨酸激酶活性,可以磷酸化它的接受器结构域(Lashbrook et al., 1998;Tieman et al., 1999)。该激酶结构域N盒的突变,可导致ETR2失去激酶活性(Wuriyanghan et al., 2009)。
果实的成熟启动不仅依赖于植物激素乙烯含量迅速增加,而且还依赖于其受体水平等组分协同变化。通过基因工程手段调控番茄中乙烯受体基因的表达,可以改变番茄果实成熟特性及其对乙烯的敏感性(Tieman et al., 2000)。有关果实乙烯受体的研究多集中于ETR1类型,对ETR2类型的研究相对较少。近年来已先后从苹果(Malus domestica)(Wiersma et al., 2007)、柿(Diospyros kaki)(Pang et al., 2007)、草莓(Fragaria×ananassa)(Trainotti et al., 2005)和柑橘(Citrus sinensis)(Karuppiah-John et al., 2010)等果实中分离了ETR2类受体全长编码基因,并研究了它们的表达特性。研究发现,ETR2类受体在某些果实成熟过程中可能起重要作用。例如,草莓果实中鉴定了3个乙烯受体编码基因,其中属于ETR2家族的FaEtr2在果实成熟过程中始终维持在较高水平。推测尽管非跃变型果实草莓采后释放少量乙烯,但较高水平的乙烯受体足以将微弱的乙烯信号传递到下游,启动与草莓成熟相关的生理生化变化(Trainotti et al., 2005)。
冬枣果实成熟过程中乙烯释放水平较低,属于非跃变型果实,但乙烯对冬枣果实成熟生理仍具有明显影响(申琳等, 2004)。魏绍冲等(2007)从冬枣果实中分离了ZjETR1和ZjERS1 2个ETR1家族类型的基因成员,为更深入了解乙烯与冬枣果实成熟生理的关系,本试验分离并研究了冬枣1个ETR2类乙烯受体基因在果实中的表达特性。
1 材料与方法 1.1 材料以冬枣果实为材料,将去除果皮及果核后的果肉组织切成薄片迅速用液氮速冻后于-70 ℃冰箱备用。大肠杆菌(Escherich coli)菌株DH5α感受态细胞采用CaCl2法制备。DNA回收纯化试剂盒、LA Taq酶和pMD-18T载体为大连宝生物公司(Takara)产品。
1.2 引物设计与合成根据GenBank登录的番茄、桃(Amygdalus persica)、苹果和草莓等ETR2家族乙烯受体成员氨基酸和核苷酸保守区序列,设计合成2条简并引物为上游引物,P3-1:5′ -GA(G/A)GCTGG(A/C)T(G/T)GCATGTT(A/C)GGATG-3′;P3-2:5′-AA(C/T)TGTGC(A/G/T)GTTTGGATGCC-3′;3′ RACE扩增的下游通用引物B26序列为:5′-GACTCGAGTCGACATCGATTTTTTTTTTTTTTTTT-3′。
为扩增ZjETR2的全长cDNA,在5′端起始密码子区域设计合成1条简并引物作为上游引物P5:5′-TGCAATGTT(A/G)A(A/G)(A/G)(A/G)CATT AGCATC-3′;根据3′ RACE的序列测定结果设计下游引物P3:5′-TGGAGGAACAAGTGCTGAAT -3′。
根据序列拼接结果设计合成1对PCR引物:QF1:5′-ATCCCCATTGAGCTGCTTTACTTT-3′;QR1:5′-AATTCCAATCTGCCGACATCTTTC-3′,用于全长的克隆。克隆所用的主要引物如图 1所示。
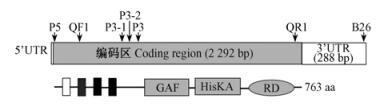
|
图 1 ZjETR2的结构及克隆所用引物 Fig.1 Structure diagram of ZjETR2 and primers used in the cDNA cloning |
果实总RNA的提取参照Salzman等(1999)的方法进行。根据果实发育天数及成熟程度将果实分为小绿果期、大绿果期、发白期、转色期、半红期和红色期等不同阶段。叶片总RNA的提取采用CTAB法(Chang et al., 1993)。提取的RNA沉淀溶解于适量DEPC(焦碳酸二乙酯,diethypyrocarbonate)处理水,经过核酸定量分析后,确定Northern杂交的总RNA用量。
1.4 RT-PCR扩增cDNA第1链合成按照MBI公司操作说明书进行。PCR反应扩增体系如下:2.5 mmol ·L-1 dNTP 8 μL, 25 mmol·L-1 MgCl2 5 μL,10×LA PCR缓冲液(Mg 2+ free)5 μL,上下游引物各2 μL(约10 pmol·L-1), 逆转录产物1 μL,高保真Takara LA Taq酶0.5 μL(5 U·μL-1),用ddH2O补充至总体积50 μL。
ZjETR2的3′ RACE扩增:以引物P3-1和B26的扩增产物为模板,再用P3-2和B26进行扩增。扩增条件:94 ℃预变性5 min;94 ℃变性45 s, 52 ℃退火50 s,72 ℃延伸90 s,共20个循环;72 ℃延伸10 min。将第1轮扩增产物稀释后做模板进行第2次PCR,反应条件与第1次完全相同。5′端序列扩增:利用P5和P3进行PCR扩增。扩增条件:94 ℃预变性5 min;94 ℃变性30 s, 54 ℃退火30 s,72 ℃延伸45 s,共30个循环;72 ℃延伸10 min。
目的片段的克隆参照Takara公司的pMD-18-T Simple Vector说明书进行,DNA序列测定委托上海英骏生物技术公司完成。
1.5 序列分析测序结果序列分析采用DNASTAR和DNAMAN软件进行,用ContigExpress序列拼接软件进行全长序列拼接。Clustal X软件进行自动排序,用Njplot程序构建蛋白系统进化树。
1.6 Northern杂交RNA甲醛变性凝胶电泳及转移至尼龙膜操作按照Sambrook等(1989)的方法。地高辛(DIG)标记RNA探针试剂盒及杂交液(DIG easy Hyb)均购自罗氏(Roche)公司,按照其操作说明书进行。获取探针序列1对引物分别为:F2:5′-AGAGGGCGCCATTTCAACTACAA-3′;R2:5′-taatacgactcactatagggGCAATGATCAAGGGCC AACTATG-3′。根据前期获得的ZjETR1乙烯受体编码基因的序列,设计合成1对用于合成ZjETR1探针引物:F1:5′-AGCCCCCAAGATATTCCTA AGT-3′;R1:5′-taatacgactcactatagggTAACCCCATT TTCATCCATAACAA-3′。
2 结果与分析 2.1 ZjETR2的全长cDNA克隆及序列分析以成熟冬枣果实的cDNA为模板,经3′ RACE扩增,结果得到2 000 bp大小的预期PCR片段。将产物回收纯化后与T载体连接,转化感受态大肠杆菌细胞,蓝白斑筛选获得重组质粒。测序后得到了大小为1 971 bp的cDNA片段,包含不完整的开放阅读框(ORF, Open Reading Frame)及3′端UTR(3′端非编码区序列)。将其核苷酸序列和推导的氨基酸序列分别在NCBI服务器的Blast(Blastn和Blastp)软件中进行检索,结果显示同源性较高的为草莓、苹果和番茄等ETR2类乙烯受体基因的序列,初步推断它们为冬枣中ETR2同源基因的片段,故将其命名为ZjETR2。
利用引物P5和P3经PCR扩增获得1个约800 bp大小的目的基因片段。克隆测序表明该基因片段大小为790 bp,为ZjETR2的5′端编码区序列及4 bp非编码区核苷酸。将该序列与3′ RACE得到的序列进行拼接,2部分重叠的183 bp序列完全相同。为防止序列拼接结果来源于不同基因的同源区段,利用拼接结果设计引物QF1和QR1,经克隆测序分析,结果得到目的cDNA序列与拼接结果完全一致,ZjETR2大小为2 578 bp。
利用DNASTAR软件包EditSeq软件进行序列分析发现,ZjETR2包含1个2 292 bp的ORF及288 bp的3′UTR,该基因编码763个氨基酸,预测所编码蛋白的分子量为85.2 ku,理论等电点(pI)为6.99。该基因在GenBank中的登录号为DQ834687。分析表明,ZjETR2在5′端含有4个保守的跨膜疏水区结构域(transmembrane domains),符合典型ETR2受体的特点,而在ETR1类受体中则只含有3个跨膜结构域,缺少SP(signal peptide)结构域。在组氨酸激酶结构域部分含有H,N,G1,F,G2共5个保守的模体(图 2)。

|
图 2 ZjETR2的核苷酸序列和由此推导的氨基酸序列 Fig.2 The nucleotide and deduced amino acid sequence of ZjETR2 划线为N端SP和3个跨膜的结构域位置,方框为5个保守模体。 Putative signal peptide (SP) and transmembrane domains (TM) are underlined; while boxed regions indicate the five consensus motifs. |
本试验所得的冬枣ZjETR2氨基酸序列与多种植物ETR2乙烯受体的氨基酸序列都具有较高同源性。经基于氨基酸序列构建的系统进化树分析,蔷薇科(Rosaceae)的梨(Pyrus communis)PcETR2、苹果MdETR2及草莓FaETR2最先聚类,然后与ZjETR2聚为一类,随后再与柑橘CsETR2聚为一大类(图 3)。DNAMAN软件分析表明,ZjETR2和柿DkETR2同源性为65.0%,说明该类受体基因在植物中较为保守。

|
图 3 一些植物ETR2类乙烯受体的系统树 Fig.3 Phylogenetic tree of some plants' ETR2-type ethylene receptors 采用邻接法,分支上的数值表示置信度(%)。 The bootstrap values(%)were indicated in the branch. |
图 4为2个受体基因在冬枣叶片和不同发育时期果实中的Northern杂交结果。可以看出,ZjETR2在冬枣叶片中基本不表达;ZjETR2在绿熟期果实中有一定表达,自发白期到转色期果实中,ZjETR2表达明显升高,而这种趋势一直维持至果实全红期,这种模式与同为非跃变型果实的草莓发育进程中FaEtr2的表达模式类似,明显不同于柿果实中DkETR2的表达(Trainotti et al., 2005;Pang et al., 2007)。ZjETR1无论在冬枣叶片或不同发育阶段的果实中则一直不表达。
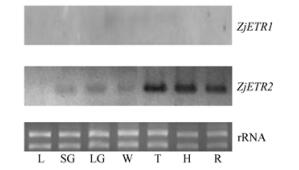
|
图 4 ZjETR1和ZjETR2在冬枣叶片和果实中的表达模式 Fig.4 Expression patterns of ZjETR1 and ZjETR2 in jujube leaf and different ripening stages of fruit L:叶片;SG:小绿果期;LG:大绿果期;W:发白期;T:转色期;H:半红期;R:红色期。 L: Leaf; SG: Small green; LG: Large green; W: White; T: Turning; H: Half red; R: Red. |
乙烯是与果实成熟密切相关的植物激素,其生物学效应最终是通过乙烯信号转导途径实现(蒋天梅等,2011)。尽管非跃变型果实成熟衰老过程没有大量的乙烯生成,但越来越多的证据支持,非跃变型果实诸多成熟相关过程也直接受乙烯调控(Barry et al., 2007)。ETR1家族和ETR2家族乙烯受体蛋白在N端分别具有3个和4个疏水跨膜结构域,Moussatche和Klee(2004)研究表明,激酶结构域的不同是ETR1和ETR2两类受体蛋白结构上最大的区别,ETR1具有组氨酸激酶的活性,而ETR2为丝氨酸/苏氨酸激酶活性。研究发现,ETR2家族的拟南芥AtETR2本身没有组氨酸激酶的活性,如果使之带有激酶活性的结构域,反而减弱了它的功能(谢芳,2006)。尽管拟南芥或番茄乙烯受体成员结构各不相同,但酵母表达试验表明,所有成员均具有结合乙烯的能力(O' Malley et al., 2005)。乙烯受体各成员可能都以负调控方式参与调节乙烯生理反应,而受体表达谱的研究表明乙烯受体种类远比数量变化更具有调控作用(Barry et al., 2007)。番茄6个家族成员中LeETR1,LeETR2和NR(LeETR3) 3个成员属于ETR1家族,其余3个成员属于ETR2家族(Tieman et al., 1999)。本试验获得的冬枣ZjETR2在N端含有4个保守的跨膜疏水区结构域,属于ETR2家族的新成员。
乙烯受体成员在果实成熟过程中可能具有多种调控模式。番茄NR(LeETR3)基因的表达受番茄果实发育高度调控,在果实成熟过程受乙烯诱导表达,但在营养组织和非成熟果实则不受乙烯诱导(Lashbrook et al., 1998)。LeETR4是番茄乙烯受体成员中转录水平最高的成员,通过番茄果实成熟突变体的深入研究及乙烯受体转基因试验进一步证实NR和LeETR4在番茄果实成熟过程中发挥重要作用(Tieman et al., 2000;Barry et al., 2007)。伴随成熟进程中微量乙烯的产生,柿DkERS和DkETR2的表达水平也相应增加,并且DkERS的表达水平一直明显高于DkETR2(Pang et al., 2007),而DkETR1的表达则一直维持较低水平。草莓FaEtr2在果实成熟过程中则始终维持在较高表达水平,明显高于草莓ETR1家族的FaEtr1和FaErs1 2个成员(Trainotti et al., 2005)。本试验Northern杂交结果表明,ZjETR2在叶片中基本不表达,而其表达水平则随冬枣果实成熟过程推进而明显上升,ZjETR2时空表达的差异暗示其很可能对冬枣果实成熟具有重要调控作用。而属于ETR1家族成员的ZjETR1在冬枣果实中不表达,这与DkETR1在柿果实中的表达类似,表明ZjETR1很可能在冬枣其他器官或生理过程中发挥作用。
| [] | 蒋天梅, 殷学仁, 王平, 等. 2011. 乙烯调控非跃变型果实成熟衰老研究进展. 园艺学报, 38(2): 371–378. |
| [] | 申琳, 生吉萍, 牛建生, 等. 2004. 冬枣酒软过程中呼吸强度和乙烯代谢的变化及1-MCP的处理效应. 中国农业大学学报, 9(2): 36–39. |
| [] | 魏绍冲, 彭福田, 束怀瑞, 等. 2007. 冬枣两个乙烯受体编码基因的克隆及序列分析. 园艺学报, 34(2): 333–338. |
| [] | 谢芳. 2006. 拟南芥乙烯受体信号作用机理的研究. 中国科学院上海生命科学研究院植物生理生态研究所博士学位论文, 97-109. |
| [] | Adams-Phillips L, Barry C, Giovannoni J. 2004. Signal transduction systems regulating fruit ripening. Trends Plant Sci, 9(7): 331–338. DOI:10.1016/j.tplants.2004.05.004 |
| [] | Barry C S, Giovannoni J J. 2007. Ethylene and fruit ripening. J Plant Growth Regul, 26(2): 143–159. DOI:10.1007/s00344-007-9002-y |
| [] | Chang C, Kwok S F, Bleecker A B, et al. 1993. Arabidopsis ethylene-response gene ETR1: similarity of product to two-component regulators. Science, 262(5133): 539–544. DOI:10.1126/science.8211181 |
| [] | Chang S, Puryear J, Cairney J. 1993. A simple and efficient method for isolating RNA from pine trees. Plant Mol Biol Rep, 11(2): 113–116. DOI:10.1007/BF02670468 |
| [] | Guo H W, Ecker J R. 2004. The ethylene signaling pathway: new insights. Curr Opin Plant Biol, 7(1): 40–49. DOI:10.1016/j.pbi.2003.11.011 |
| [] | Karuppiah-John K J, Burns J K. 2010. Degreening behavior in 'Fallglo' and 'Lee × Orlando' is correlated with differential expression of ethylene signaling and biosynthesis genes. Postharvest Biol Technol, 58(3): 185–193. DOI:10.1016/j.postharvbio.2010.07.013 |
| [] | Lashbrook C C, Tieman D M, Klee H J. 1998. Differential regulation of the tomato ETR gene family throughout plant development. Plant J, 15(2): 243–252. DOI:10.1046/j.1365-313X.1998.00202.x |
| [] | Moussatche P, Klee H J. 2004. Autophosphorylation activity of the Arabidopsis ethylene receptor multigene family. J Biol Chem, 279(47): 48734–48741. DOI:10.1074/jbc.M403100200 |
| [] | O'Malley R C, Rodriguez F I, Esch J J, et al. 2005. Ethylene-binding activity, gene expression levels, and receptor system output for ethylene receptor family members from Arabidopsis and tomato. Plant J, 41(5): 651–659. DOI:10.1111/tpj.2005.41.issue-5 |
| [] | Pang J H, Ma B, Sun H J, et al. 2007. Identification and characterization of ethylene receptor homologs expressed during fruit development and ripening in persimmon (Diospyros kaki Thumb). Postharvest Biol Technol, 44(3): 195–203. DOI:10.1016/j.postharvbio.2006.12.017 |
| [] | Salzman R A, Fujita T, Zhu-Salzman K, et al. 1999. An improved RNA isolation method for plant tissues containing high levels of phenolic compounds or carbohydrates. Plant Mol Biol Rep, 17(1): 11–17. DOI:10.1023/A:1007520314478 |
| [] | Sambrook J, Fritsh E F, Manniatis T. 1989. Molecular Cloning: A Laboratory Manual. 2nd ed. New York, Cold Spring Harbor Laboratory Press: 31-58. |
| [] | Tieman D M, Klee H J. 1999. Differential expression of two novel members of the tomato ethylene receptor family. Plant Physiol, 120(1): 165–172. DOI:10.1104/pp.120.1.165 |
| [] | Tieman D M, Taylor M G, Ciardi J A, et al. 2000. The tomato ethylene receptors NR and LeETR4 are negative regulators of ethylene response and exhibit functional compensation within a multigene family. Proc Natl Acad Sci USA, 97(10): 5663–5668. DOI:10.1073/pnas.090550597 |
| [] | Trainotti L, Pavanello A, Casadoro G. 2005. Different ethylene receptors show an increased expression during the ripening of strawberries: does such an increment imply a role for ethylene in the ripening of these non-climacteric fruits?. J Exp Bot, 56(418): 2037–2046. DOI:10.1093/jxb/eri202 |
| [] | Wiersma A, Zhang H, Lu C, et al. 2007. Survey of the expression of genes for ethylene synthesis and perception during maturation and ripening of 'Sunrise' and 'Golden Delicious' apple fruit. Postharvest Biol Technol, 44(3): 195–203. DOI:10.1016/j.postharvbio.2006.12.017 |
| [] | Wuriyanghan H, Zhang B, Cao W H, et al. 2009. The ethylene receptor ETR2 delays floral transition and affects starch accumulation in rice. Plant Cell, 21(5): 1473–1494. DOI:10.1105/tpc.108.065391 |
 2012, Vol. 48
2012, Vol. 48
