文章信息
- 刘丹, 严善春, 曹传旺, 廖月枝
- Liu Dan, Yan Shanchun, Cao Chuanwang, Liao Yuezhi
- 多杀菌素对黄褐天幕毛虫解毒酶及保护酶的影响
- Effect of Spinosad on the Detoxifying and Protective Enzymes of Malacosoma neustria testacea
- 林业科学, 2012, 48(4): 67-74.
- Scientia Silvae Sinicae, 2012, 48(4): 67-74.
-
文章历史
- 收稿日期:2011-07-07
- 修回日期:2011-10-26
-
作者相关文章
2. 中国农业科学院植物保护研究所 北京 100193
2. Institute of Plant Protection, Chinese Academy of Agricultural Sciences Beijing 100193
黄褐天幕毛虫(Malacosoma neustria testacea)属鳞翅目(Lepidoptera)枯叶蛾科(Lasiocampidae),多分布于亚洲(Shiga, 1977; Fang, 1992; Aslan et al., 2005),在欧洲及北美等国家也有分布(Ruf et al., 2003; 王春生等, 2003),是世界性害虫; 危害栎(Quercus)、杨(Populus)、柳(Salix)、白桦(Betula platyphylla)、榆(Ulmus pumila)、槐(Sophora japonica)等多种阔叶树种,亦危害梨(Pyrus)、苹果(Malus pumila)、山楂(Crataegus)、杏(Armeniaca vulgaris)、李(Prunus salicina)、梅(Prunus mume)等多种果树(Shiga, 1977; 王春生等, 2003); 具有分布广,食性杂,危害重等特点,给农业、林业及果树业生产造成了严重的经济损失(王春生等, 2003; 郭秀芝等, 2009),是众多国家重点防治的害虫之一。国内外对黄褐天幕毛虫的研究报道很多,但主要集中在对其生物学及生态学习性、发生规律与预测预报、防治方法等方面(Shiga, 1977; Fang, 1992; Verdinelli et al., 2003; 王春生等, 2003; Aslan et al., 2005; 郭秀芝等, 2009; 张国财等, 2010)。国外多使用苏云金杆菌(Bacillus thuringensis)和黄褐天幕毛虫核型多角体病毒NPV对其进行防治(Jankevica et al., 1997; Kati et al., 2009),虽然针对性强但见效较慢; 而国内多使用化学药剂进行防治(郭秀芝等, 2009),虽然快捷有效但易造成抗性及环境污染等问题。因此目前科学家们正致力于研究对黄褐天幕毛虫防治效率高且对环境友好的无公害药剂(胡春祥等, 2007; 张国财等, 2010)。
多杀菌素(Spinosad)是美国陶氏益农公司开发出来的第一个新型天然杀虫剂,集化学农药的高效、速效、广谱和生物农药的低毒、对环境友好、对天敌安全等优良特性于一身(Thompson et al., 2000)。其作用机制独特,通过刺激昆虫的神经系统,可以持续激活靶标昆虫乙酰胆碱烟碱型受体(Salgado et al., 1997),也可作用于昆虫γ氨基丁酸(GABA)受体,改变GABA门控氯离子通道的功能(Watson, 2001),导致虫体非功能性肌肉收缩、衰竭,并拌随颤抖和麻痹(Salgado, 1998)。据尹显慧等(2008)报道,亚致死浓度多杀菌素对小菜蛾(Plutella xylostella)敏感种群解毒酶系,羧酸酯酶、谷胱甘肽S-转移酶和多功能氧化酶活性均具有显著影响。对甜菜夜蛾(Spodoptern exigua)多酚氧化酶和羧酸酯酶也具有一定干扰作用(王光峰等, 2003),而对其各保护酶活性无影响(张友军等, 2003)。说明多杀菌素作用于昆虫靶标受体后,通过改变离子通道功能,从而激活昆虫解毒及保护系统做出应激反应。多杀菌素已用于防治林业害虫(Semiz et al., 2006),但研究报道较少,且尚未见对林业害虫黄褐天幕毛虫毒理机制的报道,因此本研究以林业害虫天幕毛虫为对象,研究新型微生物杀虫剂多杀菌素亚致死剂量对黄褐天幕毛虫解毒及保护系统生理生化的影响,从生化水平阐明该药剂对黄褐天幕毛虫的毒理作用,为生产上合理用药提供理论依据。
1 材料与方法 1.1 试验材料黄褐天幕毛虫卵于3月采自东北林业大学示范林场,该地未使用任何药剂防治。将采回的卵在室内孵化,幼虫用健康无药剂污染的成年杨树叶片饲养,每天观察并更换新鲜叶片,及时清理幼虫的排泄物和食物残渣。恒温饲养条件:温度(25±1)℃,相对湿度60%~80%,光周期16L: 8D。黄褐天幕毛虫幼虫从4龄开始进入暴食期,5,6龄不再集结在网中而是分散取食危害,4龄后是其主要危害时期,因此,本试验选取4龄和5龄幼虫进行毒力及酶活测定。
多杀菌素,商品名为25 g·L-1菜喜悬浮剂,购自陶氏益农公司。
1.2 毒力测定参照Zhao等(2002)叶片药膜法。在预试验的基础上,用清水将25 g·L-1多杀菌素悬浮剂稀释成系列浓度梯度,其中4龄幼虫选用的浓度为50,25,12.5,6.25,4.17,2.5 μg·L-1; 5龄幼虫选用的浓度为500, 312.5,250,125,83.3,50 μg·L-1; 以清水作对照。将未接触过药剂的杨树叶片在稀释好的药液中浸10 s后取出,在荫凉处晾干。用蘸有充足水分的脱脂棉裹住叶柄,放入透气性良好的透明养虫瓶(直径9 cm,高14 cm)中,然后接入大小一致的黄褐天幕毛虫4、5龄幼虫,每瓶放入20头,各龄均重复3次。置于恒温养虫室内饲养,分别于6,12,24 h后检查死亡数。虫体非功能性颤抖、变小、发黑视为死亡。
1.3 试虫处理根据毒力测定结果,用LC50剂量多杀菌素处理杨树叶片,饲喂健康、大小一致且饥饿12 h的4龄和5龄幼虫,其中4龄幼虫每养虫瓶放15头,5龄幼虫放10头,处理方法和饲养条件同1.2,以清水处理作对照。分别于处理后3,6,12和24 h取活试虫,储存于-80 ℃冰箱用于制备酶液。
1.4 解毒酶活性测定 1.4.1 羧酸酯酶(CarE)活性测定参照Van Asperen的方法(1962)。从-80 ℃冰箱中取出对照组和处理组天幕毛虫幼虫4龄5头、5龄3头,解冻,用0.04 mol·L-1 pH7.0磷酸缓冲液漂洗3次,在玻璃匀浆器中加入5 mL 0.04 mol·L-1 pH7.0磷酸缓冲液冰浴条件下充分匀浆,4 ℃ 12 000 r·min-1离心20 min,倒出上清液即为天幕毛虫酶源,均稀释30倍待用。在试管中分别加入3×10-4 mol·L-1的α-乙酸萘酯底物(含6×10-4 mol·L-1毒扁豆碱)5.0 mL,0.04 mol·L-1 pH7.0磷酸缓冲液0.6 mL,酶液0.4 mL,立即混匀,在30 ℃水浴振荡条件下反应30 min,然后每支试管中加入显色剂坚固蓝B盐1 mL,室温下静置15 min,600 nm下测定OD值,每个处理重复3次。用α-乙酸萘酯作底物,在30 ℃ pH7.0的条件下,经酶水解生成α-萘酚,α-萘酚与显色剂生成深蓝色物质。以酶量(mL)为自变量,OD值为因变量,根据标准曲线计算出每毫升酶液生成的α-萘酚量,再根据蛋白质含量(mg),计算出羧酸酯酶的比活力,单位以mmol·mg-1min-1表示。
1.4.2 乙酰胆碱酯酶(AchE)活性测定参照高希武(1987)的方法。从-80 ℃冰箱中取出对照组和处理组天幕毛虫幼虫4龄5头、5龄4头,解冻,用0.1 mol·L-1 pH7.5磷酸缓冲液漂洗3次,在玻璃匀浆器中加入5 mL 0.1 mol·L-1 pH7.5磷酸缓冲液冰浴条件下充分匀浆,4 ℃ 10 000 r·min-1离心20 min,倒出上清液即为天幕毛虫酶源。取原酶液0.4 mL,再加0.05 mol·L-1碘代硫化乙酰胆碱溶液0.1 mL,30 ℃反应15 min后,室温加入DTNB溶液3.6 mL,412 nm下测定OD值,每个处理重复3次。单位以OD·mg-1min-1表示。
1.4.3 多功能氧化酶(MFO)活性测定参照Hansen等(1971)的方法。从-80 ℃冰箱中取出对照组和处理组黄褐天幕毛虫幼虫4龄10头、5龄7头,解冻,用0.1 mol·L-1 pH7.8磷酸缓冲液漂洗3次,在玻璃匀浆器中加入3 mL 0.1 mol·L-1 pH7.8(内含1 mmol·L-1 EDTA, 1 mmol·L-1 DTT, 1 mmol·L-1 PTU, 1 mmol·L-1 PMSF)磷酸缓冲液冰浴条件下充分匀浆,4 ℃ 10 000 r·min-1离心20 min,倒出上清液即为黄褐天幕毛虫酶源。取4×10-3 mol·L-1对硝基苯甲醚1 mL,0.1 mol·L-1 pH7.8磷酸缓冲液0.8 mL,5×10-4 mol·L-1 NADPH-Na4 0.2 mL和酶液1 mL,以不加NADPH-Na4作对照,摇匀置于37℃水浴中反应30 min。反应体系中加入1 mol·L-1 HCL 1 mL终止反应,再加入5 mL氯仿萃取,静置10 min后,在氯仿层移取下层溶液3 mL到另一组试管内,加入0.5 mol·L-1 NaOH 3 mL萃取。静置10 min,取水相2 mL于比色皿中,400 nm下测定OD值,每个处理重复3次。单位以mmol·mg-1min-1表示。
1.4.4 谷胱甘肽S-转移酶(GST)活性测定参照Booth等(1961)的方法。从-80 ℃冰箱中取出对照组和处理组黄褐天幕毛虫幼虫4龄4头、5龄3头,解冻,用0.066 mol·L-1 pH7.0磷酸缓冲液漂洗3次,在玻璃匀浆器中加入5 mL 0.066 mol·L-1 pH7.0磷酸缓冲液冰浴条件下充分匀浆,4 ℃ 10 000 r·min-1离心20 min,倒出上清液即为黄褐天幕毛虫酶源,分别稀释30倍、50倍待用。在试管中分别加入0.066 mol·L-1 pH7.0磷酸缓冲液2.4 mL,0.05 mol·L-1谷胱甘肽0.3 mL,0.03 mol·L-1 CDNB 0.1 mL,酶液0.2 mL,立即混匀,在27 ℃ 340 nm下测定5 min内OD变化值,每个处理重复3次。单位以ΔOD·mg-1min-1表示。
1.5 保护酶活性测定 1.5.1 超氧化物歧化酶(SOD)活性测定参照Beaucham等(1971)的方法。从-80 ℃冰箱中取出对照组和处理组黄褐天幕毛虫幼虫4龄5头、5龄3头,解冻,用0.05 mol·L-1 pH7.0磷酸缓冲液漂洗3次,在玻璃匀浆器中加入5 mL 0.05 mol·L-1 pH7.0(含1% PVP,0.04%苯基硫脲和10 mmol·L-1 EDTA)磷酸缓冲液冰浴条件下充分匀浆,4 ℃ 10 000 r·min-1离心20 min,倒出上清液即为天幕毛虫酶源,均稀释30倍待用。在试管中加入3 mL反应液(含50 mmol·L-1,pH7.0磷酸缓冲液,13 mmol·L-1甲硫氨酸,10 mmol·L-1 EDTA,75 mmol·L-1 NBT)和50 μL稀释酶液,最后加入4 mmol·L-1核黄素0.6 mL,以不加酶液管作为最大光还原管,4 000 lx下光照15 min后,立即避光终止反应,560 nm下测定OD值,以未光照的相同反应管为对照管,50%抑制率所需的酶量为一个酶活性单位(U),每个处理重复3次。单位以ΔOD·mg-1min-1表示。
1.5.2 过氧化物酶(POD)活性测定参照林琎(2004)的方法。酶液制备同1.5.1。测定4龄幼虫活性时在试管中加入反应液(0.2 mol·L-1 pH6.0磷酸缓冲液50 mL,愈创木酚0.019 mL,8% H2O2 0.028 mL)2.7mL,原酶液0.3 mL; 测定5龄幼虫活性时在试管中加入反应液2.5 mL,原酶液0.5 mL,反应5 min,470 nm下测定OD值,每个处理重复3次。单位以OD·mg-1min-1表示。
1.5.3 过氧化氢酶(CAT)活性测定参照Chance等(1955)的方法。酶液制备同1.5.1。在试管中分别加入的0.1 mol·L-1 pH7.0磷酸缓冲液2 mL,0.08% H2O2 1 mL和原酶液50 μL,空白不加H2O2,改为1 mL的蒸馏水,240 nm下测定OD值,每1 min记数1次,每个处理重复3次。单位以ΔOD·mg-1min-1表示。
1.6 蛋白质含量测定采用Bradford (1976)的考马斯亮蓝G-250法。
1.7 数据处理POLO软件处理分析毒力测定结果,计算致死中浓度(LC50)及其95%置信区间; 采用SPSS 16.0软件进行方差分析,差异显著性检验采用LSD方法,显著水平为α=0.05或α=0.01。
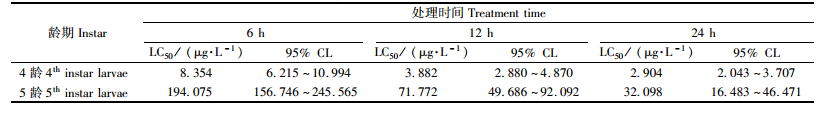
2 结果与分析 2.1 多杀菌素对黄褐天幕毛虫幼虫的毒力在供试虫体刚接触药膜叶片时,虫体状态与之前并无差异,但随着其取食时间的延长,虫体活动力逐渐下降并伴随震颤、抽搐等行为,最终虫体萎缩、体色变深、死亡。利用POLO软件获得毒力测定结果(表 1),得出多杀菌素对天幕毛虫不同龄期幼虫的致死中浓度(LC50)及其95%置信区间。从表 1可以看出:多杀菌素对天幕毛虫不同龄期幼虫均表现出较强的毒性,随着黄褐天幕毛虫幼虫龄期的增长,黄褐天幕毛虫对药剂的敏感性降低,所需药量急剧增加,但是随着处理时间的延长,LC50剂量逐渐降低。黄褐天幕毛虫4,5龄幼虫在接触药剂6 h后LC50分别为8.354和194.075 μg·L-1,5龄是4龄的23.23倍; 接触药剂12 h后LC50分别为3.882和71.772 μg·L-1,5龄是4龄的18.49倍; 接触药剂24 h后LC50分别为2.904和32.098 μg·L-1,5龄是4龄的11.05倍。本试验选用12 h LC50作为试验剂量处理黄褐天幕毛虫4,5龄幼虫来测定多杀菌素对其体内解毒酶及保护酶活性的影响。
|
|
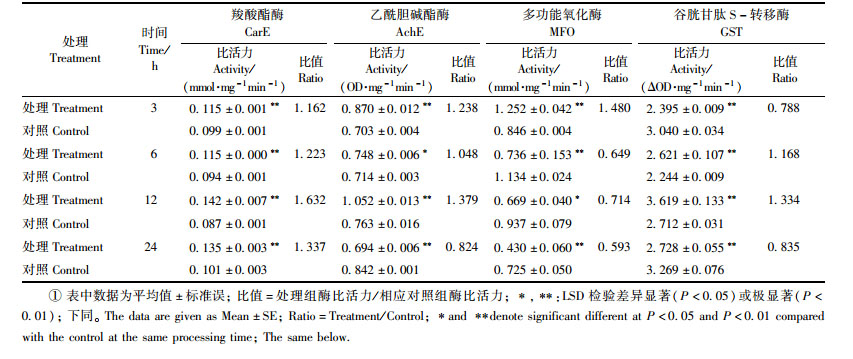
如表 2所示:多杀菌素对黄褐天幕毛虫4龄幼虫体内CarE具有明显的激活作用,处理后3,6,12和24 h酶活性与对照相比依次增加了1.162,1.223,1.632和1.337倍,且差异均极显著(P<0.01)。对AchE和MFO具有先激活后抑制的作用,与对照相比差异显著(P<0.05或P<0.01)。AchE在24 h后活性被抑制,为同期对照的0.824倍,差异极显著(P<0.01)。MFO活性仅在处理后3 h表现为激活作用;而后随着处理时间的延长,酶活力逐渐下降,表现为明显的抑制作用,处理24 h时仅为对照的0.593倍。对GST存在明显且较为复杂的影响,处理后3 h,酶活性明显被抑制;6 h后逐渐被激活,酶活明显高于对照,差异均极显著(P<0.01);在处理后12 h激活作用最强,为同期对照的1.334倍;24 h酶活低于对照,差异极显著(P<0.01)。
|
|
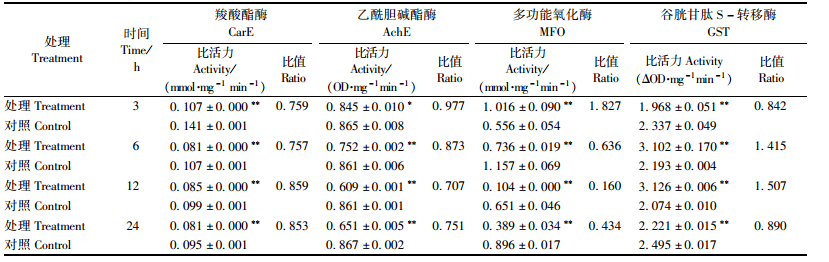
多杀菌素对黄褐天幕毛虫5龄幼虫体内解毒酶活性存在明显影响。从表 3可以看出:CarE和AchE活性均明显被抑制,在各处理时间点,对前者的抑制作用差异极显著(P<0.01);对后者的抑制作用随处理时间延长而增强,在处理12 h时,抑制作用最显著,为同期对照的0.707倍。对MFO具有明显影响(P<0.01),表现为先激活后抑制的趋势,在处理后3 h表现为激活作用,被为对照的1.827倍;而后随着时间的延长,表现为明显的抑制作用,12 h时抑制效果最明显,为同期对照的0.160倍。对GST的影响较为复杂,表现为抑制-激活-抑制作用,处理后3 h,酶活明显被抑制;6 h后逐渐被激活;12 h时激活作用最强,为同期对照的1.507倍;但24 h时又有所抑制,差异均极显著(P<0.01)。
|
|
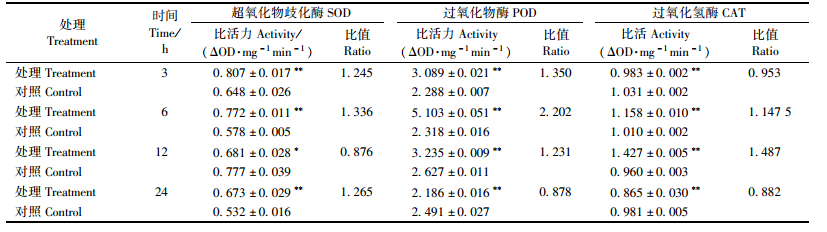
多杀菌素对黄褐天幕毛虫4龄幼虫体内保护酶存在明显影响。从表 4可以看出:处理后3~6h,SOD活性被激活,分别是对照的1.245和1.336倍; 但在处理12 h时,表现为明显的抑制作用,为同期对照的0.876倍,差异极显著(P<0.01);随着时间的延长,又表现为激活作用。对POD活性具有先激活后抑制的作用,3~12 h时酶活性表现为明显的激活作用,差异极显著(P<0.01);处理6 h时,激活作用最强,为同期对照2.202倍;而在处理后24 h表现为明显的抑制作用,为同期对照的0.878倍,差异极显著(P<0.01)。对CAT活性表现为先抑制再激活后抑制的作用,差异均极显著(P<0.01),其中处理初期3 h,酶活被抑制,为对照的0.953倍;6 h后逐渐被激活;在12 h时酶活明显高于对照组;但随着处理时间的延长,酶活性表现为抑制作用,24 h酶活低于对照。
|
|
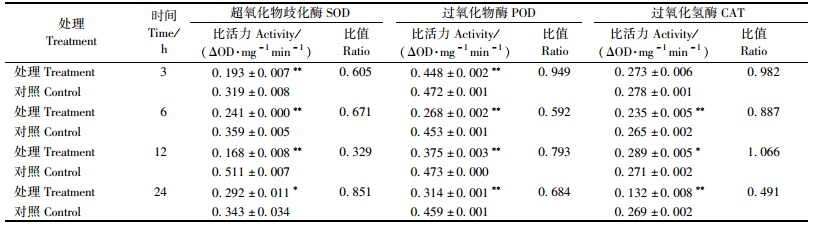
经多杀菌素处理后,黄褐天幕毛虫5龄幼虫体内保护酶活性的变化结果见表 5。对SOD和POD活性均具有明显的抑制作用,差异极显著(P<0.01),处理后12 h,对前者的抑制作用最强,为同期对照的0.329倍; 处理后6 h,对后者的抑制作用最强,为同期对照的0.592倍。对CAT的影响较复杂,处理后3 h活性几乎不受影响,但随着处理时间延长,6 h时活性被抑制,与对照相比差异极显著(P<0.01);而后酶活逐渐恢复并回升,12h时表现为激活作用,为同期对照的1.066倍,差异显著(P<0.05);处理24h时,酶活为对照的0.491倍,抑制作用明显,差异极显著(P<0.01)。
|
|
多杀菌素作用于昆虫靶标受体后,通过改变离子通道功能,激发昆虫解毒酶及保护酶在逆境条件下的应激反应。本研究发现:多杀菌素能有效干扰天幕毛虫幼虫体内CarE,MFO,GST,AchE,SOD,POD,CAT的活性,黄褐对天幕毛虫4,5龄幼虫具有极高的毒杀活性,低剂量的多杀菌素就能有效毒杀黄褐天幕毛虫高龄期幼虫。胡春祥等(2008)选用8%绿色威雷、3%高渗苯氧威对黄褐天幕毛虫进行室内胃毒试验,运用POLO软件将其数据换算成LC50,其24h时的LC50分别为2239.03×106 μg·L-1和29.10×106 μg·L-1,是多杀菌素处理4龄黄褐天幕毛虫幼虫24h时LC50的771016倍和10021倍,处理5龄幼虫24h时LC50的69756倍和907倍; 使用25%灭幼脲进行黄褐天幕毛虫胃毒加触杀试验(刘德伟等, 2008),结果显示:处理24h时LC50为94.27×106 μg·L-1(经POLO换算),是多杀菌素相同处理时间下4龄和5龄LC50的32 462倍和2 937倍。以上这几种高效低毒类杀虫药剂对黄褐天幕毛虫幼虫均具有较高的杀虫活性,但微生物源杀虫剂多杀菌素与之相比,对黄褐天幕毛虫具有更高的杀虫活性,对4龄幼虫的杀虫活性高于5龄。因此考虑到药剂杀虫活性与虫龄间的关系,在田间使用多杀菌素防治害虫时,应注意科学合理使用,尽量选择害虫对药剂相对敏感的时期施药。
羧酸酯酶、乙酰胆碱酯酶、多功能氧化酶和谷胱甘肽S-转移酶是昆虫体内重要的解毒酶,对分解外源毒物、维持正常生理代谢、昆虫抗药性方面起着重要作用(Rumpf et al., 1997; Mohan et al., 2003)。Wang等(2009)研究发现:亚致死剂量多杀菌素对黄褐中国棉铃虫(Helicoverpa armigera)3龄幼虫CarE和GST的活性没有明显影响。然而本研究发现多杀菌素作为外源有害物质能有效影响天幕毛虫4,5龄幼虫解毒酶活性,诱导昆虫自身解毒酶系做出应激反应。其中,对黄褐天幕毛虫4龄幼虫CarE具有明显的激活作用,对其AchE和MFO则具有先激活后抑制的作用,与王光峰等(2003)研究结果一致。说明用多杀菌素处理初期虫体对药剂产生应激反应,调控CarE、AchE和MFO持续表达并上调,以达到解毒目的,但随着处理时间的延长,药剂在虫体内富集量超过自身代谢解毒能力,从而使得AchE和MFO活性降低。对GST活性的影响较复杂,表现为先抑制后激活再抑制的作用,这种作用模式可能是由于多杀菌素处理初期对虫体有极强的毒杀效果并表现在对GST活性的抑制上,但是随着药剂处理时间的延长,虫体产生应激反应,诱导GST活性上升,从而产生一定的抗性,但随着处理时间的延长,因药剂在虫体内的富集而重新受到抑制。兰亦全(2004)等报道甜菜夜蛾福州种群对虫酰肼的抗性与GST有一定关系。多杀菌素对天幕毛虫5龄幼虫MFO和GST活性的影响与4龄相似; 而对CarE和AchE活性的作用与4龄相异,两种酶活性均明显被抑制,说明不同龄期幼虫对同一种药剂的应激反应不完全一致。Rabea等(2010)报道多杀菌素处理后的蜜蜂(Apis mellifera)成虫各组织中的AchE活性明显被抑制,AchE活性可作为监测多杀菌素的生物标记。
杀虫剂进入昆虫体内后,会扰乱生物体正常活性氧平衡系统,造成活性氧积累,自由基浓度升高,虫体受到伤害。昆虫的保护酶主要包括超氧化物歧化酶、过氧化物酶和过氧化氢酶,他们在消除昆虫体内过量的氧自由基方面起重要作用(Fridovich, 1977)。张友军等(2003)报道采用亚致死剂量多杀菌素处理3龄甜菜夜蛾幼虫,对其体内SOD、POD和CAT等主要保护酶系的活性无明显影响。而光活化杀虫剂α-T能使菜青虫(Pieris rapae)超氧化物歧化酶失活(Jiang et al., 2001),且有效抑制淡色库蚊(Culex pipiens pallens)SOD、POD和CAT活性,使昆虫无法及时清除虫体产生的超氧阴离子O2·等活性氧(蒋志胜等, 2003),说明不同种类的昆虫对多杀菌素存在不同的应激反应。本研究发现,多杀菌素对黄褐天幕毛虫4,5龄幼虫体内CAT均表现为抑制—激活—抑制作用; 因龄期差异,4龄幼虫SOD活性表现为激活—抑制—再激活,POD活性表现为先激活再抑制的作用,而5龄幼虫SOD和POD均表现为抑制作用。
| [] | 高希武. 1987. Gorun等改进的Ellman胆碱酯酶活性测定方法介绍. 昆虫知识(4): 245–246. |
| [] | 郭秀芝, 毛洪捷, 李长青. 2009. 天幕毛虫的生活习性及防治技术. 吉林林业科技, 38(6): 50. |
| [] | 胡春祥, 胡杨, 谢淑萍, 等. 2007. 12种生物无公害药剂对3种杨树食叶害虫的毒力测定及防治. 东北林业大学学报, 35(5): 41–43, 63. |
| [] | 胡春祥, 刘辉, 张硕. 2008. 7种药剂对榆紫叶甲和黄褐天幕毛虫的毒力测定及防治. 东北林业大学学报, 36(4): 40–41, 53. |
| [] | 蒋志胜, 尚稚珍, 万树青, 等. 2003. 光活化杀虫剂α-三噻吩的电子自旋共振分析及其对库蚊保护酶系统活性的影响. 昆虫学报, 46(1): 22–26. |
| [] | 兰亦全, 赵士熙. 2004. 甜菜夜蛾抗药性监测及机理. 福建农林大学学报:自然科学版, 33(1): 26–29. |
| [] | 林琎. 2004. 脱氧鬼臼毒素杀虫作用机理初步研究. 西北农林科技大学硕士学位论文. |
| [] | 刘德伟, 鞠丹. 2008. 几种生物制剂对黄褐天幕毛虫的生物测定. 中国林副特产(3): 21–24. |
| [] | 王春生, 邓兴林, 丁志杰. 2003. 天幕毛虫灾情测报监控及综合防治. 东北林业大学学报, 31(1): 61–63. |
| [] | 王光峰, 张友军, 柏连阳, 等. 2003. 多杀菌素对甜菜夜蛾多酚氧化酶和羧酸酯酶的影响. 农药学学报, 5(2): 7. |
| [] | 尹显慧, 吴青君, 李学峰, 等. 2008. 多杀菌素亚致死浓度对小菜蛾解毒酶系活力的影响. 农药学学报, 10(1): 28–34. |
| [] | 张国财, 赵杨, 马力, 等. 2010. 豚草杀虫活性物质毒力测定及安全测定. 东北林业大学学报, 38(6): 94–96, 100. |
| [] | 张友军, 王光锋, 吴青君, 等. 2003. 多杀菌素对不同发育阶段甜菜夜蛾的毒力及其体内超氧化物歧化酶、过氧化氢酶和过氧化物酶的影响. 农药学学报, 5(3): 31–38. |
| [] | Aslan I, Coruh S, Ozbek H, et al. 2005. Brevibacillus agri, a pathogenic bacterium of Malacosoma neustria (Lepidoptera: Lasiocampidae). Fresenius Environ Bulletin, 14(2): 98–100. |
| [] | Beauchamp C, Fridovich I. 1971. Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels. Analytical Biochem, 44(1): 276–287. DOI:10.1016/0003-2697(71)90370-8 |
| [] | Booth J, Boyland E, Sims P. 1961. An enzyme from rat liver catalysing conjugations with glutathione. Biochem J, 79(3): 516–524. DOI:10.1042/bj0790516 |
| [] | Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 72(1-2): 248–254. DOI:10.1016/0003-2697(76)90527-3 |
| [] | Chance B, Maehly A C. 1955. Assay of catalases and peroxidases. Methods Enzymol, 11(2): 764–775. |
| [] | Fang S Y. 1992. The eco-geographical distribution of forest insects in China. J Forestry Research, 3(2): 13–22. |
| [] | Fridovich I. 1977. Oxygen is toxic!. Bioscience, 27(7): 462–466. DOI:10.2307/1297527 |
| [] | Hansen L G, Hodgson E. 1971. Biochemical characteristics of insect microsomes: N-and O-demethylation. Biochem Pharmacol, 20(7): 1569–1578. DOI:10.1016/0006-2952(71)90285-1 |
| [] | Jiang Z S, Shang Z Z, Wan S Q, et al. 2001. Photosensitive Effects of two chemicals on superoxide dismutase activity in Pieris rapae larvae. Chinese J Pesti Sci, 3(1): 36–40. |
| [] | Jankevica L, Zarins I. 1997. Biological control of Malacosoma neustria L population with Latvian isolate of nuclear polyhedrosis virus//Evans H F. Microbial Insecticides: Novelty or Necessity? Symposium Proceeding No. 68 British Crop Protection Council, 285-288. |
| [] | Kati H, Ince I A, Sezen K, et al. 2009. Characterization of two Bacillus thuringiensis ssp. morrisoni strains isolated from Thaumetopoea pityocampa (Lep., Thaumetopoeidae). Biocontrol Sci Technol, 19(5/6): 475–484. |
| [] | Mohan M, Gujar G T. 2003. Local variation in susceptibility of the diamondback moth, Plutella xylostella (Linnaeus) to insecticides and role of detoxification enzymes. Crop Protection, 22(3): 495–504. DOI:10.1016/S0261-2194(02)00201-6 |
| [] | Rabea E I, Nasr H M, Badawy M E. 2010. Toxic effect and biochemical study of chlorfluazuron, oxymatrine, and spinosad on honey bees (Apis mellifera). Arch Environ Contam Toxicol, 58(3): 722–732. DOI:10.1007/s00244-009-9403-y |
| [] | Ruf C, Freese A, Fiedler K. 2003. Larval sociality in three species of central-place foraging lappet moths (Lepidoptera: Lasiocampidae): a comparative survey. Zoologischer Anzeiger-A J Comparative Zool, 242(3): 209–222. DOI:10.1078/0044-5231-00099 |
| [] | Rumpf S, Hetzel F, Frampton C. 1997. Lacewings (Neuroptera: Hemerobiidae and Chrysopidae) and integrated pest management: enzyme activity as biomarker of sublethal insecticide exposure. J Econ Entomol, 90(1): 102–108. DOI:10.1093/jee/90.1.102 |
| [] | Salgado V L, Watson G B, Sheets J J. 1997. Studies on the mode of action of spinosad, the active ingredient in tracer insect control. Dow Elanco, IN, USA: Proc Beltwide Cotton Conf: 1082–1086. |
| [] | Salgado V L. 1998. Studies on the mode of action of spinosad: Insect symptoms and physiological correlates. Pesti Biochem Physiol, 60(2): 91–102. DOI:10.1006/pest.1998.2332 |
| [] | Semiz G, Cetin H, Isik K, et al. 2006. Effectiveness of a naturally derived insecticide, spinosad, against the pine processionary moth Thaumetopoea wilkinsoni Tams (Lepidoptera: Thaumetopoeidae) under laboratory conditions. Pest Manag Sci, 62(5): 452–455. DOI:10.1002/(ISSN)1526-4998 |
| [] | Shiga M. 1977. Population dynamics of Malacosoma neustria testacea (Lepidoptera: Lasiocampidae): Stabilizing process in a field population. Researches on Population Ecol, 18(2): 284–301. DOI:10.1007/BF02510854 |
| [] | Thompson G D, Dutton R, Sparks T C. 2000. Spinosad a case study: An example from a natural products discovery programme. Pest Management Sci, 56(8): 696–702. DOI:10.1002/(ISSN)1526-4998 |
| [] | Van Asperen K. 1962. A study of housefly esterases by means of a sensitive colorimetric method. J Insect Physiol, 8(4): 401–414. DOI:10.1016/0022-1910(62)90074-4 |
| [] | Verdinelli M, Sanna-Passino G. 2003. Development and feeding efficiency of Malacosoma neustrium larvae reared with Quercus spp. leaves. Ann Appl Biol, 143(2): 161–167. DOI:10.1111/aab.2003.143.issue-2 |
| [] | Wang D, Qiu X, Ren X, et al. 2009. Effects of spinosad on Helicoverpa armigera (Lepidoptera: Noctuidae) from China: Tolerance status, synergism and enzymatic responses. Pest Manag Sci, 65(9): 1040–1046. DOI:10.1002/ps.v65:9 |
| [] | Watson G B. 2001. Actions of Insecticidal Spinosyns on γ-aminobutyric acid responses from small-diameter Cockroach Neurons. Pesti Biochem Physiol, 71(1): 20–28. DOI:10.1006/pest.2001.2559 |
| [] | Zhao J Z, Li Y X, Collins H L, et al. 2002. Monitoring and characterization of diamondback moth (Lepidoptera: Plutellidae) resistance to spinosad. J Econ Entomol, 95(2): 430–436. DOI:10.1603/0022-0493-95.2.430 |
 2012, Vol. 48
2012, Vol. 48