文章信息
- 胡玉净, 邓丽娟, 张杰, 沈红香, 姚允聪
- Hu Yujing, Deng Lijuan, Zhang Jie, Shen Hongxiang, Yao Yuncong
- 干旱胁迫下外源ABA对观赏海棠叶片可溶性蛋白和脱水素积累的影响
- Effects of Exogenous ABA on Accumulation of the Soluble Proteins and Dehydrins in Leaves of Ornamental Crabapples under Soil Drought Stress
- 林业科学, 2012, 48(4): 35-42.
- Scientia Silvae Sinicae, 2012, 48(4): 35-42.
-
文章历史
- 收稿日期:2011-06-20
- 修回日期:2011-09-21
-
作者相关文章
脱水素(dehydrin,DHD)是一类胚胎发育后期丰富蛋白(LEA, late embryogenesis abundant proteins), 属于LEAD-Ⅱ家族,分子量为9~200 ku(Cloutier et al., 1984),因其蛋白组成中富含赖氨酸的K片段, 具有高度热稳定性和亲水性。自20世纪80年代从水稻(Oryza sativa)胚胎中发现脱水素之后(Mundy et al., 1988),研究者就对其进行广泛的研究,初步证明植物脱水素具有稳定细胞膜(Koag et al., 2003)、清除自由基(Hara et al., 2003)、保护冷敏感性酶(Hara et al., 2001; Wisniewski et al., 1999)、保护细胞免受脱水伤害(Close,1996)和DNA/RNA结合特性(Mouillon et al., 2006)等功能。当植物处于干旱、高盐与寒冷胁迫逆境时,细胞失水量增加, 此时脱水素能在细胞内广泛表达(Reviron et al., 1992; Lim et al., 1998; Khedr et al., 2003),并在转录水平和蛋白水平上积累量与植株的抗逆能力成正相关(Nylander et al., 2001; Rodriguez et al., 2005; Danyluk et al., 1998; 张晓娟等,2007)。脱水素通常受发育阶段、脱落酸和脱水信号的调节, 但因植物种类或品种不同所表达种类不同。除了干旱胁迫能够引起脱水素表达以外, 外源脱落酸处理等也能诱导脱水素的表达和积累(Genadii et al., 2002)。前人研究发现植物脱水素的表达存在依赖ABA和不依赖ABA 2种途径,ABA缺陷型和ABA不敏感型突变体在种子成熟后期,蛋白质合成减少且不耐脱水, 而外施ABA或有活性的ABA类似物后表现正常(Close et al., 1989),这说明ABA和脱水素可能在此过程中也起着重要的作用(Bradford et al., 1992)。但是,Still等(1994)经过比较抗与非抗失水水稻与野稻(Z. palustris)品种胚轴的脱水素与ABA的关系,认为对脱水素的敏感与ABA的合成无关。
关于果树在逆境中脱水素积累的研究多集中在低温胁迫方面。Muthalif等(1994)从低温胁迫下的蓝莓(Vaccinium uliginosum)花芽中分离出65,60和14 kDa等脱水素,发现其在低温下含量持续增加,恢复到正常温度时,脱水素含量下降。Porat等(2002)从葡萄柚(Citrus paradiis cv. ‘Marsh’)成熟果实的果皮中发现一种脱水素COR15,它们的表达能增强果实的耐低温能力。本研究以抗旱性不同的观赏海棠品种为试材,通过外源ABA处理,研究干旱胁迫下果树脱水素的积累,其与植株水分状况、可溶性蛋白积累的关系,旨在揭示ABA处理对不同抗性品种脱水素诱导和积累的生理机制。
1 材料与方法 1.1 试验材料试验材料选用生长势相对一致的2年生观赏海棠幼树,品种为抗旱性较强的‘王族’(Malus spp.cv. ‘Royalty')和抗旱性较弱的‘红丽’(Malus spp. cv. ‘Red Splendor’)(邓丽娟等,2011), 砧木为八棱海棠(Malus micromalus)来自于北京农学院观赏海棠种质资源圃。2007年春季将幼树植入上口直径为33.5 cm、下底直径为22 cm、高28 cm塑料盆钵中。栽培基质重质量每盆10 kg,质量比例为:土壤:农家肥:锯末=3:1:1,每盆种植1株,置于日光温室内,正常管理。
1.2 试验处理试验于2008年5月10日开始处理,采用盆栽人工控水法(DW),于处理前3天,对每盆试验植株予以充分灌水,使盆内土壤含水量达田间最大持水量的90%~ 80%,此后停止灌水。设置预处理后的(第1个测定日)0天(土壤干旱对照),7和10天(重度土壤干旱处理)为干旱处理级别,以土壤含水量为处理依据(Hsiao,1973)。在上述干旱处理的基础上,从停止灌水后即设置2组处理:第1组为土壤干旱胁迫处理+喷水(DW组),在干旱处理前3天,每天上午10:00分别对‘王族’和‘红丽’植株叶面均匀喷施40 mL去离子水,然后停止浇水; 第2组为干旱处理+ABA处理(DA组),在干旱处理前3天,每天上午10:00分别于‘王族’和‘红丽’植株叶面喷施40 mL,25 μmol·L-1 ABA溶液。以ABA处理后的第1个测定日为0天。试验采用随机区组设计,单株小区,5次重复。
1.3 试验指标及方法分别于处理后0, 7,10天的早上8:00,从盆内4个方位取0~20 cm层土样,混合后四分法取适量土壤样品,装入铝盒,以待测定土壤含水量(SWC)。并采集DW组和DA组植株新梢中部4~7片成熟叶,一部分迅速装入采样袋置于冰盒中,带回测定叶片相对含水量(RWC)和相对电导率(REC)。另一部分装入样带后置于液氮中带回实验室,测定可溶性蛋白含量(SPC)和脱水素蛋白免疫杂交测定。
1.3.1 土壤含水量(SWC)采用烘干法。在盆内根系周围用土钻取样,装入铝盒。在室内称未装土的铝盒质量(W1);然后将土样装进铝盒并称质量(W2)。揭开铝盒盖,放入烘箱中,150℃下烘至恒质量(约12 h),从烘箱中取出铝盒,益好盒盖,称质量(W3)。每个土样重复3次。SWC(%)=(W1-W2)/(W2-W3)×100%。
1.3.2 叶片相对含水量(RWC)采用烘干称质量法(Zhang et al., 2010) RWC(%)=[(鲜质量-干质量)/(饱和质量-干质量)] ×100%。
1.3.3 相对电导率(REC)采用电导法(Jiang et al., 2002)。首先测量去离子水的电导率C0。然后将叶片去离子水冲洗3次后,剪成0.25 cm2的小片,称取0.25 g叶片。放入试管中,加5 mL蒸馏去离子水。在振动器上搅拌1 h,然后用电导仪测量该溶液的电导率(C1)。然后沸水浴15 min,拿出冷却至室温后,再测此溶液的电导率(C2)。按下式的公式计算REC值:相对电导率(REC)=(C1— C0)/(C2— C0)×100%。
1.3.4 可溶性蛋白(SPC)含量测定参照Jiang等(2002)的方法,稍作改进,从叶片中提取总的可溶性蛋白。液氮法研磨叶片组织(0.5 g鲜质量)至细粉状,并快速转移至干净的离心管中,加入1.5 mL硼酸缓冲液(50 mmol·L-1硼酸钠盐,50 mmol·L-1抗坏血酸,1%β-巯基乙醇,1 mmol·L-1苯甲基磺酰化氟(PMSF, pH9.0),混匀后于4 ℃,13 000 r·min-1, 离心1 h,提取上清液。采用考马斯亮蓝法(张治安等,2004)测定蛋白质含量,取30 μL蛋白样品与1.5 mL考马斯亮蓝试剂短暂混合,2 min后测定595 nm处的吸光度值,以牛血清蛋白作为标准。
1.3.5 SDS-PAGE和免疫印记杂交参照Jiang等(2002)的方法。提取上述可溶性蛋白上清液继续在4 ℃下,13 000 r·min-1,离心15 min,取上清液制备SDS-PAGE样品。取80 μL蛋白样品加入20 μL 5×SDS上样缓冲液(65 mmol·L-1 Tris-HCl,10%甘油,2%SDS,pH 6.8,1%溴酚蓝,5%β-巯基乙醇),沸水浴3~5 min,根据每管样品蛋白质浓度计算上样量体积,每孔上样30 μg总蛋白。用5%的浓缩胶和16%的分离胶,进行SDS-PAGE分析,溴酚蓝染料前沿至凝胶末端处时停止电泳。切去浓缩胶,在分离胶上做好标记放入培养皿中,倒入少量考马斯蓝G-250显色液,在摇床上振荡2 h,染色。倾去染色液,用脱色液(20%乙醇,70%冰醋酸)洗涤摇晃,期间要不断更换脱色液(4 h一次),直至凝胶背景清楚为止(12~18 h)。用直尺分别量出标准蛋白质、待测蛋白质区带中心以及溴酚蓝中心距分离胶顶端的距离,按下式计算相对迁移率:相对迁移率=样品迁移距离(cm)/染料迁移距离(cm)。以标准蛋白相对迁移率的对数为纵坐标,以标准蛋白分子量为横坐标作图,制作标准曲线。根据待测蛋白质样品的相对迁移率,从标准曲线上查出其相对分子量。
脱水素免疫印记杂交,将另一块同样处理但未经考马斯亮蓝染色的凝胶,200 mA恒流,4 ℃过夜电转移至带0.45 mm孔的硝酸纤维素膜上。印迹膜用丽春红S应用液染色2 min后, 并用PBS漂洗数次,在TBST缓冲液中,用3%的BSA室温封闭2 h后,用制备好的以1:1 000比例稀释后的抗脱水素抗血清(从Stressgen生物技术公司购买)为一抗(1:1 000)进行杂交。用TBST缓冲液漂洗3次后,凝胶膜与用碱性磷酸酶标记(AP)的羊抗兔二抗IgG(稀释比例:1:1 000)室温温育1 h。将膜放入培养皿中,加入底物反应液,室温晃动5 min,用预混匀的磷酸盐/四唑淡蓝底物反应液检测杂交条带SDS-PAGE和蛋白免疫印记分析,3次重复。
1.4 数据处理应用Excel,SPSS13.0,DPS系统软件,Brand软件进行试验数据分析。
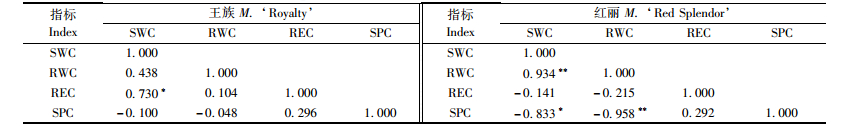
2 结果与分析 2.1 干旱胁迫下ABA处理对观赏海棠幼树根际土壤含水量(SWC)的影响随着干旱胁迫时间的延长,对照处理(DW)和ABA处理(DA)的观赏海棠幼树SWC呈显著下降趋势,而在干旱处理7天以后,SWC下降速度较缓慢。按照Hsiao(1973)的标准划分,本试验中,ABA和喷水干旱胁迫处理的观赏海棠土壤在胁迫处理7和10天后均达到重度干旱。但同一胁迫时间内,干旱胁迫处理和ABA处理的观赏海棠的SWC无显著差异(图 1)。‘王族’和‘红丽’盆栽幼树根际土壤SWC,未见品种间存在显著差异。

|
图 1 干旱胁迫下ABA处理的观赏海棠根际土壤含水量 Fig.1 Soil water content in matrix of potted ornamental crabapples by ABA pretreatment under soil drought stress DW:喷水+土壤干旱Pre-water+Soil drought;DA: ABA处理+土壤干旱ABA pretreatment+Soil drought.下同。The same below. |
由图 2可知:随着干旱处理时间的延长,在对照条件下,‘王族’叶片RWC在干旱处理7天时上升,而后下降; ‘红丽’叶片RWC则呈相反趋势; 2品种RWC在干旱处理0, 7天时出现显著差异。而在ABA处理条件下,‘王族’叶片RWC在干旱处理7天后反而下降,而后上升,‘红丽’叶片RWC在整个处理期间持续下降,2品种RWC在干旱处理7,10天时出现显著差异。与对照相比,ABA处理的‘王族’叶片在干旱处理后0和10天时RWC升高; 红丽’叶片的RWC在7和10天时下降。分析表明:‘红丽’叶片RWC与SWC呈极显著正相关,而‘王族’叶片RWC与SWC相关性不显著(表 1)。
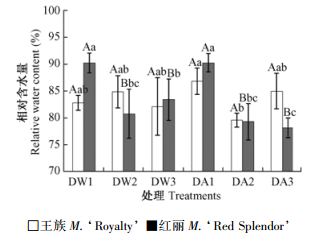
|
图 2 干旱胁迫下ABA处理的观赏海棠叶片RWC的变化 Fig.2 Changes of RWC in leaves of ornamental crabapples by ABA pretreatment under soil drought stress DW1,DW2和DW3分别代表对照+土壤干旱处理后0,7和10天,DA1,DA2和DA3分别代表ABA处理+干旱处理后0,7和10天。DW1, DW2 and DW3 refer to 0, 7 and 10 d after pre-water+soil drought treatments, respectively. DA1, DA2 and DA3 refer to 0, 7 and 11 d after ABA pretreatment + soil drought treatment respectively.大小写字母分别表示同一品种不同处理后天数间邓肯新复极差测验P < 0.01和P < 0.05显著水平。Upper and lower case letters indicated significance of P < 0.01 and P < 0.05 by Duncan's significant test in different days of treatments, respectively.下同。The same below. |
|
|
由图 3可知:随着干旱胁迫时间的延长,在对照条件下,‘王族’叶片REC在干旱处理7天时出现下降,而后恢复到0天水平,‘红丽’叶片REC则无显著变化,2品种在0, 7天时出现显著差异。而在ABA处理条件下,‘王族’叶片REC持续下降,‘红丽’在10天时出现极显著上升。和对照相比,ABA处理降低了干旱处理后10天时‘王族’叶片的REC,却提高了10天时‘红丽’叶片的REC。相关性分析表明:‘王族’叶片的REC与其SWC呈显著正相关、与RWC则无显著相关性; ‘红丽’叶片的REC与其SWC,RWC均无显著相关性。
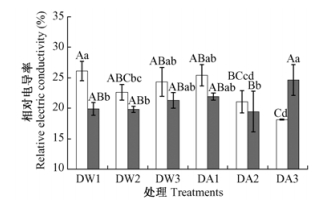
|
图 3 干旱胁迫下ABA处理的观赏海棠叶片REC的变化 Fig.3 Changes of REC in leaves of ornamental crabapples by ABA pretreatment under soil drought stress |
从图 4可知:在对照条件下,和0天相比,2个品种叶片SPC在7和10天均出现显著上升,品种间差异在各时间点上均达到极显著水平。在ABA处理条件下,‘王族’叶片SPC在10天时极显著下降,‘红丽’叶片SPC却呈极显著上升趋势,品种间差异在各时间点上也都达到显著水平。和对照相比,ABA处理提高了干旱处理0天时SPC降低了10天时‘王族’叶片的SPC; 提高了干旱处理0和10天时‘红丽’叶片的SPC。相关性分析表明:‘王族’叶片SPC与SWC,RWC相关性不显著,‘红丽’叶片的SPC与其SWC和REC则呈极显著正相关。
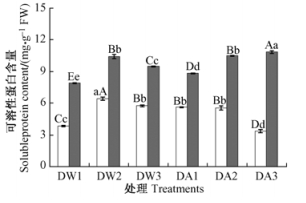
|
图 4 干旱胁迫下ABA处理的观赏海棠叶片SPC的变化 Fig.4 Changes of SPC in leaves of ornamental crabapples by ABA pretreatment under drought stress |
如图 5所示:在对照和ABA处理干旱胁迫条件下,‘王族’和‘红丽’叶片分别积累了14种可溶性蛋白,分子量从12~146 ku不等。其中表现出明显变化的各有6种,‘王族’叶片分别是14.8,18.0,46.2,50.9,78.1,145.2 ku; ‘红丽’叶片分别是14.4,18.0,32.8,46.2,89.6,141.0 ku。
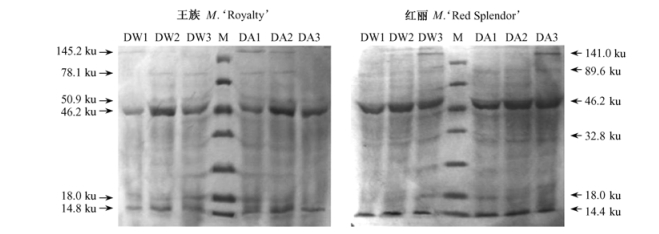
|
图 5 干旱胁迫条件下ABA处理的观赏海棠叶片可溶性蛋白SDS-PAGE Fig.5 SDS-PAGE profiles of soluble protein in leaves of ornamental crabapples by ABA pretreatment under soil drought stress 每个泳道30 μg可溶性蛋白。标准蛋白从上至下7个条带的分子量依次为: 116.0, 66.2, 45.0, 35.0, 25.0, 18.4和14.4 ku。箭头表示干旱处理条件下对照和ABA处理中变化明显的叶片可溶性蛋白组分。There is 30 μg soluble protein per lane. Molecular mass markers (MW) of protein Marker is 116.0, 66.2, 45.0, 35.0, 25.0, 18.4 and 14.4 ku from up to down. Arrows indicate soluble protein changes significantly in response to pre-water and ABA pretreatment under drought stress.下同。The same below. |
在对照条件下,‘王族’叶片50.9,78.1 ku蛋白在0天未见积累,除145.2 ku外,其他可溶性蛋白均随干旱胁迫程度加深表达量出现增强。ABA处理条件下,‘王族’叶片14.8,46.2,50.9 ku蛋白表达量则呈现先积累(7天)后下降(10天)趋势,其他可溶性蛋白表现出持续下降,尤其是78.1,145.2 ku在10天时表达量极低。从总表达量上看,ABA处理增加了‘王族’叶片可溶性蛋白的积累量,并随干旱程度加深表现出积累量增加。
在对照条件下,‘红丽’叶片18.0,141.0 ku蛋白表达量随干旱程度加深表现出积累量增加,其他蛋白表达则变化不明显。ABA处理条件下,随干旱处理时间的延长,‘红丽’叶片141.0 ku蛋白表达量随之增强,18.0 ku蛋白表达量则呈现出下降趋势; 从总表达量上看,ABA处理未促进‘红丽’叶片可溶性蛋白的积累,只有141.0 ku出现表达量增强。
2.6 干旱胁迫下ABA处理对观赏海棠幼树叶片脱水素蛋白表达的影响从图 6可知:随着干旱胁迫的加深,‘王族’和‘红丽’叶片分别积累了2种脱水素,其中,‘王族’叶片表现出14.8和51.0 ku脱水蛋白积累,‘红丽’叶片表现出14.4和32.8 ku脱水蛋白的积累。
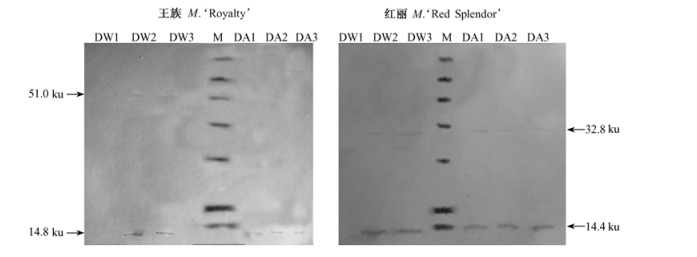
|
图 6 干旱胁迫条件下ABA处理的观赏海棠叶片可溶性蛋白免疫印迹分布 Fig.6 Immunoblotting profiles of soluble protein in leaves of ornamental align="center"rabapples by ABA pretreatment under soil drought stress |
在对照条件下,‘王族’叶片在0天时未见14.8和51.0 ku脱水素积累,但随干旱胁迫程度的加深积累量出现明显增加,并且14.8 ku的积累量远大于51.0 ku。在ABA处理条件下,‘王族’叶片显见14.8和51.0 ku脱水素积累,随干旱胁迫程度的加深,51.0 ku积累量在10天时出现下降,而14.8 ku变化不显著。ABA处理有提高‘王族’叶片0天时、减低10天时14.8和51.0 ku脱水素积累的趋势。
在对照条件下,‘红丽’叶片在0天时未见14.4和32.8 ku脱水素积累,但随干旱胁迫程度的加深积累出现量明显增加,并且14.4 ku的积累量远大于32.8 ku。在ABA处理条件下,‘红丽’叶片出现14.4和32.8 ku脱水素积累,随干旱胁迫程度的加深,32.8 ku积累量在10天时出现下降,而14.4 ku变化不显著。ABA处理有提高‘红丽’叶片0天时14.4 ku、减低10天时32.8 ku脱水素积累的趋势。
3 讨论ABA在诱导脱水素基因表达的过程中起重要作用,被认为是一类ABA响应蛋白(RAB)。外源ABA处理能够诱导多种脱水素基因的表达(Choi et al., 1999; Wang et al., 2002)。干旱处理条件下,外源ABA处理可诱导冬小麦(Triticum aestivum)、黑麦(Secale cereal)、玉米(Zea mays)幼苗63和52 ku类脱水素(Genadii et al., 2002)、转基因白桦(Betula platyphylla)脱水素基因(张瑞萍,2009)和鹰嘴豆(Cicer arietinum)101个脱水诱导型转录物的表达(Boominathan et al., 2004),大豆(Glycine max)幼苗脱水素基因Mat1的积累并不受ABA的诱导,而仅受脱水作用的诱导(Mark et al., 1997)。这说明植物脱水素的表达存在依赖ABA和不依赖ABA 2种途径。干旱胁迫和外施ABA处理均能诱导桃树(Prunus persica) ppdhnl/PCA60 (Timothy et al., 1997)和高牛毛草(Bulbostylis barbata)23~60 ku类脱水素(Jiang et al., 2002)的积累。桃树脱水素在脱水条件下积累量要比在ABA处理下的高,但高牛毛草类脱水素的积累情况却与之相反。这说明ABA有促进和减缓植物脱水素合成的双向作用,因植物种类或品种差异而不同。此外,Jiang等(2002)在研究2种高牛毛草在干旱胁迫条件下,其叶片中与脱水素和热休克蛋白合成相关发生的生理变化时,发现23和27 ku脱水素在干旱胁迫及预喷施ABA干旱胁迫处理10天后呈现表达,而在未喷施ABA干旱胁迫处理下的植株中表达量更高。本研究中,干旱处理分别比对照(0天)诱导了‘王族’叶片14.8,51.0 ku和‘红丽’14.4,32.8 ku脱水蛋白的积累。ABA处理明显诱导了2品种叶片在干旱处理0天时脱水素的积累,但降低了干旱处理7天后‘王族’叶片14.8,51.0 ku和‘红丽’叶片32.8 ku的积累; 随着土壤干旱胁迫的加重,抗旱性较强品种‘王族’叶片脱水素的下降幅度明显大于抗旱性较弱品种‘红丽’。此结果表明:ABA能够诱导正常水分条件下观赏海棠叶片脱水素的表达,当植株处于干旱胁迫时,此诱导作用随干旱胁迫的加重在不同品种和抗旱性海棠植株叶片中发生不同程度的减缓,具体表现为ABA对干旱胁迫下抗旱性较强品种脱水素的相应的减缓作用较强。推测ABA处理使抗旱性较强品种的多数可溶性蛋白积累量下降,对脱水素积累的抑制作用较强; 而使抗旱性较弱品种的少数可溶性蛋白积累量下降,对脱水素积累抑制作用较弱。此抑制作用的强弱可能与抗旱性不同品种植株,在面临干旱胁迫时所采取的抗旱策略具有一定相关性,对此还有待进一步的研究。本研究选用液氮速冻或放在冰盒的采样方法客观上不可避免的给本试验待测样品增加了瞬时的寒冷胁迫,使样品处于另一种胁迫逆境从而直接诱导脱水素的瞬时表达,但从本试验结果来看,对照组干旱处理0天时未见有任何脱水素的表达痕迹,说明此种寒冷胁迫对本研究结果造成的干扰和影响很小。
许多研究表明:大豆(Whitsitt et al., 1997)、结缕草(Zoysia spp.)(Patton et al., 2007)和小麦(杨颖,2007)等逆境植株中,脱水素或脱水素基因的表达量与其品种间抗旱性、抗寒性和抗冻性强弱有关。通常在抗性植株中的表达量要高于对逆境敏感的植株(Allagulova et al., 2003)。但也有报道认为:干旱胁迫下,抗旱和不抗旱鸭茅(Dactylis glomerata)脱水素的表达量与抗旱性没有相关性(Volaire et al., 2005)。相似的结果在茄属(Solanum)植物中也有报道。本试验中ABA处理+干旱胁迫和对照条件下,抗旱性较弱品种‘红丽’反而比抗旱性较强品种‘王族’积累了更多的脱水素,表明干旱胁迫下观赏海棠脱水素表达量与其品种间抗旱性不存在对应的相关性,这可能与观赏海棠不同品种的抗旱策略、脱水素以及相应的小分子可溶性蛋白、叶片的含水量、膜的渗透性有关。
ABA诱导脱水素积累与相应的小分子可溶性蛋白的积累密切相关。本试验结果表明:ABA处理明显增加了干旱处理下‘王族’叶片可溶性蛋白的积累量,这与ABA处理下‘王族’叶片脱水素的表达量变化趋势相一致。对于‘红丽’ABA处理未促进其叶片小分子可溶性蛋白的积累,但其18.0 ku蛋白积累量变化与其脱水素18.0 ku的变化趋势相一致,均随干旱胁迫的加重而积累量下降。2品种可溶性蛋白的表达与其相应脱水素的积累变化紧密相关。本试验还表明:ABA诱导脱水素积累与植物水分状况密切相关。已知不同耐旱性小麦品系在相同干旱胁迫条件下,耐旱性强的品种叶片相对含水量大,细胞膜相对透性较小,而耐旱性弱的品种则相反(邓丽娟等,2011; 于茜等,2010)。本研究中ABA处理条件下,‘王族’叶片0和10天时RWC明显比对照干旱处理下对应的RWC值要高,并且RWC变化与其脱水素的变化趋势相一致,叶片REC也明显降低。而ABA处理下‘红丽’叶片RWC未出现下降,RWC变化与其脱水素之间无显著一致性,叶片REC也未出现明显下降,反而在干旱处理10天后显著上升。根据以上结果推测,对于抗旱品种‘王族’来说,ABA处理能够较强的减缓干旱胁迫下脱水素的积累,较大幅度降低叶片中多数可溶性蛋白的积累量,从而降低其叶片REC,调节、维持并改善干旱胁迫下叶片的水分状况。而对抗旱性较弱品种‘红丽’而言,ABA处理对干旱胁迫下其脱水素的积累减缓作用较弱,较小幅度降低叶片中少数可溶性蛋白的积累量,因此不能有效降低其叶片REC,从而改善干旱胁迫下叶片的水分状况。
ABA诱导干旱条件下植物脱水素积累是非常复杂的生理过程,不仅与植物的水分状况、可溶性蛋白、品种间的代谢差异相关,同时与干旱条件下的组织、器官、细胞以及亚细胞的代谢水平相互关联,值得进一步的深入研究。
| [] | 邓丽娟, 沈红香, 姚允聪. 2011. 观赏海棠品种对土壤干旱胁迫的响应差异. 林业科学, 47(3): 25–32. DOI:10.11707/j.1001-7488.20110305 |
| [] | 杨颖. 2007. 小麦类脱水素基因的克隆WZY1~1抗体的制备. 西北农林科技大学硕士学位论文. |
| [] | 于茜, 张林生. 2010. 干旱胁迫下小麦叶片脱水素的表达与水分的关系. 西北农林科技大学学报.自然科学版, 38(2): 69–75. |
| [] | 张瑞萍. 2009. 脱水素基因逆境表达模式与白桦遗传转化研究. 东北林业大学博士学位论文. |
| [] | 张晓娟, 张林生, 杨颖. 2007. 水分胁迫下小麦类脱水素基因表达的半定量RT-PCR分析. 西北植物学报, 27(11): 2158–2162. DOI:10.3321/j.issn:1000-4025.2007.11.003 |
| [] | 张治安, 陈展宇. 2004. 植物组织中可溶性蛋白质含量的测定, 植物生理学实验指导. 北京, 中国农业科学技术出版社. |
| [] | Allagulova C R, Gimalov F R, Shakirova F M, Vakhitov V A. 2003. The plant dehydrins: structure and putative functions. Biochemistry, 68(9): 945–951. |
| [] | Arbip A, Wisniewski M. 1997. Tissue-specific expression of a dehydrin gene in one-year-old 'Rio Oso Gem' peach trees. J Amer Soc Hort Science, 122(6): 784–787. |
| [] | Boominathan P, Shukla R, Kumar A, et al. 2004. Long term transcript accumulation during the development of dehydration adaptation in Cicer arietinum. Plant Physiology, 135(3): 1608–1620. DOI:10.1104/pp.104.043141 |
| [] | Bradford K J, Chandler P M. 1992. Expression of "dehydrin-like" proteins in embryos and seedlings of Zizania palustris and Oryza sativa during Dehydration. Plant Physiology, 99(2): 488–494. DOI:10.1104/pp.99.2.488 |
| [] | Choi D W, Zhu B, Close T J. 1999. The barley (Hordeum vulgare L.) dehydrin multigene family: sequences, allele types, chromosome assignments, and expression characteristics of 11 Dhn genes of cv Dicktoo. Theor Appl Genet, 98(8): 1234–1247. DOI:10.1007/s001220051189 |
| [] | Close T J. 1996. Dehydrins: emergence of a biochemical role of a family of plant dehydration proteins. Physiol Plant, 97(4): 795–803. DOI:10.1111/ppl.1996.97.issue-4 |
| [] | Close T J, Kortt A A, Chandler P M. 1989. A cDNA-based comparison of dehydration-induced proteins (dehydrins) in barley and corn. Plant Mol Biology, 13(1): 95–108. DOI:10.1007/BF00027338 |
| [] | Cloutier Y, Andrew C J. 1984. Efficiency of cold hardiness induction by desiccation stress in four winter cereals. Plant Physiology, 76(3): 595–598. DOI:10.1104/pp.76.3.595 |
| [] | Danyluk J, Perron A, Houde M, et al. 1998. Accumulation of an acidic dehydrin in the vicinity of the plasma membrane during cold acclimation of wheat. Plant Cell, 10(4): 623–638. DOI:10.1105/tpc.10.4.623 |
| [] | Hara M, Terashima S, Fukaya T, et al. 2003. Enhancement of cold tolerance and inhibition of lipid peroxidation by citrus dehydrin in transgenic tobacco. Planta, 217(2): 290–298. |
| [] | Hara M, Terashima S, Kuboi T. 2001. Characterization and cryoprotective activity of cold-responsive dehydrin from Citrus unshiu. J Plant Physiol, 158(10): 1333–1339. DOI:10.1078/0176-1617-00600 |
| [] | Hsiao T C. 1973. Plant responses to water stress. Annual Review of Plant Physiology, 24: 519–570. DOI:10.1146/annurev.pp.24.060173.002511 |
| [] | Jiang Y W, Huang B R. 2002. Protein alterations in Tall Fescue in response to drought stress and abscisic acid. Crop Sci, 42(1): 202–207. DOI:10.2135/cropsci2002.2020 |
| [] | Koag M C, Fenton RD, Wilkens S, et al. 2003. The binding of maize DHN1 to lipid vesicles. Gain of structure and lipid specificity. Plant Physiol, 131(1): 309–316. DOI:10.1104/pp.011171 |
| [] | Lim C C, Krebs S L, Arora R. 1998. Freezing tolerance in Rhododendron and its association with dehydrin expression. HortScience, 33(3): 443–558. |
| [] | Mouillon J M, Gustafsson P, Harryson P. 2006. Structural investigation of disordered stress proteins. Comparison of full-length dehydrins with isolated peptides of their conserved segments. Plant Physiol, 141(2): 638–650. DOI:10.1104/pp.106.079848 |
| [] | Mundy J, Chua N H. 1988. Abscisic acid and water stress induce the expression of a novel rice gene. EMBO J, 7(8): 2279–2286. |
| [] | Muthalif M M, Rowland L J. 1994. Identification of dehydrin-like proteins responsive to chilling in floral buds of blueberry (Vaccinium, section Cyanococcus). Plant Physiology, 104(4): 1439–1447. DOI:10.1104/pp.104.4.1439 |
| [] | Nylander M, Svensson J, Palva E T, et al. 2001. Stress-induced accumulation and tissue-specific localization of dehydrins in Arabidopsis thaliana. Plant Mol Biol, 45(3): 263–279. DOI:10.1023/A:1006469128280 |
| [] | Patton A J, Cunningham S M, Volenec J J, et al. 2007. Differences in freeze tolerance of zoysiagrasses: Ⅰ. Role of proteins. Crop Science, 47(5): 2162–2169. DOI:10.2135/cropsci2006.11.0739 |
| [] | Porat R, Pavoncello D, Lurie S, et al. 2002. Identification of a grapefruit cDNA belonging to a unique class of citrus dehydrins and characterization of its expression patterns under temperature stress conditions. Physiol Plant, 115(4): 598–603. DOI:10.1034/j.1399-3054.2002.1150414.x |
| [] | Reviron M, Vartanian N, Sallantin M, et al. 1992. Characterization of a novel protein induced by progressive or rapid drought and salinity in Brassica napus leaves. Plant Physiology, 100(3): 1486–1493. DOI:10.1104/pp.100.3.1486 |
| [] | Rodriguez E M, Svensson J T, Malatrasi M, et al. 2005. Barley Dhn13 encodes a KS-type dehydrin with constitutive and stress responsive expression. Theor Appl Genet, 110(5): 852–828. DOI:10.1007/s00122-004-1877-4 |
| [] | Still D W, Kovach D A, Bradford K J. 1994. Development of Desiccation Tolerance during Embryogenesis in Rice (Oryza sativa) and Wild Rice (Zizania palustris) (Dehydrin expression, abscisic acid content, and sucrose accumulation). Plant Physiology, 104(2): 431–438. DOI:10.1104/pp.104.2.431 |
| [] | Volaire F, Norton M R, Norton G M, et al. 2005. Seasonal patterns of growth, dehydrins and water-soluble carbohydrates in genotypes of Dactylis glomerata varying in summer dormancy. Annals of Botany, 95(6): 981–990. DOI:10.1093/aob/mci102 |
| [] | Wang X G, Loh C S, Yeoh H H, et al. 2002. Drying rate and dehydrin synthesis associated with abscisic acid induced dehydration tolerance in Spathoglottis plicata orch idaceae protocorms. J Exp Bot, 53(368): 551–558. DOI:10.1093/jexbot/53.368.551 |
| [] | Whitsitt M S, Collins R C, Mullet J E. 1997. Modulation of dehydration tolerance in soybean seedlings-Dehydrin Mat1 is induced by dehydration but not by abscisic acid. Plant Physiol, 114(3): 917–925. DOI:10.1104/pp.114.3.917 |
| [] | Zhang J, Yao Y C, Streeter J G, et al. 2010. Influence of soil drought stress on photosynthesis, carbohydrates and the nitrogen and phophorus absorb in different section of leaves and stem of Fugi/M. 9EML, a young apple seedling. African Journal of Biotechnology, 9(33): 5320–5325. |
 2012, Vol. 48
2012, Vol. 48