文章信息
- 王存国, 韩士杰, 周玉梅, 张军辉, 张岩, 徐媛, 王树堂
- Wang Cunguo, Han Shijie, Zhou Yumei, Zhang Junhui, Zhang Yan, Xu Yuan, Wang Shutang
- 长白山阔叶红松林群落的细根现存量及养分内循环
- Fine Root Mass and Internal Nutrient Cycling in a Broad Leaved-Korean Pine Forest Community of the Changbai Mountain
- 林业科学, 2012, 48(3): 148-153.
- Scientia Silvae Sinicae, 2012, 48(3): 148-153.
-
文章历史
- 收稿日期:2011-05-17
- 修回日期:2011-10-05
-
作者相关文章
2. 中国科学院研究生院 北京 100049
2. Graduate University of Chinese Academy of Sciences Beijing 100049
细根(直径≤2 mm)是植物吸收水分和养分的重要器官,细根通过呼吸作用和周转过程向土壤输送有机质(Jackson et al., 1997; 王政权等,2008)。细根生物量虽然仅占植物体总生物量的5%左右,但由于细根生长和周转迅速,其生长量可占森林初级生产力的50%~75%(Nadelhoffer et al., 1992),每年通过枯死细根归还到土壤中的有机物是地上凋落物的数倍,归还到土壤的N元素比凋落物多18%~58%(McClaugherty et al., 1982; Vogt et al., 1986; 1996;李凌浩等,1998),所以细根一定程度上制约着森林生态系统的C分配和养分循环。如果忽略细根的生产、死亡和分解,土壤有机物质和养分元素的周转将被低估20%~80%(Vogt et al., 1996)。自20世纪70年代以来,细根生产、周转、分解、季节动态及细根养分转移等研究逐步揭示出不同生态系统细根生物量、寿命、周转的大致格局,形成了对细根从出生到死亡的生活史的初步了解(McClaugherty et al., 1982; Vogt et al., 1986; Hendrick et al., 1993b; 杨丽韫等,2007; Quan et al., 2010; Yang et al., 2010)。
养分内循环是植物体内各器官或组织之间进行的养分转移(刘增文等,1997; 黄石竹等,2006),细根在频繁的死亡过程中,将大量养分归还给土壤的同时又通过养分内循环,将养分转移给其他器官,这种养分的转移使树木在养分有效性较低的土壤或养分供应不足的季节维持正常生长,以弥补土壤养分供应的不足,因此,养分内循环是树木减少养分损失的适应对策,是提高养分利用效率的重要途径(黄石竹等,2006; 吴勇等,2010)。目前关于树木地下部分根系养分内循环的研究相对较少,且因细根养分内循环研究的难度较大,对树木细根养分内循环的研究结论还存在诸多争议(Nambiar,1987; Gordon et al., 2000; 黄石竹等,2006; 吴勇等,2010)。
本研究以长白山原始阔叶红松林为对象,调查了生长季(6—10月)0~10 cm和10~20 cm土层群落主要木本植物细根现存量及细根中C,N,P,K含量的季节动态,揭示了阔叶红松林细根在生态系统物质和养分循环中的重要作用并为今后开展长白山阔叶红松林细根周转及养分循环的研究提供理论依据。
1 研究地概况与研究方法 1.1 研究地概况与样地选择研究样地位于长白山原始阔叶红松林内(42°24′ N,128°05 ′E,海拔768 m),该区属于典型的大陆性季风气候,冬季漫长而寒冷,常有积雪覆盖;夏季短暂且温暖,降雨较多。2009年6—10月降水量为576 mm,平均气温为11.9 ℃(图 1),土壤类型为火山灰母质上发育的暗棕色森林土。根据群落的连片程度和树木生长状况选择3块50 m×50 m的林地作为样地。试验区林分郁闭度为0.8,主要乔木为红松(Pinus koraiensis)、紫椴(Tilia amurensis)、色木槭(Acer mono)、水曲柳(Fraxinus mandshurica)、糠椴(Tilia mandshurica)和枫桦(Betula costata);主要灌木为毛榛子(Corylus mandshurica)、东北山梅花(Philadelphus schrenkii)和刺五加(Eleutherococcus senticosus);主要草本植物包括山茄子(Brachybotrys paridiformis)、透骨草(Phryma leptostachya)、水凤仙(Impatiens aquatilis)。

|
图 1 2009年5—10月月平均气温及月降雨量 Fig.1 Mean monthly air temperature and precipitation from May to October, 2009 |
1) 细根现存量及养分含量测定2009年6—10月,每月中旬用内径5 cm的土钻在样地内沿相距10 m的3条线走“S”形,等距离地钻取土芯30个(每条线取10个)。钻取土柱前,去除地表枯落物,分0~10 cm和10~20 cm深度分别钻取土芯;以前研究显示该林型细根主要集中在20 cm以上的土壤层中(郭忠玲等,2006)。将取出的土芯放入自封袋密封,运回实验室在-4 ℃下保存。处理时将土芯放置在2,1,0.5,0.25 mm土壤套筛上,用流动水冲洗直至洗净为止,捡出细根(直径≤2 mm),同时依据根的外形、颜色、弹性、根皮与中柱分离的难易程度等区分活细根和死细根。所有捡出的细根主要包括红松、色木槭、水曲柳和紫椴等的细根。将挑出的细根放置在65 ℃的烘箱中烘干至恒量并称量。
因每个取样点细根量较少,粉碎和化学分析前需把每个样地内相同土层的细根混在一起。粉碎的细根先用H2SO4-H2O2消煮制备待测液,采用凯氏法测定全氮,钼锑抗比色法测定全磷,利用原子吸收法测定全钾,利用重铬酸钾法测定全碳。
利用下列公式计算细根现存量和细根养分内循环率:现存量(t·hm-2)=平均每个土芯细根质量(g)×102π(d/2)2,其中d为根钻内径(cm)。
养分内循环率(%)=(活细根养分含量(mg·g-1)-死细根养分含量(mg·g-1)/活细根养分含量(mg·g-1)(黄石竹,2006)。
1.3 数据分析采用SPSS 17.0(SPSS Inc.,USA)软件进行统计分析。细根现存量及养分含量的季节变化,不同土层间以及活细根和死细根间养分含量的差异均用单因素方差分析。
2 结果与分析 2.1 细根现存量的动态变化生长季内,活细根和死细根质量均表现出明显的月份差异(图 2,P < 0.05)。多重比较表明:8月活细根生物量比7月高13.21%(分别为6.00,5.30 t·hm-2),而7,9,10月活细根生物量无明显差异,平均为5.35 t·hm-2,6月活细根生物量(2.93 t·hm-2)明显低于其他月份(P < 0.001)。7月(2.03 t·hm-2)和9月(2.16 t·hm-2)死细根质量明显高于6月(1.14 t·hm-2)和10月(1.34 t·hm-2)(P < 0.05)。生长季内,活细根平均生物量(5.00 t·hm-2)大约是死细根平均质量(1.81 t·hm-2)的3倍。细根现存量(活细根+死细根)6月最低,为4.07 t·hm-2,而7—10月细根现存量无明显差异,平均为7.35 t·hm-2。

|
图 2 生长季0~20 cm土层活细根生物量及死细根现存量 Fig.2 Fine root biomass and necromass in 0~20 cm soil across growing season 不同字母表示活细根生物量(小写字母)和死细根现存量(大写字母)月份间差异显著,P < 0.05。Different letters indicate that differences of fine root biomass (lowercase) and necromass (uppercase) among months is significant at 0.05 level. |
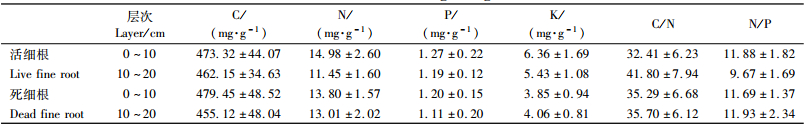
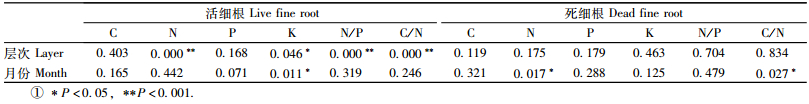
0~10 cm土层土壤活细根中N,K含量以及N/P均明显比10~20 cm土层中的高(分别高30.83%,17.13%和22.85%),而C/N则低22.46%(表 1,2,P < 0.001),C和P含量虽然也显示出上层0~10 cm较高的趋势,但差异不显著(表 2,P>0.05)。0~10 cm和10~20 cm土层死细根中的各元素含量差异不显著(表 1,2,P>0.05)。
|
|
|
|
活细根中K含量呈明显的月变化(图 3e,表 2,P < 0.05),而生长季各月的C,N,P含量无明显差异;死细根中N含量季节波动明显(图 3b,表 2,P < 0.05),而C,P,K含量无明显差异。9月活细根中K含量最高7.17 mg·g-1,8月最低5.14 mg·g-1,平均为5.92 mg·g-1。6—10月,活细根中C,N,P的平均含量分别为468.19,13.30,1.24 mg·g-1。死细根N含量最高是8月(14.44 mg·g-1),最低是6月(11.96 mg·g-1),平均为13.40mg·g-1,C,P,K的平均含量分别为467.29,1.15,3.96 mg·g-1(图 3,表 3)。

|
图 3 cm土层活细根及死细根中C,N,P,K及C/N与N/P动态变化 Fig.3 Seasonal variations in contents of C, N, P and K, ratio of C/N and N/P in live and dead fine root in 0~20 cm soil |
|
|
生长季节内,活细根C/N及N/P均无明显月变化,平均值分别为36.73和10.83;死细根C/N呈明显的月变化(图 3f,表 2,P < 0.05),6月最高,达40.04,7—10月无明显差异,而死细根N/P各月间差异不明显,平均值为11.81(图 3d,表 3)。
2.3 细根养分内循环率0~20 cm土层活细根P的平均含量显著高于死细根(表 3,P < 0.05),其内循环率为7.26%,活细根和死细根中K的平均含量差异极显著(表 3,P < 0.001),其内循环率为33.11%,而活细根与死细根中N含量差别不大,分别为13.30 mg·g-1(活细根)和13.40 mg·g-1(死细根),此外,C含量也没有明显的差异(表 3)。
3 讨论温带森林活细根生物量在4.4~7.4 t·hm-2(Vogt et al., 1986; Jackson et al., 1997),本研究中活细根生物量(5.00 t·hm-2)在这一范围内,接近单建平等(1993)(5.05 t·hm-2)和郭忠玲等(2006)对这一地区的研究结果(4.49 t·hm-2),但低于杨丽韫等(2005)的研究结果(8.28 t·hm-2)。长白山阔叶红松林细根量在不同调查年份间的差异,预示着细根具有高度的时间异质性同时反映出环境条件的年际间变化。此外,本研究中活细根生物量和死细根现存量均存在明显的季节变化,其他温带森林的研究结论(Quan et al., 2010)也支持这一结论。细根现存量受生物因素和非生物因素(物种组成、降水量、土壤温度和养分有效性等)的综合影响(McClaugherty et al., 1982; 郭忠玲等,2006; Quan et al., 2010)。在温带地区,森林生态系统细根现存量可能存在1个(春季或夏季)或2个生长高峰(春季和秋季),但也有的研究认为细根现存量没有明显季节变化(McClaugherty et al., 1982; Hendrick et al., 1993a; 1993b;陈光水等,2004)。本研究中活细根生物量在8月达到高峰,较高的细根现存量通常伴随着旺盛的植物生长及充足的养分和水分(Hendrick et al., 1993a),6—7月土壤温度上升,降雨增加,细根生长加速,林地细根生物量在8月达到高峰。而随着雨季的到来,植被光合作用减弱,细根生长下降(Nadelhoffer,2000)。此外,较高的细根现存量意味着植物分配更多的C到根系中去(Nadelhoffer et al., 1992),但本研究中当细根现存量出现高峰时,细根中的C含量却没有出现较大升高,可能是因为细根的N含量较高,呼吸加速消耗大量C的结果(Pregitzer et al., 1995)。生长季内死细根现存量与活细根生物量变化趋势基本相同,但有明显的时滞现象(Vogt et al., 1986; 郭忠玲等,2006)。
本研究中活细根中K含量季节变化明显,这一方面与K的理化特征有关,K在植物体内基本以游离态存在,极易发生移动(黄石竹等,2006)。另外,植物对K元素需求的阶段性以及土壤养分和水分的供应状况都会影响植物器官中的K元素含量。6月降雨量较多,温度升高,细根新陈代谢活动加强,新的细根开始生长,吸收养分的能力也相应增强,因此细根K含量也开始上升。8月群落地上部分生长加剧,对养分的需求量增加,细根输送养分到地上部分,致使细根中K含量下降。而到秋季,地上部分叶片开始凋落,地下部分细根大量死亡,死细根和叶片中K迁移,因而活细根K含量再度升高。死细根N含量季节变化明显,其原因可能在于6—8月降雨和温度增加,微生物固定了来自树干茎流、降雨和大气中的N,细根N元素增加,9—10月,温度降低且降雨量减少,细根中N元素变化不大(杨丽韫等,2007)。
本研究中发现0~10 cm土层细根中养分含量高于10~20 cm土层,而在其他生态系统的研究(Gordon et al., 2000; Shemesh et al., 2010; 杜有新等,2010)也证实了这一点。土壤N的有效性影响生态系统C的分配格局,细根中N和P的含量与土壤资源有效性密切相关(Nadelhoffer,2000; Norby et al., 2000)。不同土层土壤资源有效性具有差异性,土壤表面积累的大量枯落物为土壤微生物提供C源和养分,提高土壤的养分有效性和贮量,促进细根在表层土壤中的相对聚集,从而决定细根中养分含量也随土层加深而逐渐降低(Hertel et al., 2002; 杜有新等,2010)。
根系吸收养分需要C的投入,根系C/N及N/P既反映根系构建成本,又反映土壤的营养状况(于立忠等,2009)。Jackson等(1997)和Gordon等(2000)综述包括热带、温带、寒带和苔原等群落类型细根(直径≤2 mm)中养分元素含量后得出,全球细根平均N和P含量分别为11.00~11.70 mg·g-1和0.90~1.10 mg·g-1,长白山原始阔叶红松林群落主要木本植物活细根中N(13.30 mg·g-1)含量和P(1.24 mg·g-1)含量均高于全球平均水平,但N含量接近Yang等(2010)的研究结果(12.80 mg·g-1)。而本研究中C/N(36.73) 与N/P(10.83) 均低于全球平均C/N(43.00~45.00) 和N/P(11.00~12.00)(Jackson et al., 1997; Gordon et al., 2000),高于Valverde-Barrantes等(2007)和Stover等(2010)的研究结果。造成这些差异的主要原因可能是群落组成的差别,以及对细根定义的不一致,由于取样点不同,植被构成不同,细根的直径范围在0.5~2 mm内变动,而养分含量又直接与细根径级相关(Gordon et al., 2000; Pregitzer et al., 2002)。
N在树木体内虽是移动性较高的元素,但本研究未发现细根中N的转移,活细根与死细根中N含量分别为13.30 mg·g-1和13.40 mg·g-1。目前多数研究也认为N在细根衰老过程中不存在转移(Nambiar,1987; Gordon et al., 2000; 黄石竹等,2006)。Gordon等(2000)对热带、温带及苔原地区乔、灌、草等活细根和死细根中平均N含量的分析表明:死细根中平均N含量略高于活细根(分别为11.50,11.10 mg·g-1),因此认为N在细根衰老过程中没有发生内循环。此外,因为Ca是较稳定的元素,在根系中不易发生移动,所以Nambiar(1987)采用Ca/N来衡量辐射松(Pinus radiata)细根中N是否发生转移,发现辐射松活细根和死细根之间N含量和Ca/N比值均无差异。但也有研究认为,细根在衰老过程中N的内循环率高达23% (Ferrier et al., 1991)。吴勇等(2010)研究表明在人为加速死亡的柳杉(Cryptomeria fortunei)细根中N的内循环率更是高达48.85%。
本研究中发现阔叶红松林群落0~20 cm土层活细根P的平均含量显著高于死细根(P < 0.05),其内循环率为7.26%。Gordon等(2000)综述发现多数植物死根中P的平均含量低于活细根,P的内循环率约为30.43%。廖利平等(2000)研究发现桤木(Alnus cremastogyne)和刺楸(Kalopanax septemlobum)活细根中P含量高于死细根,说明两者细根衰老过程中P发生转移,而杉木(Cunninghamia lanceolata)死细根中P的含量大于活细根,说明杉木细根P未发生转移。但Nambiar(1987)研究表明辐射松细根中Ca/P变化很小,认为不存在P的转移。吴勇等(2010)也未发现柳杉细根衰老过程中P含量的显著变化。
K在树木体内基本以游离态存在,所以,在理论上K应该是极易发生转移的元素(黄石竹等,2006)。本研究表明K是内循环率较高的元素,达33.11%。廖利平等(2000)研究发现在整个生长季桤木、刺楸、杉木活细根中K的含量高于死细根,说明这3个树种细根衰老过程中K极可能发生转移。Gordon等(2000)通过综述大量已发表文献,认为K内循环率为39.29%。吴勇等(2010)对柳杉细根过程中养分内循环的研究发现细根中K的内循环率最高为51.52%。但Nadelhoffer等(1992)研究表明辐射松衰老的细根不存在K的转移。因此,养分在细根衰老死亡过程中是否发生转移的问题一直没有得到解决,其最大的限制就是细根养分内循环的研究方法(Gordon et al., 2000; 黄石竹等,2006)。首先,辨别森林生态系统根系何时死亡是很困难的,而且细根的死亡与分解是同时进行的;其次,根系没有凋落的空间,活细根与死细根养分含量的差异可能是细根衰老或取样过程中易移动养分淋洗的结果(Newman et al., 2006)。影响死细根中养分含量的因素除树木自身特性外还包括土壤温度、湿度以及养分有效性等环境因素,这些因素甚至影响同一种植物根系的养分含量,使评估养分迁移更加复杂。此外,细根与其他有机体(如微生物和土壤动物)存在密切关系,菌根在细根养分转移过程中的作用以及细根分解释放出的养分是否被植物优先利用都需要今后进行深入探讨(Gordon et al., 2000; 黄石竹等,2006)。因此,今后在细根养分内循环的研究上不但要改进研究方法,更需要严格控制这些变异因子来验证养分迁移问题。
| [] | 陈光水, 杨玉盛, 何宗明, 等. 2004. 福建柏和杉木人工林细根生产力、分布及周转的比较. 林业科学, 40(4): 15–21. DOI:10.11707/j.1001-7488.20040403 |
| [] | 杜有新, 潘根兴, 李恋卿, 等. 2010. 贵州中部喀斯特山地不同植被生态系统细根生态特征及养分储量. 应用生态学报, 21(8): 1926–1932. |
| [] | 郭忠玲, 郑金萍, 马元丹, 等. 2006. 长白山几种主要森林群落木本植物细根生物量及其动态. 生态学报, 26(9): 2855–2862. |
| [] | 黄石竹. 2006. 水曲柳和落叶松细根养分内循环的研究. 东北林业大学硕士论文. |
| [] | 黄石竹, 张彦东, 王政权. 2006. 树木细根养分内循环. 生态学杂志, 25(11): 1395–1399. DOI:10.3321/j.issn:1000-4890.2006.11.019 |
| [] | 李凌浩, 林鹏, 邢雪荣. 1998. 夷山甜槠林细根生物量和生长量研究. 应用生态学报, 9(4): 337–340. |
| [] | 廖利平, 高洪. 2000. 人工混交林中杉木, 恺木和刺楸细根养分迁移的初步研究. 应用生态学报, 11(2): 161–164. |
| [] | 刘增文, 李雅素, 吕月玲. 1997. 刺槐主要养分元素内循环及外循环研究. 南京林业大学学报, 21(4): 6–10. |
| [] | 单建平, 陶大立, 王淼, 等. 1993. 长白山阔叶红松林细根周转的研究. 应用生态学报, 4(3): 241–245. |
| [] | 王政权, 郭大立. 2008. 根系生态学. 植物生态学报, 32(6): 1213–1216. |
| [] | 吴勇, 李贤伟, 荣丽, 等. 2010. 柳杉细根衰老过程中的养分内循环. 林业科学, 46(2): 1–5. DOI:10.11707/j.1001-7488.20100201 |
| [] | 杨丽韫, 李文华. 2005. 长白山原始阔叶红松林细根分布及其周转的研究. 北京林业大学学报, 27(2): 1–5. |
| [] | 杨丽韫, 李文华, 吴松涛. 2007. 长白山原始红松阔叶林及其次生林细根分解动态和N元素的变化. 北京林业大学学报, 29(6): 10–15. |
| [] | 于立忠, 丁国泉, 朱教君, 等. 2009. 施肥对日本落叶松不同根序细根养分浓度的影响. 应用生态学报, 20(4): 747–753. |
| [] | Ferrier R C, Alexander I J. 1991. Internal redistribution of N in Sitka spruce seedlings with partly droughted root systems. Forest Science (USA), 37(3): 860–870. |
| [] | Gordon W S, Jackson R B. 2000. Nutrient concentrations in fine root. Ecology, 81(1): 275–280. DOI:10.1890/0012-9658(2000)081[0275:NCIFR]2.0.CO;2 |
| [] | Hendrick R L, Pregitzer K S. 1993a. The dynamics of fine root length, biomass, and nitrogen content in two northern hardwood ecosystems. Canadian Journal of Forest Research, 23(12): 2507–2520. DOI:10.1139/x93-312 |
| [] | Hendrick R L, Pregitzer K S. 1993b. Patterns of fine root mortality in two sugar maple forests. Nature, 361(6407): 59–61. DOI:10.1038/361059a0 |
| [] | Hertel D, Leuschner C. 2002. A comparison of four different fine root production estimates with ecosystem carbon balance data in a Fagus Quercus mixed forest. Plant and Soil, 239(2): 237–251. DOI:10.1023/A:1015030320845 |
| [] | Jackson R B, Mooney H A, Schulze E D. 1997. A global budget for fine root biomass, surface area, and nutrient contents. Proceedings of the National Academy of Sciences, 94(14): 7362–7366. DOI:10.1073/pnas.94.14.7362 |
| [] | McClaugherty C A, Aber J D, Melillo J M. 1982. The role of fine root in the organic matter and nitrogen budgets of two forested ecosystems. Ecology, 63(5): 1481–1490. DOI:10.2307/1938874 |
| [] | Nadelhoffer K J. 2000. The potential effects of nitrogen deposition on fine-root production in forest ecosystems. New Phytologist, 147(1): 131–139. DOI:10.1046/j.1469-8137.2000.00677.x |
| [] | Nadelhoffer K J, Raich J W. 1992. Fine root production estimates and belowground carbon allocation in forest ecosystems. Ecology, 73(4): 1139–1147. DOI:10.2307/1940664 |
| [] | Nambiar E K S. 1987. Do nutrients retranslocate from fine roots. Canadian Journal of Forest Research, 17(8): 913–918. DOI:10.1139/x87-143 |
| [] | Newman G S, Hart S C. 2006. Nutrient covariance between forest foliage and fine root. Forest Ecology and Management, 236(2/3): 136–141. |
| [] | Norby R J, Jackson R B. 2000. Root dynamics and global change:seeking an ecosystem perspective. New Phytologist, 147(1): 3–12. DOI:10.1046/j.1469-8137.2000.00676.x |
| [] | Pregitzer K S, DeForest J L, Bruton A J, et al. 2002. Fine root length, diameter, specific root length and nitrogen concentrations of nine tree species across four North American Biomes. Ecological Monographs, 72: 293–309. DOI:10.1890/0012-9615(2002)072[0293:FRAONN]2.0.CO;2 |
| [] | Pregitzer K S, Zak D R, Curtis P S, et al. 1995. Atmospheric CO2, soil nitrogen and turnover of fine root. New Phytologist, 129(4): 579–585. DOI:10.1111/nph.1995.129.issue-4 |
| [] | Quan X K, Wang C K, Zhang Q Z, et al. 2010. Dynamics of fine root in five Chinese temperate forests. Journal of Plant Research, 123(4): 497–507. DOI:10.1007/s10265-010-0322-9 |
| [] | Shemesh H, Arbiv A, Gersani M, et al. 2010. The effects of nutrient dynamics on root patch choice. PloS ONE, 5(5): 10824. DOI:10.1371/journal.pone.0010824 |
| [] | Stover D B, Day F P, Drake B G, et al. 2010. The long-term effects of CO2 enrichment on fine root productivity, mortality, and survivorship in a scrub-oak ecosystem at Kennedy Space Center, Florida, USA. Environmental and Experimental Botany, 69(2): 214–222. DOI:10.1016/j.envexpbot.2010.03.003 |
| [] | Valverde-Barrantes O J, Raich J W, Russell A E. 2007. Fine-root mass, growth and nitrogen content for six tropical tree species. Plant and Soil, 290(1): 357–370. |
| [] | Vogt K A, Grier C C, Vogt D J. 1986. Production, turnover, and nutrient dynamics of above-and belowground detritus of world forests. Advances in Ecological Research, 15: 303–377. DOI:10.1016/S0065-2504(08)60122-1 |
| [] | Vogt K A, Vogt D J, Palmiotto P A, et al. 1996. Review of root dynamics in forest ecosystems grouped by climate, climatic forest type and species. Plant and Soil, 187(2): 159–219. |
| [] | Yang L Y, Wu S T, Zhang L B. 2010. Fine root biomass dynamics and carbon storage along a successional gradient in Changbai Mountains, China. Forestry, 83(4): 379–387. DOI:10.1093/forestry/cpq020 |
 2012, Vol. 48
2012, Vol. 48