文章信息
- 崔俊, 李孟楼
- Cui Jun, Li Menglou
- 羟基马桑毒素及其3种衍生物对粘虫的拒食活性与生理指标的影响
- Antifeedant Activities and Effects of Tutin and Its Derivatives on Mythimna separate (Lepidoptera: Noctuidae) and Its Physiological Parameters
- 林业科学, 2012, 48(3): 95-99.
- Scientia Silvae Sinicae, 2012, 48(3): 95-99.
-
文章历史
- 收稿日期:2010-08-11
- 修回日期:2011-09-26
-
作者相关文章
羟基马桑毒素(Tutin)是马桑(Coriaria sinica)中所含的倍半萜内酯类苦毒素物质,对多种昆虫具有拒食和胃毒活性(李孟楼等, 1996;马希汉等, 1995)。本实验室研究发现:低剂量的Tutin就能使粘虫(Mythimna separate)产生昏迷、抽搐等症状(郭新荣等,2007a),它对粘虫神经递质γ-氨基丁酸具有显著的拮抗作用(李孟楼等,2003),并对其乙酰胆碱酯酶、谷胱甘肽S-转移酶、消化酶、羧酸酯酶具有显著影响(郭新荣等,2007a;2007b)。另外,Tutin在胃毒作用下可造成粘虫和苹掌舟蛾(Phalera flavescens)中肠组织结构发生病变,破坏试虫马氏管的吸收-排泄循环方式(庄世宏等,2007)。虽然马桑中含有7种结构类似的倍半萜内酯化合物,但是Tutin的杀虫活性最高,这可能由于其具有2位羟基等特殊的化学结构(Li et al., 2007),因而Tutin的衍生物的合成与筛选备受研究者的关注(Matsuda et al., 2007)。本实验室于2007年报道了Tutin的晶体结构,并以Tutin为模板合成了3种2位羟基酰化衍生物(Li et al., 2007)。然而,对于这些化合物的拒食活性变化,以及其对试虫生理代谢指标的影响一直未见报道。
杀虫剂亚致死剂量的生理效应及酶学水平上的研究是杀虫剂筛选的基础(James et al., 2002)。酯酶和保护酶是昆虫体内最主要的解毒酶,其活性的改变与昆虫中毒死亡或产生耐药性有关,可溶性总糖则为昆虫的解毒代谢提供了能量基础(Conyers et al., 1998)。基于此,本文比较分析了亚致死剂量下Tutin及其衍生物对粘虫在48 h内的拒食活性,及其酯酶、保护酶和可溶性总糖等生理指标的变化趋势,以期为马桑内酯的进一步改造和结构优化提供依据。
1 材料与方法 1.1 材料 1.1.1 试虫粘虫购自西北农林科技大学无公害农药研究中心,用玉米(Zea mays)叶饲养,挑选蜕皮后第2天发育正常、个体大小一致的4龄幼虫供试。
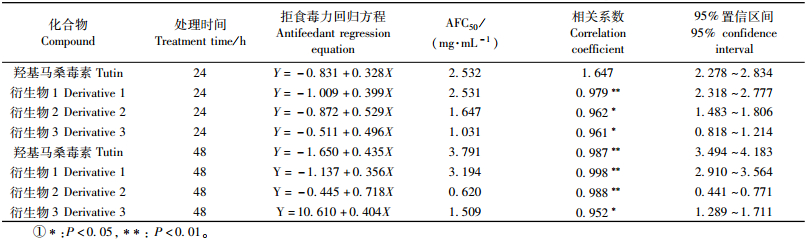
1.1.2 试剂Tutin由实验室提取于秦岭马桑籽中;其衍生物1为Tutin苯甲酰化衍生物(2-benzoyl-tutin)、衍生物2为Tutin α-甲基-丙烯酰化衍生物(2-iso-butenoyl-tutin)、衍生物3为Tutin氯乙酰化衍生物(2-chloroacetyl-tutin),均由本实验室以Tutin纯品为模版,以酰化加成的方法合成(Li et al., 2007),其化学结构如图 1所示。其他试剂均为分析纯。
|
图 1 Tutin及其衍生物(1, 2, 3) 的化学结构 Fig.1 Chemical structures of tutin and its derivatives 1, 2 and 3 |
拒食活性测定采用非选择性叶碟法(慕立义, 1997)。将Tutin及其衍生物分别配制成0.25, 0.50, 1.00, 2.00, 4.00 mg·mL-1的丙酮溶液,在直径1 cm圆形新鲜玉米叶碟上均匀涂抹5 μL样品液制成携毒叶碟,对照组涂抹5 μL丙酮液。在底部垫有湿润滤纸,直径9 cm的培养皿中放入携毒叶片和1头饥饿12 h的4龄粘虫,每浓度处理试虫30头,隔8 h观察1次并更换新的携毒叶片,共观察48 h。用方格纸法测定叶片的被食面积。
1.3 生理指标的测定 1.3.1 供试液的提取用Tutin及其衍生物2.0 mg·mL-1丙酮溶液,以非选择性叶碟法饲养试虫,对照组为丙酮液,每处理32头。每隔8 h取出食叶量相同的粘虫幼虫4头,在缓冲液中解剖出中肠,去除围食膜及食物残渣,分别称虫体和中肠质量;在研钵中加入0.04 mol·L-1(pH=7.0) 磷酸缓冲液和少许石英砂,在冰浴中研磨提取后分别定容至5 mL,然后在4 000 r·min-1、4 ℃条件下离心15 min,将上清液保存于4 ℃冰箱中备用。每处理重复提取5次。
1.3.2 酯酶活性的测定按陈长琨(1996)的比色法测定。其中,蛋白质含量按考马斯亮兰G-250染色法测定,以牛血清蛋白(bovine serum albumin,BSA)为标准蛋白。
1.3.3 保护酶活性的测定过氧化物酶(peroxidase,POD)活性采用愈创木酚比色法测定(Penney et al., 1981);超氧化物歧化酶(superoxide dismutase,SOD)活性按邻苯三酚自氧化法测定(李周直等, 1994)。
1.3.4 可溶性总糖含量的测定采用蒽酮比色法测定(高俊凤等,2000),以每μg样品中可溶性总糖的百分比表示。
1.4 统计与分析拒食活性测定中的拒食率=[(对照组食叶量-处理组食叶量)/对照组食叶量]×100%,对拒食毒力采用DPS 3.01软件中的时间-剂量死亡率模型进行分析,并获得拒食毒力回归方程。生理指标测定中的各生理指标变化率=[(处理组测定值-对照组测定值)/对照组测定值]×100%,所测数据用SPSS 13.0软件进行方差分析、多重检验(Duncan氏检验),用OriginPro 7.5进行制图。
2 结果与分析 2.1 拒食活性测定结果从表 1的差异显著性方差分析(df=3,F=191.177,P=0.000<0.01) 可知,Tutin的3种结构衍生物对粘虫的拒食活性均较Tutin有所提高;但以衍生物2的拒食活性最高,较Tutin提高了51.20%~55.49%,且在48 h内有9.30%的试虫死亡。
|
|
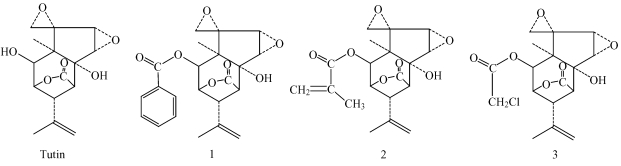
如图 2所示:在24 h衍生物2处理下的粘虫体液酯酶活性升高195.38%,显著高于另外3个化合物(df=3,F=9.17,P=0.006<0.01);而Tutin和衍生物1,3处理下粘虫体液酯酶活性变化率分别仅为17.28%,11.77%和22.27%。在32 h以后,4种化合物处理下体液酯酶活性变化率达92.29%~109.72%。Duncan氏检验表明:衍生物2与1,3之间差异显著,而Tutin与3种衍生物间的差异未达到显著水平。
|
图 2 Titin及其衍生物对粘虫酯酶活性的影响 Fig.2 Effects of tutin and its derivatives on esterase activities of M.separate A, B:体液Body fluid;C, D:中肠Midgut柱状图上不同字母表示差异显著(P<0.05),下同。 Bars labeled with different letters are significantly different (P < 0.05), the same below. |
Tutin和衍生物1,3对粘虫中肠酯酶具有一定的抑制作用,作用初期中肠酯酶活性变化率为-47.54%~-23.60%;但衍生物2约在16 h后酯酶活性逐渐升高,至48 h时达到51.23%。Duncan氏检验表明:衍生物2与Tutin、衍生物3之间差异显著,而衍生物1与另外3种化合物物间的差异未达到显著水平。
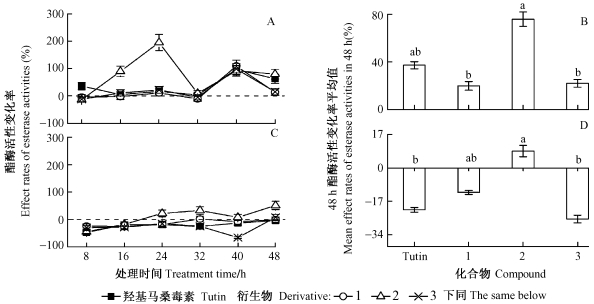
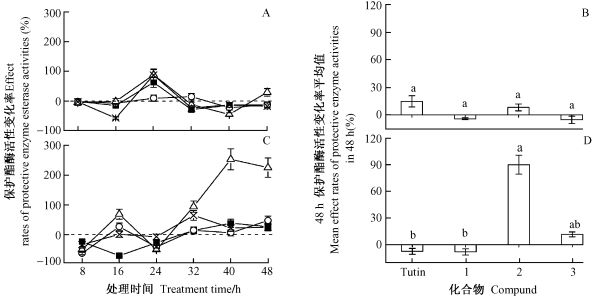
2.3 保护酶活性的变化由图 3可知:衍生物1和3处理组粘虫POD酶活性略有下降,48 h的平均值分别为-4.11%和-5.27%;而Tutin和衍生物2处理组粘虫POD酶活力略有上升,48 h的平均值分别为14.87%和8.28%。Duncan氏检验表明4种化合物处理组间粘虫POD酶活性变化无显著差异。
|
图 3 Tutin及其衍生物对粘虫保护酶活性的影响 Fig.3 Effects of tutin and its derivatives on protective enzyme activities of M.separate A, B: POD;C, D: SOD |
在48 h内,Tutin及其衍生物1,3对粘虫SOD酶活性平均值分别为-7.62%、-8.26%和11.46%,而衍生物2则达253.93%。Duncan氏检验表明:衍生物2与Tutin、衍生物1之间差异显著,而衍生物3与另外3种化合物物间的差异未达到显著水平。
2.4 可溶性总糖含量的变化由图 4可知,衍生物2, 3对粘虫幼虫体液可溶性总糖含量的影响趋势相同,衍生物1的影响则甚小,Tutin的影响在初期使可溶性总糖含量略下降、后期增加;以衍生物2的影响最大,可溶性总糖含量增幅达230.44%~265.34%。方差分析(df=3,F=3.979,P=0.002<0.01) 及Duncan氏检验表明:衍生物2与1和Tutin间差异显著,3与另外3种化合物间的差异未达到显著水平。
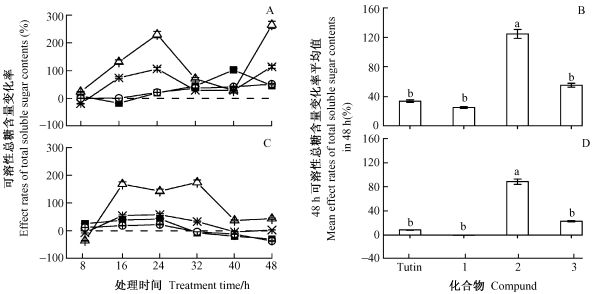
|
图 4 Tutin及其衍生物对粘虫可溶性总糖含量的影响 Fig.4 Effects of tutin and its derivatives on total soluble sugar contents of M.separate A, B:体液Body fluid;C, D:中肠Midgut. |
在处理48 h内,仍以衍生物2对中肠可溶性总糖含量的影响最大,其余3种化合物的影响则较小;Duncan氏检验表明:衍生物2与另外3种化合物间差异显著,Tutin与衍生物1, 3之间无差异。
3 讨论酯酶、SOD酶和POD酶在昆虫体内起到分解外源毒物、维持虫体正常生理活动的重要作用,糖类则是昆虫生理活动的主要能源物质(Feng et al., 1995;钟国华等,2001;Mukanganyama et al., 2003)。低剂量的酯类杀虫剂作用于酯类代谢过程及其底物可能会诱导酯酶活性升高,而高剂量的同类酯类杀虫剂则会聚集在参与其代谢过程的酶分子上,抑制酯酶的活性(Srinivasa et al., 2004)。SOD酶在生物体内可与氧自由基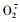
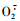
Tutin和衍生物1,2,3进入虫体后,首先与中肠液发生作用,破坏中肠的围食膜(Penney et al., 1981),然后作用于肠壁细胞,再进入虫体血液而影响其生理代谢过程。本研究中试虫摄食亚致死剂量的Tutin和3种衍生物后,其拒食活性为衍生物2>衍生物3>衍生物1>Tutin,在Tutin和衍生物1, 2, 3作用下,虫体体液及中肠液可溶性总糖含量升高,体液酯酶活性增加、中肠液酯酶含量降低,但Tutin和衍生物1,3对SOD和POD酶活性的影响不显著;而在衍生物2作用下,体液和中肠液酯酶、SOD酶活性显著升高,并导致部分试虫死亡。Tutin及其衍生物导致虫体体液和中肠总糖含量升高,可能使试虫生理代谢中的抗性酶活及解毒代谢增强,呼吸与能量代谢加速,导致脂肪体转化为单糖,释放至体液,并进入中肠。因此,Tutin和衍生物1, 2, 3对试虫酯酶的作用类似于低剂量的酯类杀虫剂(李孟楼等,2000),衍生物2可能对虫体内某一生理过程产生了影响,使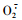
综上所述,对Tutin的2位羟基经酰化加成后得到的苯甲酰化衍生物1、α-甲基-丙烯酰化衍生物2、氯乙酰化衍生物3,对试虫的毒性均大于Tutin,表明对Tutin 2位羟基进行酰化加成改造能够提高其拒食活性。衍生物2是本试验中的最优结构化合物,表明对Tutin加成不同的基团后其活性有显著的差异,因而使用其他基团进行结构改造能否得到杀虫活性更理想的物质,还需要进行探索。
| [] | 陈长琨. 1996. 昆虫生理生化实验. 北京, 农业出版社. |
| [] | 高俊凤. 2000. 植物生理学实验技术. 西安, 世界图书出版公司. |
| [] | 郭新荣, 张雅林, 李孟楼. 2007a. 马桑内酯对粘虫幼虫体内3种酶活性的影响. 西北植物学报, 27(8): 1656–1660. |
| [] | 郭新荣, 张雅林, 李孟楼. 2007b. 马桑内酯对粘虫体内蛋白质和消化酶的影响. 西北植物学报, 27(12): 2456–2460. |
| [] | 李孟楼, 郭新荣, 唐光辉. 2000. 侧柏毒蛾幼虫酯酶对马桑毒素及4种杀虫剂的应激性反应. 西北农业学报, 9(3): 23–27. |
| [] | 李孟楼, 郭新荣, 谢恩魁, 等. 1996. 马桑毒素提取物对几种蚜虫的毒力试验. 西北林学院学报, 11(4): 55–59. |
| [] | 李孟楼, 庄世宏, 宗娜. 2003. 马桑毒素B对粘虫几种生理生化指标的影响. 西北农林科技大学学报, 31(6): 54–58. |
| [] | 李周直, 沈惠娟, 蒋巧根, 等. 1994. 几种昆虫体内保护酶系统活力的研究. 昆虫学报, 37(4): 399–403. |
| [] | 马希汉, 郭新荣, 李孟楼. 1995. 马桑籽提取物对黑肩毛胸榆叶甲取食及生殖的影响. 西北林学院学报, 10(1): 64–67. |
| [] | 慕立义. 1997. 植物化学保护研究方法. 北京, 中国农业出版社. |
| [] | 庄世宏, 宗娜, 李孟楼. 2007. 马桑毒素B对试虫马氏管及中肠组织的影响. 西北农林科技大学学报, 35(7): 127–130. |
| [] | 钟国华, 胡美英, 林进添, 等. 2001. 闹羊花素-Ⅲ对菜粉蝶幼虫血淋巴和中肠酯酶的影响. 华中农业大学学报, 20(1): 15–19. |
| [] | Conyers C M, MacNicoll A D, Price N R. 1998. Purification and characterisation of an esterase involved in resistance to organophosphorous insecticides in the saw-toothed grain beetle, Oryzaephilus surinamensis, (Coleoptera: Silvernidae). Insect Biochemistry and Molecular Biology, 28(7): 435–448. DOI:10.1016/S0965-1748(97)00113-6 |
| [] | Feng R Y, Chen W K, Isman M B. 1995. Synergism of malathion and inhibition of midgut esterase activities by an extract from Melia toosendan (Meliaceae). Pesticide Biochemistry and Physiology, 53(1): 34–41. DOI:10.1006/pest.1995.1052 |
| [] | Grubor-Lajsic G, Block W, Jovanovic A. 1996. Antioxidant enzymes in larva of the Antarctic fly, Belgica antarctica. Cryo Letters, 17(1): 39–42. |
| [] | Grubor-Lajsic G, Block W, Telesmanic M, et al. 1997. Eeffect of cold acclimation of the antioxidant defense system of two larval Lepidoptera (Noctuidae). Archives of Insect Biochemistry and Physiology, 36(1): 1–10. DOI:10.1002/(ISSN)1520-6327 |
| [] | James D J, Price T S. 2002. Fecundity in two spotted spider mite (Acari: Tetranychidae) is increased by direct and systemic exposure to imidacloprid. Journal of Economic Entomology, 95(4): 729–732. DOI:10.1603/0022-0493-95.4.729 |
| [] | Li M L, Cui J, Qin R H, et al. 2007. Semisynthesis and antifeedant activity of new acylated derivatives of Tutin, a sesquiterpene lactone from Coriaria sinica. Heterocycles, 71(5): 1155–1162. DOI:10.3987/COM-07-11021 |
| [] | Matsuda S, Matsumura K, Watanabe M, et al. 2007. Synthesis of a partially benzylated derivative of the anhydro-D-altro-heptulose found in Coriaria japonica A. Tetrahedron Letters, 48(33): 5807–5810. DOI:10.1016/j.tetlet.2007.06.057 |
| [] | Mukanganyama S, Figueroa C C, Hasler J A, et al. 2003. Effects of DIMBOA on detoxification enzymes of the Aphid Rhopalosiphum padi (Homoptera: aphididae). Journal of Insect Physiology, 49(3): 223–229. DOI:10.1016/S0022-1910(02)00269-X |
| [] | Penney G C, Hawkins R A. 1981. Comparison between biochemical and histochemical assessments of peroxidase activity in rat mammary tumours. Histochemical Journal, 13(6): 983–988. DOI:10.1007/BF01002638 |
| [] | Srinivasa R, Udikerib S S, Jayalakshmib S K, et al. 2004. Identification of factors responsible for insecticide resistance in Helicoverpa armigera. Comparative Biochemistry and Physiology Part C, 137(3): 261–269. |
 2012, Vol. 48
2012, Vol. 48