文章信息
- 李晓瑞, 胡尚连, 曹颖, 卢学琴, 任鹏, 吴晓宇, 周美娟
- Li Xiaorui, Hu Shanglian, Cao Ying, Lu Xueqin, Ren Peng, Wu Xiaoyu, Zhou Meijuan
- 农杆菌介导慈竹4CL基因遗传转化梁山慈竹
- Agrobacterium-Mediated Transformation of 4CL Gene from Neosinocalamus affinis into Dendrocalamus farinosus
- 林业科学, 2012, 48(3): 38-44.
- Scientia Silvae Sinicae, 2012, 48(3): 38-44.
-
文章历史
- 收稿日期:2011-07-14
- 修回日期:2011-10-27
-
作者相关文章
竹类植物在分子标记(Dong et al., 2011;Tang et al., 2010)、功能基因的分离与鉴定(Zhou et al., 2011)等方面的研究取得了一定的进展,但仍滞后于如水稻(Oryza sativa)、玉米(Zea mays)、小麦(Triticum aestivum)等禾本科(Gramineae)农作物。由于竹子本身很难开花的特殊生物学特性,限制了竹子遗传改良进程。近年来,尽管有调控竹木质素合成酶基因克隆(金顺玉等,2010;胡尚连等,2009)、纤维素合成酶基因克隆(张智俊等,2010;杜亮亮等,2010)等方面的研究报道,但仍未见成功遗传转化竹的相关研究,严重制约了基因工程在竹遗传改良方面的应用。
梁山慈竹(Dendrocalamus farinosus)为竹亚科(Bambusoideae)牡竹属(Dendrocalamus)植物,是四川省本土大型丛生竹种之一,耐寒性较强,是优质高产纸浆用材的原料,具有较好的水土保持作用,能够明显地减少地表径流和泥沙侵蚀。长期以来对梁山慈竹的研究主要集中在竹材解剖(方伟等,1998)、退耕还林中的水土保持效应(笪志祥等,2007)、纤维及造纸性能(张喜,1995)、遗传多样性(蒋瑶等,2008)以及愈伤组织诱导与植株再生(Hu et al., 2011)等方面,而遗传转化方面的研究至今尚未见报道。作者所在研究室采用RACE技术已克隆到慈竹(Neosinocalamus affinis)的4CL(4-香豆酸辅酶A连接酶4-coumarate:CoA ligase,简称为4CL)全长cDNA序列(GenBank:EU327341)(胡尚连等,2009),并已构建好具有降低木质素含量的PBI121-4CL-RNAi表达载体(周建英等,2010),同时也建立了梁山慈竹愈伤组织培养与植株再生体系(Hu et al., 2011),为本文研究奠定了良好的基础。鉴于此,本文以梁山慈竹种子成熟胚的愈伤组织为材料,采用根癌农杆菌(Agrobacterium tumefaciens)介导法将构建好的PBI121-4CL-RNAi表达载体导入梁山慈竹愈伤组织,通过研究影响梁山慈竹遗传转化的因素,建立农杆菌遗传转化梁山慈竹的方法,获得转基因植株,为梁山慈竹遗传转化研究奠定基础,为竹功能基因组学研究提供一个研究平台。
1 材料与方法 1.1 植物材料以梁山慈竹2种类型的成熟胚愈伤组织(第1种类型为淡黄色、颗粒状、疏松易碎的胚性愈伤组织;第2种类型为有绿色芽点的颗粒状胚性愈伤组织)作为转化受体。
1.2 主要培养基基本培养基为改良的愈伤组织诱导培养基(MS2)(Hu et al., 2011)。侵染培养基由液体MS2、稀释后的根癌农杆菌菌液和100 μmol·L-1的乙酰丁香酮组成。共培养的培养基:由固体MS2培养基和100 μmol·L-1的乙酰丁香酮组成。抗性筛选培养基:由固体MS2、55 mg·L-1卡那霉素(Kana)和500 mg·L-1羧卞霉素(Carb)组成,筛选30天后,抗性愈伤组织转接到固体MS2+300 mg·L-1羧卞霉素的继代培养基上。芽诱导培养基:当抗性愈伤组织分化出绿色芽点时,将其转接到用于诱导芽分化的固体培养基(MA1)(Hu et al., 2011)上,同时加入300 mg·L-1羧卞霉素。根诱导培养基:当芽长到3~5 cm高时,将其转接到含100 mg·L-1羧卞霉素的生根培养基(Hu et al., 2011)上,进行根的诱导。
1.3 根癌农杆菌菌株及质粒根癌农杆菌菌株为EHA105,采用冻融法,将周建英(2010)构建好的PBI121-4CL-RNAi质粒转化根癌农杆菌EHA105,该质粒携带4CL基因和抗卡那霉素的NPT Ⅱ选择基因。
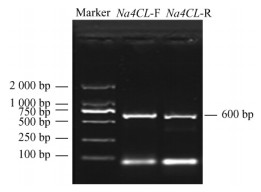
1.4 根癌农杆菌的活化挑取已转入pBI121-4CL-RNAi质粒的农杆菌,在含有50 mg·L-1利福平和100 mg·L-1卡那霉素的LB平板上划线,在28 ℃培养箱中培养2天,挑单菌于3 mL摇菌管中,28 ℃摇动培养2天;以菌液为模板,采用周建英(2010)设计的引物,在PTC-200 PCR自动扩增仪上分别扩增正向Na4CL-F和反向Na4CL-R基因目标片段约600 bp(图 1),电泳验证正确的菌液保存备用。
|
图 1 pBI121-4CL-RNAi根癌农杆菌菌液PCR验证 Fig.1 PCR identification of Agrobacterium tumefaciens with plasmid of pBI121-4CL-RNAi |
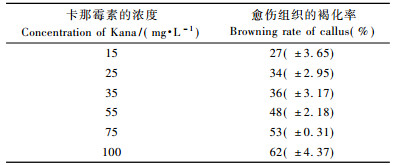
将梁山慈竹第1种类型的愈伤组织接种在含15,35,55,75,100 mg·L-1卡那霉素的MS2培养基上,共5个处理,每个处理3次重复,每次30~40块愈伤组织。30天后统计愈伤组织褐化率,以确定抗性筛选时卡那霉素的使用浓度。经试验,卡那霉素以55 mg·L-1为宜。
1.5.2 外植体的筛选用含有PBI121-4CL-RNAi质粒的根癌农杆菌遗传转化2种不同类型的愈伤组织,在MS2+55 mg·L-1 Kana+500 mg·L-1Carb的固体培养基上筛选30天后,观察并统计其褐化率,选择适宜的转化受体。
1.5.3 预培养时间的确定以预培养0,4,8,15天的第1种类型的愈伤组织作为受体材料,在OD600=0.2的菌液中,110 r·min-1、28 ℃的条件下侵染20 min,然后接种在表面加有1层无菌滤纸的共培养基上,25 ℃黑暗培养2天,再将其置于MS2+55 mg·L-1 Kana+500 mg·L-1 Carb的固体培养基上,共4个处理,每个处理3次重复,每次30~40块愈伤组织。筛选培养30天,观察并统计愈伤组织褐化率,选择合适的预培养时间。
1.5.4 根癌农杆菌菌液浓度与侵染时间的确定将已确定较适宜预培养天数的第1种类型愈伤组织,分别在OD600值为0.05,0.2,0.5的菌液中和110 r·min-1,28 ℃的条件下侵染10,20,30 min,然后将其接种在表面加有1层无菌滤纸的共培养基上,25 ℃黑暗培养2天,再将其置于MS2+55 mg·L-1 Kana+500 mg·L-1 Carb的固体培养基上,每个处理3次重复,每次30~40块愈伤组织。筛选培养30天,观察并统计愈伤组织褐化率,确定抗性愈伤组织获得率较高的组合。
1.5.5 共培养时间、温度及方式的确定将已确定较适宜预培养天数的第1种类型愈伤组织,分别在OD600值为0.05,0.2,0.5的菌液中和110 r·min-1,28 ℃的条件下侵染20 min后,分别在25,28 ℃条件下,将其接种在表面加有1层无菌滤纸和不加的共培养基上,分别黑暗培养2天、3天,然后将其置于MS2+55 mg·L-1 Kana+500 mg·L-1 Carb的固体培养基上,每个处理3次重复,每次30~40块愈伤组织。抗性筛选30天,确定最佳共培养时间、温度和共培养方式。
1.5.6 抗性愈伤组织筛选与植株再生共培养结束后,将愈伤组织转接到抗性筛选培养基(MS2+ 55 mg·L-1 Kana +500 mg·L-1 Carb)上,然后将筛选30天的抗性愈伤组织,转入含有300 mg·L-1Carb的MS2培养基上继代培养,每2~3周继代1次,将培养至泛绿的愈伤组织转接到芽诱导分化培养基(MA1+300 mg·L-1 Carb)上,待芽长至3~5 cm后,将其转接到生根培养基上。
1.6 PCR与RT-PCR检测以筛选培养2个月的抗性愈伤组织及其抗性植株为材料,分别在液氮中迅速研磨后,采用TIANGEN试剂盒分别提取DNA和RNA。
扩增NPT Ⅱ全长引物序列为F:AGAGGCT ATTCGGCTATGACTG;R:ACTCGTCAAGAAGGCG ATAGAA。扩增4CL基因引物序列为F:TAGGA CAGGGCTATGGGATG;R:ATGCAAATCTCCCCTG ACTG。扩增Tublin内参基因引物序列为F:AAC ATG TTGCCTGAGGTTCC;R:GTTCTTGGCATCCCA CATCT。序列由上海生物工程有限公司合成。
NPT Ⅱ-PCR检测:PCR扩增体系为20 μL。反应程序为:95 ℃预变性3 min;95 ℃变性30 s,65 ℃退火30 s,72 ℃延伸50 s,35个循环;72 ℃延伸5 min。取PCR产物5 μL在1%琼脂糖凝胶上进行电泳检测。
RT-PCR检测:选择已导入4CL基因的愈伤组织和植株的RNA为模板,由宝生物(TaKaRa)公司的Reverse Transcriptase M-MLV(RNase Hˉ)反转录试剂盒提供的试剂,进行cDNA合成反应,然后通过Bio-Rad公司的PTC-200 PCR自动扩增仪进行扩增。反应体系为20 μL,42 ℃保温1.5 h,70 ℃保温15 min,停止反转录反应,取出合成的cDNA产物,-20 ℃条件下保存。4CL基因、Tublin基因的RT-PCR扩增反应体系都为20 μL,取2 μL cDNA模板,95 ℃ 3 min,95 ℃ 30 s,56 ℃ 30 s,72 ℃ 45 s,72 ℃10 min,30个循环。PCR反应产物在1%琼脂糖凝胶上进行电泳。
2 结果与分析 2.1 卡那霉素抗性筛选浓度的确定卡那霉素浓度的敏感性试验结果表明:随着浓度不断提高,没有转基因的梁山慈竹第1种类型愈伤组织表现出明显褐化现象。由表 1可知,Kana对梁山慈竹愈伤组织具有强烈的抑制作用,30天后,在Kana浓度为55 mg·L-1的培养基上,愈伤组织的褐化率为48.7%;Kana浓度为100 mg·L-1的培养基上,62.0%的愈伤组织褐化死亡。由于竹愈伤组织再生植株较难,因此,本研究以55 mg·L-1的Kana作为抗性筛选浓度。
|
|
在遗传转化过程中,受体材料的类型十分重要。用含有PBI121-4CL-RNAi质粒的根癌农杆菌遗传转化2种不同类型的愈伤组织后,共培养2~3天,第2种类型的愈伤组织,虽然其抗性愈伤组织率为50%,但是在诱导芽分化时,其易受农杆菌和抗生素的影响,大部分褐化死亡,不适合作转化受体;第1种类型,即淡黄色、颗粒状、疏松易碎的愈伤组织在抗性培养基上筛选时,抗性愈伤组织获得率可达90%。因此,第1种类型的愈伤组织是较好的遗传转化受体。
2.3 外植体预培养时间对愈伤组织遗传转化的影响在遗传转化过程中,受体材料的状态也很重要。选择淡黄色、颗粒状、疏松易碎、生长分裂旺盛的胚性愈伤组织作为转化受体材料。通过试验结果表明,以预培养8天、生长良好的愈伤组织为受体材料,更有利于遗传转化(图 2A)。

|
图 2 外植体预培养时间、菌液浓度和侵染时间、共培养时间对梁山慈竹愈伤组织遗传转化的影响 Fig.2 Effects of explants preculture time, infection time and concentration, co-cultivation time on transformation of callus in Dendrocalamus farinosus |
农杆菌接种侵染的过程是农杆菌侵入植物组织并吸附在植物细胞上的过程,侵染时间越久,农杆菌吸附在植物细胞上的数量也就越多。而在本研究中,菌液浓度过高、侵染时间过长,梁山慈竹抗性愈伤组织获得率呈降低趋势(图 2B)。所以,对梁山慈竹愈伤组织侵染时,农杆菌浓度以OD600=0.05和OD600=0.2较为适宜,侵染时间为20 min。
2.5 共培养时间、温度及方式对愈伤组织遗传转化的影响共培养时间的长短对遗传转化有着很大的影响。本研究表明,菌液浓度越高,共培养的时间越久,愈伤组织褐化越严重,抗性愈伤组织率也越低(图 2C),且周围有农杆菌生长,没有褐化的愈伤组织表面呈暗黄色。侵染后的愈伤组织分别在25,28 ℃下共培养时,愈伤组织褐化程度较低的共培养温度是25 ℃,且在共培养基表面加1层无菌滤纸,能有效抑制农杆菌的生长和减少愈伤组织的褐化。在共培养2天时,OD600=0.05侵染愈伤组织20 min时,可获得较高的抗性愈伤组织率(90%)。在共培养3天时,随菌液浓度的增加,抗性愈伤组织率也在降低。通过对影响抗性愈伤组织率的共培养时间、温度及方式的研究,认为较低菌液浓度OD600=0.05侵染的愈伤组织,在表面加有1层无菌滤纸的共培养基上,25 ℃暗培养2天,可以获得较高的抗性愈伤组织率。
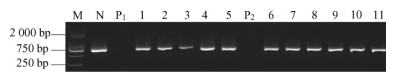
2.6 转基因植株的获得与RT-PCR检测将预培养8天的梁山慈竹第1种类型胚性愈伤组织,在OD600=0.05的菌液中、110 r·min-1、28 ℃侵染20 min,25 ℃暗培养2天后(图 3A),转接到含有55 mg·L-1 Kana的筛选培养基上筛选30天(图 3B),获得抗性愈伤组织,经PCR检测,pBI-4CL-RNAi质粒已导入愈伤组织内(图 4)。将已导入4CL基因的抗性愈伤组织转入诱导芽的MA1培养基上(图 3C),诱导30天后,可以获得丛生芽(图 3D),待丛生芽长至3~5 cm时(图 3E),将其转入生根培养基,经过20~30天的诱导(图 3F),可产生1~8条根,获得梁山慈竹抗性植株(图 3G)。经PCR检测,扩增出约750 bp的目的条带,证明pBI-4CL-RNAi质粒已转入梁山慈竹抗性小植株内(图 4),表明已获得转4CL的梁山慈竹小植株,转化效率为9%,将获得的转基因植株移栽至小盆中生长(图 3H)。在本研究中,羧卞霉素对梁山慈竹生根影响很大,转基因植株的根比未转基因(图 3I)的短。

|
图 3 梁山慈竹愈伤组织遗传转化与植株再生 Fig.3 Genetic transformation of callus and plant regeneration in Dendrocalamus farinosus A.愈伤组织共培养;B.抗性愈伤组织筛选;C.抗性愈伤组织分化;D.抗性芽的诱导;E.抗性芽的伸长;F.抗性芽生根;G,H.转基因植株;I.未转基因植株的根(左)和转基因植株的根(右)。 A. Co-cultivation for resistant callus; B. Selection for resistant callus; C. Differential culture of resistant callus; D. Induction of resistant shoots; E. Elongation of resistant shoots; F. Rooting of resistant shoots; G, H. Transgenic plants; I. The root of the non-transgenic plant (left) and the transgenic plant (right). |
|
图 4 转慈竹4CL基因抗性愈伤组织和再生植株的PCR检测 Fig.4 PCR identification of Kana-resistant embryogenic callus and transgenic plants with 4CL gene from Neosinocalamus affinis M. Marker (DL2000);N. (阳性对照)质粒DNA;P1. (阴性对照)未转化愈伤组织DNA;1-5.转基因愈伤组织;P2. (阴性对照)未转基因植株DNA;6-11.转基因植株。 M. Marker (DL2000); N. Plasmid DNA(positive control); P1. Non-transgenic embryogenic callus DNA(negative control); 1-5. Transgenic embryogenic callus; P2. Non-transgenic plants DNA(negative control); 6-11.Transgenic plants. |
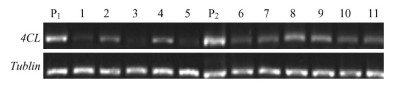
以转慈竹4CL基因抗性愈伤组织和再生植株的cDNA为模板,分别用4CL和Tublin引物进行RT-PCR扩增,如图 5所示,转基因愈伤组织和植株中均可获得特异性扩增产物,但与未转基因的对照相比,其表达量明显降低,说明采用RNAi技术将慈竹4CL基因导入梁山慈竹愈伤组织和再生植株后,能有效抑制梁山慈竹转基因愈伤组织和植株的内源4CL基因的表达水平。
|
图 5 转慈竹4CL基因的愈伤组织和再生植株的RT-PCR检测 Fig.5 RT-PCR detection of transgenic embryogenic callus and transgenic plants with 4CL gene from Neosinocalamus affinis P1. (阴性对照)未转化愈伤组织cDNA;1-5.转基因愈伤组织;P2. (阴性对照)未转基因植株cDNA;6-11.转基因植株;Tubulin.内参。 P1. Non-transgenic embryogenic callus cDNA(negative control); 1-5. Transgenic embryogenic callus; P2. Non-transgenic plants cDNA(negative control); 6-11.Transgenic plants. Tubulin. Control. |
外植体的类型(Shen et al., 1993)和预培养(Lawrence et al., 2000;Xu et al., 2009)、菌株类型(Hiei et al., 1994)和菌液浓度(Swain et al., 2010)、侵染时间(Barik et al., 2005)、共培养时间(Zhao et al., 2002;Ishida et al., 1996)和温度(Frame et al., 2002;Fullner et al., 1996)等对遗传转化效率有很大影响。本研究在菌液浓度OD600=0.05的条件下,采用EHA105侵染梁山慈竹成熟胚愈伤组织20 min,获得较好的转化效果。不同的菌株类型对不同类型植物的作用不同,王宏芝等(2004)认为高毒性的菌株EHA105对小麦具有更强的侵染力;在陶传涛等(2008)的研究中,使用EHA105侵染玉米未成熟胚愈伤组织20 min,获得了较高转化率,但是菌液浓度为OD600=0.6,远高于本研究使用的OD600=0.05的浓度;而Ozawa(2009)的研究采用OD600=0.04的EHA 101侵染水稻愈伤组织,获得了较高转化率。由此可见,不同的禾本科植物对农杆菌的敏感性不同,因此,寻找适宜的菌株类型及菌液浓度和侵染时间的组合十分重要。
已有研究表明,20~25 ℃共培养可提高转化效率(Frame et al., 2002;Fullner et al., 1996)。本研究在共培养时,25 ℃暗培养2天,不同于He等(2006)的21 ℃和Hiei等(1994)的22 ℃的结论。关于共培养时间,一般认为2~3天为佳(Zhao et al., 2002;Ishida et al., 1996)。本研究认为共培养方式也是影响转化效率的重要因素,在固体共培养基表面加1层无菌滤纸,能有效抑制农杆菌的生长,这样也兼顾了愈伤组织的生长温度(25 ℃),而不用降低共培养温度来防止农杆菌过度生长。Ozawa(2009)的研究表明,侵染后的水稻愈伤组织,在用液体培养基浸湿的3层滤纸上,25 ℃暗培养3天,转化效果比共培养在固体培养基上更好。
Cheng等(2004)认为AS(乙酰丁香酮)能有效促进农杆菌对一些植物的转化,尤其是单子叶植物。Mohri等(1997)在日本白桦(Betula platyphylla var. japonica)的转化中报道,在共培养基中加入100 μmol·L-1 AS可使转化率提高8倍,但也有在侵染液中加入AS取得很好的转化效果的报道(Owens et al., 1988)。鉴于AS能促进单子叶植物的转化,并且在共培养基中或侵染液中加入AS能起到很好的促进作用,本研究在侵染液和共培养基中均加入了100 μmol·L-1的AS,也取得好的转化效果。
本研究通过农杆菌介导法成功地将慈竹4CL基因导入梁山慈竹愈伤组织中,并筛选出转基因植株。在整个过程中,高效的组织培养和再生体系的建立是重要因素之一。对影响农杆菌介导梁山慈竹愈伤组织遗传转化效率因素(菌液浓度、侵染时间、共培养时间和温度及方式等)的研究表明:菌液浓度、侵染时间、共培养方式对愈伤组织的存活和转化效果有明显影响,采用OD600=0.05的EHA105侵染梁山慈竹愈伤组织20 min,在表面加有1层无菌滤纸的共培养基上,25 ℃暗培养2天,抗性愈伤组织的获得率高达90%,转化效率为9%。不同的植物对Kana的敏感性不同,在本研究中,Kana的使用浓度55 mg·L-1要比水稻(500 mg·L-1)(Dekeyser et al., 1999)、小麦(100 mg·L-1)(贺杰等,2010)等禾本科农作物的低,但是,Kana强烈抑制梁山慈竹愈伤组织根芽分化。在今后的研究中,还需要进一步摸索防褐化条件,减少抗性愈伤组织的死亡;进一步优化移栽条件,提高转基因植株成活率。
本研究采用RT-PCR技术已证明,在已获得的梁山慈竹转基因愈伤组织和植株中,其内源4CL基因的表达水平得到抑制,这些结果有助于进一步分析转基因植株4CL酶活性、木质素含量及其组分的变化,为有效筛选减少木质素含量或改变木质素组成的梁山慈竹提供了可行途径。尽管在转录水平上对转基因梁山慈竹植株进行了检测,但在今后的研究中,还需采用Western杂交技术对转基因植株的蛋白质进行分析,以检测在翻译水平上的转基因表达量。
| [] | 笪志祥, 楼一平, 董文渊. 2007. 梁山慈竹在退耕还林中的水土保持效应研究. 浙江林业科技, 27(3): 23–27. |
| [] | 杜亮亮, 鲁专, 金爱武. 2010. 雷竹纤维素合成酶基因cDNA克隆与表达分析. 江西农业大学学报, 32(3): 535–540. |
| [] | 方伟, 黄坚钦, 卢敏, 等. 1998. 17种丛生竹竹材的比较解剖研究. 浙江林学院学报, 15(3): 225–231. |
| [] | 胡尚连, 曹颖, 黄胜雄, 等. 2009. 慈竹4CL基因的克隆及其生物信息学分析. 西北农林科技大学学报:自然科学版, 37(8): 204–210. |
| [] | 贺杰, 王伟, 胡海燕, 等. 2010. 影响农杆菌介导的小麦遗传转化条件的研究. 种子, 29(5): 5–8. |
| [] | 蒋瑶, 胡尚连, 陈其兵, 等. 2008. 四川省不同地区梁山慈竹RAPD与ISSR遗传多样性研究. 福建林学院学报, 28(3): 276–280. |
| [] | 金顺玉, 卢孟柱, 高健. 2010. 毛竹木质素合成相关基因C4H的克隆及组织表达分析. 林业科学研究, 23(3): 319–325. |
| [] | 陶传涛, 丁在松, 李连禄, 等. 2008. 农杆菌介导玉米遗传转化体系的优化. 作物杂志(4): 26–29. |
| [] | 王宏芝, 魏建华, 李瑞芬. 2004. 农杆菌介导的小麦生殖器官的整体转化. 中国农业科技导报, 6(3): 22–26. |
| [] | 张喜. 1995. 贵州主要竹种的纤维及造纸性能的分析研究. 竹子研究汇刊, 14(4): 14–30. |
| [] | 张智俊, 杨洋, 何沙娥, 等. 2010. 毛竹纤维素合成酶基因PeCesA的克隆及组织表达谱分析. 园艺学报, 37(9): 1485–1492. |
| [] | 周建英, 曹颖, 孙霞, 等. 2010. 慈竹木质素合成酶基因4CL RNAi载体构建与烟草转化. 福建林业科技, 37(2): 28–32. |
| [] | Barik D P, Mohapatra U, Chand P K. 2005. Transgenic grasspea (Lathyrus sativus L.): factors influencing Agrobacterium-mediated transformation and regeneration. Plant Cell Rep, 24(9): 523–531. |
| [] | Cheng Ming, Lowe B A, Spencer T M, et al. 2004. Invited review: Factors influencing Agrobacterium-mediated transformation of monocotyledonous species. In Vitro Cell Dev Biol Plant, 40(1): 31–45. DOI:10.1079/IVP2003501 |
| [] | Dekeyser R, Claes B, Marichal M, et al. 1999. Evaluation of selectable markers for rice transformation. Plant Physiol, 90: 217. |
| [] | Dong W J, Lin Y, Zhou M B, et al. 2011. Development of 15 EST-SSR markers, and its cross-species/genera transferability and interspecies hybrid identification in caespitose bamboo species. Plant Breed. DOI:10.1111/j.1439-0523.2011.01860.x |
| [] | Frame B R, Shou H X, Chikwamba R K, et al. 2002. Agrobacterium tumefaciens-mediated transformation of maize embryos using a standard binary vector system. Plant Physiol, 129(1): 13–22. DOI:10.1104/pp.000653 |
| [] | Fullner K J, Lara J C, Nester E W. 1996. Pilus assembly by Agrobacterium T-DNA transfer genes. Science, 273(5278): 1107–1109. DOI:10.1126/science.273.5278.1107 |
| [] | He Ruifeng, Wang Yuanyuan, Du Bo, et al. 2006. Development of transformation system of rice based on binary bacterial artificial chromosome (BIBAC) vector. Acta Genetica Sinica, 33(3): 269–276. DOI:10.1016/S0379-4172(06)60050-4 |
| [] | Hiei Y, Ohta S, Komari T, et al. 1994. Efficient transformation of rice (Oryza sativa L.) mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA. Plant J, 6(2): 271–282. |
| [] | Hu Shanglian, Zhou Jianying, Cao Ying, et al. 2011. In vitro callus induction and plant regeneration from mature seed embryo and young shoots in a giant sympodial bamboo, Dendrocalamus farinosus (Keng et Keng f.) Chia et H.L. Fung. African Journal of Biotechnology, 10(16): 3210–3215. |
| [] | Ishida Y, Saito H, Ohta S, et al. 1996. High efficiency transformation of maize (Zea mays L.) mediated by Agrobacterium tumefaciens. Nature Biotechnology, 14: 745–750. |
| [] | Lawrence P K, Koundal K R. 2000. Simple protocol for Agrobacterium tumefaciens mediated transformation of pigeonpea[Cajanus cajan (L.) Millsp.]. J Plant Biol, 27: 299–302. |
| [] | Mohri T, Mukai Y, Shinohara K. 1997. Agrobacterium tumefaciens-mediated transformation of Japanese white birch (Betula platyphylla var. japonica). Plant Sci, 127(1): 53–60. DOI:10.1016/S0168-9452(97)00107-6 |
| [] | Owens L D, Smigocki A C. 1988. Transformation of soybean cells using mixed strains of Agrobacterium tumefaciens and phenolic compounds. Plant Physiol, 88(3): 570–573. DOI:10.1104/pp.88.3.570 |
| [] | Ozawa K. 2009. Establishment of a high efficiency Agrobacterium-mediated transformation system of rice (Oryza sativa L.). Plant Science, 176: 522–527. DOI:10.1016/j.plantsci.2009.01.013 |
| [] | Shen W H, Escudero J, Schläppi M, et al. 1993. T-DNA transfer to maize cells: histochemical investigation of beta-glucuronidase activity in maize tissues. Proc Natl Acad Sci, USA, 90(4): 1488–1492. DOI:10.1073/pnas.90.4.1488 |
| [] | Swain S S, Sahu L, Barik D P, et al. 2010. Agrobacterium×plant factors influencing transformation of 'Joseph's coat'(Amaranthus tricolor L.). Scientia Horticulturae, 125(3): 461–468. DOI:10.1016/j.scienta.2010.04.034 |
| [] | Tang Dingqin, Lu Jiangjie, Fang Wei, et al. 2010. Development, characterization and utilization of GenBank microsatellite markers in Phyllostachys pubescens and related species. Mol Breed, 25(2): 299–311. DOI:10.1007/s11032-009-9333-4 |
| [] | Xu Jin, Wang Yuzhen, Yin Hengxia. 2009. Efficient Agrobacterium tumefaciens-mediated transformation of Malus zumi (Matsumura) Rehd using leaf explant regeneration system. Electron J Biotechnol, 12(1): 1–8. |
| [] | Zhao Zuoyu, Gu Weining, Cai Tishu, et al. 2002. High throughput genetic transformation mediated by Agrobacterium tumefaciens in maize. Mol Breed, 8(4): 323–333. DOI:10.1023/A:1015243600325 |
| [] | Zhou Mingbing, Zhang Yan, Tang Dingqin. 2011. Characterization and primary functional analysis of BvCIGR, a member of the GRAS gene family in Bambusa ventricosa. Bot Rev, 77(3): 233–241. DOI:10.1007/s12229-011-9079-7 |
 2012, Vol. 48
2012, Vol. 48