文章信息
- 李永华, 吴波, 卢琦, 靳占虎, 刘殿军, 张金鑫
- Li Yonghua, Wu Bo, Lu Qi, Jin Zhanhu, Liu Dianjun, Zhang Jinxin
- 白刺叶片形态变化对叶片δ13C的影响
- Variation in Leaf Shapes of Nitraria Species and Effect on Leaf δ13C
- 林业科学, 2012, 48(3): 25-30.
- Scientia Silvae Sinicae, 2012, 48(3): 25-30.
-
文章历史
- 收稿日期:2011-05-04
- 修回日期:2011-08-09
-
作者相关文章
2. 国家林业局林木培育重点实验室 北京 100091
2. Key Laboratory of Tree Breeding and Cultivation, State Forestry Administration Beijing 100091
叶片形态是植物形态结构的重要组成部分,广泛应用于传统植物分类学研究中(中国科学院中国植物志编辑委员会,1998),其变化能够直接改变植物与周围环境物质、能量交换,从而影响植物的生存和适应能力(Morrow et al., 1971;Smith et al., 1980;Ehleringer, 1982;Geller et al., 1982;Nobel 1991;Schuepp, 1993;Vogel, 2009)。相关研究显示:随着辐射强度(或温度)的增加,植物叶角、单面叶片面积上的叶片表面绒毛均出现增加趋势,从而增加叶片对光的反射比例或直接降低叶片对辐射的吸收比例,以达到降低叶温的目的(Ehleringer et al., 1978;Medina et al., 1978;Ehleringer, 1980;Smith et al., 1997;Schrader et al., 2004;Picotte et al., 2009);随着水分有效性的降低,植物往往降低叶面积指数、单叶面积等来实现减少水分蒸腾量(McDonald et al., 2003;Rozendaal et al., 2006;Picotte et al., 2007;Lambers et al., 2008;黄玫等,2010);随着干旱程度和光照强度的增加,叶片裂齿数量、裂叶深度及裂叶占叶面积的比例均具有增加趋势(Sisó et al., 2001;Nicotra et al., 2008;Royer et al., 2009);另外,在水分有效性降低,单叶叶面积减少过程中叶片宽度明显减少(Picotte et al., 2009),而在水分有效性增加,单叶叶面积增加过程中叶片长度明显增加(Balota et al., 2008)。
在水分胁迫环境下,植物叶片或叶面积指数变小将有利于降低叶片蒸腾空间,从而降低植物体内水分损失。但是仍缺乏充分的样地观测数据解释水分有效性降低背景下叶片宽度优先降低(Picotte et al., 2009),而水分有效性增加背景下,叶片优先增长(Balota et al., 2008),叶片裂齿数量、裂叶深度及裂叶占叶面积的比例为何增加(Nicotra et al., 2008, Royer et al., 2009)的原因。为更好的解释叶片形态变化,一些研究者从理论出发,尝试引用物理学中边界层导度(或阻力)的概念解释叶片形态变化的原因(Nobel,1991;Schuepp,1993;Picotte et al., 2009;Yates et al., 2010)。由于先前的研究无法更为深入解释叶片裂叶及叶齿的变化原因(Nobel,1991;Schuepp,1993;Nicotra et al., 2008),从而无法获得连接叶片形态与叶片边界层导度间普遍存在的具有生理生态学意义的合理指标。
白刺属(Nitraria)植物是我国干旱地区常见的优势植物,其分布地域广阔,叶片形态丰富、随环境变化多样而明显(中国科学院中国植物志编辑委员会,1998;李永华,2010),是研究干旱地区植物叶片形态变化的理想物种。本研究选取不同水分条件下唐古特白刺(Nitraria tangutorum)和泡泡刺(N. sphaerocarpa)作为研究对象,利用样地实地观测数据,对比研究不同生境下白刺叶片形态变化规律,并尝试选取新的形态指标研究叶片形态变化与叶片δ13C关系规律,解释白刺叶片叶片长、宽非同步变化与水分利用优化的相关关系。
1 研究区概况敦煌为温带极干旱大陆气候,多年平均降雨量为40 mm,年均蒸发量为2 500 mm左右,多年平均温度为9.3 ℃。敦煌样地位于敦煌东部约30 km处(东湖附近的山前洪积扇),地理坐标在94°43′E,40°08′ N附近。泡泡刺叶片样品分别采集于洪积扇中部与底部。洪积扇中部样地常见植物为泡泡刺、膜果麻黄(Ephedra przewalskii)、戈壁沙拐枣(Calligonum gobicum),湿润年份可见1年生植物骆驼蹄瓣(Zygophyllum fabago);洪积扇底部样地常见植物为泡泡刺、戈壁沙拐枣,骆驼刺(Alhagi sparsifolia),湿润年份可见一年生植物骆驼蹄瓣、雾冰藜(Bassia dasyphylla)等。
民勤为温带干旱大陆性季风气候,多年平均降雨量为115 mm,年均蒸发量为2 600 mm左右,多年平均温度为7.4 ℃。民勤唐古特白刺叶片样品采集于甘肃省民勤治沙综合试验站三号塔附近,地理坐标为102°58′ E,38°34′ N,地表为半固定沙地,土壤类型为风沙土。唐古特白刺为样地内唯一的多年生灌木,湿润年份样地内可见沙蓬(Agriophyllum squarrosum)、虫实(Corispermum declinatum)等一年生植物。
磴口为温带干旱大陆性季风气候,多年平均降雨量为145 mm,年均蒸发量为2 400 mm左右,多年平均温度为7.6 ℃。磴口唐古特白刺叶片样品采集于中国林业科学研究院沙漠林业实验中心二场附近,地理坐标为106°43′ E,40°24′ N,地表为半固定沙地,土壤类型为风沙土。样地内优势植物为唐古特白刺,常见伴生种有芦苇(Phragmites australis)、油蒿(Artemisia ordosica),常见一年生植物有沙鞭(Psammochloa villosa)、沙蓬、虫实等。
2 材料与方法 2.1 样品采集与测定2008年8—9月,笔者在上述4个样地分别选择4~6个唐古特白刺(或泡泡刺)灌丛(或灌丛沙包),从每丛植物的不同位置随机摘取30~70枚成熟、完好的叶片,然后将同一灌丛的叶片装入一个自封袋,放在保温箱带回室内并扫描(A688,紫光股份有限公司)。扫描时将叶片整齐的摆放在扫描仪上,在确认叶片无任何重叠的情况下开始扫描,扫描比例为1:1、DPI为150。叶片扫描完成后保存图像,同时用信封收集叶片,在75 ℃环境下烘干24 h后粉碎,粉碎样装入自封袋保存并带回中国林业科学研究院同位素实验室测定叶片δ13C。同时,利用Image-Pro Plus6.0图像处理软件分析获得叶片扫描图像中每个单叶的最大长度、最大宽度、面积、周长数据。根据测定数据计算叶片长/宽比、周长/面积比。
叶片δ13C的测定:粉碎叶片样品在实验室过80目筛,然后用锡杯在百万分之一的天平称量后包好,最后将样品放进Flash1112 HT,950 ℃环境下高温氧化为CO2,利用质谱仪DELTAV检测CO2中的C同位素,得到样品中的δ13C的比率值。δ13C标准样为:国际标准(GLY和UREA)。
2.2 统计分析方法所有数据输入Excel存储,在PASW Statistics 18环境下应用统计分析获得样地长、宽、周长、面积、叶片长/宽比和周长/面积比的均值和标准差,应用配对样品T测试检测叶片样品间长、宽、周长、面积、叶片长/宽比和周长/面积比的差异性,应用一元线性回归分析拟合叶片长、宽变化特征。最后应用Excel作图。
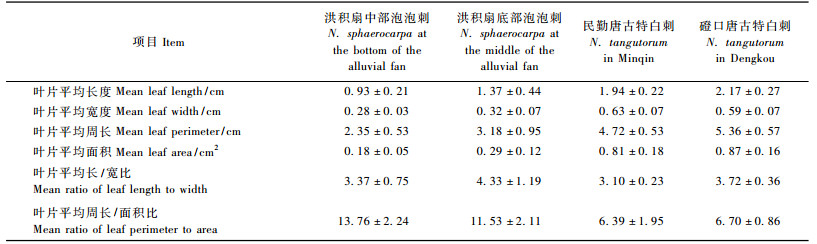
3 结果与分析 3.1 不同环境下叶片形态参数的变化特征不同环境下生长的泡泡刺和唐古特白刺,种内叶片形态差异显著。敦煌东湖附近洪积扇中部和底部的泡泡刺叶片形态比较,除周长/面积比外,洪积扇底部的泡泡刺叶片长、宽、周长、面积均大于洪积扇中部的泡泡刺(表 1)。配对T测试结果显示:2个样地的泡泡刺叶片长、宽、周长、面积及周长/面积比间差异性显著(P<0.05)。进一步比较发现:从洪积扇中部到底部,泡泡刺叶片长、宽增加具有非同步特征,从洪积扇中部到洪积扇底部泡泡刺叶片宽度增加约14%,而叶片长度增加约47%,从而使洪积扇底部的泡泡刺叶片长/宽比更大(P<0.05)。
|
|
民勤和磴口的唐古特白刺叶片形态比较,除叶片宽度外,磴口的唐古特白刺叶片长、周长、面积、长/宽比、周长/面积比均大于民勤的唐古特白刺(表 1)。配对T测试结果显示:两地的唐古特白刺叶片长、宽、周长间差异性显著(P<0.05),而叶片面积和周长/面积比无明显差异(P>0.05)。进一步比较发现:从民勤到磴口,唐古特白刺叶片长宽变化同样具有非同步特征,既叶片长度增加的同时叶片宽度降低,从而磴口唐古特白刺叶片长/宽比更大(P<0.05)。
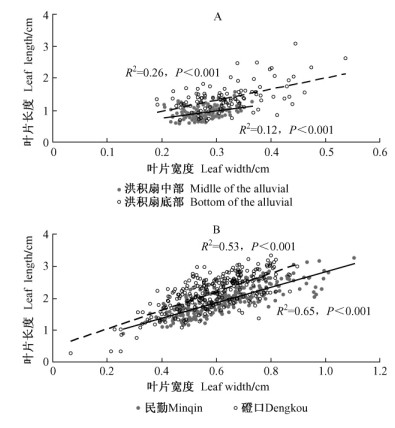
3.2 不同环境下白刺叶片长、宽变化规律唐古特白刺叶片性状为倒卵形或长椭圆形,泡泡刺叶片形状为宽条形或倒披针状条形,二者叶片的长宽变化是决定其他几何形态指标的关键因子(李永华,2010)。因此,本文重点分析白刺叶片长宽变化规律。分析结果表明:唐古特白刺、泡泡刺叶片长度与宽度具有线性相关特征(R2=0.12-0.65,P<0.01)。同时,这种相关性在不同环境下具有平行位移现象。相同叶片宽度,洪积扇底部的泡泡刺叶片长度高于洪积扇中部的泡泡刺,同时磴口的唐古特白刺叶片长度高于民勤的唐古特白刺(图 1)。
|
图 1 白刺叶片长宽变化特征比较 Fig.1 Comparison between leaf length and leaf width A:敦煌东湖附近洪积扇中部和底部的泡泡刺N. sphaerocarpa in Dunhuang; B:民勤、磴口的唐古特白刺N. tangutorum in Minqin and Dengkou。 |
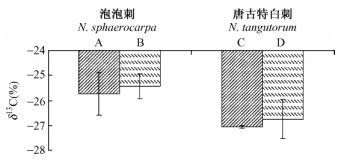
应用配对T测试,比较煌东湖洪积扇底部和中部的泡泡刺叶片δ13C值之间的差异性,结果显示:2个试验样地叶片δ13C间没有明显差异(P>0.05);同样磴口、民勤的唐古特白刺叶片δ13C值也没有显现明显的差异(P>0.05)(图 2)。
|
图 2 白刺叶片同位素值比较 Fig.2 Comparison between δ13C values A:敦煌东湖附近洪积扇底部的泡泡刺N. sphaerocarpa at the bottom of alluvial fan; B:中部的泡泡刺N. sphaerocarpa at the middle of alluvial fan in Dunhuang; C:磴口的唐古特白刺N. tangutorum in Dengkou;D:民勤的唐古特白刺N. tangutorum in Minqin。 |
比较磴口、民勤长期气象数据发现,磴口多年均温度(磴口7.6 ℃)仅比民勤多年均温度(磴口7.4 ℃)高出不足3%,而多年平均降雨量磴口(145 mm)远远高于民勤(115 mm)26%,并且年均蒸发量磴口(2 400 mm)低于民勤(2 600 mm)约8%,磴口地区自然水分条件明显好于民勤。比较敦煌东湖洪积扇中部与底部水分条件可知:由于敦煌地区降雨极为稀少,山前径流仅在个别丰雨年份才能形成,所以洪积扇中部水分补给不足,地下水埋深超过15 m;而洪积扇底部海拔较低,且毗邻敦煌东湖湿地,地下水埋深仅为6~9 m。所以生长于洪积扇底部的多年生植物水分压力远远低于洪积扇中部生长的植物。
结合本研究的研究数据,笔者初步判定:生长于水分条件较好地区的白刺叶片更大,而且白刺叶片在变大过程中,叶片长、宽变化具有非同步特征(表 1);相同宽度,水分条件较好地区的白刺,往往拥有更长的叶片长度(图 1)。相关研究证实土壤水分有效性是影响叶片长度变化的主要因子(Smith et al., 1978),而且水分增加能够优先刺激叶片长度的增加。Balota等(2008)通过人工灌溉研究了3个品种的小麦叶片生长变化,灌溉能够明显增加小麦旗叶面积,随着叶面积的增加,小麦旗叶叶片宽度分别增加18%~20%,而旗叶长度分别增加了28%~35%。
在跨越大的环境梯度,不同物种间叶片形态生长显现趋同变化的格局。McDonald等(2003)跨越47个研究站点,对澳大利亚东南部690种植物叶片形态变化进行了研究,随降雨增加能够增加叶片长、宽和面积,而且叶片长、宽变化具有等比例的特征。但该研究涉及区域较大,物种较多,其结果可能掩盖了同一物种在不同水分环境下叶片形态的分异特征。
4.2 叶片形态变化对δ13C的影响影响叶片表面物质、能量交换过程的决定因子主要是气孔阻力和叶片边界层阻力(Nobel,1991;Schuepp,1993;Vogel,2009)。在气孔开度较大或风速较高的环境下,叶片形态(边界层阻力或边界层厚度)的变化对叶片表面物质、能量交换影响十分微弱,但在气流较为稳定的环境下,叶片形态(边界层阻力)的变化直接决定了叶片表面热对流、传导交换和水分蒸腾速率(Nobel,1991;Vogel,2009;Yates et al., 2010)。在土壤水势快速下降,植物无力依靠蒸腾降温时,叶片形态(边界层阻力)变化对于降低叶温,保持叶片正常的光合尤为重要。叶片形态变化必将影响叶片瞬时或长期水分利用效率(Dudley,1996;Picotte et al., 2007)。
无论是叶片形态与叶片生理生态学过程相关,或是叶片形态与叶片水分利用效率相关关系研究,研究者仍依赖叶片宽度解释边界层阻力变化(Nobel,1991;Picotte et al., 2007;Vogel,2009;Yates et al., 2010)。但是,仅利用叶片宽度估算叶片边界层阻力(或厚度)具有巨大的局限性,尤其是叶片具有叶齿或裂叶的时候,应用叶片宽度将无法估算叶片边界层厚度(Nobel,1991)。Schuepp(1993)认为叶片边界层平均厚度(或阻力)的物理意义应该根据叶片内部距离叶片边缘的权重平均距离定义。叶片某点的边界层厚度是由该点与叶片边缘的最近距离直接控制。研究者利用人工模型模拟、计算机仿真模拟以及热感相机测定技术证实,不同形态叶片,表面某点的流热传导速率随该点距离叶片边缘的距离增加而增加(Vogel, 1970;Roth-Nebelsick,2001;Stokes et al., 2006;Vogel,2009)。虽然Schuepp(1993)关于叶片边界层平均厚度的定义是正确的,但实际应用中仍很难应用数学积分和统计的方法对大量叶片求算其边界层厚度。如果换个角度分析,首先对叶片进行网格化处理,可以更为清晰的认识到:叶片边界层平均厚度(或阻力)应该与单位边距长度(周长)所包围的叶片面积(网格单元数目)直接相关(Roth-Nebelsick,2001)。由于利用现代图像分析技术笔者很容易获得叶片的周长和面积,所以应用面积/周长比作为叶片的特征长度估算叶片边界层平均厚度(或边界层阻力)不仅具有可靠的理论依据,而且在处理复杂叶片形态时具有巨大的实践价值。
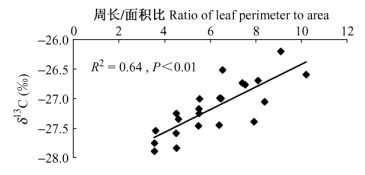
笔者推断:叶片周长/面积比将能够直接影响叶片生理生态学过程,从而影响叶片长期水分利用效率。为验证这一假设,2010年在民勤治沙站3号塔附近选取采集4个大小、地势相近白刺沙包,每个沙包上采集300~400枚叶片,同时依据周长/面积比进行分组,并测试了各组叶片δ13C值。结果显示:唐古特白刺叶片δ13C值与周长/面积比之间具有显著的线性正相关(图 3)。
|
图 3 民勤唐古特白刺叶片周长/面积比与叶片δ13C值的相关关系 Fig.3 Relationship between leaf δ13C value and the ratio of leaf perimeter to area in N. tangutorum in Minqin |
利用对周长/面积的深入认识,笔者可以进一步解释干旱地区不通水分胁迫下叶片长、宽非同步变化的原因。从敦煌洪积扇中部到底部,以及从民勤到磴口,泡泡刺和唐古特白刺在水分胁迫降低的情况下,植物选择优先增加叶片长度(图 1),一方面能够增加叶面积从而增加光合生产,另一方面能够阻止叶片周长/面积比(叶片边界层阻力)的快速上升,从而在水分条件改善的情况下减缓叶片水分利用效率的降低速率(李永华,2010)。最终致使敦煌洪积扇中部和底部的泡泡刺以及从民勤和磴口的唐古特白刺具有相似的叶片δ13C值(图 2)。
有研究预测未来我国干旱荒漠地区降雨量将出现不同程度的增加(Gao et al., 2001;施雅风等, 2003, 王英等, 2006, Parry et al., 2007)。通过笔者的研究结果可以初步推断:未来降雨增加背景下,白刺在干旱地区不仅能够通过增加叶面积进一步提高光合生产能力,从而保持其生长优势,并且能够通过叶片长度的优先增加获得稳定的水分利用效率,从而获得更大的竞争与发展空间。
| [] | 黄玫, 季劲钧. 2010. 中国区域植被叶面积指数时空分布—机理模型模拟与遥感反演比较. 生态学报, 30(11): 3057–3064. |
| [] | 李永华. 2010. 白刺叶片性状对人工增雨的响应. 中国林业科学研究院博士学位论文. |
| [] | 施雅风, 沈永平, 李栋梁, 等. 2003. 中国西北气候由暖干向暖湿转型的特征和趋势探讨. 第四纪研究, 23(2): 152–164. |
| [] | 王英, 曹明奎, 陶波, 等. 2006. 全球气候变化背景下中国降水量空间格局的变化特征. 地理研究, 25(6): 1031–1040. |
| [] | 中国科学院中国植物志编辑委员会. 1998. 中国植物志. 北京, 科学出版社. |
| [] | Balota M, Payne W A, Evett S R, et al. 2008. Morphological and physiological traits associated with canopy temperature depression in three closely related wheat lines. Crop Science, 48(5): 1897–1910. DOI:10.2135/cropsci2007.06.0317 |
| [] | Dudley S A. 1996. Differing selection on plant physiological traits in response to environmental water availability: a test of adaptive hypotheses. Evolution, 50(1): 92–102. DOI:10.1111/evo.1996.50.issue-1 |
| [] | Ehleringer J, 1980. Leaf morphology and reflectance in relation to water and temperature stress. //Turner N C, Kramer P J. Adaptations of plants to water and temperature stress. New York: John Wiley and Sons, 295-308. |
| [] | Ehleringer J. 1982. The influence of water stress and temperature on leaf pubescence development in Encelia farinosa. American Journal of Botany, 69(5): 670–675. DOI:10.2307/2442956 |
| [] | Ehleringer J R, Mooney H A. 1978. Leaf hairs: Effects on physiological activity and adaptive value to a desert shrub. Oecologia, 37(2): 183–200. DOI:10.1007/BF00344990 |
| [] | Gao X, Zhao Z, Ding Y, et al. 2001. Climate change due to greenhouse effects in China as simulated by a regional climate model. Advances in Atmospheric Sciences, 18(6): 1224–1230. DOI:10.1007/s00376-001-0036-y |
| [] | Geller G N, Smith W K. 1982. Influence of leaf size, orientation, and arrangement on temperature and transpiration in three high-elevation, large-leafed herbs. Oecologia, 53(2): 227–234. DOI:10.1007/BF00545668 |
| [] | Lambers H, Chapin F S, Pons T L. 2008. Plant Physiological Ecology. New York, Springer-Verlag. |
| [] | McDonald P G, Fonseca C R, Overton J M, et al. 2003. Leaf-size divergence along rainfall and soil-nutrient gradients: is the method of size reduction common among clades?. Functional Ecology, 17(4): 50–57. |
| [] | Medina E, Sobrado M, Herrera R. 1978. Significance of leaf orientation for leaf temperature in an Amazonian sclerophyll vegetation. Radiation and Environmental Biophysics, 15(2): 131–140. DOI:10.1007/BF01323262 |
| [] | Morrow P A, Slatyer R O. 1971. Leaf temperature effects on measurements of diffusive resistance to water vapor transfer. Plant Physiology, 47(4): 559–561. DOI:10.1104/pp.47.4.559 |
| [] | Nicotra A, Cosgrove M, Cowling A, et al. 2008. Leaf shape linked to photosynthetic rates and temperature optima in South African Pelargonium species. Oecologia, 154(4): 625–635. DOI:10.1007/s00442-007-0865-1 |
| [] | Nobel P S. 1991. Physicochemical and environmental plant physiology. New York, Academic Press. |
| [] | Parry M, Canziani O, Palutikof J, et al. 2007. Climate change 2007: impacts, adaptation and vulnerability. Contribution of working group Ⅱ to the fourth assessment report of the intergovernmental panel on climate change. London, Cambridge University Press. |
| [] | Picotte J, Rhode J, Cruzan M. 2009. Leaf morphological responses to variation in water availability for plants in the Piriqueta caroliniana complex. Plant Ecology, 200(2): 267–275. DOI:10.1007/s11258-008-9451-9 |
| [] | Picotte J J, Rosenthal D M, Rhode J M, et al. 2007. Plastic responses to temporal variation in moisture availability: consequences for water use efficiency and plant performance. Oecologia, 153: 821–832. DOI:10.1007/s00442-007-0794-z |
| [] | Roth-Nebelsick A. 2001. Computer-based analysis of steady-state and transient heat transfer of small-sized leaves by free and mixed convection.Plant. Cell and Environment, 24(6): 631–640. DOI:10.1046/j.1365-3040.2001.00712.x |
| [] | Royer D L, Kooyman R M, Little S A, et al. 2009. Ecology of leaf teeth: A multi-site analysis from an Australian subtropical rainforest. American Journal of Botany, 96(4): 738–750. DOI:10.3732/ajb.0800282 |
| [] | Rozendaal D M A, Hurtado V H, Poorter L. 2006. Plasticity in leaf traits of 38 tropical tree species in response to light; relationships with light demand and adult stature. Functional Ecology, 20(2): 207–216. DOI:10.1111/fec.2006.20.issue-2 |
| [] | Schrader S M, Wise R R, Wacholtz W F, et al. 2004. Thylakoid membrane responses to moderately high leaf temperature in Pima cotton. Plant. Cell and Environment, 27(6): 725–735. DOI:10.1111/pce.2004.27.issue-6 |
| [] | Schuepp P H. 1993. Tansley review No.59 leaf boundary layers. New Phytologist, 125(3): 477–507. DOI:10.1111/nph.1993.125.issue-3 |
| [] | Sisó S, Camarero J, Gil-Pelegrín E. 2001. Relationship between hydraulic resistance and leaf morphology in broadleaf quercus species: a new interpretation of leaf lobation. Trees-Structure and Function, 15(6): 341–345. DOI:10.1007/s004680100110 |
| [] | Smith W, Geller G. 1980. Leaf and environmental parameters influencing transpiration: theory and field measurements. Oecologia, 46(3): 308–313. DOI:10.1007/BF00346257 |
| [] | Smith W, Nobel P S. 1978. Influence of irradiation, soil water potential, and leaf temperature on leaf morphology of a desert broadleaf, Encelia farinosa Gray (Compositae). American Journal of Botany, 65(4): 429–432. DOI:10.2307/2442699 |
| [] | Smith W K, Vogelmann T C, DeLucia E H, et al. 1997. Leaf form and photosynthesis. BioScience, 47(11): 785–793. DOI:10.2307/1313100 |
| [] | Stokes V, Morecroft M, Morison J. 2006. Boundary layer conductance for contrasting leaf shapes in a deciduous broadleaved forest canopy. Agricultural and Forest Meteorology, 139(112): 40–54. |
| [] | Vogel S. 1970. Convective cooling at low airspeeds and the shapes of broad leaves. Journal of Experimental Botany, 21(1): 91–101. DOI:10.1093/jxb/21.1.91 |
| [] | Vogel S. 2009. Leaves in the lowest and highest winds: temperature, force and shape. New Phytologist, 183(1): 13–26. DOI:10.1111/nph.2009.183.issue-1 |
| [] | Yates M J, Verboom G A, Rebelo A G, et al. 2010. Ecophysiological significance of leaf size variation in Proteaceae from the Cape Floristic Region. Functional Ecology, 24(3): 485–492. DOI:10.1111/j.1365-2435.2009.01678.x |
 2012, Vol. 48
2012, Vol. 48