文章信息
- 崔凯, 张建国, 李昆, 廖声熙, 孙永玉
- Cui Kai, Zhang Jianguo, Li Kun, Liao Shengxi, Sun Yongyu
- 山合欢种子超干燥贮藏的生理生化效应
- Physiological and Biochemical Response of Albizzia kalkora Seeds to Ultra-dry Storage
- 林业科学, 2012, 48(3): 17-24.
- Scientia Silvae Sinicae, 2012, 48(3): 17-24.
-
文章历史
- 收稿日期:2011-05-06
- 修回日期:2011-12-03
-
作者相关文章
2. 中国林业科学研究院林业研究所 国家林业局林木培育重点实验室 北京 100091
2. Key Laboratory of Silviculture of State Forestry Administration Research Institute of Forestry, CAF Beijing 100091
通常人们认为种子含水量和储藏温度是制约种子活力的主要因素。1976年,国际植物遗传资源委员会(IBPGR)推荐5%±1%的含水量和-18 ℃作为长期保存种质资源的理想条件。冷藏成为当前种子储藏最通用的手段。而有些种子在极度干燥的状态下保存成百上千年依然能保持活力(Kivilaan et al., 1981;Shen-Miller et al., 1995;Steiner et al., 1995;Telewski et al., 2002),这一现象引起科研工作者极大的关注,种子超干燥保存技术应运而生。许多研究表明:有些种子脱水至5%含水量(传统认为的安全含水量)以下,在常温条件下保存能取得较好的效果,甚至优于低温保存(Buitink et al., 2004)。Burke(1986)提出干燥种子细胞质有可能会形成一种“玻璃化”状态,而这种状态可以使种子长时间保持活力。很多研究都证明了种子细胞质“玻璃化”的存在,目前认为可能细胞质“玻璃化”可以使一些生物大分子保持结构和功能的完整性(Slade et al., 1995)、减少褐变反应(Karmas et al., 1992)、增强某些保护酶的活性(Chang et al., 1996)、以及阻止蛋白的构象变化(Prestrelski et al., 1993)。如果切实可行,超干燥保存不失为一条高效节能的好途径。目前超干燥保存技术在农作物种子上运用较多,在林木种子上较少。不同物种的种子生物学特性差异大,种子保存试验耗时比较长,前人的种子超干燥试验又没有统一的试验条件,其结果难以横向比较,当前人们对种子超干燥机制掌握的比较有限。因此有必要增大供试材料的范围,探索超干燥保存的规律。
山合欢(Albizzia kalkora)属豆科(Leguminosae)含羞草亚科乔木,是重要的药用植物资源,具有镇静安神、止痛、抗肿瘤和增强免疫的功效(Park et al., 2006),它同时是干旱和半干旱地区植被恢复中重要的树种。山合欢种子是采用低温保存的,这要耗费相当一部分能源,而且笔者发现山合欢种子经过低温保存半年后生活力有明显的下降(山合欢种子初采集时发芽率能达到90%以上,在4 ℃保存半年后发芽率降到60%左右)。在本研究中,笔者探索用超干燥手段来保存山合欢种子的可行性,同时研究其生理生化方面的变化。一方面为解决生产应用中出现的问题,另一方面为种子超干保存的研究提供理论依据。
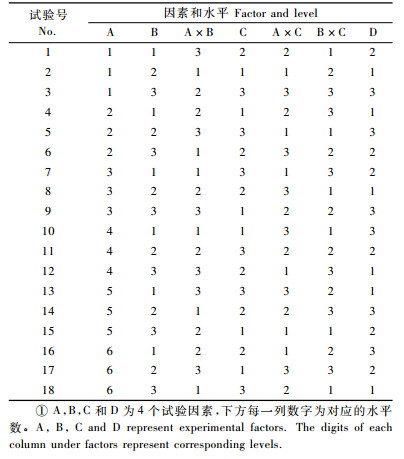
1 材料与方法 1.1 试验材料供试材料山合欢种子采自云南省元谋县干热河谷,采后于4 ℃保存。试验时种子的初始含水量为9.42%,采后种子的初始发芽率在90%以上。
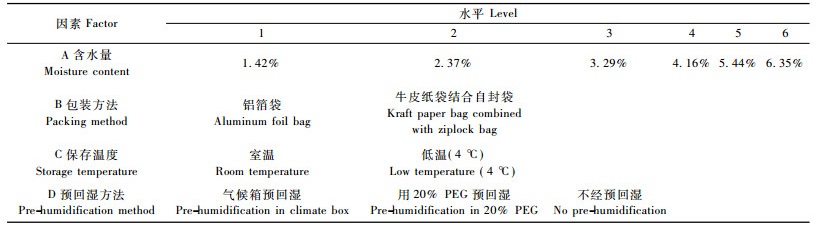
1.2 试验方法 1.2.1 种子含水量梯度的获得将种子置于盛有变色硅胶的干燥器内(硅胶质量与种子比例为6:1),每隔24 h对种子称质量并且更换硅胶,最终得到1.42%,2.37%,3.29%,4.16%,5.44%,6.35% 6个含水量梯度。以不经超干处理的种子在室温保存为对照1(CK1),在4 ℃冰箱保存为对照2(CK2)。种子含水量测定采用烘干法(宋松泉等,2005),以湿质量为基数计算种子含水量,用称量法测定种子含水量。试验设3次重复,取平均值。
1.2.2 超干保存和预回湿处理将获得的不同含水量梯度种子装入铝箔袋(20 cm×14 cm)或牛皮纸袋(外面套一个塑料自封袋),用封口机真空密封,在室温下保存1年。取出时,采用3种方法进行预回湿处理:气候箱预回湿,即室温下回湿48 h后用人工气候箱回湿48 h(25 ℃,相对湿度为80%);20%PEG预回湿,即用质量分数为20%的PEG溶液(聚已二醇,相对分子质量6 000)回湿12 h;不经预回湿。
1.2.3 发芽试验处理后的种子进行发芽试验,参照《1996国际种子检验规程》(国际种子检验协会,1996)的规定,采用2层滤纸法。每种处理设4次重复,每重复50粒种子。发芽温度为25 ℃,每天全光照12 h,以胚芽伸出种子粒长的一半为萌发,每天记录种子发芽个数,10天时统计种子的发芽率。
1.2.4 试验设计为检验种子含水量、包装方法、保存温度和预回湿方法4个因素不同水平对超干种子保存效果的影响,采用L18(61×36)正交试验设计(洪伟,1993),每个试验处理设3次重复,具体设计见表 1和2。
|
|
|
|
生理指标测定参照李合生(2000)的方法,相对电导率(RC)测定采用电导率仪法;MDA含量的测定采用硫代巴比妥酸(TBA)法;Pro含量的测定采用茚三酮比色法;SOD活性测定采用氮蓝四唑(NBT)光还原比色法,以抑制NBT光化还原的50%为1个酶活性单位;POD活性测定采用愈创木酚法,以每分钟内A470 nm变化0.01为1个酶活性单位;CAT活性测定采用高锰酸钾滴定法,酶活性以每克鲜质量样品1分钟内分解H2O2的毫克数表示;可溶性总糖含量和脂肪酸组分委托农业部农产品质量监督检验测试中心(昆明)测定,选用不经预回湿处理的种子。可溶性总糖含量的测定参照GB/T 5009.7-2003中的3,5-二硝基水杨酸比色法,脂肪酸参照GB/T 17377-1998中动植物油脂脂肪酸甲脂的气象色谱分析法测定。各项指标在测定时做3次重复。
1.2.7 数据处理结果为百分数的数据经平方根反正弦变换,试验数据用DPS 8.01和SPSS 13.0进行分析。
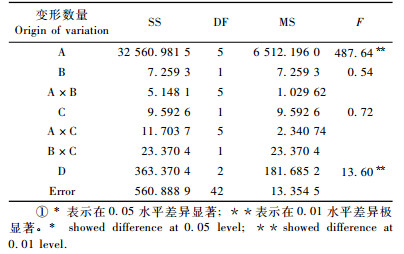
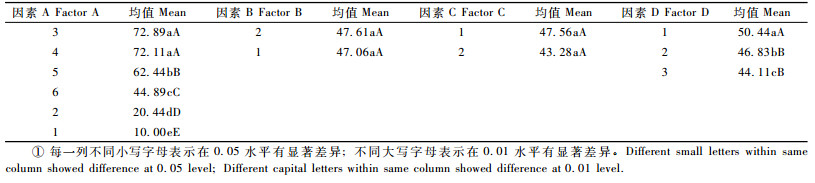
2 结果与分析 2.1 种子超干保存最适方案的选择通过发芽试验得出山合欢CK1(常温保存)种子发芽率为41%,CK2(低温保存)种子发芽率为56%。由表 3可知:A(含水量)、D(预回湿方法)2因素水平的极差(R)分别居于发芽率前2位,是影响种子发芽率的关键因素,其他因素(含交互作用)的影响较小。根据各试验因子的各水平总数或各水平均值(Ki)得到影响种子发芽率的最佳水平组合为:A3B2C1D1,即3.29%含水量+自封袋包装+常温保存+气候箱回湿。含水量因素中3,4,5水平(3.29%,4.16%,5.44%含水量)种子的发芽率都明显高于对照。
|
|
通过方差分析考察各因素的显著程度可知:含水量(A)和预回湿方法(D)对种子发芽率的影响达到显著水平,包装方法(B)和保存温度(C)的影响均不显著(表 4)。多重比较可知:含水量因素中(Factor A),3,4水平(3.29%,4.16%含水量)要显著优于其他水平;预回湿方法(Factor D)中,第1水平(气候箱回湿)显著优于其他;包装方法(Factor B)和保存温度(Factor C)2个因素的各水平之间无显著差异(表 5)。多重比较筛选的最优方案也是A3B2C1D1,与直观分析结果一致。
|
|
|
|
从图 1A可以看出:不同干燥程度对种子相对电导率影响较大,而预回湿处理对相对电导率影响较小。当种子采用含水量第3,4水平(3.29%,4.16%)时,相对电导率在3.11%以下,当种子采用第1水平(1.42%)时,相对电导率可达到7.75%,说明适宜的含水量对种子细胞膜伤害较小,种子在含水量为3.29%和4.16%时,相对电导率显著低于其他处理(P<0.05)。无论何种储藏方式,经过1年保存之后,种子都出现MDA的积累(图 1B),MDA的趋势和相对电导率一致,种子含水量为3.29%,4.16%和5.44%时,MDA含量显著较低(P<0.05),并明显的低于对照。

|
图 1 不同脱水和预回湿处理的山合欢种子的生理指标变化 Fig.1 Changes of physiological index of seeds treated with different dehydration and pre-humidification of A. kalkora 在各个图中,同一底纹柱子上方不同小写字母代表显著差异(P<0.05),多重比较采用Tukey法,虚线右边区域为2个对照处理。误差线代表标准差。 In each picture, different letters on the column with the same pattern indicate significant difference at P < 0.05 according to the Tukey test, and two controls were displayed in the right of dotted line. Bar represent ST. |
经过不同程度干燥种子Pro含量有显著差异(图 1C),当种子采用含水量为第3水平(3.29%含水量)时,Pro含量达到最高,在0.18 mg·g-1左右,当种子采用含水量第1水平(1.42%含水量)时,Pro含量达到最低,在0.11 mg·g-1。种子在含水量为3.29%和4.16%时,其种子的脯氨酸含量要显著高于其他处理(P<0.05),3种预回湿方法相比,20%PEG处理的种子其Pro含量相对较高。
2.4 不同处理种子3种抗氧化酶的比较随着种子含水量降低,种子的CAT活性呈现出单峰曲线变化(图 1D)。当种子含水量从6.35%降低至3.29%时,种子CAT活性呈现持续增加趋势,种子含水量为3.29%时CAT活性达到峰值,为11.86 U·g-1min-1。随着含水量进一步降低至2.37%,CAT活性迅速降低至3.65 U·mg-1min-1,当含水量降至1.42%时,种子CAT仅为2.13 U·mg-1min-1。方差分析表明:不同含水量种子的CAT活性差异显著(P<0.05),通过进一步多重比较指出:3.29%和4.16%含水量种子的CAT活性要显著高于其他4个含水量梯度种子和对照;经过气候箱预回湿和PEG预回湿的种子,与不经预回湿处理的种子相比,其CAT活性都要高一些,其中气候箱回湿种子的CAT活性更高。
POD活性变化和CAT活性变化相似,不同含水量种子的POD活性呈现出单峰曲线变化形式(图 1E)。种子含水量为3.29%时POD活性达到峰值,为19.02 U·mg-1min-1。随着含水量进一步降低至2.37%,POD活性迅速降低为5.85 U·mg-1min-1,当含水量降至1.42%时,种子POD仅有3.41 U·mg-1min-1左右。方差分析表明:不同含水量种子的POD活性差异显著(P<0.05),在6个含水量梯度种子中,3.29%,4.16%,5.44%和6.35%4个含水梯度的POD活性要显著高于另外2个含水量梯度。不同含水量种子的SOD活性有差异显著(P<0.05)(图 1F),其变化趋势与POD和CAT基本一致。
对超干种子的发芽率和6种生理指标做相关分析,结果表明:种子发芽率与相对电导率(RC)和MDA含量呈极显著负相关(P<0.01),与Pro,CAT,POD和SOD呈极显著正相关(P<0.01)(图 2)。

|
图 2 超干种子发芽率与6种生理指标的关系 Fig.2 elationship between seed germination percentage and six physiological indices of A. kalkora Pearson相关系数被分析,n=54。 Prearson coefficient was analyzed. n=54. |
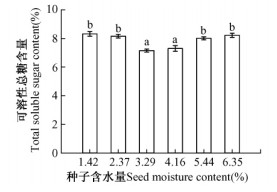
经不同超干处理山合欢种子的可溶性总糖含量有显著差异(P<0.05)(图 3)。3.29%含水量种子的发芽率为72.89%,含水量4.16%种子的发芽率为72.11%,但这2种含水量种子的可溶性总糖含量要显著比其他种子低。含水量1.42%种子的发芽率只有10%,而其可溶性总糖含量在所有梯度中是最高的,可见种子可溶性总糖含量的变化与其活力的保持呈相反的趋势。
|
图 3 不同脱水处理山合欢种子的可溶性总糖含量 Fig.3 Total soluble sugar content in seeds treated with different dehydration of A. kalkora 不同小写字母代表显著差异(P<0.05),多重比较采用Tukey法。 Different letters on the column indicate significant difference at P < 0.05 according to the Tukey test. |
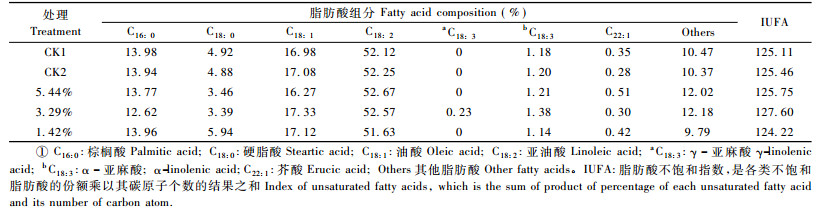
从表 6可知:山合欢种子经过脱水处理后,脂肪酸含量有所差异,如5个处理中只有3.29%含水量种子含有少量的γ-亚麻酸,其他均未检测到。含水量5.44%种子的亚油酸含量最高,含水量3.29%种子的油酸、γ-亚麻酸和α-亚麻酸的含量都相对最高。与其他处理相比,含水量为1.42%的种子的棕榈酸、硬脂酸2种饱和脂肪酸含量明显较高,亚油酸含量较低。5个处理种子的脂肪酸不饱和指数从高到低排序为:3.29%,5.44%,CK2,CK1,1.42%,这一排序结果与种子发芽率高低基本相符。
|
|
适宜的干燥程度(或脱水梯度)是影响种子寿命的关键点(Ellis et al., 2006),那么种子超干保存试验的目标其实可以说是为找到一个最佳的“脱水阈值”。本研究通过筛选6个含水量,发现3.29%含水量可以使山合欢种子的发芽率达到最高,这很可能是因为山合欢种子在3.29%含水量时,细胞质更容易进入玻璃化状态,从而使代谢减缓。另外,超干种子容易引发吸胀损伤(Zheng,1998),通过对种子发芽前的预先回湿处理可以降低这种损伤,如前人采用饱和水气或氯化钙来进行预先回湿处理,本研究中发现利用气候箱预回湿可以取得较好的效果。铝箔袋包装是种子超干保存试验的经典方法,为节约成本,本研究引入了牛皮纸袋+自封袋包装的方法,结果表明包装方法对种子生活力影响不大,只要能满足干燥和密封这2个条件即可,但本试验周期只有1年,可以使用自封袋,但它的材质容易老化,不适用于长期保存。
种子在储藏过程中,细胞膜损伤是造成种子劣变的主要原因之一(Leprince et al., 1995a),所以测定电解质渗漏率成为衡量种子劣变的常规手段。挥发性醛类和MDA是脂质氧化和过氧化的产物(Li et al., 2007)。很多研究都表明种子劣变过程中相对电导率和MDA含量会升高(Li et al., 2007;Li et al., 2008),但Mira等(2011)通过对芸薹属(Brassica)4种野生型植物种子的老化试验,发现种子活力降低过程中相对电导率明显降低,丙二醛含量无明显变化,由此推断这些种子活力丧失与膜完整性有关,与脂质过氧化无关。在本研究中,把山合欢种子含水量从6.35%降至3.29%,经过储藏后相对电导率是逐渐降低的,而含水量降低至2.37%和1.42%时,相对电导率显著提高,MDA含量的变化趋势和相对电导率一致,这表明山合欢种子劣变与细胞膜损伤和脂质氧化都有关,同时适度的脱水不会引起细胞膜的伤害,反而有利于细胞膜的保护,同时能降低脂质过氧化。
自由基引起的伤害是种子劣变的另一个重要因素(Pinhero et al., 1998)。通常认为种子劣变与活性氧物质如超氧自由基、过氧化氢(H2O2)和羟基(-OH)的累积有关。超氧自由基和过氧化氢的毒性在于它们可以促发级联反应从而形成羟氢氧基和其他破坏性物质,如脂质过氧化物(Noctor et al., 1998)。抗氧化酶可以有效的清除超氧自由基和过氧化氢,如超氧化物可以在SOD作用下转化为过氧化氢,一部分过氧化氢被CAT转化成水和氧气,一部分过氧化氢被过氧化物酶清除。通过自由基和过氧化物调节的脂质过氧化很可能是种子在储藏过程中造成活力丧失的一个重要因素(Goel et al., 2003)。超干处理对种子的抗氧化酶活性有明显影响。Li等(2008)发现经过超干处理的霸王(Zygophyllum xanthoxylon)种子的SOD,PER,CAT活性与未经脱水的种子相比有显著提高。Li等(2007)在对巴隆补血草(Limonium aureum)种子超干处理的研究中也指出POD,SOD,GR,APX和CAT活性与未经脱水的种子相比有提高,挥发性醛含量和相对电导率降低。Song等(2004)对鹧鸪花(Trichilia dregeana)种子的胚轴进行脱水处理,发现抗氧化酶如SOD,APX,CAT,GR和DHAR活性明显降低,通过施加外源抗坏血酸维C可以提高抗氧化酶的活性,并且有效抑制种子劣变。另外Zhu等(2007)对花生(Arachis sativum)种子的研究也得出相似的结论。本研究表明:把山合欢种子含水量控制在6.35%~3.29%,3种抗氧化酶(CAT,POD和SOD)的活性与未经脱水处理的种子相比是显著增强的(图 1),这表明把种子控制在适宜的脱水阈值,有可能会提高其抗氧化酶活性。
以前糖(特别是一些寡糖,如麦芽糖)被认为是种子“玻璃化”状态形成的决定性物质(Horbowicz et al., 1994;Leprince et al., 1995b),随后更多的证据支持种子“玻璃化”物质的成分是蛋白和糖的聚合物(van den Dries et al., 1998;Wolkers et al., 1999)。MacFarlane等(2002)认为胞内玻璃化物质是蛋白、糖、无机盐(如氯化镁)和小分子多羟基化合物的聚合物。在种子玻璃化物质组成的问题上存在很多争议(Buitink et al., 2008)。Zhu等(2007)指出花生种子经脱水处理后(MC 2.0%)与对照(非脱水种子)相比,非还原性糖/还原性糖的比值和抗老化能力都有明显提高,从而认为超干保存能延长种子活力与可溶性糖的变化有关。本研究发现:山合欢种子脱水至3.29%和4.16%时,可溶性总糖含量显著低于其他脱水梯度的种子,而这种状况下种子能保持较高的发芽率,另外含水梯度3.29%和4.16%的种子的Pro含量相对于其他脱水梯度有明显提高,所以笔者认为山合欢超干种子可溶性总糖含量的降低和Pro含量提高有可能与“玻璃化”物质形成有关。
不饱和脂肪酸及其衍生物在植物抗逆反应中具有调节作用,它们通过不同代谢途径形成结构各异、功能相关的一组化合物。作为信号分子,控制防御相关基因的转录,调节病程相关蛋白质的表达,另一方面作为抗菌物质和愈伤物质的有效组成,提高植物的免疫能力,增强植物的抗性(Weber,2002)。不饱和脂肪酸的过氧化被认为是种子在储藏过程中丧失生活力的主要原因之一,不饱和脂肪酸的过氧化源自于抗氧化酶的水平降低(Rao et al., 2006)。胡小荣等(2006)的研究表明:大葱种子经超干处理后,脂肪酸总体含量的增加有利于种子生活力保持。之前,在笔者对云南干热地区2种植物木豆(Cajanus cajan)(崔凯等,2008a)和酸角(Tamarindus indica)(崔凯等,2008b)种子的超干燥保存试验中表明,保持较高发芽率的超干种子其不饱和脂肪酸含量与对照相比都有明显增加。本研究表明:适宜的超干处理使山合欢种子油酸和亚麻酸的含量提高,进而使脂肪酸不饱和指数增加,这一状况有利于种子保持较高的发芽率,这表明不饱和脂肪酸的累积有可能在山合欢超干种子生活力的保持中发挥了作用。Berjak等(2008)指出种子的耐脱水性是由其物种的生物学特性所决定的,种子耐脱水性与植物种属的划分无明显的关联性,而与该物种的原生境有关,本研究也支持这一观点。
| [] | 崔凯, 李昆. 2008a. 酸角种子超干保存最适含水量的选择及机制分析. 西北农业学报, 17(3): 186–190. |
| [] | 崔凯, 李昆, 李立, 等. 2008b. 木豆种子超干保存最适含水量的选择及其机制分析. 东北林业大学学报, 36(5): 19–21. |
| [] | 国际种子检验协会(ISTA). 1996国际种子检验规程. 农业部全国农作物种子质量监督检测中心, 浙江大学种子科学中心译. 北京: 中国农业出版社. |
| [] | 胡小荣, 陶梅, 卢新雄, 等. 2006. 不同含水量大葱种子贮藏后的脂肪代谢研究. 植物遗传资源学报, 7(4): 464–467. |
| [] | 洪伟. 1993. 林业试验设计技术与方法. 北京, 科学技术出版社. |
| [] | 李合生. 2003. 植物生理生化实验原理和技术. 北京, 高等教育出版社. |
| [] | 宋松泉, 程红焱, 龙春林, 等. 2005. 种子生物学研究指南. 北京, 科学出版社. |
| [] | Berjak P, Pammenter N. 2008. From Avicennia to Zizania: seed recalcitrance in perspective. Annals of Botany, 101(2): 213–228. |
| [] | Buitink J, Leprince O. 2004. Glass formation in plant anhydrobiotes: survival in the dry state. Cryobiology, 48(3): 215–228. DOI:10.1016/j.cryobiol.2004.02.011 |
| [] | Buitink J, Leprince O. 2008. Intracellular glasses and seed survival in the dry state. Comptes Rendus Biologies, 331(10): 788–795. DOI:10.1016/j.crvi.2008.08.002 |
| [] | Burke M J. 1986. The glassy state and survival of anhydrous biological systems. NY, Cornell University Press. |
| [] | Chang B S, Beauvais R M, Dong A, et al. 1996. Physical factors affecting the storage stability of freeze-dried interleukin-1 receptor antagonist: glass transition and protein conformation. Archives of Biochemistry and Biophysics, 331(2): 249–258. DOI:10.1006/abbi.1996.0305 |
| [] | Ellis R H, Hong T D. 2006. Temperature sensitivity of the low-moisture-content limit to negative seed longevity moisture content relationships in hermetic storage. Annals of botany, 97(5): 785–791. DOI:10.1093/aob/mcl035 |
| [] | Goel A, Sheoran I S. 2003. Lipid peroxidation and peroxide-scavenging enzymes in cotton seeds under natural ageing. Biologia Plantarum, 46(3): 429–434. DOI:10.1023/A:1024398724076 |
| [] | Horbowicz M, Obendorf R L. 1994. Seed desiccation tolerance and storability: dependence on flatulence-producing oligosaccharides and cyclitols-review and survey. Seed Science Research, 4(4): 385–405. |
| [] | Karmas R, Pilar Buera M, Karel M. 1992. Effect of glass transition on rates of nonenzymic browning in food systems. Journal of Agricultural and Food Chemistry, 40(5): 873–879. DOI:10.1021/jf00017a035 |
| [] | Kivilaan A, Bandurski R S. 1981. The one hundred-year period for Dr.Beal's seed viability experiment. American Journal of Botany, 68(9): 1290–1292. DOI:10.2307/2443054 |
| [] | Leprince O, Vertucci C W, Hendry G A F, et al. 1995a. The expression of desiccation-induced damage in orthodox seeds is a function of oxygen and temperature. Physiologia Plantarum, 94(2): 233–240. DOI:10.1111/ppl.1995.94.issue-2 |
| [] | Leprince O, Walters-Vertucci C. 1995b. A calorimetric study of the glass transition behaviors in axes of bean seeds with relevance to storage stability. Plant Physiology, 109(4): 1471–1481. DOI:10.1104/pp.109.4.1471 |
| [] | Li Y, Feng H Y, Chen T, et al. 2007. Physiological responses of Limonium aureum seeds to ultra-drying. Journal of Integrative Plant Biology, 49(5): 569–575. DOI:10.1111/jipb.2007.49.issue-5 |
| [] | Li Y, Qu J J, Dong Z B, et al. 2008. Storage behavior of Zygophyllum xanthoxylon (Bge.) Maxim seeds at low moisture contents. Acta Physiologiae Plantarum, 30(5): 651–656. |
| [] | MacFarlane D, Pringle J, Annat G. 2002. Reversible self-polymerizing high Tg lyoprotectants. Cryobiology, 45(2): 188–192. DOI:10.1016/S0011-2240(02)00127-X |
| [] | Mira S, Estrelles E, González-Benito M E, et al. 2011. Biochemical changes induced in seeds of Brassicaceae wild species during ageing. Acta Physiologiae Plantarum, 33(5): 1–7. |
| [] | Noctor G, Foyer C H. 1998. Ascorbate and glutathione: keeping active oxygen under control. Annual Review of Plant Biology, 49(1): 249–279. DOI:10.1146/annurev.arplant.49.1.249 |
| [] | Park S Y, Lee W Y, Park Y, et al. 2006. Effects of nitrogen source and bacterial elicitor on isoflavone accumulation in root cultures of Albizzia kalkora (Roxb) Prain.. Journal of Integrative Plant Biology, 48(9): 1108–1114. DOI:10.1111/jipb.2006.48.issue-9 |
| [] | Pinhero R G, Paliyath G, Yada R Y, et al. 1998. Modulation of phospholipase D and lipoxygenase activities during chilling: Relation to chilling tolerance of maize seedlings. Plant Physiology and Biochemistry, 36(3): 213–224. DOI:10.1016/S0981-9428(97)86878-7 |
| [] | Prestrelski S J, Tedeschi N, Arakawa T, et al. 1993. Dehydration-induced conformational transitions in proteins and their inhibition by stabilizers. Biophysical Journal, 65(2): 661–671. DOI:10.1016/S0006-3495(93)81120-2 |
| [] | Rao R G S, Singh P M, Rai M. 2006. Storability of onion seeds and effects of packaging and storage conditions on viability and vigour. Scientia Horticulturae, 110(1): 1–6. DOI:10.1016/j.scienta.2006.06.002 |
| [] | Shen-Miller J, Mudgett M B, Schopf J W, et al. 1995. Exceptional seed longevity and robust growth: ancient sacred lotus from China. American Journal of Botany, 82(11): 1367–1380. DOI:10.2307/2445863 |
| [] | Slade L, Levine H. 1995. Water and the glass transition-Dependence of the glass transition on composition and chemical structure: Special implications for flour functionality in cookie baking. Journal of Food Engineering, 24(4): 431–509. DOI:10.1016/0260-8774(95)90766-5 |
| [] | Song S Q, Berjak P, Pammenter N. 2004. Desiccation sensitivity of Trichilia dregeana axes and antioxidant role of ascorbic acid. Acta Botanica Sinica, 46(7): 803–810. |
| [] | Steiner A M, Ruckenbauer P. 1995. Germination of 110-year-old cereal and weed seeds, the Vienna Sample of 1877.Verification of effective ultra-dry storage at ambient temperature.. Seed Science Research, 5(4): 195–199. |
| [] | Telewski F W, Zeevaart J A D. 2002. The 120-yr period for Dr.Beal's seed viability experiment. American Journal of Botany, 89(8): 1285–1288. DOI:10.3732/ajb.89.8.1285 |
| [] | van den Dries I J, van Dusschoten D, Hemminga M A. 1998. Mobility in maltose-water glasses studied with 1H NMR. The Journal of Physical Chemistry B, 102(51): 10483–10489. DOI:10.1021/jp982718v |
| [] | Weber H. 2002. Fatty acid-derived signals in plants. Trends in Plant Science, 7(5): 217–224. DOI:10.1016/S1360-1385(02)02250-1 |
| [] | Wolkers W F, Tetteroo F A A, Alberda M, et al. 1999. Changed properties of the cytoplasmic matrix associated with desiccation tolerance of dried carrot somatic embryos.An in situ Fourier transform infrared spectroscopic study. Plant Physiology, 120(1): 153–164. DOI:10.1104/pp.120.1.153 |
| [] | Zheng G H. 1998. Ultradry seed storage: Improve strategy and technology for germplasm conservation. Chin Biodiv(2): 61–65. |
| [] | Zhu C, Chen J. 2007. Changes in soluble sugar and antioxidant enzymes in peanut seeds during ultra dry storage and after accelerated aging. Seed Science and Technology, 35(2): 387–401. DOI:10.15258/sst |
 2012, Vol. 48
2012, Vol. 48