文章信息
- 杨淑敏, 刘杏娥, 费本华, 江泽慧, 杨喜, 单海斌
- Yang Shumin, Liu Xing'e, Fei Benhua, Jiang Zehui, Yang Xi, Shan Haibin
- 茶秆竹细胞壁解剖特性以及木质素微区分布
- Main Anatomy Characteristics in Cell Wall and Lignin Distribution of Bamboo Culms(Pseudosasa amabilis)
- 林业科学, 2012, 48(2): 129-133.
- Scientia Silvae Sinicae, 2012, 48(2): 129-133.
-
文章历史
- 收稿日期:2010-05-24
- 修回日期:2010-09-09
-
作者相关文章
茶秆竹(Pseudosasa amabilis)是一种优良的笋、竹两用竹种,竹材通直、节平、坚韧、弹性强、耐腐蚀、不易虫蛀,可作建筑材料,也可用于家具、胶合板和竹浆造纸等,是我国传统出口商品竹。茶秆竹竹笋富含18种氨基酸和多种人体必需的微量元素,是天然保健食品。对茶杆竹的研究多集中在育苗造林技术上,对其细胞壁特性的研究还比较少。茶杆竹纤维细胞壁较厚,腔径小,纤维壁上明显有节状加厚。以往对纤维细胞形态的研究比较多,对薄壁组织和导管的形态研究鲜见报道(Alvin et al., 1988)。木质素作为竹茎纤维、导管和薄壁组织等细胞壁的主要组成成分之一,对其在细胞壁中的微区分布和竹材木质化过程都有过研究(Itoh,1990; Yoshizawa et al.,1991; Lin et al., 2002; Lybeer et al., 2005a; 2005b),但对茶秆竹木质素的分布研究较少。本文研究了茶秆竹各种组织的细胞壁特性以及各微区的木质素组成单元及其含量,对进一步研究竹材生物形成机制具有重要参考价值。
1 材料与方法茶秆竹采自浙江安吉竹种园,选取1年生代表性竹株2~3株,自基部向上的第3节间中部切取0.5cm×0.5cm×T(T为竹壁径向宽度)的小竹块,置于FAA固定液中固定。
常规切片:固定后的小竹块经清洗、甘油酒精溶液软化后,利用滑走切片机切取20μm厚的切片。切片一部分用番红(1%)溶液染色、酒精脱水、二甲苯透明、加拿大树胶封片后,制作永久显微玻片; 另一部分用于组织化学染色的光学显微镜观察,拍照; 还有一部分用于测定可见光吸收光谱。
显微观察及摄影:利用永久切片,分竹青、竹中和竹黄3个区域,在光学显微镜下结合显微图像分析系统,观察并测定维管束的密度、长度、宽度,每个分区的维管束全部观测。纤维、导管和薄壁组织细胞的双壁厚和腔径,每分区重复测定30次,取平均值,每部位重复测定90次。
组织化学染色:Mäule反应———切片用1%高锰酸钾溶液染色5min后,用蒸馏水冲洗3遍,在3%HCL中浸泡1min,蒸馏水洗涤,29%氨水封片观察; Wiesner反应———切片用2%间苯三酚酒精(95%)溶液浸泡5min,滴加6mol·L-1HCL封片观察。
可见光显微分光光度计测定吸收光谱:Mäule和Wiesner反应后的切片利用可见光显微分光光度计(Univar,点径1μm,谱带宽10mm)测量可见光吸收光谱。测定纤维组织次生壁、细胞角隅区和复合胞间层在最大吸收峰处的吸光度时,分别在竹壁的竹黄、竹中和竹青3个区域选择有代表性的维管束3个,按照图 1所示的箭头方向,以靠近原生木质部导管和初生韧皮部筛管的纤维作为起点,以靠近薄壁组织的纤维作为终点,依次测定外方纤维帽和内方纤维帽近似值线上的纤维次生壁、细胞角隅区和复合胞间层的吸光度,然后取3个维管束的平均值作为竹壁径向不同位置的吸光度。
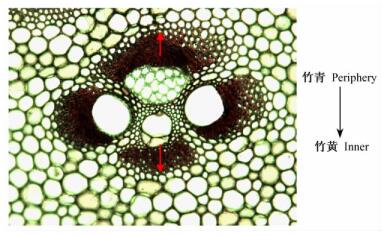
|
图 1 纤维Mäule和Wiesner反应吸光度测定示意 Fig.1 Detail to measure absorbance of fiber in bamboo stem after Mäule reaction and Wiesner reaction |
在竹壁横切面,维管束分布于基本薄壁组织中,是输导组织和强固组织的综合体。茶秆竹维管束按照Grosser等(1971)的分类方法属于开放型。维管束的密度从竹青到竹黄逐渐下降,平均2个。维管束形状从竹青长而窄变成竹黄部位的短而宽,维管束平均长度和宽度分别为618和545μm(表 1)。在本研究中,维管束密度由竹壁外侧到内侧呈渐减趋势,这与乔士义等(1991)对52种竹材维管束研究得到的结论一致。对比维管束的径向长度、弦向长度和径弦向长度比值的大小可以得出,径向长度从竹青到竹黄逐渐下降与以往研究竹壁中部的最大不一致(乔士义等,1991); 弦向长度在竹黄部位最大,这与乔士义等(1991)和魏学智(1999)结论是一致的。径弦向之比值自外而内递减和熊文愈等(1980) 的结论一致。
|
|
竹纤维细长,呈纺锤状,两端尖锐,纤维平均长度比针叶木略短,比阔叶木要长。平均长度随品种而异,多在15~20mm之间,宽度为15~18μm,长宽比较大,纤维素与木材相接近,可作为造纸的好原料。纤维细胞壁较厚,腔径小,纤维壁上明显有节状加厚。茶秆竹纤维双壁厚竹青部位最大,竹黄次之,竹中最小,而腔径是竹中>竹黄>竹青,壁腔比和双壁厚的变化趋势一致。纤维平均双壁厚、平均腔径和平均壁腔比分别为15.3μm,3.5μm和4.5;导管双壁厚从竹青到竹黄逐渐增加,腔径在竹壁径向上的变化规律与纤维腔径一致(竹中>竹黄>竹青),3个分区的壁腔比相差较小。导管平均双壁厚、平均腔径和平均壁腔比分别为3.9μm,102.5μm和0.04;薄壁组织细胞双壁厚和纤维双壁厚的变化规律一致,而腔径从竹青到竹黄逐渐增加,壁腔比从竹青到竹黄逐渐降低,薄壁组织细胞平均双壁厚、平均腔径和平均壁腔比分别为7μm,41.2μm和0.2(表 1)。壁腔比小于1者为很好的造纸原料,壁腔比大于1者为劣等的造纸原料。12个月的茶秆竹壁腔比大于1,已经不是较好的造纸原料。茶秆竹的纤维、薄壁组织细胞和导管的双壁厚、腔径和壁腔比在竹青、竹中和竹黄的变化趋势未表现出明显的规律。对于薄壁组织细胞和导管双壁厚,腔径和壁腔比与造纸和工业利用的关系未见报道。
2.2 细胞壁木质素的定性分布竹木质素由对羟基苯基丙烷单元(H)、愈创木基丙烷单元(G)和紫丁香基丙烷单元(S)形成(Lybeer et al., 2005a; 2005b),即使在相同竹种的不同细胞中也不相同。Kim等(2008)在研究竹材腐朽时发现,复合胞间层和导管都含有S,H和G木质素单元,纤维次生壁的木质素只含有G和S2种组成单元。运用组织化学染色,其中Mäule反应对紫丁香基、Wiesner反应对紫丁香基(S)和愈创木基(G)产生颜色反应,从而可以鉴别木质素组成单元的存在。对12个月茶秆竹的木质素分布利用组织化学染色进行研究看出:纤维、薄壁组织和导管经过Mäule试剂显示出棕色(图版Ⅰ-1~3),经过Wiesner反应显示暗红色(图版Ⅰ-4~6),说明木质素大量沉积,并且含有G和S2种木质素组成单元。
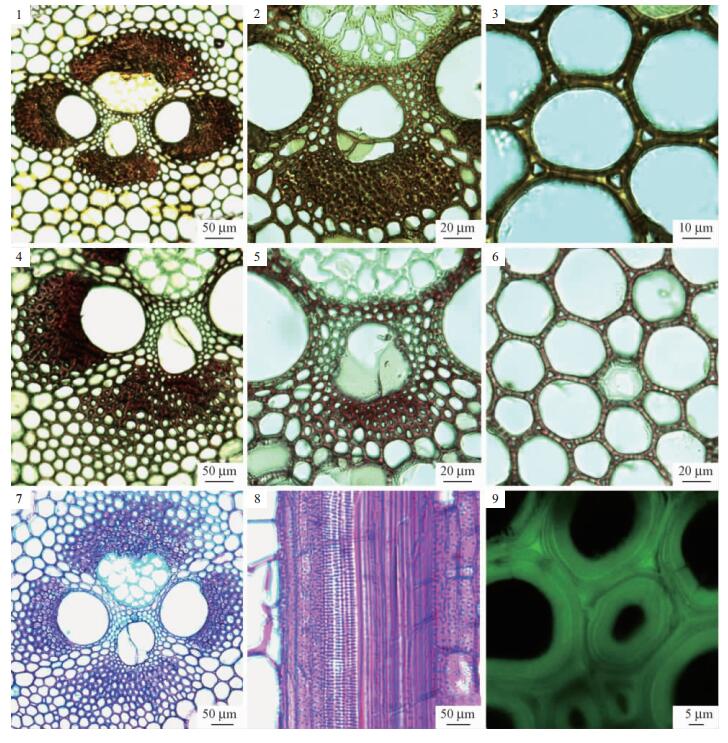
|
图 图版Ⅰ 杨淑敏等:茶秆竹细胞壁解剖特性以及木质素微区分布 Fig.图版Ⅰ Yang Shumin et al.: Main anatomy characteristics in cell wall and lignin distribution of bamboo culms (Pseudosasa amabilis) 1-3. M ule反应,横切面。1.纤维和导管呈深棕色,薄壁组织呈棕色;2.导管、纤维和维管束内薄壁组织呈棕色;3.薄壁组织呈棕色。4-6. Wiesner,横切面。4.靠近维管束内部的纤维和导管呈红色,薄壁组织颜色较浅;5.纤维呈深红色,导管、初生韧皮部、原生木质部导管和薄壁组织呈红色;6.薄壁组织呈红色。7-8.番红固绿对染。7.纤维、导管和薄壁组织细胞染成红色,横切面;8.导管、纤维和薄壁组织染成红色,径切面。9.纤维次生壁多层结构,薄层荧光强于宽层。 1-3. M ule reaction, cross section. 1. The cell walls of fiber and vessel were stained deep brown, of parenchyma brown. 2. Vessel, fiber and parenchyma in vascular bundle in brown. 3. Parenchyma in brown. 4-6. Wiesner reaction, cross section. 4. Fiber and vessel adjacent to vascular bundle in red, parenchyma in light red. 5. Fiber in deep red, vessel, protoxylem, primary phloem and parenchyma in red. 6. Parenchyma in red. 7-8. Safranin and fast-green staining. 7. Fiber, vessel and parenchyma were stained red, cross section. 8. Fiber, vessel and parenchyma were stained red, radial section. 9. CLSM picture, the secondary cell wall multilayer structure, fluorescence in thin layer stronger than that in the thick. |
番红固绿染色后,纤维、导管和薄壁组织被染成红色,说明已经有木质素的沉积,这和组织化学染色的结果一致(图版Ⅰ-7,8)。靠近维管束内部的纤维红色较深,木质素沉积从维管束内部向外进行(图版Ⅰ-7)。原生木质部导管、后生木质部导管细胞壁染成红色,纤维和薄壁组织呈现红色,1年时纤维全部呈现红色,纤维全部木质化(图版Ⅰ-8)。纤维的次生壁显示了多层结构,并且薄层的荧光比厚层的明显(图版Ⅰ-9)。纤维细胞壁次生壁中木质素并非均匀分布,在宽层木质素浓度较低,而窄层木质素浓度较高(Murphy et al., 1992)。本文的试验结果与此结论相符。
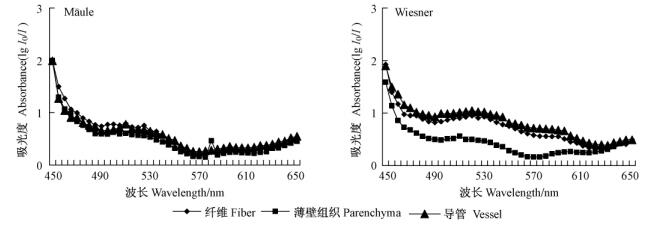
2.3 木质素在细胞壁的微区分布根据最大吸收峰谱图(图 2),找到对应吸收峰处的波长列于表 2,分别在每个组织相对应的最大吸收峰波长处测定相应组织及其各微区的吸光度。纤维、薄壁组织和导管的2种组织化学染色的可见光吸收光谱在500~520nm都具有较强的吸收峰值,说明不同组织中同时含有S基和G基木质素。纤维Mäule的吸收峰值在510nm,这个结果同已经报道的一些结论较为接近,竹茎在500,508和510nm处具有较大的吸收峰,黄杨(Buxus spp.)、桦木(Betula spp.)和尾巨桉分别(Eucalyptus urophylla×E.grandis)在515,500和510nm处显示了最大吸收峰(Yoshizawa et al., 1993),这个范围内吸收峰值的出现是由于木质素中紫丁香基成分的存在。
|
图 2 茶秆竹纤维、薄壁组织和导管Mäule和Wiesner反应后可见光吸收光谱 Fig.2 Visible light absorption spectra of fiber, vessel and parenchyma cell walls in bamboo stem |
|
|
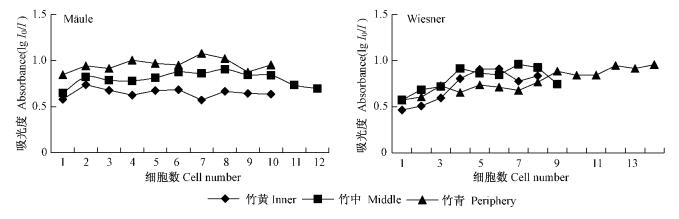
Mäule反应后,茶秆竹纤维次生壁(SW)、细胞角隅区(CCML)和复合胞间层(CML)在竹壁径向的吸光度从竹黄到竹青部位逐渐加大,S基木质素的含量在竹青部位最大; Wiesner反应后,纤维次生壁、细胞角隅区和复合胞间层竹中部位的吸光度最大,竹青的次之,竹黄的最小,竹青和竹黄部位的吸光度相差较小(表 3)。茶秆竹维管束内的纤维细胞中不同位置的纤维次生壁的吸光度未呈现规律性的变化(图 3)。
|
|
|
图 3 维管束内纤维次生壁Mäule和Wiesner反应的吸光度的径向变异 Fig.3 The radial variation of absorbance in fiber secondary wall within one vascular bundle after Mäule and Wiesner reaction |
茶秆竹纤维细胞壁Mäule反应中吸光度的顺序为纤维次生壁>复合胞间层>细胞角隅区,3个微区的吸光度差别比较小; Wiesner反应中,纤维次生壁>细胞角隅区>复合胞间层(表 4)。茶秆竹薄壁组织细胞的纤维次生壁、复合胞间层和细胞角隅区的木质素含量为:Mäule反应中,木质素含量顺序为细胞角隅区>纤维次生壁>复合胞间层; Wiesner反应中,木质素含量顺序为细胞角隅区>纤维次生壁>复合胞间层(表 4)。
|
|
木素沉积首先发生在细胞角隅区和复合胞间层,其次是纤维次生壁(Lybeer et al., 2005a; 2005b)。在生长过程中,不同微区木质化速率随竹龄有显著变化,即CML和SW加快,而CCML则减慢,最终使得CCML,CML和SW木质素浓度差别减小。在本研究中,12个月时,茶杆竹纤维次生壁的木质素含量较大,复合胞间层次之,细胞角隅区较小,也验证了此结论。对于薄壁组织细胞各微区,CCML>SW>CML,由此推断,薄壁组织的木质化程度12个月后还会加强,最终使三者的木质素含量相差较小。
对纤维、薄壁组织和导管单个细胞不同区域的木质素分布进行分析。由图 4可以看出:茶秆竹复合胞间层的木质素含量在2种反应中都小于纤维次生壁的木质素含量平均值,纤维次生壁薄层的木质素含量略大于厚层的。

|
图 4 纤维次生壁薄厚层和复合胞间层以及薄壁组织和导管次生壁各个层次Mäule和Wiesner反应的吸光度差异 Fig.4 The difference of absorbance in fiber, parenchyma, and vessel secondary wall with lamellae after Mäule and Wiesner reaction |
从胞间层到细胞腔,逐一测定薄壁组织和导管次生壁每个层次上的吸光度。由图 4可以看出:经过Mäule和Wiesner反应后,薄壁组织次生壁各个层次上的吸光度值相差不大,没有明显的分布规律; 同样,导管次生壁各个壁层的木质素含量未呈现规律性的变化趋势。
2.3.3 不同组织木质素含量的差异由图 5可以看出:不同组织细胞次生壁经过Mäule和Wiesner反应后,吸光度也有明显的不同,导管次生壁的吸光度都小于纤维的、大于薄壁组织细胞的。这也验证了以前对竹材研究的结论,一般竹材纤维的木质素含量高于导管的,薄壁组织的木质素含量最低(Lin et al., 2002)。

|
图 5 薄壁组织、纤维和导管次生壁Mäule和Wiesner反应的吸光度的差异 Fig.5 The difference of absorbance in parenchyma, fibre and vessel secondary wall after Mäule and Wiesner reaction |
1) 维管束的密度从竹青到竹黄逐渐下降,平均2个。维管束形状从竹青长而窄变成竹黄部位的短而宽,维管束平均长度和宽度分别为618和545μm。纤维平均双壁厚、平均腔径和平均壁腔比分别为15.3μm,3.5μm和4.5。
2) 木质素在各组织中均有分布,其含量因组织类型及其细胞壁微区不同而有差异。
3) 细胞壁各微区中存在愈创木基(G)和紫丁香基(S)2种木质素组成单元。
4) 竹壁径向和纤维帽不同位置的木质素含量未有明显的规律性变化。
5) 纤维次生壁具有薄厚层交替的多层结构,薄层木质素含量大于厚层。
| [] | 乔士义, 朱建彬, 崔东风. 1991. 52种竹材维管束的观测报告. 竹类研究, 10(1): 84–100. |
| [] | 魏学智. 1999. 四种竹材维管束和薄壁组织的比较解剖研究. 山西师大学报:自然科学版, 13(2): 44–47. |
| [] | 熊文愈, 乔士义, 李又芬. 1980. 毛竹(Phyllostachys pubescens Mazel ex H.de Lehaie)杆茎的解剖构造. 植物学报, 22(4): 343–348. |
| [] | Alvin K L, Murphy R J. 1988. Variation in fibre and parenchyma wall thickness in culms of the bamboo Sinobambusa tootsik. IAWA Bull, 9(4): 353–361. DOI:10.1163/22941932-90001095 |
| [] | Grosser D, Liese W. 1971. On the anatomy of Asian bamboos, with special reference to their vascular bundles. Wood Sci Technol, 5(4): 290–312. DOI:10.1007/BF00365061 |
| [] | Itoh T. 1990. Lignification of bamboo(Phyllostachys heterocycla Mitf.) during its growth. Holzforschung, 44: 191–200. DOI:10.1515/hfsg.1990.44.3.191 |
| [] | Kim J S, Lee K H, Cho C H, et al. 2008. Micromorphological characteristics and lignin distribution in bamboo (Phyllostachys pubescens)degraded by the white rot fungus Lentinus edodes. Holzforschung, 62: 481–487. |
| [] | Lin J X, He X Q, Hu Y X, et al. 2002. Lignification and lignin heterogeneity for various age classes of bamboo (Phyllostachys pubescens)stems. Physiologia Plantarum, 114(2): 296–302. DOI:10.1034/j.1399-3054.2002.1140216.x |
| [] | Lybeer B, Koch G. 2005a. A topochemical and semiquantitative study of the lignification during ageing of bamboo culms (Phyllostachys viridiglaucescens). IAWA Journal, 26(1): 99–109. DOI:10.1163/22941932-90001605 |
| [] | Lybeer B, Koch G. 2005b. Lignin distribution in the tropical bamboo species Gigantochloa levis. IAWA Journal, 26(4): 443–456. DOI:10.1163/22941932-90000126 |
| [] | Murphy R J, Alvin K L. 1992. Variation in fibre wall structure in bamboo. IAWA Bull, 13: 403–410. DOI:10.1163/22941932-90001296 |
| [] | Yoshizawa N, Satoh I, Yokota S, et al. 1991. Lignification and peroxidase activity in bamboo shoots(Phyllostachys edulis A.et C.Riv.). Holzforschung, 45: 169–174. DOI:10.1515/hfsg.1991.45.3.169 |
| [] | Yoshizawa N, Satoh M, Yokota S, et al. 1993. Distribution of guaiacyl and syringyl lignins in normal and compression wood of Buxus microphylla var.insularis Nakai. IAWA Journal, 14(2): 139–151. DOI:10.1163/22941932-90001307 |
 2012, Vol. 48
2012, Vol. 48