文章信息
- 余旋, 朱天辉, 刘旭
- Yu Xuan, Zhu Tianhui, Liu Xu
- 不同解磷菌剂对美国山核桃根际微生物和酶活性的影响
- Effects of Different Phosphate-Solubilizing Bacteria on Rhizosphere Microorganism and Enzyme Activities of Pecan Seedlings
- 林业科学, 2012, 48(2): 117-123.
- Scientia Silvae Sinicae, 2012, 48(2): 117-123.
-
文章历史
- 收稿日期:2010-07-20
- 修回日期:2010-10-08
-
作者相关文章
2. 西北农林科技大学葡萄酒学院 杨凌 712100
2. College of Enology, Northwest Agricultural & Forestry University Yangling 71210
磷是植物生长发育必需的营养元素,缺磷可导致农作物产量明显降低。土壤全磷含量虽然较高,但多以难溶态存在于土壤中,难以被植物吸收利用(陈哲等,2009)。为了获得高产,生产上反复施用大量磷素化肥,其中大约70%转化为Ca-P,Fe-P和Al-P等难溶性化合物而储存在土壤中(Bagyaraj et al.,2000;Holford,1997),这不仅耗竭有限的磷矿资源、造成环境污染,还会给食物安全和人类健康带来影响(Gyaneshwar et al., 2002)。解磷细菌(phosphate-solubilizing bacteria,PSB)通过活化土壤磷元素或影响植物根系分泌物的种类和数量,增加植物根系对K,Ca,Mg,Fe,Zn等营养元素的吸收,从而促进植物的生长发育(Rodríguez et al., 1999; Alagawadi et al., 1992)。解磷细菌还通过分泌各种酶类(钟传青等,2005)或有机酸(Henri et al., 2008; Chen et al., 2006; Illmer et al., 1992)来活化土壤中的难溶态磷,并影响根际微生物的群落结构(毕银丽等,2007; Kokalis-Burelle et al., 2006)。但解磷细菌的解磷能力和促生效应受土壤生态条件的影响,特别是与土壤中固有的有效磷含量密切相关,并受植物生长发育进程的反馈调节。目前,对解磷菌剂的研究主要集中在其对植物(主要是大田作物)生长、营养吸收及产量和品质的影响上(Ekin,2010;朱培淼等,2007; Fernandez et al., 2007; Valverde et al., 2006),有关其对木本植物根际土壤微生态环境和土壤酶活性的影响报道很少(洪坚平等,2007;Kim et al., 1998)。但在生防菌上的相关研究较多,如在甜瓜(Cucumis melo)上定殖后的生防荧光假单胞菌(Pseudomonas fluorescens)2P24对土壤中细菌和真菌均有较强的抑制作用,对放线菌却具有促进作用。在收获期,2P24对土壤中细菌和放线菌的影响逐渐减弱,而对真菌表现了一定的促进作用(朱伟杰等,2010)。陈雪丽等(2008)研究认为蔬菜种类是决定根际微生物群落结构的主要因素,接种生防细菌对根际细菌群落结构影响不显著,而对根际真菌群落结构的影响因蔬菜种类的不同而有差异。另外,接种菌根真菌提高了玉米(Zea mays)根际土壤酸性和碱性磷酸酶活性,不同菌根菌和不同P源对磷酸酶活性有明显影响(宋勇春等,2001)。
美国山核桃(Carya illinoensis)在我国西南山区已引种栽培,其植株生长对磷元素的需求量较大。本试验研究了在3种施P水平下,接种不同解磷菌剂对美国山核桃苗各生长发育期根际土壤细菌、放线菌、真菌数量和土壤磷酸酶、脲酶活性的影响,为筛选适宜解磷细菌在其生长发育过程中发挥最大效应的土壤养分条件(特别是土壤P素水平)提供依据,并进一步阐明解磷细菌促生效应的微生物学作用机制,以便为生产上选择合适的接种时期提供借鉴。
1 材料与方法 1.1 试验材料供试菌株绿针假单胞菌(Pseudomonas chlororaphis)、荧光假单胞菌(P.fluorescens)和蜡样芽孢杆菌(Bacillus cereus)等由四川农业大学森林保护省级重点实验室提供,其液体培养基中的解磷量分别为195.99,191.48,185.27mg·L-1。
供试植株为美国山核桃的1年生实生苗,由四川省林业科学研究院提供。
供试土壤采自四川省雅安市大兴镇山核桃苗木繁育基地,采样深度为0~20cm,砂壤土,其土壤理化性质为:有机质10.43g·kg-1,全氮0.80g·kg-1,全磷0.34g·kg-1,碱解氮51.90mg·kg-1,速效磷4.50mg·kg-1,速效钾47.07mg·kg-1。样土风干后过1mm筛,并与过1mm筛的河沙以3:1(V:V)混合后备用。
1.2 试验设计盆栽试验采用2因素完全随机区组设计,因素1为菌群,共设6个处理:处理1,接种绿针假单胞菌菌剂50mL(T1);处理2,接种荧光假单胞菌菌剂50mL(T2);处理3,接种蜡样芽孢杆菌菌剂50mL(T3);处理4,接种混合菌剂(T1:T2:T3=1:1:1)50mL(T4);处理5,接种经121℃灭菌2h的LB培养基50mL为培养基对照(CK1);处理6,不添加任何菌剂为土壤对照(CK2)。因素2为施磷水平,参考各个核桃产区根际土壤的有效磷含量(数据未发表)及盆栽土的特点,共设3种施P处理:P1(不施磷肥,即0g·kg-1土)、P2(每千克土施入1g过磷酸钙,即1g·kg-1土)和P3(每千克土施入2g过磷酸钙,即2g·kg-1土),每处理重复5次。所用磷肥含P2O512.4%。每个处理均按N300mg·kg-1和K2O200mg·kg-1施入氮肥(尿素)和钾肥(硝酸钾),以满足植株对N,K营养的需求。每盆装土5kg。
试验于2009年3月起在四川农业大学林木种质圃进行,美国山核桃苗生长期间除进行常规管理外,定期轮换花盆的位置。
1.3 试验方法 1.3.1 菌剂制备及接种方法菌剂制备:分别接种3种解磷细菌于LB液体培养基中,28℃,125r·min-1振荡培养48h。待菌株充分生长后,测定各菌株悬浮液OD660值。当OD660值大于0.5时,调整各菌悬液的OD660值至相等。每个三角瓶(300mL)内装入150mL LB液体培养基,分别接种15mL上述各菌悬液,28℃、125r·min-1振荡培养2~3天后测定其OD660值,使含菌量达到108~109CFU·mL-1,即为解磷细菌液体菌剂。
接种方法:待山核桃苗移栽成活后,立即在其根际周围用无菌注射器注射菌剂50mL,CK1每盆注射灭菌后的LB培养基50mL,CK2则注射无菌水50mL。
1.3.2 土样采集分别在山核桃苗的展叶期(4月中旬)、新梢生长期(7月中旬)和落叶期(10月上旬)采集土壤样品,每个处理重复5次。在土壤水分含量适中时采用剥落分离法取样,将带土植株取出,轻轻抖动附在根系上的土壤作为根际土壤样品。取样后一部分样品立即进行土壤微生物测定,一部分土样风干过筛后进行土壤酶活性测定。
1.3.3 微生物数量测定采用稀释平板法(李阜棣等,1996)。细菌采用牛肉膏蛋白胨培养基; 放线菌采用改良高氏一号合成培养基,临用时每300mL培养基加入1mL3%重铬酸钾; 真菌采用马丁氏孟加拉红培养基,临用时每100mL培养基加入0.3mL1%链霉素液。测定结果以CFU·g-1干土表示。
1.3.4 土壤酶活性测定土壤磷酸酶活性采用磷酸苯二钠比色法测定,脲酶活性采用靛酚蓝比色法测定(关松荫,1986),重复5次。
1.4 数据处理试验数据经Excel2003作图,采用SPSS11.5统计软件进行方差分析和多重比较(LSD法)。
2 结果与分析分析不同解磷菌剂,不同施P水平对美国山核桃菌3个生长时期根际微生物和酶活性的影响。
2.1 对根际细菌数量的影响同一生长时期,不同施P水平下各种解磷菌剂对根际细菌数量的影响不同(图 1)。1) 展叶期和新梢生长期:P1,P2水平下,各菌剂处理后的根际细菌数量均有所增加,且在P1水平下增幅大于P2水平,随着施P量的提高,根际细菌数量的增幅逐渐减少。各菌剂处理以混合菌群(T4) 增幅最大,并显著高于其余3种菌剂(P<0.05),说明混合菌群较单一菌种更利于苗木根际细菌数量的增加。P3水平下,各处理的根际细菌数量与CK2差异不显著,说明在高施P水平下,解磷菌剂不能增加根际细菌的数量。2) 落叶期:P1,P2水平下,仅有T4菌剂的根际细菌数量较CK2显著增加(P<0.05)。P3水平下各处理对根际细菌数量的影响与展叶期和新梢生长期相同。试验对照CK1和CK2间无显著性差异(P<0.05),说明添加灭菌后的LB培养基对根际细菌数量无影响。
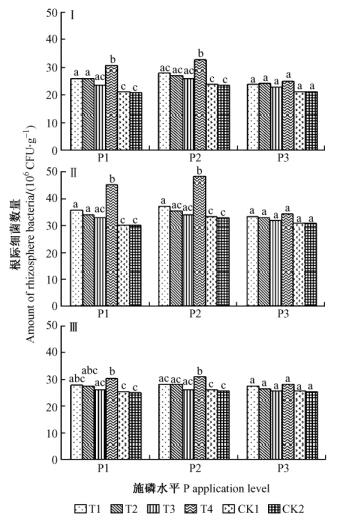
|
图 1 解磷菌剂对美国山核桃苗不同生长时期根际细菌数量的影响 Fig.1 Effects of phosphate-solubilizing bacteria on the amounts of rhizosphere bacteria at different growth stages of pecan seedlings Ⅰ:展叶期Leaf expansion stage; Ⅱ:新梢生长期Shoot growth stage; Ⅲ:落叶期Defoliation. T1:绿针假单胞菌Pseudomonas chlororaphis 50 mL; T2:荧光假单胞菌Pseudomonas fluorescens 50 mL; T3:蜡样芽孢杆菌Bacillus cereus 50 mL; CK1: T1: T2: T3 = 1: 1: 1 50 mL; CK2:无菌剂No bacteria. P 1,P2,P3 :每千克土施过磷酸钙。1,2 g Calciumsuperphosphate applied per kg soil,0,1,2 g.不同小写字母表示各处理间差异显著(P<0. 05)。Different letters in the same column mean significant difference among treatments at 0. 05 level.下同The same below. |
由图 2可见:3种施P水平下,苗木根际放线菌数量均较CK2有所增加。
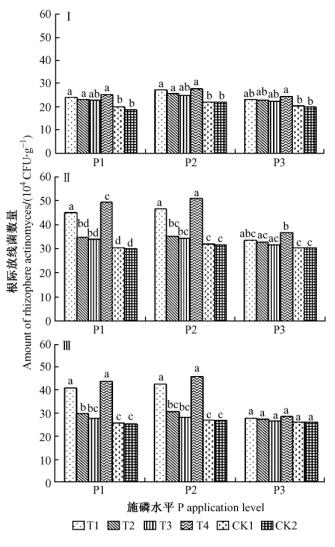
|
图 2 解磷菌剂对美国山核桃苗不同生长时期根际放线菌数量的影响 Fig.2 Effects of phosphate-solubilizing bacteria on the amounts of rhizosphere actinomyces at different growth stages of pecan seedling |
不同施P水平下,在同一生长时期,不同解磷菌剂对根际放线菌数量的影响不同:1) P1水平下,3个生长时期4种菌剂的根际放线菌数量均有所上升,但以T4菌剂增幅最大,且在落叶期的增幅大于前2个时期,为73.23%; 2) P2水平下,展叶期各种解磷菌剂对根际放线菌数量的影响与P1水平下相似,仍以T4菌剂增幅最大。新梢生长期和落叶期相似,T1,T4菌剂的根际放线菌数量较CK2显著增加(P<0.05),其中,T4菌剂分别增加了61.01%和71.11%; 3) P3水平下,展叶期和新梢生长期仅T4菌剂与CK2差异显著。落叶期各菌剂对根际放线菌数量无显著影响(P<0.05)。试验对照CK1和CK2间无显著性差异(P<0.05),说明添加灭菌后的LB培养基对根际放线菌数量无影响。
2.3 对根际真菌数量的影响由图 3可见:就苗木同一生长时期而言,不同施P水平下各种解磷菌剂对其根际真菌数量的影响不同。1) 展叶期:3种施P水平下,接种4种解磷菌剂后根际真菌数量均有减少,且以T3菌剂的减少幅度最小,与CK2无显著性差异(P<0.05),T4菌剂减少幅度最大,分别为39.13%,42.05%,25.26%,且与CK2差异显著(P<0.05); 2) 新梢生长期:与展叶期相似,但在P3水平下,各菌剂均与CK2间无显著性差异(P<0.05); 3) 落叶期:除T4菌剂的根际真菌数量减少幅度较大外,其余3种菌剂变化相近。
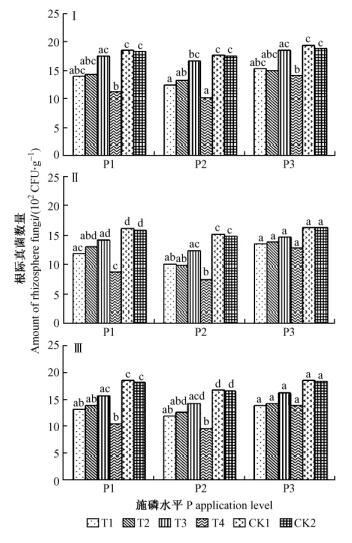
|
图 3 解磷菌剂对美国山核桃苗不同生长时期根际真菌数量的影响 Fig.3 Effects of phosphate-solubilizing bacteria on the amounts of rhizosphere fungi at different growth stages of pecan seedlings |
总体来看,施入中等水平P素(P2) 后接种解磷菌剂,根际真菌数量的减少幅度最大,P1水平下与之相近,P3水平下最小。试验对照CK1和CK2间无显著性差异(P<0.05),说明添加灭菌后的LB培养基对根际真菌数量无影响。
2.4 对根际脲酶活性的影响土壤脲酶是决定土壤中N素转化的关键酶,其活性高低反映了各种生化过程的方向和强度。由图 4可见:就同一施P水平而言,在苗木的同一生长时期,各菌剂对根际脲酶活性的影响不同。1) P1水平下,3个生长时期各处理的根际脲酶活性都有所增加,但以T4菌剂的增幅最大,且3个时期的增幅较为接近; 2) P2水平下,展叶期T1,T2,T4菌剂接种后的根际脲酶活性分别较CK2显著增加(P<0.05),新梢生长期和落叶期仅T4菌剂的根际脲酶活性较CK2增加显著(P<0.05),其余菌剂对根际脲酶活性无影响(P<0.05); 3) P3水平下,3个生长时期各菌剂对根际脲酶活性均无影响,试验对照CK1和CK2间无显著性差异(P<0.05),说明添加灭菌后的LB培养基对根际脲酶活性的增加无影响。

|
图 4 解磷菌剂对美国山核桃苗不同生长时期根际脲酶活性的影响 Fig.4 Effects of phosphate-solubilizing bacteria on urease activity at different growth stages of pecan seedlings |
磷酸酶是一种诱导酶,可催化磷酸酯或磷酸酐水解。由图 5可见:就同一施P水平而言,各菌剂在苗木的同一生长时期对根际磷酸酶活性的影响不同。1) P1水平下,苗木生长的前2个时期4种菌剂处理后根际磷酸酶活性较CK2显著增加(P<0.05),但以T4菌剂的增幅最大; 2) P2水平下,展叶期T1,T2,T4菌剂的根际磷酸酶活性较CK2均有显著增加(P<0.05),新梢生长期和落叶期只有T4菌剂较CK2显著提高(P<0.05),分别增加了20.95%和15.96%; 3) P3水平下,3个生长时期各处理的根际磷酸酶活性均较CK2有所提高,但无显著性差异(P<0.05)。总体来看,P1水平下各处理的根际磷酸酶活性增幅最大,在高施P水平下,根际磷酸酶活性无明显变化。这与土壤处于低磷水平时解磷微生物分泌的磷酸酶增加、根际土壤磷酸酶活性提高有关,而高的土壤磷素水平则在一定程度上抑制了这种作用。试验对照CK1和CK2间无显著性差异(P<0.05),说明灭菌后的LB培养基对根际磷酸酶活性的增加无影响。
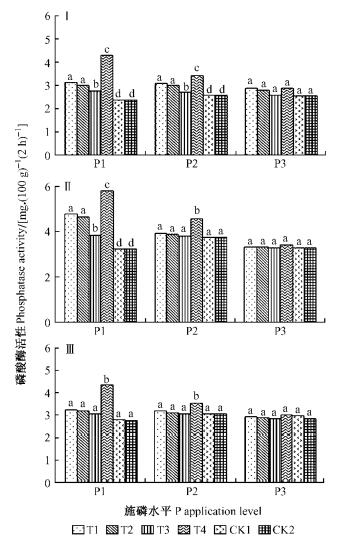
|
图 5 解磷菌剂对美国山核桃苗不同生长时期根际磷酸酶活性的影响 Fig.5 Effects of phosphate-solubilizing bacteria on phosphatase activity at different growth stages of pecan seedlings |
土壤三大类微生物区系比例是土壤肥力的衡量指标之一,细菌、放线菌数量与土壤养分含量及作物产量呈显著正相关,而真菌与养分含量之间相关性较差(李秀英等,2005)。本研究结果表明:分别接种绿针假单胞菌、荧光假单胞菌、蜡样芽孢杆菌及其混合菌群后,根际细菌和放线菌数量在山核桃的展叶期、新梢生长期和落叶期的变化规律相似,均为较对照有所增加,而真菌数量减少。根际细菌数量的增加可促进土壤中可给性N和P含量的提高,从而提高土壤肥力(许艳丽等,2007)。根际放线菌数量的增加有利于土壤中有机质分解,并产生各种抗生素和植物激素,从而有利于植株根系的发育和养分吸收。土壤真菌虽在物质分解中也起重要作用,但往往与作物的许多土传病害有关(张信娣等,2007)。施入解磷菌剂后,植株根际细菌和放线菌的数量同真菌数量的比值(B/F,A/F)增大,有效地改善了根际土壤的微生态环境,对提高土壤肥力、改善植物营养等具有重要意义(许艳丽等,2007)。本试验对美国山核桃苗接种解磷菌剂后根际微生物的数量变化进行了研究,但需进一步对植株根际优势细菌、放线菌和真菌进行分离、鉴定,以明确接种解磷菌剂到底引起何种根际微生物的数量变化。
解磷菌剂对根际微生物数量及酶活性的影响与施入的磷素水平密切相关。本试验发现:4种解磷菌剂在不施入P肥的情况下,对根际微生物数量及酶活性的影响大于P2,P32个施P水平,这与洪坚平等(2007)的研究结果一致。在土壤低磷条件下,植物根系形态会发生相应变化,如根毛数量和长度、须根数量、表面积、生物量比以及比根长(SRL)等均有所增加,且根系分级更加旺盛(Lambers et al., 2006); 同时,根系分泌物的组分也有所改变,如还原性糖、各种有机酸(如苹果酸、柠檬酸、氨基酸、羧酸等)的含量将增加,磷酸烯醇氏丙酮酸羧化酶(PEPC)活性有所提高(Pang et al., 2010),这有利于土壤中难溶态磷的活化,从而被植物吸收。根系分泌物是根际微生物生长的营养源,不同的根系分泌物可导致根际微生物群落结构发生变化(朱丽霞等,2003)。在本试验的后续研究中,应进一步明确接种解磷细菌前后美国山核桃苗根系分泌物的具体变化。但是,土壤中过高的磷素水平也可导致根系分泌物减少(赵丽莉等,2006)。本试验结果表明:高施P水平下除接种混合菌群(T4) 在展叶期和新梢生长期对根际细菌数量的影响显著外,各种解磷菌剂对根际微生物数量及酶活性无显著影响。这可能是由于根系分泌物的减少,不能满足解磷细菌的正常生长和繁衍,从而降低其定殖能力。这需要通过解磷细菌在根际的定殖试验进一步研究。
根际微生物数量与植株生长发育进程具有一定的相关性(黄继川等,2010; 于翠等,2007; 湛方栋等,2005)。本试验中,接种解磷菌剂后,根际微生物的数量与酶活性变化也与美国山核桃苗植株生长发育进程密切相关。从展叶期到新梢生长期,植株新陈代谢逐渐加强,生长迅速,需磷量日益增大,根系将分泌更多的物质(如有机酸或胞外磷酸酶等)来活化土壤中的难溶态磷,以满足植株的生长发育。进入落叶期后,植株生长减缓,光合能力降低,对磷的需求逐渐下降,根系分泌物相应减少。此时土壤温度逐渐降低,解磷细菌的生长和繁殖能力下降,并和土著微生物产生营养竞争。所以在落叶期,根际各类微生物(细菌、放线菌、真菌)数量和土壤磷酸酶、脲酶活性明显降低。因此,生产上应在美国山核桃苗新梢生长期施入解磷菌剂,并于新梢停长期向植物根部施入一定的有机养分,供给根际微生物生长和繁殖。
不同解磷细菌之间、解磷细菌与其他菌种如丛枝菌根菌(VAM)、根瘤菌、生防菌等之间一般存在协同作用(秦芳玲等,2000; Rudresh et al., 2005)。在温室或田间条件下,混合接种往往比任何一种菌剂单一接种更能促进植株生长和营养吸收(Guiñazú et al., 2010; Madhaiyan et al., 2010)。此外,解磷细菌与纤维素分解菌也具有一定的协同作用(张新平等,2007;林启美等,2001)。本研究发现:3种施P水平下,接种混合解磷菌群(T4) 的效应优于单一解磷菌种。这可能是由于混合菌群具有更高的适应土壤环境的能力,并能与根际土著微生物有效竞争养分和生态位,从而较快地在植株根际定殖,形成优势菌群,发挥解磷作用。但是,对解磷细菌协同效应的作用机制仍有待进一步研究。
| [] | 毕银丽, 任婧. 2007. 接种菌根对根际微生物群落和磷营养的影响. 能源环境保护, 21(3): 25–28. |
| [] | 陈雪丽, 王光华, 金剑, 等. 2008. 两株芽孢杆菌对黄瓜和番茄根际土壤微生物群落结构影响. 生态学杂志, 27(11): 1895–1900. |
| [] | 陈哲, 吴敏娜, 秦红灵, 等. 2009. 土壤微生物溶磷分子机理研究进展. 土壤学报, 46(5): 925–931. DOI:10.11766/trxb200803140522 |
| [] | 关松荫. 1986. 土壤酶及其研究法. 北京:中国农业出版社, 78: 78–81. |
| [] | 洪坚平, 郝晶, 毕理智, 等. 2007. 不同解磷菌群对油菜土壤养分与酶活性的影响. 中国生态农业学报, 15(5): 51–54. |
| [] | 黄继川, 彭智平, 于俊红, 等. 2010. 施用玉米秸秆堆肥对盆栽芥菜土壤酶活性和微生物的影响. 植物营养与肥料学报, 16(2): 348–353. DOI:10.11674/zwyf.2010.0213 |
| [] | 李阜棣, 喻子牛, 何绍江. 1996. 农业微生物学实验技术. 北京:中国农业出版社, 98: 98–101. |
| [] | 李秀英, 赵秉强, 李絮花, 等. 2005. 不同施肥制度对土壤微生物的影响及其与土壤肥力的关系. 中国农业科学, 38(8): 1591–1599. |
| [] | 林启美, 赵小蓉, 孙焱鑫, 等. 2001. 纤维素分解菌与无机磷细菌的相互作用. 生态学杂志, 20(3): 69–70. |
| [] | 秦芳玲, 王敬国, 李晓林, 等. 2000. VA菌根真菌和解磷细菌对红三叶草生长和氮磷营养的影响. 草业学报, 9(1): 9–14. |
| [] | 宋勇春, 李晓林. 2001. 泡囊丛枝(VA)菌根对玉米际磷酸酶活性的影响. 应用生态学报, 12(4): 593–596. |
| [] | 许艳丽, 张红骥, 张匀华, 等. 2007. 施用根腐病生防颗粒剂对大豆田土壤微生物区系的影响. 大豆科学, 26(2): 198–203. |
| [] | 于翠, 吕德国, 秦嗣军, 等. 2007. 本溪山樱根际微生物区系. 应用生态学报, 18(10): 2277–2281. |
| [] | 湛方栋, 陆引罡, 关国经, 等. 2005. 烤烟根际微生物群落结构及其动态变化的研究. 土壤学报, 42(3): 488–494. DOI:10.11766/trxb200406090321 |
| [] | 张信娣, 史永军, 陈银科. 2007. 光合细菌和有机肥对土壤主要微生物类群的影响. 中国土壤与肥料(3): 59–62. DOI:10.11838/sfsc.20070315 |
| [] | 张新平, 万里强, 李向林, 等. 2007. 添加乳酸菌和纤维素酶对苜蓿青贮品质的影响. 草业学报, 16(3): 139–143. |
| [] | 赵丽莉, 滕华容, 贺学礼. 2006. 施磷量和AM真菌对柴胡生长的交互效应. 中草药, 37(9): 1405–1409. |
| [] | 钟传青, 黄为一. 2005. 不同种类解磷微生物的溶磷效果及其磷酸酶活性的变化. 土壤学报, 42(2): 286–294. |
| [] | 朱丽霞, 章家恩. 2003. 根系分泌物与根际微生物相互作用研究综述. 生态环境, 12(1): 102–105. |
| [] | 朱培淼, 杨兴明, 徐阳春, 等. 2007. 高效解磷细菌的筛选及其对玉米苗期生长的促进作用. 应用生态学报, 18(1): 107–112. |
| [] | 朱伟杰, 王楠, 郁雪平, 等. 2010. 生防菌Pseudomonas fluorescens 2P24对甜瓜根围土壤微生物的影响. 中国农业科学, 43(7): 1389–1396. |
| [] | Alagawadi A R, Gaur A C. 1992. Inoculation of Azospirillum brasilense and phosphate-solubilizing bacteria on yield of sorghum in dry land. Trop Agric, 69(4): 347–350. |
| [] | Bagyaraj D J, Krishnaraj P U, Khanuja S P S. 2000. Mineral phosphate solubilization:Agronomic implications, mechanism and molecular genetics. Proc Indian Nat Sci Acad, 66(2/3): 69–82. |
| [] | Chen Y P, Rekha P D, Arun A B, et al. 2006. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities. Appl Soil Ecol, 34(1): 33–41. DOI:10.1016/j.apsoil.2005.12.002 |
| [] | Ekin Z. 2010. Performance of phosphate solubilizing bacteria for improving growth and yield of sunflower(Helianthus annuus L.)in the presence of phosphorus fertilizer. African Journal of Biotechnology, 9(25): 3794–3800. |
| [] | Fernandez L A, Zalba P, Gomez M A, et al. 2007. Phosphatesolubilization activity of bacterial strains in soil and their effect on soybean growth under greenhouse conditions. Biol Fertil Soils, 43(6): 805–809. DOI:10.1007/s00374-007-0172-3 |
| [] | Gyaneshwar P, Kumar G N, Parekh L J, et al. 2002. Role of soil microorganisms in improving P nutrition of plants. Plant Soil, 245(1): 83–93. DOI:10.1023/A:1020663916259 |
| [] | Guiñazú L B, Andrés J A, Papa M F Del, et al. 2010. Response of alfalfa(Medicago sativa L.)to single and mixed inoculation with phosphate-solubilizing bacteria and Sinorhizobium meliloti. Biol Fertil Soils, 46(2): 185–190. DOI:10.1007/s00374-009-0408-5 |
| [] | Henri F, Laurette N N, Annette D, et al. 2008. Solubilization of inorganic phosphate and plant growth promotion by strains of Pseudomonas fluorescens isolated from acidic soils of Cameroon. Afr J Microbiol Res, 2(7): 171–178. |
| [] | Holford I C R. 1997. Soil phosphorus:its measurement, and its uptake by plants. Aus J Soil Res, 35(2): 227–240. DOI:10.1071/S96047 |
| [] | Illmer P, Schinner F. 1992. Solubilization of inorganic phosphates by microorganisms isolated from forest soils. Soil Biol Biochem, 24(4): 389–395. DOI:10.1016/0038-0717(92)90199-8 |
| [] | Kim K Y, Jordan D, McDonald G A. 1998. Effect of phosphatesolubilizing bacteria and vesicular-arbuscular mycorrhizae on tomato growth and soil microbial activity. Biol Fertil Soils, 26(2): 79–87. |
| [] | Kokalis-Burelle N, Kloepper J W, Reddy M S. 2006. Plant growthpromoting rhizobacteria as transplant amendments and their effects on indigenous rhizosphere microorganisms. Appl Soil Ecol, 31(1/2): 91–100. |
| [] | Lambers H, Shane M W, Cramer M D, et al. 2006. Root structure and functioning for efficient acquisition of phosphorus:Matching morphological and physiological traits. Ann Bot, 98(4): 693–713. DOI:10.1093/aob/mcl114 |
| [] | Madhaiyan M, Poonguzhali S, Kang B G, et al. 2010. Effect of coinoculation of methylobacterium oryzae with Azospirillum brasilense and Burkholderia pyrrocinia on the growth and nutrient uptake of tomato, red pepper and rice. Plant Soil, 328(1/2): 71–82. |
| [] | Pang J Y, Ryan M H, Tibbett M, et al. 2010. Variation in morphological and physiological parameters in herbaceous perennial legumes in response to phosphorus supply. Plant Soil, 331(1/2): 241–255. |
| [] | Rodríguez H, Fraga R. 1999. Phosphate solubilizing bacteria and their role in plant growth promotion. Biotechnol Adv, 17(4/5): 319–339. |
| [] | Rudresh D L, Shivaprakash M K, Prasad R D. 2005. Effect of combined application of Rhizobium, phosphate solubilizing bacterium and Trichoderma spp.on growth, nutrient uptake and yield of chickpea. Appl Soil Ecol, 28(2): 139–146. DOI:10.1016/j.apsoil.2004.07.005 |
| [] | Valverde A, Burgos A, Fiscella T, et al. 2006. Different effects of coinoculations with Pseudomonas jessenii PS06 and esorhizobium ciceri C-2/2stains on the growth and seed yield of chick pea under greenhouse and field conditions. Plant Soil, 287(1/2): 43–50. |
 2012, Vol. 48
2012, Vol. 48

