文章信息
- 李姝江, 朱天辉, 黄艳娜, 韩珊, 谯天敏
- Li Shujiang, Zhu Tianhui, Huang Yanna, Han Shan, Qiao Tianmin
- 水杨酸诱导山茶抗灰斑病的作用及生理生化响应
- Roles of Salicylic Acid in Inducing Resistance of Camellia to the Gray Spot and the Biochemical Responses
- 林业科学, 2012, 48(2): 103-109.
- Scientia Silvae Sinicae, 2012, 48(2): 103-109.
-
文章历史
- 收稿日期:2011-04-07
- 修回日期:2011-12-28
-
作者相关文章
2. 四川农业大学森林保护省级重点实验室 雅安 625014
2. Provincial Key Laboratory of Forest Protection, Sichuan Agricultural University Ya'an 625014
山茶(Camellia pitardii)为我国十大传统名花之一,在我国多个省份广泛种植,其观赏与经济价值逐渐引起人们的重视。但山茶常发生多种病害,其中灰斑病(Pestalotiopsis guepinii)发生十分普遍,造成叶、梢干枯,影响植株观赏价值,甚至导致整株衰弱死亡,造成巨大的经济损失。目前,对该病的研究主要集中在病害的发生(Garibaldi et al., 2001)、病原菌生物学特性(邢勇等,1990)及化学防治(黄新华,2000; Sanjay et al., 2008)等方面; 另外,Yoshida等(2010)运用植物催化剂诱导其抗性,但其诱导机制尚未见报道。
近年来,利用生物源或非生物源激发子诱导植物抗病性已成为植物病理学领域的研究热点(梁元存等,2001),其中,水杨酸(salicylic acid,SA)已被普遍认为是诱导植物产生系统获得抗性(systemic acquired resistance,SAR)的信号分子之一(Silverman et al., 2005)。SA是植物体内普遍存在的一种天然活性物质,与植物多种生理调节过程有关,它可诱导植物体内抗病性酶活性增加、加速木质素合成、限制病原菌的侵入和扩展,从而增强寄主抗性(王媛等,2007)。最早在研究烟草花叶病毒时发现施用SA后会引起烟草体内病程相关蛋白的积累(pathosgenetisis-related proteins,PRP)(丁秀英等,2001),后续研究发现,SA对许多植物的多种病害都有作用,且可诱导植物体内源SA的积累,但是主要集中农作物上,如水稻抗白叶枯病(Xanthomonas oryzae)(刘凤权等,2000)、黄瓜抗炭疽病(Kubota etal.,2006)、玉米抗大斑病(Exserohilum turcicum)(张莹等,2008)、土豆抗根腐病(Fusarium oxysporum f.sp.Lycopersicin)(Mandal et al., 2009),在木本植物上的研究相对较少,如桉树抗青枯病(Ralstonia solanacearum)(冉隆贤等,2004)、阿勒比松抗枯梢病(Diplodia pinea)(Moret et al., 2007)、杨树抗锈病(Melampsora larici-populina)(徐擎等,2011)等,在园林花卉植物中几乎没有报道。李姝江等(2011)研究显示:山茶经SA诱导后,防御酶系有不同程度的响应,本试验在此基础上通过测定SA诱导以及诱导后挑战接种后山茶叶片内丙二醛(MDA)、木质素、可溶性蛋白含量的变化与病害发生的关系,为揭示SA诱导山茶产生抗病性的生理生化机制提供理论依据,也为挖掘新型有效的山茶灰斑病的生防途径提供线索。
1 材料与方法 1.1 试验材料山茶品种:西南红山茶,又名七心红(Camellia pitardii‘Cohen-Stuart’),4年生,雅安花卉公司购买,种植于田间,行距1m,株距0.5m。
供试菌种:山茶灰斑病菌,四川农业大学森林保护省级重点实验室提供。菌种接种于PDA的平板上,25~28℃于人工气候箱培养,产孢后用无菌水配成孢悬液(2× 103 CFU·mL-1)接种备用。
供试试剂:水杨酸(分析纯)购自上海通微生物技术有限公司。0.05%吐温-80、99%三氯乙酸(TCA,化学纯)、99%硫代巴比妥酸(TBA,分析纯)、聚乙烯吡咯烷酮(PVP,分析纯)、硫代硫酸钠(Na2S2O3,分析纯)、99%丙酮、考马斯亮蓝G-250等均购自上海实验试剂有限公司。
1.2 不同浓度的水杨酸对病原菌孢子萌发的影响配制SA终浓度为0.5,1,2,3,5,7,10mmol·L-1的孢子悬浮液,1mmol·L-1 NaOH调节pH至6.8。采用玻片萌发法(黄昌华,1993),于25~28℃保湿培养,以无菌水为对照,分别在5和10h后测定孢子萌发率(%),每处理观测300个孢子。
1.3 水杨酸诱导山茶抗灰斑病持续期的测定根据室内试验的筛选结果,选取5mmol·L-1的SA进行诱导抗病性持续期的测定。调节SA溶液pH至6.8,加0.05%Tween-80进行叶面喷雾处理:每株选择长势均一的山茶叶片6片,以溶液布满叶面不下流为宜,套袋保湿12h,无菌水为对照,分别处理12株,3次重复,第2,3天各重复1次,以确保SA能够有效被植株吸收。以上植株分别于处理1,3,7,10,15,20天后针刺接种(王绍雪等,2010)山茶灰斑病菌:针刺部位在叶片中部叶脉两侧(不刺穿为宜),伤口处滴一滴菌液,约0.05mL,对照滴无菌水; 套袋保湿,于接种后10天做病情调查,按照下列方法计算病情指数及其诱抗效果。病情分级标准:0级:叶片无病斑; 1级:叶片病斑面积为10cm2以下; 2级:叶片病斑面积为10~20cm2; 3级:叶片病斑面积为20~40cm2; 4级:叶片病斑面积为40cm2以上。病情指数(%)=[(病级指数×病叶数)/(叶数总和×发病最重的病级数)] × 100;诱抗效果(%)= [(对照病情指数-处理病情指数)/对照病情指数] × 100。
1.4 水杨酸诱导与山茶生化反应测定 1.4.1 水杨酸的诱导处理设置SA的浓度为0.5,2,5mmol·L-1进行诱导处理,以无菌水做对照。试验设置2组处理:1) SA诱导但不接种; 2) SA诱导后间隔3天挑战接种灰斑菌。对照接种无菌水。每处理12株,3次重复。一组用于生化指标的测定,分别于接种后1,2,3,4,5,7,15天随机选取各处理叶片,-80℃超低温冰箱中保存备用; 另一组于接种后10天进行病情调查,计算病情指数方法(同1.3)。
1.4.2 丙二醛含量测定参照邹琦(1995)的方法。取0.5g叶片,加少许石英砂和10%的TCA 8mL,冰浴研磨,匀浆于10000g冷冻离心10min,取上清液2mL加入0.6%TBA 2mL混匀后,于沸水浴反应20min,迅速冷却,离心。取上清液测定532,600和450nm波长下的吸光度。用水做参比,计算公式如下:CMDA(μmol·L-1)= 6.45(OD532-OD600)-0.56OD450; MDA含量(μmol·g-1 FW-1)=CMDA×样品提取液体积(mL)/样品鲜质量(g)。
1.4.3 木质素含量测定无菌水洗净叶片后用滤纸擦干,放入铝盒,立即放进烘箱内进行烘烤。首先将温度调到120℃快速杀青,使叶片细胞死亡,然后将温度调至60℃将叶片烘干至恒质量。参照Ali等(2006) 的碘量法。计算公式:X= 0.433K(a-b)/DW[X为木质素含量(%); K为滴定用Na2S2O3的浓度(W/V); DW为样品干质量(g); a为滴定对照液所用的0.1mol·L-1 Na2S2O3量(mL); b为滴定样品液所用的0.1mol·L-1 Na2S2O3量(mL)]。
1.4.4 可溶性蛋白含量的测定取叶片1g,液氮中研磨,加适量PVP、2mL50mmol·L-1 pH7.5Tris-HCl缓冲液(1%2-巯基乙醇),摇匀后4℃放置1h。取出摇匀,于4℃、14000r·min-1离心20min,转上清至新管,按1: 4(V/V)加入-20℃预冷的丙酮,摇匀,-20℃放置2h,沉降蛋白,取出后5000r·min-1、4℃离心20min,去上清,沉淀于4℃放置,使丙酮完全挥发。将沉淀溶解于60mmol·L-1 pH6.8Tris-HCl缓冲液(2%SDS,5%2-巯基乙醇,10%甘油),4℃、13000r·min-1离心10min,取上清0.1L与5mL考马斯亮蓝G-250染色剂进行显色,测OD595,以牛血清蛋白作标准曲线,从标准曲线找出其浓度,计算蛋白质含量(Bradford,1976)。
1.5 数据处理试验数据采用Microsoft Excel和LSD多重差异比较、SSR测验进行统计分析。
2 结果与分析 2.1 水杨酸对山茶灰斑菌孢子萌发的影响山茶灰斑菌的孢子在不同浓度SA溶液中的萌发试验表明:5,10h后7,10mmol·L-1的SA处理的孢子萌发率与对照差异显著(P<0.05)(表 1),说明高浓度的SA处理后对病原菌的萌发有明显的抑制作用; SA浓度为0~5mmol·L-1的各处理间的孢子萌发率均无显著差异(P<0.05),说明SA浓度小于5mmol·L-1时对灰斑菌的孢子萌发无抑制作用。
|
|
水杨酸诱导的抗性在不同的时间间隔均有作用(图 1):病情指数与诱抗效果呈现相反的趋势; 其中间隔3天接种有最佳诱抗效果且病情指数最低,与其余各处理差异显著; 随着间隔时间的延长,诱导效果逐渐下降,病情指数升高。可见,随着处理时间的延长,水杨酸诱导山茶对灰斑病的抗性逐渐降低。从诱导效果变化来看,水杨酸诱导山茶对灰斑病的抗性可以持续10~15天,诱导最佳间隔期为3天。
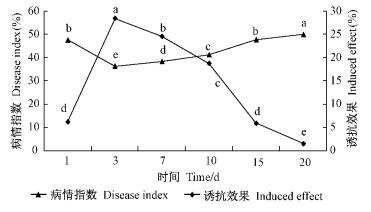
|
图 1 水杨酸诱导山茶抗灰斑病的持续期 Fig.1 The duration of induced resistance of camellia gray spot by SA |
SA诱导后均可引起山茶叶片中MDA含量在一定时间范围内减少,膜脂的过氧化程变降低,有利于增强植株抗病性; 但随着处理时间的延长,这种诱导抗性的作用逐渐减弱,且在不同浓度处理间存在差异(图 2)。其中5mmol·L-1 SA诱导后MDA含量较其他处理低,且始终维持在较对照低的水平上,0.5与2mmol·L-1的处理MDA含量变化幅度较5mmol·L-1的大,且二者表现出相似的变化趋势,其中0.5mmol·L-1 SA处理较2mmol·L-1提前2天出现最大值,说明随着SA诱导浓度的增加,山茶叶片膜脂过氧化的程度减小,即5mmol·L-1 SA诱导后更有利于增强山茶的抗病性。在诱导并挑战接种的处理中,2mmol·L-1的SA处理在整个阶段除1,15天略低于对照外,其余时间均较对照高,0.5与5mmol·L-1 2个处理表现为初期低于对照,后期缓慢上升的变化趋势。下同。The same below.

|
图 2 不同处理丙二醛含量的变化
Fig.2 Changes of MDA content in different treatments
A: SA处理不接种SA treated; ; B: SA处理并接种灰斑菌SA treated and P. guepinii inoculated.
|
0.5,2mmol·L-1的SA诱导处理表现为初期下降、2天后上升的变化趋势,高浓度SA诱导后木质素含量持续上升,后期趋于稳定,各处理变化幅度均不大(图 3); 诱导后再挑战接种处理的木质素含量具有基本相似的变化趋势,即除接种2天时叶片木质素含量略有下降外,其余天数均保持上升趋势,最后趋于稳定,其中5mmol·L-1的SA处理木质素含量最高,2mmol·L-1的SA处理居中,0.5mmol·L-1的处理最低,并低于对照。
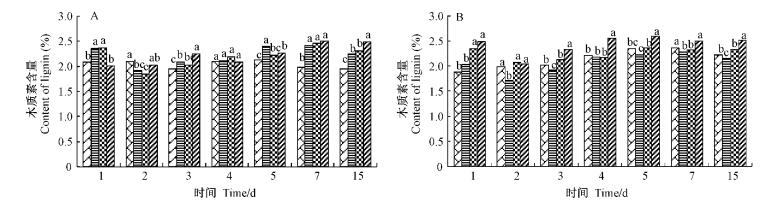
|
图 3 不同处理木质素含量的变化 Fig.3 Changes of lignin content in different treatments |
SA诱导后叶片内的可溶性蛋白含量呈缓慢上升趋势,至4天时均达到最大值(图 4),分别较对照提高18.0%,22.2%,17.6%,之后缓慢下降,7天时仍高于对照,但无显著差异。SA诱导后挑战接种处理的可溶性蛋白含量也表现出相同的变化趋势,4天时有最大值,较当天的空白对照提高13.4%,14.1%,16.7%,19.7%,但各处理间并无显著差异。所以,SA诱导能够诱导山茶叶部可溶性蛋白含量的增加。
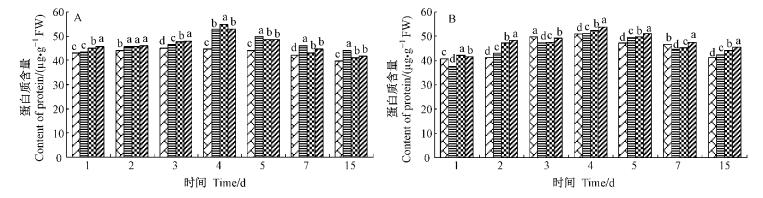
|
图 4 不同处理可溶性蛋白含量变化 Fig.4 Changes of soluble protein content of different treatments |
将SA诱导后挑战接种的各生化因子的平均值与感病程度做相关性分析(表 2),其中MDA含量、木质素含量与病情指数达到显著水平(P<0.05),说明两生化指标与抗病密切负相关。尽管可溶性蛋白含量指标的相关系数没有达到显著水平,但由于相关系数较高,所以与山茶的抗病性仍然具有很高的相关性。SA诱导并挑战接种10天后,5mmol·L-1的处理病情指数最低,诱抗效果最高且和其余处理差异显著,表明随SA浓度的升高,山茶抗病能力随之增强; 而处理浓度过低(0.5mmol·L-1)不仅不能诱导山茶抗病性,反而在一定程度上增加它的感病能力(病情指数显著高于对照且诱抗效果呈负值)。
|
|
20世纪90年代以来,已经把水杨酸作为一种植物对胁迫反应所需的信号分子来研究,积累了大量的资料(Malamy et al., 1990)。本试验中SA浓度小于5mmol·L-1时对灰斑菌的孢子萌发无抑制作用,这与SA对该菌菌丝生长(李姝江等,2011)的结果一致,进一步印证0~5mmol·L-1的SA对灰斑菌无直接毒性。多项研究结果表明:在不同病害系统中的诱导抗性所需的SA浓度不同可能与植物体内的内源SA含量的高低有关(Lisa et al., 2009; Mandal et al., 2009):对内源SA含量较低的植物来说,诱导植物产生抗性所需的SA浓度较高,诱导黄瓜植株产生对炭疽病抗性的浓度为14.5mmol·L-1; 而对SA内源含量高的植物,SA诱导抗性的浓度相对较低,如诱导水稻抗瘟病所需浓度范围为0.01~0.1mmol·L-1(冉隆贤等,2004)。诱导山茶抗灰斑病的SA的最佳浓度为5mmol·L-1,而低浓度的SA诱抗效果较低,发病后期的感病指数与对照无显著差异,这可能与山茶植株内源SA含量较低有关。
丙二醛(MDA)是膜脂过氧化的主要产物之一,其含量可作为衡量膜脂过氧化程度的一个重要指标(边秀秀等,2008; 余文英等,2008; 吴国昭等,2009)。本试验表明:SA诱导后均可引起山茶叶片中MDA含量在一定时间范围内减少,这与霍彩霞等(2005)、商闯等(2007)在玉米(Zea mays)诱导抗病过程中含量变化结果相似,说明SA诱导降低了膜脂的过氧化程度,有利于增强植株抗病性; 其中5mmol·L-1 SA诱导后MDA含量较其他处理低,即该浓度SA诱导后更有利于增强山茶的抗病性。在诱导并挑战接种的处理中,各处理表现为初期低于对照,后期缓慢上升的变化趋势,结合曾富华2004 的研究,此结果可能与此时POD,CAT的酶活性受抑制导致MDA累积有关。
植物的木质素是由许多苯丙烷单体聚合在一起的交联分子,在细胞壁上经常和纤维素及其他糖类联结在一起,沉积在壁上形成木栓化,阻止病原菌侵染和蔓延。SA诱导不仅会引起寄主植物苯丙烷类代谢途径的相关酶活性的升降,也会促进其次生代谢产物木质素的形成和积累,这将有助于增加细胞壁厚度和组织木质化程度,形成病原菌入侵的机械屏障(李伟等,2003)。欧阳光察等(1988)认为木质素可作为植物抗病的生理指标。本研究结果表明:经SA诱导处理后,山茶叶片内木质素的含量增加,且高浓度诱导的积累量大于低浓度,这与SA诱导山茶抗灰斑病的效果呈正相关。在CSBⅠ诱导水稻抗稻瘟病(Magnaporthe oryzea)中,木质素含量开始增加出现在该激发子诱导水稻POD和PAL活性升高之后(李云峰等,2004),结合前期研究(李姝江等,2011)可推测当病原菌入侵时,细胞受到刺激后启动PAL系统,产生木质素并沉积在细胞壁周围,将病原物限制在一定的细胞范围之内阻止其进一步扩散危害。
在诱导抗性的研究中发现,经诱导产生抗性的植株中可溶性蛋白会增加并且有一种新蛋白出现(可能是病程相关蛋白)(Okuno et al., 1991; 蔡新忠等,1995;蒋继志等,2010)。本试验中,SA诱导后叶片内可溶性蛋白含量显著增加,这有利于增强抗病性,其原因可能与植株体内抗性蛋白、防卫酶系等的合成代谢有关(Zhang et al.2002; 范海延等,2006;Urszula,2006)。另外,挑战接种处理的山茶可溶性蛋白的含量要比只诱导处理和对照的高,说明病原菌侵入后,山茶体内很多平衡受到破坏,蛋白质合成增多,激活了一些酶系统,使某些酶活性升高,从而也增加了可溶性蛋白质的含量。但是,诱导后可溶性蛋白是否包含病程相关蛋白以及抗病基因,包括植保素合成酶基因、病程相关蛋白基因、细胞壁结构蛋白和木质素合成酶基因的表达仍有待于更进一步的研究。
MDA、木质素、可溶性蛋白含量的变化趋势表明,经SA诱导后再挑战接种的处理较仅用SA诱导的高,其原因可能是接种的病原菌激发植株体内产生了抗病信号(赵淑清等,2003),活化了防卫基因的表达(Lamb,1994),促进抗病性的增强。其中高浓度SA诱导后的各生化指标的变化幅度最大,这说明在对病原菌无抑制作用的前提下,SA处理浓度越高,对病原菌引起的自身代谢失调的保护反应也就越强,植物表现的抗病性就越强,外在的抗病性差异具有内在的生理基础。
| [] | 边秀秀, 尚勋武, 王化俊. 2008. 外源水杨酸(SA)诱导小麦抗条锈病研究初报. 麦类作物学报, 28(4): 701–704. |
| [] | 蔡新忠, 宋凤鸣, 郑重. 1995. 植物病程相关蛋白. 植物生理学通讯, 31(2): 129–136. |
| [] | 丁秀英, 张军, 苏宝林, 等. 2001. 水杨酸在植物抗病中的作用. 植物学通报, 18(2): 163–168. |
| [] | 范海延, 曲国富, 邵美妮, 等. 2006. 葡聚六糖对黄瓜幼苗生长及生理特性的影响. 中国蔬菜, 1: 18–20. DOI:10.3969/j.issn.1000-6346.2006.01.006 |
| [] | 黄昌华. 1993. 用琼脂玻片法测定孢子萌发率. 植物保护, 19(3): 36–37. |
| [] | 黄新华. 2000. 百菌清等3种药剂防治油茶炭疽病药效试验. 江西林业科技, 2: 18–19. |
| [] | |
| [] | 蒋继志, 孙琳琳, 郭会婧, 等. 2010. 几种微生物提取物诱导马铃薯抗晚疫病及机理的初步研究. 植物病理学报, 40(2): 173–179. |
| [] | 李姝江, 朱天辉, 黄艳娜. 2011. 防御酶系对山茶灰斑病诱导抗性的响应. 植物保护学报, 38(1): 59–64. |
| [] | 李伟, 熊谨, 陈晓阳. 2003. 木质素代谢的生理意义及遗传控制研究进展. 西北植物学报, 23(4): 675–681. |
| [] | 李云峰, 王振中, 贾显禄. 2004. 稻瘟菌激发子CSB(诱导水稻防御性相关酶的变化. 作物学报, 30(6): 613–617. |
| [] | 梁元存, 刘爱新. 2001. 激发子诱导植物抗性的作用机制. 植物生理学通讯, 37(5): 442–446. |
| [] | 刘凤权, 王金生. 2000. 水杨酸诱导水稻幼苗抗白叶枯病研究. 植物保护学报, 27(1): 47–52. |
| [] | 欧阳光察, 薛应龙. 1988. 植物苯丙烷类代谢的生理意义及其调控. 植物生理学通讯, 24(3): 9–16. |
| [] | 冉隆贤, 谷文众, 吴光金. 2004. 水杨酸诱导桉树抗青枯病的作用及相关酶活性变化. 林业科学研究, 17(1): 12–18. |
| [] | 商闯, 马春江, 霍彩霞, 等. 2007. 丙二醛(MDA)含量在玉米诱导抗病过程中的变化. 华北农学报, 22(增刊): 29–32. |
| [] | 王绍雪, 马改转, 魏兰芳, 等. 2010. 西南地区水稻细菌性条斑病菌致病力的分化. 湖南农业大学学报:自然科学版, 36(2): 188–191. |
| [] | 王媛, 杨红玉, 程在全. 2007. SA诱导拟南芥对灰霉病的抗性与木质素含量的关系. 植物保护, 33(4): 50–53. |
| [] | 吴国昭, 谢丽君, 宋圆圆, 等. 2009. 外源信号物质诱导广东高州普通野生稻抗稻瘟病的生理生化机理. 西北农业学报, 18(3): 254–258. |
| [] | 邢勇, 何定萍. 1990. 病菌生物学特性研究. 植物病理学报, 20(3): 161–166. |
| [] | 徐擎, 胡景江, 薛盼盼. 2011. 外源低番糖、水杨酸诱导杨树抗病生理机制的研究. 西北林学院学报, 26(2): 124–128. |
| [] | 余文英, 王伟英, 邱永祥, 等. 2008. 水杨酸对甘薯抗薯瘟病和抗氧化酶系统的影响. 福建农林大学学报:自然科学版, 37(1): 23–26. |
| [] | 曾富华, 吴岳轩, 郑小林. 2004. 化学因子对脂膜组分的影响与诱导抗病作用的关系. 核农学报, 18(5): 397–401. |
| [] | 张莹, 王畅辉, 郝敏, 等. 2008. 水杨酸诱导对玉米大斑病根性的影响. 农业生物技术学报, 16(3): 501–507. |
| [] | 赵淑清, 郭剑波. 2003. 植物系统性获得抗性及其信号转导途径. 中国农业科学, 36(7): 781–787. |
| [] | 邹琦. 1995. 植物生理生化实验指导. 北京, 中国农业出版社. |
| [] | Ali M B, Singh N, Shohael A M, et al. 2006. Phenolics metabolism and lignin synthesis in root suspension cultures of Panax ginseng in response to copper stress. Plant Science, 171(1): 147–154. DOI:10.1016/j.plantsci.2006.03.005 |
| [] | Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram uqantities of protein utilizing the principle of protein-dye bingding. Analytical Biochemistry, 72(1/2): 248–254. |
| [] | Garibaldi A, Gilardi G, Bertetti D, et al. 2001. Proof for the occurrence of flower blight caused by Ciborinia camelliae in Italy. Plant Disease, 85(8): 924. |
| [] | Kubota M, Nishi K. 2006. Salicylic acid accumulates in the roots and hypocotyl after inoculation of cucumber leaves with Colletotrichum lagenarium. Journal of Plant Physiology, 163(11): 1111–1117. DOI:10.1016/j.jplph.2005.09.005 |
| [] | Lamb C J. 1994. Plant disease resistance genes in signal perception and transduction. Cell, 76(3): 419–422. DOI:10.1016/0092-8674(94)90106-6 |
| [] | Lisa L, Grazia T, Cristina P, et al. 2009. Exogenous spermidine, arsenic and b-aminobutyriacid modulate tobacco resistance to tobacco mosaic virus, and affect local and systemic glucosylsalicylic acid levels and arginine decarboxylase gene expression in tobacco leaves. Journal of Plant Physiology, 166(1): 90–100. DOI:10.1016/j.jplph.2008.01.011 |
| [] | Malamy J, Carr J P, Klessig D F, et al. 1990. Salicylic acid -a likely endogenous signal in the resistance response of tobacco to viral infection. Science, 250(4983): 1001–1004. |
| [] | Mandal S, Mallick N, Mitra A, et al. 2009. Salicylic acid-induced resistance to Fusarium oxysporum f.sp.lycopersiciin tomato. Plant Physiology and Biochemistry, 47(7): 642–649. DOI:10.1016/j.plaphy.2009.03.001 |
| [] | Moret A, Muñoz Z. 2007. Control of Diplodia pinea and D.scrobiculata in Pinus halpepensis by 5-chloro-salicylic acid. Phytopathologia Mediterranea, 46(2): 150–156. |
| [] | Okuno T, Nakayama M, Okajima N, et al. 1991. Systemic resistance to downy mildew and appearance of acid soluble proteins in cucumber leaves treated with biotic and abiotic inducers. Annals of the Phytopathological Society of Japan, 57(2): 203–211. DOI:10.3186/jjphytopath.57.203 |
| [] | Sanjay R, Ponmurugan P, Baby U I. 2008. Evaluation of fungicides and biocontrol agents against grey blight disease of tea in the field. Crop Protection, 27(3/5): 689–694. |
| [] | Silverman F P, Petracek P D, Heiman D F, et al. 2005. Salicylate activity 3Structure relationship to systemic acquired resistance. Journal Agricultural Food Chemistry, 53(25): 9775–9780. DOI:10.1021/jf051383t |
| [] | Urszula M. 2006. Induction of disease resistance by acibenzolar-S-methyl and o-hydroxyethylorutin against Botrytis cinerea in tomato plants. Crop Protection, 25(9): 956–962. DOI:10.1016/j.cropro.2005.12.009 |
| [] | Yoshida K, Ogin A, Yamada K, et al. 2010. Induction of disease resistance in tea (Camellia sinensis L.)by plant activators. Japan Agricultural Research Quarterly, 44(4): 391–398. DOI:10.6090/jarq.44.391 |
| [] | Zhang S A, Moyne A L, Reddy M S, et al. 2002. The role of salicylic acid in induced systemic resistance elicited by plant growthpromoting rhizobacteria against blue mold of tobacco. Biological Control, 25(3): 288–296. DOI:10.1016/S1049-9644(02)00108-1 |
 2012, Vol. 48
2012, Vol. 48



