文章信息
- 路超, 崔彬彬, 黄禄君, 孙鹏, 张国君, 李云
- Lu Chao, Cui Binbin, Huang Lujun, Sun Peng, Zhang Guojun, Li Yun
- 同源四倍体刺槐花序变异表型观察与分析
- Phenotypic Observation and Analysis of Inflorescence Variation of Autotetraploid Robinia pseudoacacia
- 林业科学, 2012, 48(2): 63-68.
- Scientia Silvae Sinicae, 2012, 48(2): 63-68.
-
文章历史
- 收稿日期:2011-06-09
- 修回日期:2011-08-25
-
作者相关文章
2. 保定学院生化系 保定 071000;
3. 河北科技师范学院园艺科技学院 秦皇岛 066004
2. Department of Biology and Chemistry, Baoding University Baoding 071000;
3. College of Horticulture Science and Technology, Hebei Normal University of Science & Technology Qinhuangdao 066004
多倍体是生物界中普遍存在的一种现象,而且一直被认为是生物进化的主要推动力之一。在原始脊椎动物(McLysaght et al., 2002)、两栖动物(Bogart,1979)和酵母(Kellis et al., 2004)的进化过程中都曾出现了基因组加倍的现象,而且它的重要性已经得到了广泛的认可。在植物界多倍体更为普遍,在多达70%的现存被子植物的进化史中经历过至少一次的多倍体化(Masterson,1994)。但是由于多倍体材料在自然界中难于寻找,对多倍体的研究曾经受到过限制。这一局面在Blakeslee等(1937)成功利用秋水仙素诱导体细胞染色体加倍后得到了改善,大量人工诱导的多倍体材料被用于试验研究,多倍体研究又一次成为植物学研究的热点之一。
与二倍体相比,多倍体体现出很多优势(Chen et al., 2006),如更高的杂合性和变异性、等位基因的亚功能化等。根据染色体组来源相同与否,多倍体可以分成2类,即同源多倍体和异源多倍体。一直以来,由于异源多倍体中更容易得到变异材料,所以对其研究比较多(Albertin et al., 2006; Li Lukens et al.,2006)。但是,异源多倍体本身存在着对研究不利的因素,就是很难将倍性效应从其他的变异效应中区分出来,比如杂合效应。Auger等(2005)在对玉米(Zea mays)的研究中发现基因组的杂合效应对基因表达改变的影响大于倍性效应的影响。而在同源多倍体中就不存在杂合性,所以它是研究倍性效应和基因功能的良好材料。
同源四倍体刺槐(Robinia pseudoacacia)是通过人工诱导二倍体刺槐体细胞染色体(2x)加倍而育成的木本植物同源四倍体(4x)(Li et al., 2009),1997年由北京林业大学从韩国山林厅林木育种研究所引入到我国的刺槐优良无性系。过去几年对同源四倍体刺槐的研究主要集中在它的宏观经济特性,比如繁育技术(王树芝等,1999; 李云等,2004)和营养价值评价(李云等,2006)等,而对其形态学方面的变异研究很少,特别是花器变异方面。在前期的研究中,发现在同源四倍体刺槐的花序发育过程中出现了明显的不同于二倍体刺槐的变异,包括花器官的巨大化、花序结构复化以及开花时间的改变等(姜金仲等,2008)。随着分子生物学及其相关技术的快速发展,对同源多倍体花器变异方面的研究已经开展,但也主要是集中在草本植物,如水稻(Oryza sativa)(黄群策,1999; 2002)、欧洲油菜(Brassica napus)(Schranz,2004)、玉米(Guo et al., 1996)等主要农作物上,而对木本植物同源多倍体相关方面的研究较少,更没有对花序复化现象的报道以及有关这种现象的解释。所以,以同源四倍体刺槐为材料的研究结果可能会为以后对此类现象的解释提供理论借鉴。对同源四倍体刺槐花序变异机制的研究也有其重要的植物进化论意义,很可能揭示植物由单花序进化为复花序的重要原因。
在本研究中,主要针对同源四倍体刺槐花序变异进行研究,总结其变异类型和规律,并从发育生物学和分子生物学等角度分析其产生的原因。
1 试验材料试验材料采于北京市延庆县北京林业大学同源四倍体刺槐与二倍体刺槐无性系试验林。试验林于2002年种植,2005年开始逐渐开花。试验林基地(40°35'N,116°04'E)海拔489 m,地形平坦,土壤为黄壤; 属暖温带湿润气候带,年平均气温8 ℃,年平均降水量568.9 mm,冬春两季多干旱。
2 试验方法 2.1 表型观察在2008年和2009年,连续对试验林中的100株同源四倍体刺槐和10株二倍体刺槐上的全部花序进行花序类型、物候期观察,同时分别从中随机挑选各300个花序,对其长度和小花数量等表型特征进行观测。
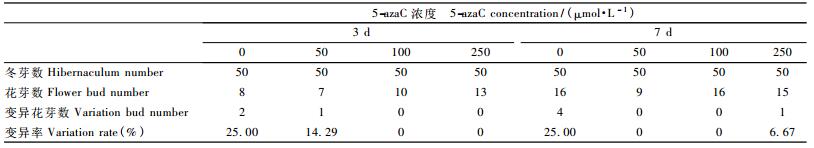
2.2 5-azaC处理冬芽根据李梅兰(2001)和Ng等(1999)的方法,使用50,100,250 μmol·L-1 3种浓度的5-氮杂胞苷(5-azacytidine,5-azaC)溶液,蒸馏水作为对照,采用棉浸法,处理时间分为3天和7天,共8组试验。每组试验挑选10个处于一级花序原基发育期的饱满冬芽进行处理,在花芽萌发后观察5-azaC对四倍体刺槐花序变异情况的影响。
2.3 开花决定基因克隆通过对大豆(Glycine max)、豌豆(Pisumsativum)和百脉根(Lotus corniculatus)等豆科(Leguminosae)植物的LEAFY(LFY),TERMINAL FLOWER1(TFL1)基因3’端的保守序列进行分析比对设计引物,最终筛选各1对特异引物(RpLFYf:GAAGTGGCGCGTGGGAAAAAGAA; RpLFYr: CGGAGCTTGGTTGGAACGTACCA; RpTFL1f: GGGGTACCGTTCTTACAATCTCTTTAGCG; RpTFL1r: GCTCTAGACATTATATTGCAGCAACAAGC),进行花分生组织决定基因的DNA片段克隆。
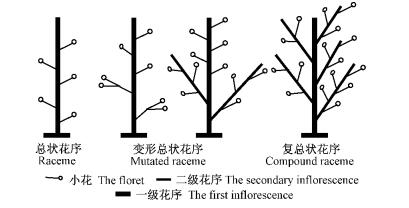
3 结果与分析 3.1 花序变异表型观察 3.1.1 花序长度及小花数的变异在对花序生长情况的观察中发现,同源四倍体刺槐与二倍体刺槐在花序长度和单花序上小花的着生数量存在明显差异,因此,对同源四倍体刺槐的3种早花序类型(图 1)和二倍体刺槐的总状花序进行了比较(表 1)。同源四倍体刺槐的总状花序的长度最短,为6.914cm,而变形总状花序的长度最长,为8.132 cm,二者间的差异达到了极显著水平,而它们与复总状花序和二倍体总状花序的长度差异不显著。但在花序的小花着生数量方面的结果与花序长度的结果相反,同源四倍体刺槐的总状花序和变形总状花序间的差异不显著,但它们与复总状花序、二倍体总状花序之间的差异都达到了极显著水平。这表明花序长度与小花着生数量二者之间没有明显的相关性,并且通过相关性比较得到了证实(R=0.208,P=0.396)。
|
图 1 同源四倍体刺槐3种早花序类型示意 Fig.1 The schematic diagram of three types of earlier inflorescence in autotetraploid Robinia pseudoacacia |
|
|
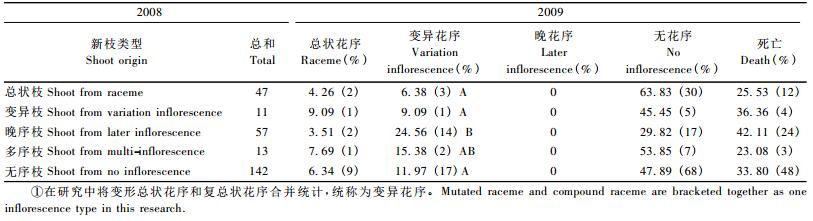
2008年和2009年,分别对100株同源四倍体刺槐的几种花序类型所占比例的观测结果(表 2):首先变化最大的是晚花序1)的数量,在2009年的花序观测中,却只在6株观测树上发现了7个晚花序,比2008年的1 496个晚花序少产生了1 489个,这也导致了2年间总花序数量差异; 其次,虽然早花序数量2年间变异不大,但是各类型花序所占比例却发生了很大的变化,在2008年,总状花序在早花序中的比例为75.13%,但在2009年它的比例下降了34.43%,而变形总状花序和复总状花序的比例,在2009年明显上升,特别是复总状花序的比例上升了21.04%。通过相关性分析,晚花序和变异花序之间呈现极显著的负相关性(R=-0.461,P=0.000)。
|
|
1) 早花序与晚花序: 2008年5月7日左右,即在正常花序萌发生长20天后,在新枝的叶腋处发现了新萌发的花序。所以笔者将同源四倍体刺槐中正常发育的花序定义为早花序,将5月7日后新萌发的花序定义为晚花序,以便于将这2类花序区分开。
同时,对270个冬芽的发育方向进行了连续观测,如表 3所示,2009年的新枝存活率最高的是多序枝(76.92%),最低的为晚序枝(由上一年的晚花序发育而来的新枝)(57.89%),而通过方差分析发现不同新枝类型间的存活率差异不显著(F=0.1579,P=0.958),这说明冬芽的不同发育方向对新枝的存活率没有影响。对2008年不同类型新枝上的冬芽类型进行统计,总状花序生成率最高的是变异枝(9.09%),而变异花序生成率最高的是晚序枝(24.56%),而无花序生成的比率最高的为总状枝(63.83%); 在对各项比率进行方差分析(表 3)后,发现总状花序生成率(F=0.488,P=0.744)和无花序生成率(F=0.904,P=0.473),各类型新枝间的差异不显著,但在变异花序生成率上,各类型新枝间的差异达到了显著水平(F=3.071,P=0.030),通过多重比较后发现晚序枝上的冬芽在2009年发育出变异花序的比例最高。根据方差分析比较,第1年形成的晚序枝很可能有促进其上的冬芽向变异花序发展的作用。所以,对同源四倍体刺槐冬芽发育方向的研究还有待深入。
|
|
在研究中发现,同源四倍体刺槐的花期为25天左右,比二倍体刺槐的花期长1倍左右。着生于同源四倍体刺槐2种变异花序类型二级花序结构上的小花的发育明显晚于一级花序结构上小花的发育。在进一步的观察中,还发现了这种发育不同步性的极端情况—晚花序,即在正常花序(早花序)萌发生长20天后,在新枝的叶腋处又萌发出的新花序,其上着生小花的发育基本与早花序二级花序结构上的小花同步。但发现小花的开花天数并不受所在位置的影响,都为13天左右。因此,这种不同位置上小花发育的不同步性,是导致同源四倍体刺槐花期延长的原因。
3.2 同源四倍体刺槐花序变异原因的初步分析 3.2.1 花分生组织决定基因DNA序列分析在前面的研究中,一系列的现象表明了花分生组织决定基因很可能在同源四倍体刺槐花序变异的过程中起着十分重要的作用。LFY和TFL1作为花分生组织的促进基因和抑制基因已经在拟南芥(Arabidopsis thaliana)等模式植物中被广泛研究,其功能也被普遍认可,所以本试验选择这2个基因作为初步研究同源四倍体刺槐花序变异分子机制的基因。根据豆科已有的LFY和TFL1的同源基因为参考设计引物,通过试验最终筛选出各1对引物:
RpLFYf: GAAGTGGCGCGTGGGAAAAAGAA;
RpLFYr: CGGAGCTTGGTTGGAACGTACCA;
RpTFL1f: GGGGTACCGTTCTTACAATCTCTTTAGCG;
RpTFL1r: GCTCTAGACATTATATTGCAGCAACAAGC。
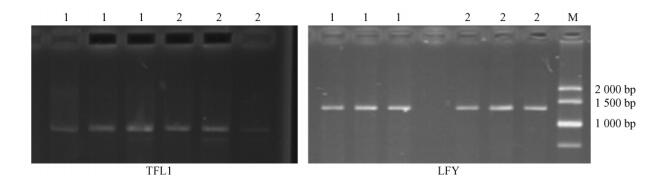
利用这2对引物,在同源四倍体刺槐和二倍体刺槐的基因组DNA中对LFY和TFL1同源基因进行了克隆(图 2)。从结果上看,同源四倍体刺槐和二倍体刺槐的LFY和TFL1同源基因的分子量基本相同,TFL1同源基因的分子量为1 000 bp左右,LFY同源基因的分子量为1 400 bp左右,并且在随后的基因测序分析中发现2个同源基因TFL1和LFY的片段在同源四倍体和二倍体刺槐中的同源性分别为98.44%和98.00%。利用BLAST工具对它们的共同序列进行比较,所得到的RpLFY序列中的部分片段与大豆的LFY1和LFY2基因的同源性都为91%,与菜豆(Phaseolus vulgaris)不同品种的LFY基因的同源性为88%;RpTFL1序列中的部分片段与百脉根的CEN/TFL1同源基因的同源性为73%,与菜豆不同品种的TFL1基因的同源性为90%。
|
图 2 同源四倍体刺槐和二倍体刺槐中LFY和TFL1的同源基因 Fig.2 The homologous gene of LFY and TFL1 in autotetraploid and diploid Robinia pseudoacacia 1. The sample of diploid Robinia pseudoacacia; 2. The sample of autotetraploid Robinia pseudoacacia; M. DNA marker. |
通过开花基因克隆没有发现同源四倍体与二倍体刺槐间存在差别,因此,进行5-azaC处理试验,进一步检测DNA甲基化是否对花序变异产生影响。如表 5所示,对照组的花序变异率较稳定,都为25.00%,而3个浓度处理组对花序的变异都表现出了明显的抑制作用,特别是100 μmol·L-1浓度组对花序变异的抑制作用最明显,在3天和7天2个处理时间水平上花序的变异率都为0。而且,经5-azaC处理的花序发育明显早于对照。
4 结论与讨论在本研究观测中发现,在花序长度上同源四倍体刺槐与二倍体刺槐间不存在明显差异,但在小花数量上明显多于二倍体刺槐,达到了显著水平。并且发现,同源四倍体刺槐的花序类型虽然比较稳定,但是各种类型在不同年份间的比例存在明显变化,并且晚花序和变异花序之间存在着极显著的负相关性(R=-0.461,P=0.000)。而且在连续观测试验中发现,同一新枝上着生多个不同结构花序的现象。同一新枝上的花序应该是由同一细胞或一团细胞发育而来,它们的遗传背景应该十分相似或相同,而且它们发育时所处的位置十分接近,所受到的内部影响和外部影响区别也应该不大,但是它们在结构上却有很大的变异。关于这一现象产生的原因,推测可能与同源四倍体刺槐的细胞倍性存在一定关系,邢少辰等(2001)在水稻的同源四倍体自交后代的根尖细胞中发现了不同倍性的细胞与四倍体细胞嵌合的现象,而在作者所在实验室以前利用流式细胞仪对同源四倍体刺槐自交产生的种子进行倍性鉴定的试验(姜金仲等,2008)中也发现了类似的现象。这些都说明同源四倍体的有丝分裂是存在异常的,从而产生不同倍性的细胞,这样即使处在同一环境中,由于它们倍性的不同也有可能导致植物同源四倍体相关器官的变异。这可能是同源四倍体刺槐花序变异多样化的原因之一,对于这一方面的研究还有待进一步的验证。
|
|
同源四倍体刺槐花序不同位置小花出现了发育的不同步性,从而导致了其花期比二倍体刺槐延长1倍,而这种开花时间的改变在自然界中存在的多倍体植物中并没有发现(Bretagnolle et al., 1995),只在后期的人工诱变多倍体植物中发现过(Schranz et al.,2000; Comai et al., 2000; Husband et al., 2000)。在一定程度上说明人工多倍体诱变过程中染色体加倍效应与自然形成多倍体有不同之处,人工诱变的多倍体在花序变异方面表现更复杂和更多样。
在对同源四倍体刺槐冬芽发育石蜡切片试验中,基本上确定了同源四倍体刺槐花序结构变异产生的时期是在一级花序原基的发育后期(有关数据和内容将另文发表)。正常总状花序在这一阶段的一级花序轴上的花序分生组织应该转化为花分生组织,后者分化并最终形成小花; 但在同源四倍体刺槐的变异花序中,这些花序分生组织保持了其独特性,并继续发育形成二级花序结构,从而导致同源四倍体刺槐花期的延长和变异结构花序的形成。这一过程与水稻的多类型花序的形成十分相似(Itoh et al.,2005),并且,Ikeda-Kawakatsu等(2009)发现这一现象的最主要原因是花序分生组织转化阶段不同所致。目前,对植物分生组织分化方向的研究主要集中在花分生组织决定基因上,拟南芥中的TFL1基因为维持花序分生组织发育的功能基因(Conti et al.,2007),其过量表达有推迟开花并促进侧芽的发生的效果(Shannon et al., 1991),而与之相对的LFY基因为长效表达基因,能够促进花序分生组织向花分生组织转化,使植物提前开花(Weigel et al., 1992; Mandel et al., 1995),2个基因间存在着相互抑制的关系。
但在同源四倍体刺槐的观察中发现,其花序变异并不能简单地归因于染色体加倍后的剂量效应,以LFY和TFL1基因为例,2个基因被同时加倍时,它们之间的平衡关系应该保持不变,即同源四倍体刺槐的花序结构和开花时间与二倍体刺槐应该保持一致; 而且即使产生剂量效应,由于LFY基因是长效表达基因,那么它的过量表达能够抑制TFL1基因的表达,从而促使同源四倍体刺槐提前开花。所以作者认为同源四倍体刺槐花序变异很可能是由于花组织发育过程中的某些关键基因沉默或少量表达,以及与其相应基因的过量表达引起的。前人研究表明,在多倍体的形成过程中伴随着大量的基因沉默现象,而形成基因沉默的原因包括染色体重组、点突变(Song et al., 1995),或者是DNA甲基化等(Wolffe et al., 1999)。特别是人工合成的多倍体植物,主要是通过秋水仙素处理或温度激变等化学和物理方法诱导产生,在其形成过程中染色体很容易发生变异,这也是人工合成多倍体变异明显多于天然多倍体的原因之一。所以,将研究重点放在LFY和TFL1等花分生组织决定基因上,首先设想是不是由于点突变等原因使基因序列发生改变,从而使其沉默,进而影响其他基因的表达。根据对克隆出的LFY和TFL1基因同源片段的分析表明,在已克隆出的有效基因片段中未发现同源四倍体刺槐与二倍体刺槐间的差异。而后利用DNA甲基化抑制剂5-azaC处理处于一级花序原基时期的同源四倍体刺槐的冬芽,结果表明5-azaC有明显抑制花序变异率和促进提前开花的效果。试验结果说明,DNA甲基化很可能是同源四倍体刺槐花序变异产生的原因之一,这也进一步表明在同源多倍体变异中,基因沉默也起着十分重要的作用。
同源四倍体刺槐花序变异是个十分复杂的过程,不太可能是由于一种调控机制所引起的,它应该是多个机制共同作用的结果。同源四倍体刺槐花序变异十分丰富,很有可能还有没有发现的变异形式,而只有更多地了解同源四倍体刺槐的变异形式才能更好地明确研究方向,了解花序变异的机制。所以对同源四倍体刺槐花序变异进行更加细致的表观观察是十分必要和重要的。
| [] | 黄群策, 孙敬三, 白素兰. 1999. 同源四倍体水稻雌雄配子体多态性的研究. 杂交水稻, 14(1): 32–33. |
| [] | 黄群策, 向茂成, 刘文海. 2002. 同源四倍体水稻胚囊内反足细胞团的多态性. 杂交水稻, 17(3): 47–50. |
| [] | 姜金仲, 郝晨, 李云, 等. 2008. 四倍体刺槐花器原基分化及其成熟表型变异. 林业科学, 44(6): 34–38. DOI:10.11707/j.1001-7488.20080607 |
| [] | 李梅兰. 2001. DNA甲基化与白菜的生长转变. 浙江大学博士学位论文. |
| [] | 李云, 田砚亭, 钱永强. 2004. NAA和IBN对四倍体刺槐试管苗生根影响及不定根发育过程解剖观察. 林业科学, 40(3): 75–79. DOI:10.11707/j.1001-7488.20040313 |
| [] | 李云, 张国君, 路超, 等. 2006. 四倍体刺槐不同生长时期和部位的叶片的饲料营养价值分析. 林业科学研究, 19(5): 580–584. |
| [] | 王树芝, 田砚亭, 罗晓芳. 1999. 刺槐宽叶和四倍体无性系的组织培养. 植物生理学通讯, 35(3): 204–205. |
| [] | 邢少辰, 蔡玉红, 周开达, 等. 2001. 特异水稻同源多倍体的染色体行为. 邯郸农业高等专科学校学报, 18(3): 1–3. |
| [] | Albertin W, Balliau T, Brabant P, et al. 2006. Numerous and rapid nonstochastic modifications of gene products in newly synthesized Brassica napus allotetraploids. Genetics, 173(2): 1101–1113. DOI:10.1534/genetics.106.057554 |
| [] | Auger D L, Gray A D, Ream T S, et al. 2005. Nonadditive gene expression in diploid and triploid hybrids of maize. Genetics, 169(1): 389–397. |
| [] | Blakeslee A F, Avery A G. 1937. Methods of inducing doubling of chromosomes in plants by treatment with colchicine. J Hered, 28(12): 393–411. DOI:10.1093/oxfordjournals.jhered.a104294 |
| [] | Bogart J P. 1979. Evolutionary implications of polyploidy in amphibians and reptiles. Basic Life Sci, 13(13): 341–378. |
| [] | Bretagnolle F, Lumaret R. 1995. Bilateral polyploidization in Dactylis glomerata L.subsp. lusitanica: occurrence, morphological and genetic characteristics of first polyploids. Euphytica, 84(3): 197–207. |
| [] | Chen Z J, Ni Zhongfu. 2006. Mechanisms of genomic rearrangements and gene expression changes in plant polyploids. BioEssays, 28(3): 240–252. DOI:10.1002/(ISSN)1521-1878 |
| [] | Comai L, Tyagi A P, Winter K, et al. 2000. Phenotypic instability and rapid gene silencing in newly formed Arabidopsis allotetraploids. The Plant Cell, 12(9): 1551–1567. DOI:10.1105/tpc.12.9.1551 |
| [] | Conti L, Bradley D. 2007. TERMINAL FLOWER1 is a mobile signal controlling Arabidopsis architecture. The Plant Cell, 19(3): 767–778. DOI:10.1105/tpc.106.049767 |
| [] | Guo Mei, Davis D, Birchler J A. 1996. Dosage effects on gene expression in a maize ploidy series. Genetics, 142(4): 1349–1355. |
| [] | Husband B C, Schemske D W. 2000. Ecological mechanisms of reproductive isolation between diploid and tetraploid Chamerion angustifolium. Journal of Ecology, 88(4): 689–701. DOI:10.1046/j.1365-2745.2000.00481.x |
| [] | Ikeda-Kawakatsu K, Yasuno N, Oikawa T, et al. 2009. Expression level of ABERRANT PANICLE ORGANIZATION1 determines rice inflorescence form through control of cell proliferation in the meristem. Plant Physiol, 150(2): 736–747. DOI:10.1104/pp.109.136739 |
| [] | Itoh J, Nonomura K, Ikeda K, et al. 2005. Rice plant development:from zygote to spikelet. Plant Cell Physiol, 46(1): 23–47. DOI:10.1093/pcp/pci501 |
| [] | Kellis M, Birren B W, Lander E S. 2004. Proof and evolutionary analysis of ancient genome duplication in the yeast Saccharomyces cerevisiae. Nature, 428(6983): 617–624. DOI:10.1038/nature02424 |
| [] | Li Yun, Zhang Guojun, Jiang Jinzhong. 2009. Tetraploid black locust, a promising tree resource for biomass energy and forage. In Vitro Cell Dev Biol-Plant, 45(4): 504–505. |
| [] | Lukens L N, Pires J C, Leon E, et al. 2006. Patterns of sequence loss and cytosine methylation within a population of newly resynthesized Brassica napus allopolyploids. Plant Physiol, 140(1): 336–348. |
| [] | Mandel M A, Yanofsky M F. 1995. A gene triggering flower development in Arabidopsis. Nature, 377(6549): 522–524. DOI:10.1038/377522a0 |
| [] | Masterson J. 1994. Stomatal size in fossil plants: Evidence for polyploidy in the majority of angiosperms. Science, 264(5157): 421–424. DOI:10.1126/science.264.5157.421 |
| [] | McLysaght A, Hokamp K, Wolfe K H. 2002. Extensive genomic duplication during early chordate evolution. Nat Genet, 31(2): 200–204. DOI:10.1038/ng884 |
| [] | Ng H H, Bird A. 1999. DNA methylation and chromatin modification. Curr Opin Genet Dev, 9(2): 158–163. DOI:10.1016/S0959-437X(99)80024-0 |
| [] | Schranz M E, Osborn T C. 2000. Novel flowering time variation in the resynthesized polyploid Brassica napus. The Journal of Heredity, 91(3): 242–246. DOI:10.1093/jhered/91.3.242 |
| [] | Shannon S, Meeks-Wagner D R. 1991. A mutation in the Arabidopsis TFL1 gene affects inflorescence meristem development. The Plant Cell, 3(9): 877–892. DOI:10.1105/tpc.3.9.877 |
| [] | Song Keming, Lu Ping, Tang Keliang, et al. 1995. Rapid genome change in synthetic polyploids of Brassica and its implications for polyploid evolution. Proc Natl Acad Sci USA, 92(17): 7719–7723. DOI:10.1073/pnas.92.17.7719 |
| [] | Weigel D, Alvarez J, Smyth D R, et al. 1992. LEAFY controls floral meristem identify in Arabidopsis. Cell, 69(5): 843–859. DOI:10.1016/0092-8674(92)90295-N |
| [] | Wolffe A P, Matzke M A. 1999. Epigenetics: regulation through repression. Science, 286(5439): 481–486. DOI:10.1126/science.286.5439.481 |
 2012, Vol. 48
2012, Vol. 48