文章信息
- 梁为, 成军, 卜春亚, 靳永胜, 师光禄, 王有年
- Liang Wei, Cheng Jun, Bu Chunya, Jin Yongsheng, Shi Guanlu, Wang Younian
- 瑞香狼毒超临界萃取物的化学成分及其杀螨活性
- Componential Analysis and Acaricidal Activities of Stellera chamaejasme Extracts by Supercritical Fluid Extraction
- 林业科学, 2012, 48(1): 181-185.
- Scientia Silvae Sinicae, 2012, 48(1): 181-185.
-
文章历史
- 收稿日期:2010-04-26
- 修回日期:2010-10-01
-
作者相关文章
2. 农业部都市农业(北方) 重点开放实验室 北京 102206;
3. 北京农学院 北京 102206
2. Key Laboratory of Urban Agriculture (North) of Ministry of Agriculture Beijing 102206;
3. Beijing University of Agriculture Beijng 102206
我国农业害螨的抗药性越发严重,在防治过程中害螨的天敌也受到杀伤,造成害螨的再猖獗,严重影响农作物及经济林的产量和品质(Kalaisekar et al., 2003; Shi et al., 2004)。瑞香狼毒(Stellera chamaejasme)是对我国草地危害较重的有毒植物之一,在东北、华北、西南及西部地区分布广、数量大,是重度退化草原的主要种群。狼毒的根可以制成杀虫剂,具有驱虫、杀蝇、灭蛆的效果,可用于防治农作物、饲料牧草上的害虫(Kalaisekar et al., 2003)。研究表明:瑞香狼毒提取物对农业害螨具有毒杀活性,如Shi等(2004)和曹挥等(2003)发现瑞香狼毒根部氯仿提取物对山楂叶螨(Tetranychus viennensis)具有触杀和内吸活性,LC50分别为8.397 2 mg·mL-1和5.588 8 mg·mL-1; 韩建勇等(2003)发现0.01g·mL-1的瑞香狼毒石油醚提取物对柑橘全爪螨(Panonychus citri) 24 h触杀率达100%,杀卵率接近100%; 潘为高等(2004)发现瑞香狼毒根正己烷索氏提取物和石油醚索氏提取物对柑橘全爪螨的毒力分别是氧乐果原药毒力的12.8倍和11.5倍; 陈梅等(2008)采用超临界CO2萃取法提取瑞香狼毒根部油脂,提取率达到2.68%,并证明超临界萃取物对朱砂叶螨(Tetranychus cinnabarinus)具有触杀活性,LC50为2.436 6 mg·mL-1; Peng等(2006)采用超临界CO2萃取法针对瑞香狼毒根部的daphnoretin、7-methoxy-daphnoretin和1,5-diphenyl-1-pentanone进行提取。目前未见瑞香狼毒超临界萃取物对朱砂叶螨的内吸活性以及化学组分的研究。
本研究采用均匀试验设计,对超临界CO2萃取瑞香狼毒根部油脂的工艺进一步优化,并通过GC /MS技术对瑞香狼毒的挥发性化学成分进行分析。同时,对最佳提取条件下超临界萃取物对朱砂叶螨的触杀和内吸活性进行研究,并与冷浸提取法进行比较,为开发新型杀螨剂提供理论基础。
1 材料与方法 1.1 材料瑞香狼毒根,采自山西省大同地区金沙滩。将狼毒置于通风背阴处风干后用电动粉碎机粉碎,过60目筛。
试螨为朱砂叶螨雌成螨,经室内多代繁殖的敏感品系,室内培养后(25℃ ± 1℃,相对湿度60% ±10%,L ︰ D = 18 h ︰ 6 h)选取健康活泼、日龄及大小一致的试螨进行试验。采用芸豆(Phaseolus vulgaris)幼苗饲养。
1.2 超临界CO2萃取采用江苏南通市华安超临界萃取有限公司的HA221-50-06型超临界CO2萃取设备,CO2气体由北京亥普北分气体工业有限公司提供,纯度≥99.5%。将瑞香狼毒粉末100 g加入萃取釜(1 L)中,在选定的温度和压强下,以21 L·h-1的流速萃取2 h,夹带剂为无水乙醇。
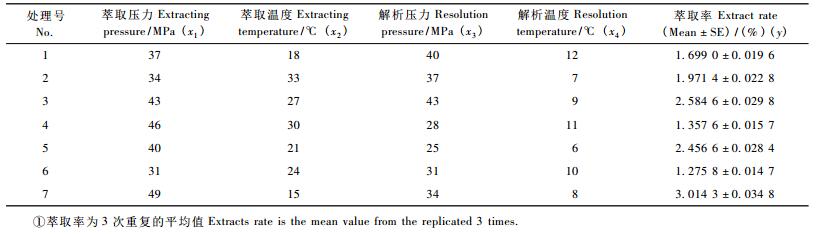
将试验条件的4个因素等分为7个水平,见表 1。各处理重复3次。萃取压力为31 ~ 49 MPa,萃取温度为15 ~ 33 ℃,解析压力为25 ~ 43 MPa,解析温度为6 ~ 12 ℃。
|
|
将100 g狼毒干粉装入广口瓶中,分别加入干粉5倍量的溶剂,室温下浸提5天,滤渣继续浸泡3天,重复3次,合并提取物,减压浓缩。根据曹挥等(2003)的方法,选择提取溶剂为石油醚和三氯甲烷。
1.4 超临界萃取物对朱砂叶螨的生物活性触杀效应:参照Busvine(1980)的方法并稍作改进。将双面胶带粘贴于玻片一端,揭去上面的纸片,用零号毛笔挑取大小一致、颜色鲜艳的活泼雌成螨,将其背部粘在双面胶带上,不可粘住螨足、口器及须肢,保证螨足自由活动,每片粘约30头,粘好的玻片在双目解剖镜下检查,剔除不活动、受伤和粘的不合格的螨,将供试螨浸入待测药液中轻轻摇动约5 s后取出,用吸水纸条小心吸去螨体周围的多余药液。各处理重复3次,对照采用蒸馏水加1%体积的吐温- 80。在同等饲养条件下培养24 h后,在双目解剖镜下检查结果,用毛笔轻触螨体,以螨足不动者为死亡。
内吸效应:把新鲜的芸豆叶片的叶柄截去0.5cm后插于药液中,72 h后取出置于培养皿中。将雌成螨个体接于叶片上取食24 h后观察其死亡率。每一叶片接虫30头,每种提取物设5个浓度,每一浓度重复3次,对照为蒸馏水加1%体积的吐温- 80。
1.5 超临界萃取物组分分析采用Agilent 6890气相色谱仪-5973N质谱仪; HP-5MS 30 m × 0.25 mm × 0.25 μm弹性石英毛细管柱。
进样口温度300 ℃,柱初温150 ℃,保持2 min,以2 ℃ ·min-1升至180 ℃,保持2 min,以5℃·min-1升至200 ℃,保持3 min,以8 ℃·min-1升至250 ℃,保持10 min。载气为高纯氦气,流速1.0mL·min-1,进样方式为不分流,进样量1 μL。
质谱条件: GC-MS进样口温度280 ℃,离子源温度230 ℃,四极杆温度150 ℃,电离方式EI源,电力能量70 eV,电子倍增器电压1 718 eV,溶剂延迟8 min,检测方式SIM,扫描离子m /z 63,79,210。
1.6 活性成分的杀螨效果验证根据GC/MS分析结果,于Sigma-Aldrich购买主要成分的标准品进行触杀和内吸效果的验证。
1.7 数据处理数据处理采用SPSS 17.0完成。均匀实验采用偏最小二乘回归法进行方程拟合; 毒力回归方程采用死亡几率值法进行拟合; 多重比较采用Duncan’ s新复极差法。
2 结果与分析 2.1 超临界CO2萃取瑞香狼毒的最佳参数不同萃取条件的提取率见表 2。对不同条件下的萃取率进行偏最小二乘回归,得到二次回归方程模型: y =4.962 7 + 0.123 0x1-0.218 5x2-0.270 9x3 +0.448 8x4-0.001 1x12 + 0.003 6x22 + 0.004 5x32 -0.035 9x42 (R2 = 0.930 1,df = 6,F = 10.154)。通过回归方程,并结合萃取设备指标范围,得出最优条件为萃取压力49 MPa,萃取温度15℃,解析压力43MPa,解析温度6.25 ℃。将最优参数带入方程得y = 3.773 1。按优化条件安排试验,实测萃取率为3.753 4%,相对误差为0.52%。
|
|
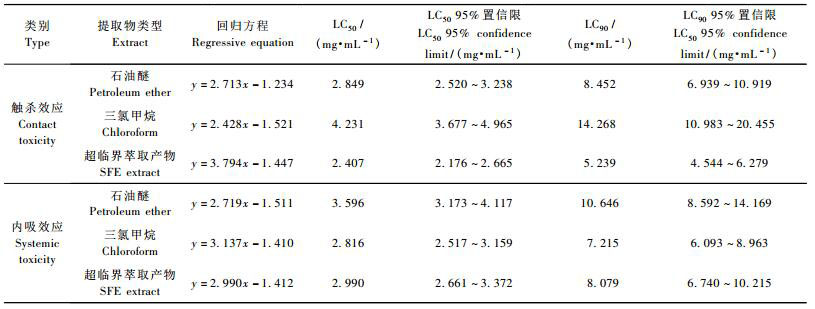
将石油醚、三氯甲烷提取物和超临界萃取物配制成质量浓度为4 mg·mL-1的乳化液进行测定,对照为1%吐温-80溶液,结果见表 3。瑞香狼毒超临界萃取物对朱砂叶螨有触杀效应和内吸效应; 与石油醚和三氯甲烷提取物相比,超临界萃取物的触杀效应最好,分别为石油醚和三氯甲烷提取物的1.15倍和1.54倍左右; 并兼有较高的内吸效应,分别是石油醚和三氯甲烷提取物的1.24倍和0.98倍左右。
|
|
进而根据浓度对数值与朱砂叶螨校正死亡率机率值分别求出毒力回归方程,结果见表 4。瑞香狼毒3种提取物对朱砂叶螨的雌成螨均有较好的触杀和内吸效应。其中超临界萃取物触杀和内吸效应的LC50值分别达到2.407和2.990 mg·mL-1; LC90达到5.239和8.079 mg·mL-1。
|
|
应用GC/MS对最优条件下超临界萃取物组分进行分析,并采用面积归一法计算各组分的相对百分含量(表 5)。超临界萃取物中检测到13种组分,占全部组分的99.99%。其主要成分为角鲨烯、(Z,Z) 9,12-十八碳二烯酸、正十六烷酸、喹啉、菜油甾醇等。其中角鲨烯含量超过全部组分的1 /3。因此,采用Sigma-Aldrich公司角鲨烯的标准品做了进一步研究。
|
|
不同质量浓度角鲨烯对朱砂叶螨的生物活性如表 6所示。触杀效应的回归方程为y = 1.96x-1.953,LC50为9.918 mg·mL-1 (95%置信限8.505 ~ 11.653mg·mL-1),角鲨烯LC90为44.707 mg·mL-1 (95%置信限33.763 ~ 65.590 0 mg·mL-1); 内吸效应的毒力回归方程为y = 1.976x-2.195,LC50为12.918 mg·mL-1 (95%置信限11.052 ~ 15.365mg·mL-1),LC90为57.534 mg·mL-1 (95%置信限42.499 ~ 87.510 mg·mL-1)。结果表明角鲨烯对朱砂叶螨有一定的触杀和内吸效应,触杀效应较强。
|
|
陈梅等(2008)采用超临界萃取法对瑞香狼毒根部油脂进行提取,提取率达到2.68%。本研究确定瑞香狼毒超临界CO2最佳萃取条件为:萃取压力49 MPa,萃取温度15 ℃,解析压力43 MPa,解析温度6.25 ℃; 理论萃取率为3.773 1%,实测萃取率3.753 4%,相对误差0.52%。该条件的超临界萃取物具有较好的触杀和内吸效应,LC50值分别达到2.407和2.990 mg·mL-1; 与冷浸提取法相比,超临界萃取法避免了溶剂残留,体现了较高的杀螨活性。
国内外对瑞香狼毒化学组分的研究,主要集中在药用成分的分离鉴定方面,如Feng等(2005)从瑞香狼毒中分离得到6种具有抗糖尿病及抑制视网膜病变活性的双黄酮化合物; Yang等(2008)分离得到isosikokianin A,具有抗乙型肝炎病毒的活性。病虫害防治方面,已证明伞形花内酯、瑞香亭、狼毒色原酮、β-谷甾醇对菜粉蝶(Pieris rapae)有拒食活性(张国洲等,2000; 王亚维等,2004); Lu等(2007)和Tang等(2008)从狼毒中分离得到的1,5-diphenyl-1-pentanone对豆蚜(Aphis craccivora)和白纹伊蚊(Culex pipiens pallens)有触杀活性; Liu等(2008)也证明狼毒中的S-(+) -1,5-diphenly-3-hydroxy-1-pentanone能够防治菜青虫(Peries rapae)。虽然有瑞香狼毒提取物杀螨活性的研究(曹挥等,2003; 陈梅等,2008),但对粗提物的组分少有报道。本试验采用GC/MS技术对最佳条件下的超临界萃取物进行检测,共发现13种化合物,占全部组分的99.99%,主要包括角鲨烯、(Z,Z) 9,12-十八碳二烯酸、正十六烷酸、喹啉、菜油甾醇等,角鲨烯等为首次在瑞香狼毒中报道。对角鲨烯的杀螨活性进行研究,验证了角鲨烯对朱砂叶螨具有一定的触杀和内吸效应,LC50值分别为9.918和12.918 mg·mL-1。此外,前人研究发现喹啉、1,2-benzenedicarboxylic acid等成分具有强致畸性和致癌性(谭君等,2007; 张秀霞等,2009),可能对超临界萃取物的杀螨活性贡献较多,但不宜直接在杀螨剂中应用。
角鲨烯主要存在于海洋鱼类和植物油脂中,在医药和化妆品等领域应用广泛,具有抑制肿瘤细胞、抗胆固醇和解毒作用(张秀霞等,2009; Huang et al., 2009; Seiki et al., 2009)。有研究表明:角鲨烯能够作为抗菌剂和杀虫剂,尤其是防治火蚂蚁和蚊子的效果最好(Masuda et al., 1982; Zieglfr,1990)。同时,角鲨烯对人体有益无害,不会因残留对人体造成威胁。因此,角鲨烯在新型杀螨剂中具有良好的应用前景,可以通过分子结构修饰等方法增强其杀螨活性。角鲨烯的杀螨作用机制仍需深入研究。有关超临界萃取物中其他化合物的报道较少,其生物活性有待进一步研究。
曹挥, 刘素琪, 赵莉蔺, 等. 2003. 瑞香狼毒提取物对山楂叶螨的生物活性及酶活性影响[J]. 林业科学, 39(1): 98-102. DOI:10.11707/j.1001-7488.20030116 |
陈梅, 师光禄, 李照会. 2008. 瑞香狼毒的CO2超临界提取工艺及其杀螨活性的研究[J]. 北京农学院学报, 23(3): 40-42. |
韩建勇, 曾鑫年, 杜利香, 等. 2003. 几种植物的杀螨活性研究初报[J]. 广东农业科学, (2): 43-46. |
潘为高, 高平, 刘燕萍, 等. 2004. 瑞香狼毒各组分杀螨活性及组分间相互作用的研究[J]. 四川大学学报:自然科学版, 41(1): 208-211. |
谭君, 林竹光. 2007. GC-EI-MS内标法分析鱼肉中邻苯二甲酸酯[J]. 化学学报, 65(24): 2875-2882. DOI:10.3321/j.issn:0567-7351.2007.24.013 |
王亚维, 张国洲, 徐汉虹, 等. 2004. 瑞香狼毒杀虫活性成分的提取与分离[J]. 安徽农业科学, 32(4): 671-672. |
张国洲, 徐汉虹, 赵善欢, 等. 2000. 瑞香狼毒根提取物杀虫活性成分的分离与鉴定[J]. 湖北农学院学报, 20(1): 19-22. |
张秀霞, 吴伟林, 单宝来, 等. 2009. 固定化降解菌Q5降解喹啉动力学[J]. 石油学报(石油加工), 25(3): 442-446. |
Busvine J R. 1980. Recommended methods for measurement of resistance to pesticides ∥ FAO. Plant Production and Protection 21. Rome: FAO, 77-90.
|
Feng B M, Wang T, Zhang Y, et al. 2005. Aldose reductase inhibitors from Stellera chamaejasme[J]. Pharmaceutical Biology, 43(1): 12-14. DOI:10.1080/13880200590903246 |
Huang Z R, Lin Y K, Fang J Y. 2009. Biological and pharmacological activities of squalene and related compounds: Potential uses in cosmetic dermatology[J]. Molecules, 14(1): 540-554. DOI:10.3390/molecules14010540 |
Kalaisekar A, Naidu V G, Rao N V. 2003. Efficacy of some pesticides against citrus rust mite, Phyllocoptruta oleivora[J]. Indian Journal of Entomology, 65(3): 308-310. |
Liu Q, Jia H, Xiao B, et al. 2008. A new compound against Peries rapae from Stellera chamaejasme[J]. Natural Product Research, 22(4): 248-252. |
Lu T, Chen L, Hou T P. 2007. Synthesis and structure-activity study of botanical aphicides 1, 5-diphenyl-1-pentanone analogues[J]. Pesticide Biochemistry and Physiology, 89(1): 60-64. DOI:10.1016/j.pestbp.2007.02.008 |
Masuda A, Akiyama S, Kuwano M, et al. 1982. Potentiation of antifungal effect of amphotericin B by squalene, an inter-mediate for sterol biosynthesis[J]. Journal of Antibiotics, 35(2): 230-234. DOI:10.7164/antibiotics.35.230 |
Peng J Y, Dong F Q, Xu Q W, et al. 2006. Orthogonal test design for optimization of supercritical fluid extraction of daphnoretin, 7-methoxy-daphnoretin and 1, 5-diphenyl-1-pentanone from Stellera chamaejasme L and subsequent isolation by high-speed countercurrent chromatography[J]. Journal of Chromatography A, 1135(2): 151-157. DOI:10.1016/j.chroma.2006.08.099 |
Seiki S, Frishman W H. 2009. Pharmacologic inhibition of squalene synthase and other downstream enzymes of the cholesterol synthesis pathway: a new therapeutic approach to treatment of hypercholesterolemia[J]. Cardiology in Review, 17(2): 70-76. DOI:10.1097/CRD.0b013e3181885905 |
Shi G L, Liu S Q, Cao H, et al. 2004. Acaricidal activities of extracts of Stellera chamaejasme against Tetranychus viennensis (Acari: Tetraanychidae)[J]. Journal of Economic Entomology, 97(6): 1912-1916. DOI:10.1093/jee/97.6.1912 |
Tang X R, Hou T P. 2008. Separation and identification of botanical insecticide 7-hydroxycoumarin and its biological activity against Aphis craccivora and Culex pipiens pallens[J]. Natural Product Research, 22(4): 365-370. DOI:10.1080/14786410701856009 |
Yang G H, Chen D F. 2008. Bilfavanones, flavonoids, and coumarins from the roots of Stellera chamaejasme and their antiviral effect on hepatitis B virus[J]. Chemistry & Biodiversity, 5(7): 1619-1424. |
Zieglfr H. 1990. Detoxification of humans and animals with squalane and squalene. DE Patent: 4 017 172, 1990-12-20.
|
 2012, Vol. 48
2012, Vol. 48