文章信息
- 陈新, 王贵禧, 梁丽松, 马庆华
- Chen Xin, Wang Guixi, Liang Lisong, Ma Qinghua
- 平榛冷适应相关基因CBF的克隆及时空表达特性分析
- Cloning and Temporal-Spatial Expression of a CBF Homolog Associated with Cold Acclimation from Corylus heterophylla
- 林业科学, 2012, 48(1): 167-172.
- Scientia Silvae Sinicae, 2012, 48(1): 167-172.
-
文章历史
- 收稿日期:2010-12-20
- 修回日期:2011-11-17
-
作者相关文章
低温是影响植物分布、进而影响生长和产量的关键因素之一。Weiser(1970)指出低温导致植物的基因表达发生变化; 早在20世纪90年代研究者就发现了植物的冷适应现象(Guy et al., 1985)。虽然迄今为止植物抗寒的分子机制还没完全清楚,但研究者基本总结出了2条冷调节的网络途径:依赖ABA和非依赖ABA低温响应方式。通过分子生物学手段来创制抗寒种质材料已经成为当代植物遗传改良的研究热点。CBF作为一种转录因子能与功能基因的CRT/DRE顺式作用元件特异结合,从而激活下游多个功能基因的协同表达使植株多方面的抗逆性得到提高,因此CBF已经成为研究最为深入的转录因子之一(Liu et al., 1998)。CBF首先在拟南芥(Arabidopsis thaliana)中被克隆得到,以后不断有CBF在其他植物中异源表达提高耐寒力的验证,如番茄(Lycopersicon esculentum) (Hsieh et al., 2002)、菊花(Dendranthema) (Hong et al., 2009)、烟草(Nicotiana tabacum) (Yang et al., 2010)、马铃薯(Solanum tuberosum) (Behnam et al., 2007)等。多年生木本植物越冬一般经过3个过程:抗寒锻炼(秋)、耐冷时期(冬)、脱除冷锻炼(春)。植物经过一定时间的非冻低温(2 ~ 6 ℃)驯化后具有较强的抗寒性(Guo et al., 2002),该过程称为冷适应或者抗寒锻炼; 春天随着温度的回升,需冷量满足后,休眠芽开始再生长,抗寒锻炼开始脱除。所以木本植物的抗寒相对于草本植物来说增加了短日照导致木本植物休眠的过程,基因表达网络更复杂。迄今为止CBF基因在樱桃(Prunus) (Owens et al., 2002)、杨树(Populus) (Benedict et al., 2006; 周洲等,2010)、葡萄(Vitis) (Xiao et al., 2006)、柑橘(Citrus)(Champ et al., 2007)等木本植物上克隆得到。
平榛(Corylus heterophylla)为桦木科(Betulaceae)榛属(Corylus)植物,在我国野生资源丰富,主要特性是抗寒性强,可抗冬季-48 ℃的极端低温,而世界上广泛栽培的欧榛(Corylus avellana)的抗寒能力远不如平榛,早春和晚秋的霜冻会冻伤或者冻死花芽,影响果树的产量从而给果农造成大量的经济损失。目前平榛的CBF基因还未见报道。因此,本研究选取平榛花芽为试材,利用RACE-PCR技术分离克隆了1个平榛CBF基因全长,并对该基因在自然条件下和人工可控温度条件下对低温信号的响应进行比较研究,旨在为进一步研究平榛CBF基因的功能、探讨平榛抗寒分子机制提供理论依据和基础数据,并为今后利用基因工程技术培育抗寒欧榛新品种提供可操作基因。
1 材料与方法 1.1 试验材料平榛材料采于河北木兰围场国有林场(116°32'—118°14'E,41°35'—42°40'N)。为保证材料的一致性,选择成片分布、从一个克隆母株上萌发的基因型一致的根蘖苗。取材后立即投入液氮冻干,保存于-80 ℃冰箱。
1) 用于自然条件下CBF表达模式研究的材料及处理 ①参照Naik等(2007)方法(稍作修改),分别于2009年9月29日(处于未进入冷适应时期non-cold acclimation,NC,日均温7 ℃以上)、2009年11月2日(处于冷适应时期cold acclimation,CA,日均温7 ℃以下)、2009年12月29日(处于寒冬时期mid-winter,MW,日均温0 ℃以下)、2010年4月24日(处于脱除冷适应时期deacclimation,DA,日均温回升至7 ℃以上) 4个不同时间点摘取花芽,用于研究CBF基因的季节表达。②选择在冷适应CA时期(2009年11月2日采集)分别取花芽、雄花序、树皮,用于检测在冷适应期冬季暴露的不同器官中CBF基因的差异表达情况。
2) 用于人工控制的低温胁迫条件下CBF表达模式研究的材料及处理为研究在人工可控条件下CBF基因的表达,参照Rinne等(1998)萌芽前从取样地带土挖回基因型一致的根蘖苗,栽植在温室,培育苗龄2 ~ 3个月的无性系,放入光照箱中适应2 h以上(光照强度100 μmol·m-2 s-1,光照时间光下16 h/黑暗8 h,昼夜温度25 ℃ /21 ℃,湿度80% ~90%),然后进行4 ℃低温胁迫处理,分别在处理0,2,4,8,24 h时采集叶片,采集叶位相同,用于研究CBF基因响应低温的表达模式。
1.2 方法1) ChCBF基因的克隆与序列分析 平榛研究样品材料的总RNA提取采用CTAB法(Chang et al., 1993),并用DNaseⅠ(TaKaRa)处理以去除基因组DNA的污染。应用Clontech公司的SMARTTM RACE试剂盒反转录得到第1链用于基因RACE扩增,本实验室前期采用Solexa Sequencing技术对寒冬时期平榛花芽的转录本进行了高通量测序,组装得到了4万多条unigene; 在此基础上,通过分析文库筛选得到多条类似CBF基因的序列,同源BLASTN分析结果表明分别对应拟南芥中的AtCBF1,AtCBF2,AtCBF3,本文选取其中1条unigene编号为30161的基因序列进行研究。设计扩增3'方向的引物P1和5'方向的引物P2 (表 1),按照Race试剂盒SMARTTM RACE cDNAAmplification Kit说明书进行cDNA末端快速扩增(图 1)。扩增方法采用Touch down PCR程序,凝胶回收与预期片段大小一致的泳带,连接克隆载体并转化感受态细胞,通过蓝白斑筛选及质粒酶切鉴定阳性克隆后,在北京诺赛生物公司进行序列测定。

|
图 1 ChCBF基因RACE-PCR扩增 Figure 1 Diagram of Rapid amplification of cDNA ends of ChCBF gene |
|
|
为获得ChCBF基因全长,根据由unigene序列和2段末端序列拼接而得到的cDNA全长序列,设计1对特异性引物ChCBF-F和ChCBF-R进行PCR扩增(表 1),PCR产物克隆到PMD19-T载体上,测序结果在GenBank中进行Blast分析。利用在线软件ProtParam(http:∥www.expasy.org)预测所编码蛋白的分子量、理论等电点及保守结构域等。采用DNAMAN软件进行多序列比对及系统进化分析。
2) 相对荧光定量PCR表达分析 分别提取不同处理材料的总RNA,用DNaseⅠ酶(RNase free)消化基因组DNA后,各取0.5 μg为模板,反转录合成cDNA第1链作为实时荧光定量PCR (Quantitative Real-Time PCR,qRT-PCR)的模板。根据ChCBFcDNA全长序列,按照荧光定量PCR引物设计原则在ChCBF的3'非翻译区附近设计1对特异引物CBFQR-F和CBFQR-R (表 1),获得的扩增片段为160 bp。以平榛Actin基因(GenBank accession number HQ677569)为稳定内参,设计其特异引物Actin-F和Actin-R(表 1),获得的扩增片段为101 bp,进行相对荧光定量分析。
反应在ABI 7500实时定量PCR仪上进行,方法参照《美国应用生物系统公司7300 /7500实时定量PCR仪相对定量实验入门指南》和荧光定量试剂盒SYBR PrimeScriptTM RT-PCR Kit (TaKaRa)说明书。反转录的反应体系为:总RNA 2 μL (1 μg),5 × PrimeScriptTM Buffer 4 μL,PrimeScriptTM RT Enzyme Mix I 1 μL,Random primer(100 μmol·L-1)和Oligo dT primer (50 μmol·L-1)各1 μL,加水(RNase free)补足20 μL。荧光定量PCR扩增的反应体系为: cDNA模板2 μL,2 × SYBR Premix Ex TaqTM 10 μL,特异引物(10 μmol·L-1) 0.4 μL,50 ×ROX Reference Dye Ⅱ 0.4 μL,用水补足20 μL。采用两步法标准程序: 95 ℃预变性30 s; 5 ℃变性5 s,60 ℃复性34 s,共45个循环。每个试验设4次重复,利用ABI 7500 PCR仪Sequence Detection software软件(2-ΔΔCt法) (Livak et al., 2001)和Origin 6.2软件进行数据分析。
2 结果与分析 2.1 平榛ChCBF cDNA全长的获得及序列分析通过分析采用Solexa Sequencing技术对寒冬时期平榛花芽转录本进行的高通量测序结果,发现unigene30161疑似CBF,设计末端扩增的特异引物P1和P2,以平榛花芽的cDNA为模板,经RACEPCR扩增和产物克隆、测序后,分别得到长度为660bp的3'末端和853 bp的5'末端(图 2,条带1和条带2)。5'RACE是根据3'RACE扩增到的非编码区设计的,5'RACE扩增片段与unigene片段和3'RACE扩增片段均有一段完全重叠的区域,说明克隆到的是基因的5'端和3'端。并将其与全长扩增引物(表 1)所得的720 bp序列(图 2,条带3)进行比较,最终扩增获得1条长度为1 053 bp的包含开放阅读框的cDNA全长序列。Blast比对发现,该cDNA序列与CBF基因同源,命名为ChCBF,GenBank登录号为HQ639413。BlastP分析发现,该片段编码的氨基酸序列保守结构域区段AP2/EREBP及其侧翼特征位点与多种植物的CBF蛋白高度同源,其中与柑橘CBF同源性最高,达80%以上。利用NCBI提供的ORF Finder进行分析发现,ChCBF全长1 053 bp,包含1个长度为684 bp的开放读码框(open reading frame,ORF)和1个poly (A)尾巴,5'非翻译区长57 bp,3'非翻译区长315 bp。其ORF编码1个含227个氨基酸的蛋白质,ProtParam预测ChCBF所编码蛋白的分子量为25.3 ku,理论等电点(pI)为5.41。

|
图 2 平榛ChCBF基因的PCR扩增电泳 Figure 2 Agrose gel electrophoresis analysis of ChCBF gene fragments in Corylus heterophylla M: DNA标准分子质量DL2000.1.ChCBF 3'RACE扩增产物; 2.ChCBF 5'RACE扩增产物; 3.ChCBF cDNA全长的电泳检测结果。 M: DNA marker DL2000.1.Amplification product of 3'RACE; 2.Amplification product of 5'RACE; 3.Electrophoresis result of ChCBF full-length cDNA. |
ChCBF基因推导的氨基酸序列与其他物种的AP2/EREBP蛋白的比对分析表明: ChCBF蛋白中除了存在预测的AP2/EREBP结构域外,在AP2 /EREBP结构域的前面还含有一段碱性氨基酸区域—RRAGRKKFK,被认为是在CBF/DREB1类蛋白中起核定位信号(NLS)作用的区域(Dubouzet et al., 2003),而在该结构域的后面还含有1个类似于典型DREB1/CBF基序的四氨基酸序列DASW(Jaglo et al., 2001)。另外,ChCBF的AP2/EREBP结构域中含有保守的氨基酸残基V14,据报道这个氨基酸残基在DREB亚族中是相对保守的(Medina et al., 1999)。
2.2 ChCBF编码氨基酸区段的同源性分析及系统进化发育为对ChCBF与其他物种CBF进行同源性分析,利用DNAMAN软件对包括ChCBF在内的其他物种的CBF蛋白氨基酸序列进行了多重比对。结果发现:平榛CBF与已知其他植物的CBF蛋白氨基酸序列的同源性不是很高,其中与芸香科(Rutaceae)柑橘(Citrus trifoliata)的亲缘关系较近,相似性仅为58%,其次是蔷薇科(Rosaceae)、茄科(Solanaceae)等植物,与拟南芥的相似性更低; 但如果只比对保守结构域及特征序列则同源性会相对高一些(图 3)。二级结构预测显示AP2 DNA结合域中含有1个参与同其他转录因子及DNA间相互作用的α螺旋,α螺旋结构域被认为在低温诱导下使得磷脂双分子层向内弯曲,来抵抗低温引起细胞脱水造成的膜损伤。DNA结合区域内还有3个与DNA大沟内碱基对互作对识别各类顺式作用元件起关键作用的折叠(Allen et al., 1998)。更有趣的是,19位氨基酸E(谷氨酸)突变为K(赖氨酸),在垂枝桦(Betula pendula) BpCBF3中也发现了这种突变现象(Welling et al., 2008)。

|
图 3 平榛与其他植物的AP2保守结构域和侧翼CBF特征序列的多重比对分析 Figure 3 Alignment of AP2 and flanking CBF signature sequences of Corylus heterophylla and other plants CBF transcription factors Ct:柑橘Citrus trifoliata (ABH08746); Md:苹果Malus domestica (ADE41100); Pm:梅Prunus mume(ADF43033);Lh:番茄Lycopersicon hirsutum(ACB45078); At:拟南芥Arabidopsis thaliana(AtCBF1,AAV80413;AtCBF2,AAV80415; AtCBF3,AAV80414).下同。The same below. 方框处表示AP2/EREBP DNA结合位点; 侧翼CBF特征序列用实线表示; 保守的氨基酸残基V14和突变的氨基酸位点K19用箭头表示。AP2/EREBP domain are boxed,and the flanking CBF signature sequences is marked with a line.The 14th (V) and 19th (K) amino acids of AP2/EREBP domain are arrowed。 |
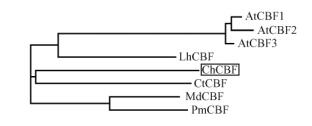
在多重比对的基础上,为进一步了解ChCBF与其他植物CBF之间的进化关系,用上述8个CBF的氨基酸序列构建了系统进化树(图 4),从图中不难发现CBF在拟南芥中是以基因家族形式存在,本文得到的平榛ChCBF和AtCBF3关系较近。结果(图 4)还表明: ChCBF同芸香科柑橘(CtCBF,ABH08746)首先组成1个分支,蔷薇科的苹果(MdCBF,ADE41100)、梅(PmCBF,ADF43033)组成1个分支,1年生草本植物拟南芥AtCBF1(AAV80413),AtCBF2 (AAV80415),AtCBF3(AAV80414)和番茄(LhCBF,ACB45078)聚在一起位于另一个分支中。ChCBF的进化基本符合植物分类学分类特征,并具有明显的种属特性。
|
图 4 平榛ChCBF与其他物种CBF保守结构域的氨基酸序列系统进化树 Figure 4 Phylogenetic tree of ChCBF in Corylus heterophylla and CBF proteins from other species |
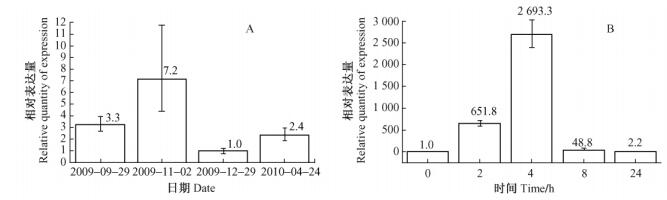
以Actin为内参,对平榛ChCBF基因自然越冬条件4个时间点在花芽中的表达和4 ℃低温胁迫条件下(0,2,4,8,24 h)在叶片中的表达模式进行了初步的研究。结果表明:在自然条件下进入冷适应期后花芽ChCBF基因表达量快速的上升,寒冬时期反而表达减弱,脱除冷适应时期ChCBF表达又上升(图 5A); 4 ℃低温胁迫处理后平榛叶片ChCBF基因表现快速的上调表达,mRNA迅速积累并在胁迫处理4 h时达到最大值,是对照的2 500多倍(图 5B)。
|
图 5 平榛叶片在冷适应过程4个不同时期(A)和4℃低温处理不同时间(B) CBF的荧光定量PCR分析 Figure 5 RT-PCR analysis of total RNA isolated from floral bud at four different stages(A) and treated leaves at different time points (0, 2, 4, 8, and 24 h) (B) Actin作为内参,试验重复4次。The Actin gene was used as the control for the normalization of RNA loading amount in RT-PCR reaction.The experiment was repeated four times.样品采集日期The date of samples collecting: 2009-09-29,2009-11-02,2009-12-29,2010-04-24,respectively. |
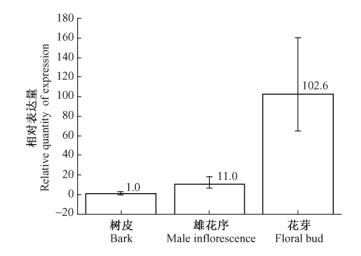
分别以平榛Actin基因为内参照,采用荧光定量PCR的方法对平榛不同组织中ChCBF的表达进行检测,结果(图 6)表明: ChCBF在花芽中的表达量最高,其次为雄花序,树皮中最低。因此,尽管在各组织中均检测到了ChCBF的转录本,但表达量的差异悬殊说明其表达具有一定的组织特异性。花芽作为木本植物感受低温的敏感部位,在检测的3个不同器官中花芽中的表达量最高,是最低表达部位树皮的100多倍,表明ChCBF在平榛冬季花芽应对外界低温过程中有贡献,推测ChCBF可能在转录水平上在平榛花芽越冬过程中起调控作用。
|
图 6 ChCBF在平榛不同组织的表达 Figure 6 ChCBF expression in different tissues of Corylus heterophylla |
本研究成功分离了平榛ChCBF基因,并对其时空表达特性进行了分析,转录因子通过启动下游的功能基因的表达来发挥作用,一般来说转录因子的表达量相对较低。采用qRT-PCR分析CBF基因在平榛花芽不同冷适应时期的表达模式,结果表明:自然条件下CBF基因的表达丰度出现在冷适应时期(CA),寒冬时期基因已经下调表达,可能的原因是,处于寒冬时期外界温度已经降到冰点以下,植物体内本身的酶类代谢被抑制或者细胞外结冰造成细胞内大量渗调物质的形成从而阻滞了大部分细胞学功能(Ameglio et al., 2001); 脱除冷适应时期CBF转录水平反而又呈现上升的趋势,这可能是植物应对春天的气温回升做出的响应,这和CBF基因的表达随着温度变化而波动的特点相一致。
自然条件下植物的适应性休眠包括了感应低温和短日照2个主要因子,为探讨平榛CBF的表达与低温和短日照的关系,利用人工气候室进行模拟低温胁迫(4 ℃)处理平榛幼苗。结果表明:在胁迫处理4 h时CBF基因的表达达到最大值,说明ChCBF基因受低温信号的调节,并可能在植物体适应寒冷的过程中有着重要作用,尤其在逆境初期,冷适应阶段CBF的早期上调表达可以启动下游功能基因的表达,从而为抗零下冻温做准备,这与杨树CBF5的研究结果(周洲等,2010)相一致。
本研究检测的平榛3个不同组织中花芽中的表达量最高,是最低表达部位树皮的100多倍,表明ChCBF的空间表达具有特异性,可能是调控花芽越冬过程的重要基因。很多研究表明,CBF基因过量表达或者异源表达能增加下游功能基因的表达,导致代谢物(包括抗氧化物质和渗调物质等)的增加从而对提高植物的抗寒性发挥重要作用(Gilmour et al., 1998; 严海燕等,2004; 金建凤等,2005)。ChCBF下游的调节子将成为下一步研究的重点,这对于揭示花芽受冻害的分子机制,并为进一步开发抗寒分子标记进行抗寒为目标的分子育种提供帮助。
金建凤, 高强, 陈勇, 等. 2005. 转移拟南芥CBF1基因引起水稻植株脯氨酸含量提高[J]. 细胞生物学杂志, 27(1): 73-76. |
严海燕, SteponkusP L. 2004. CBF3基因过量表达的拟南芥细胞质膜组分的变化[J]. 武汉植物学研究, 22(6): 529-533. |
周洲, 李永丽. 2010. 毛白杨转录因子PtCBF5的表达模式分析[J]. 林业科学, 46(4): 58-63. DOI:10.11707/j.1001-7488.20100409 |
Allen M D, Yamasaki K, Ohme-Takagi M, et al. 1998. A novel mode of DNA recognition by a β-sheet revealed by the solution structure of the GCC-box binding domain in complex with DNA[J]. EMBO J, 17(18): 5484-5496. DOI:10.1093/emboj/17.18.5484 |
Ameglio T, Ewers F W, Cochard H, et al. 2001. Winter stem xylem pressure in walnut trees: effects of carbohydrates, cooling and freezing[J]. Tree Physiol, 21(6): 387-394. DOI:10.1093/treephys/21.6.387 |
Behnam B, Kikuchi A, Celebi-Toprak F, et al. 2007. Arabidopsis rd29A::DREB1A enhances freezing tolerance in transgenic potato[J]. Plant Cell Rep, 26(8): 1275-1282. DOI:10.1007/s00299-007-0360-5 |
Benedict C, Skinner J S, Meng R, et al. 2006. The CBF1-dependent low temperature signalling pathway, regulon and increase in freeze tolerance are conserved in Populus spp[J]. Plant Cell Environ, 29(7): 1259-1272. DOI:10.1111/pce.2006.29.issue-7 |
Champ K I, Febres V J, Moore B D. 2007. The role of CBF transcriptional activators in two Citrus species (Poncirus and Citrus) with contrasting levels of freezing tolerance[J]. Physiologia Plantarum, 129(3): 529-541. DOI:10.1111/ppl.2007.129.issue-3 |
Chang S, Puryear J, Cairney J. 1993. A simple and efficient method for isolating RNA from pine trees[J]. Plant Molecular Biol Reporter, 11(2): 113. DOI:10.1007/BF02670468 |
Dubouzet J G, Sakuma Y, Ito Y, et al. 2003. OsDREB genes in rice, Oryza sativa L., encode transcription activators that function in drought-, high-salt-and cold-responsive gene expression[J]. Plant Journal, 33(4): 751-763. DOI:10.1046/j.1365-313X.2003.01661.x |
Gilmour S J, Zarka D G, Stockinger E J, et al. 1998. Low temperature regulation of the Arabidopsis CBF family of AP2 transcriptional activators as an early step in cold-induced COR gene expression[J]. Plant Journal, 16(4): 433-442. DOI:10.1046/j.1365-313x.1998.00310.x |
Guo Y, Xiong L, Ishitani M, et al. 2002. An Arabidopsis mutation in translation elongation factor 2 causes superinduction of CBF/DREB1 transcription factor genes but blocks the induction of their downstream targets under low temperatures[J]. Proc Natl Acad Sci, 99(11): 7786-7791. DOI:10.1073/pnas.112040099 |
Guy C L, Niemi K L, Brambl R. 1985. Altered gene expression during cold acclimation of spinach[J]. Proc Natl Acad Sci, 82(11): 3673-3677. DOI:10.1073/pnas.82.11.3673 |
Hong Bo, Ma Chao, Yang Yingjie, et al. 2009. Over-expression of AtDREB1A in chrysanthemum enhances tolerance to heat stress[J]. Plant Mol Biol, 70(3): 231-240. DOI:10.1007/s11103-009-9468-z |
Hsieh T H, Lee J T, Charng Y Y, et al. 2002. Tomato plants ectopically expressing Arabidopsis CBF1 show enhanced resistance to water deficit stress[J]. Plant Physiol, 130(2): 618-626. DOI:10.1104/pp.006783 |
Jaglo K R, Kleff S, Amundsen K L, et al. 2001. Components of the Arabidopsis C-repeat/dehydration-responsive element binding factor cold-response pathway are conserved in Brassica napus and other plant species[J]. Plant Physiol, 127(3): 910-917. DOI:10.1104/pp.010548 |
Liu Q, Kasuga M, Sakuma Y, et al. 1998. Two transcription factors, DREB1 and DREB2, with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought-and low-temperature-responsive gene expression, respectively, in Arabidopsis[J]. Plant Cell, 10(8): 1391-1406. DOI:10.1105/tpc.10.8.1391 |
Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
Medina J, Bargues M, Terol J, et al. 1999. The Arabidopsis CBF gene family is composed of three genes encoding AP2 domain-containing proteins whose expression is regulated by low temperature but not by abscisic acid or dehydration[J]. Plant Physiol, 119(2): 463-470. DOI:10.1104/pp.119.2.463 |
Naik D, Dhanaraj A L, Arora R, et al. 2007. Identification of coldresponsive genes in blueberry (Vaccinium corymbosum L.) using a hybridization approach[J]. Plant Science, 173(2): 213-222. DOI:10.1016/j.plantsci.2007.05.003 |
Owens C L, Thomashow M F, Hancock J F, et al. 2002. CBF orthologs in sour cherry and strawberry and the heterologous expression of CBF1 in strawberry[J]. J Amer Soc Hort Sci, 127(4): 489-494. |
Rinne P, Welling A, Kaikuranta P. 1998. Onset of freezing tolerance in birch (Betula pubescens Ehrh.) involves LEA proteins and osmoregulation and is impaired in an ABA-deficient genotype[J]. Plant Cell and Environment, 21(6): 601-611. DOI:10.1046/j.1365-3040.1998.00306.x |
Welling A, Palva E T. 2008. Involvement of CBF transcription factors in winter hardiness in Birch[J]. Plant Physiology, 147(3): 1199-1211. DOI:10.1104/pp.108.117812 |
Weiser C J. 1970. Cold resistance and injury in woody plants[J]. Science, 169(3952): 1269-1278. DOI:10.1126/science.169.3952.1269 |
Xiao H, Siddiqua M, Braybrook S, et al. 2006. Three grape CBF/DREB1 genes respond to low temperature, drought and abscisic acid[J]. Plant Cell and Environment, 29(7): 1410-1421. DOI:10.1111/pce.2006.29.issue-7 |
Yang J S, Wang R, Meng J J, et al. 2010. Overexpression of Arabidopsis CBF1 gene in transgenic tobacco alleviates photoinhibition of PSⅡ and PS Ⅰ during chilling stress under low irradiance[J]. Journal of Plant Physiology, 167(7): 534-539. DOI:10.1016/j.jplph.2009.11.005 |
 2012, Vol. 48
2012, Vol. 48


