文章信息
- 何龙喜, 吴小芹, 吉静, 俞禄珍
- He Longxi, Wu Xiaoqin, Ji Jing, Yu Luzhen
- 不同松树感染松材线虫后NO和核酸酶变化与其抗病性的关系
- Role of Nitric Oxide and Nucleases in Different Pine Species Inoculated with a Nematode(Bursaphelenchus xylophilus) in Their Resistance to the Infection
- 林业科学, 2012, 48(1): 109-114.
- Scientia Silvae Sinicae, 2012, 48(1): 109-114.
-
文章历史
- 收稿日期:2010-07-25
- 修回日期:2010-12-02
-
作者相关文章
松材线虫病(Bursaphelenchus xylophilus)是由松材线虫引起的松树萎蔫死亡的一种传染性病害, 该病害已在中国大部分省份发生流行, 给森林生态系统和国民经济造成了重大损失。由于松材线虫的致病机制以及松树的抗病机制尚未明确, 这给松材线虫病的防治带来了困难。国内外学者在松材线虫病的致病机制、组织病理学和病理生理学等方面做了大量研究(刘军民等, 1995; 金钢, 2007; 厉艳, 2008), 很多研究表明松树与松材线虫互作早期某些次生代谢物质的快速变化与松树的抗病性有直接关系, 有些可诱导松树的防卫反应(Suga et al., 1993), 并与松材线虫病的发展趋势一致。近年来, 大量研究表明一氧化氮(NO)是调控植物抗感病信号的重要信号分子(Gouvea et al., 1997)。许多报道证实NO可参与大豆(Glycine max)-假单胞菌(Pseudomonas sp.)、烟草-TMV和拟南芥(Arabidopsis thaliana)-丁香假单胞菌(Pseudomonas syringae)的抗病信号转导(Wendehenne et al., 2004)。此外, NO偶联于cGMP, 促进cADP核糖(cADP-ribose, cADPR)的合成, 后者是有效的钙离子激活剂, 偶联于胞内钙通道, 激活第2信使钙离子的释放, 诱导寄主细胞过敏性反应(Clark et al., 2000)。NO还能和活性氧互作共同诱导细胞过敏性反应和细胞膜质过氧化(Durner et al., 1998), 这些均是植物抗病反应中的关键性生理生化过程。刘劼等(2008)研究认为超氧自由基可能在松树与松材线虫互作早期具有重要作用。同时, 有关植物细胞程序性死亡(PCD)的研究发现植物PCD发生与多种核酸酶相关。一些研究结果表明核酸酶可能参与植物细胞的分化、过敏性反应、胁迫反应、抗逆反应和叶片老化等过程, 并在其中起着重要作用(Neill et al., 2003; Mittler et al., 1997)。但有关NO和核酸酶在松材线虫病中的作用研究鲜见报道。前人研究表明不同松树品种对松材线虫的抗性与植物抗病反应(细胞过敏性反应和膜脂过氧化)有密切关系(陈玉惠等, 2002)。大量研究表明:火炬松(Pinus taeda)对松材线虫表现为高度抗病, 马尾松(P.massoniana)中度感病, 黑松(P.thunbergii)高度感病(杨宝君等, 1993)。不同抗性松树与松材线虫互作中NO和核酸酶的变化规律是否一致, 其变化是否与松树的抗性存在一定的相关性至今未见相关研究报道。本研究以火炬松、马尾松和黑松为研究对象, 比较不同抗性松树接种松材线虫后内源NO和核酸酶变化的差异, 以期弄清NO和核酸酶在该互作体系中的功能作用, 为阐明松材线虫病的致病机制和松树的抗病机制提供一定的参考依据。
1 材料与方法 1.1 供试松材线虫、松苗及接种松材线虫17#虫株采自江苏连云港黑松。采用贝尔曼漏斗法分离纯培养保存的松材线虫, 将获得的线虫用0.1%硫酸链霉素表面消毒5 min, 再用无菌水洗涤3次后, 移置长满灰葡萄孢(Botrytis cinerea)的PDA平板上。25 ℃培养箱中培养7天, 用于接种试验。
供试松苗为3年生、生长较一致、健康的马尾松、黑松和火炬松盆栽苗(采自安徽), 平均苗高和地径分别约为30 cm和2 cm。采用人工皮接法(方中达, 1998)接虫, 接种点为苗高20 cm处松茎。供试松材线虫接种量均为每毫升6 000条, 接种后棉球保湿12 h, 然后置于30 ℃、16 h·d-1光照条件的温室中生长。每种松树接种35株。以割伤接种等量无菌水(CK1)以及未做任何处理的健康松苗(CK2)作为对照。每种松树每处理接种30株。每天观察松苗的发病情况。
1.2 不同松树感染松材线虫后内源NO自由基测定 1.2.1 松苗松针样品制备各处理松苗于接种后4, 12, 24, 48, 72, 96和120 h分别取各处理松苗接种部位以上1 cm处针叶, 剪碎、混匀后各称取1.2 g。用液氮研磨, 然后加入8.4 mL预冷的磷酸缓冲液(PBS)(pH7.4, 10 mmol·L-1 Tris-HCl, 0.1 mmol·L-1 EDTA-Na2, 0.01mol·L-1蔗糖, 0.8% NaCl)匀浆, 4 ℃冷冻离心(12 000 r·min-1, 15 min), 取上清液备用。每处理重复3次。
1.2.2 NO自由基的测定NO检测采用硝酸还原酶法, 采用购自南京建成生物工程研究所(批号20090627及20090704)一氧化氮检测(硝酸还原酶法)试剂盒对黑松体内的NO含量进行检测。NO测定按试剂盒说明书操作。
1.3 不同松树感染松材线虫后核酸酶活性测定 1.3.1 松苗松针样品制备分别取各处理松苗接种部位以上1 cm处针叶1 g放入先用液氮冷却好的干净研钵里研磨, 然后加入2.5 mL冷却的50 mmol·L-1的Tris-Cl缓冲液(pH 7.5, 150 mmol·L-1的NaCl, 1 mmol·L-1 N-乙基顺丁烯二酰亚胺), 4 ℃冷冻离心(14 000 r·min-1, 15 min)。取上清液做为酶提取液, 上清液用液氮保存或在-80 ℃下保存待用。
1.3.2 单链核酸酶和双链核酸酶活性测定核酸酶活性测定参照Wood等(1998)方法。单链DNA由小牛胸腺DNA水溶液(1 mg·mL-1)通过煮沸10 min和冰浴10 min制成。反应体系由143 μL单链DNA或双链DNA(Sigma), 69 μL BSA (1 mg·mL-1), 69 μL 1 mol·L-1 Tris-Cl pH 7.4及294 μL酶提缓冲液组成。用115 μL酶提取液混匀启动反应, 并迅速分成各为300 μL的2份。一份用1 mL 3.4%(V/V)高氯酸混匀并在冰上放置10 min, 作为0时间点反应液; 另一份放在31 ℃下反应15 min, 然后加入1 mL 3.4%高氯酸置于冰上10 min。2份反应液在4 ℃下冷冻离心(12 000 r·min-1, 10 min)后取上清液, 在紫外分光光度仪(Helios Gamma Thermo Spectronic Great Britain)上测定反应0时间和15 min后的OD260值, 得到15 min内OD260的下降值做为核酸酶的变化值。每处理重复3次。
1.4 数据处理与分析将所获得的各数据采用SPSS 13.0在显著水平P = 0.05下进行统计学分析。
2 结果与分析 2.1 3种松树与松材线虫互作中内源NO含量的差异经测定, 3种松树健康状态下(CK2)针叶内NO平均含量为:火炬松2 130.30 μmol·g-1、马尾松2 157.77 μmol·g-1、黑松2 133.57 μmol·g-1, 三者之间无显著差异(图 1a)。

|
图 1 3种松树接种松材线虫后松针叶内NO含量 Figure 1 The content of NO in the leaf of three pines species inoculated with B.xylophilus a.割伤直接无菌水处理(CK1), 未做任何处理(CK2) Inoculated with distilled water(CK1), No treatment(CK2); b.接种松材线虫Inoculated with nematodes; c.接种后较割伤处理(CK1)升高幅度Increasement of NO content by the inoculation of nematodes comparing to CK1. |
3种松树在割伤只接无菌水(CK1)的处理中, 火炬松和马尾松针叶内NO含量在4 h时较其健康状态值都有所升高, 火炬松升高幅度比马尾松大, 而黑松基本与其健康状态值持平; 在24 h时, 3种松树CK1的NO含量迅速下降, 都低于其健康状态; 48 h时黑松和马尾松CK1处理的与其健康状态基本持平, 而火炬松CK1处理的NO含量较其健康状态有所升高; 72~120 h时黑松和马尾松的CK1处理有所升高(高于其健康状态), 但变化幅度较小, 而火炬松CK1处理的有所下降, 低于其健康状态(图 1a)。
3种松树感染松材线虫后4~24 h, 黑松针叶内NO含量先升后降, 火炬松和马尾松的一直处于下降趋势; 在12 h时3种松树体内的NO含量为黑松>马尾松>火炬松且差异较明显, 并在24 h达到显著差异。与其割伤仅接无菌水的处理(CK1)相比, 黑松和和马尾松针叶内NO含量都明显高于其CK1, 而火炬松低于其CK1。48 h时, 3种松树针叶体内NO含量都开始升高, 黑松较其CK1升高67%, 马尾松较其CK1升高16%, 火炬松较其CK1升高9%;此时3种松树体内的NO含量差异显著, 为黑松>马尾松>火炬松, 但这种差异在48 h后不明显。可见松树受侵后的4~48 h阶段可能是松材线虫病发生发展的一个关键时期。48 h后, 3种松树针叶内NO含量继续升高且明显高于其CK1, 其中火炬松在72 h达到其峰值(高于其CK1约66.4%); 黑松和马尾松在96 h达到峰值(分别高于其CK1约17%和39.1%), 较火炬松晚24 h(图 1b, c)。由此可见, 在接种后期(72~120 h)火炬松NO峰值比黑松和马尾松出现早, 且3种松树较其CK1升高幅度为火炬松>马尾松>黑松。这说明在接种后期松树针叶内NO峰值出现的先后及较割伤只接无菌水处理上升幅度的大小与松树的抗性存在正相关。
2.2 不同松树与松材线虫互作中单链核酸酶的变化黑松、马尾松和火炬松在健康状态下针叶内单链核酸酶的平均活性无显著性差异(图 2a)。割伤处理(CK1)后3种松树针叶内的单链核酸酶变化在4~12 h存在差异:4 h时单链核酸酶活性火炬松>马尾松>黑松; 12 h时火炬松的单链核酸酶活性下降, 而黑松和马尾松的处理则有所升高, 基本处于同一水平, 并高于火炬松; 在12 h后3种松树割伤处理的单链核酸酶活性无显著差异, 但24 h后火炬松一直稍高于马尾松和黑松(图 2a)。这说明火炬松对伤口的反应比马尾松和黑松更敏感。
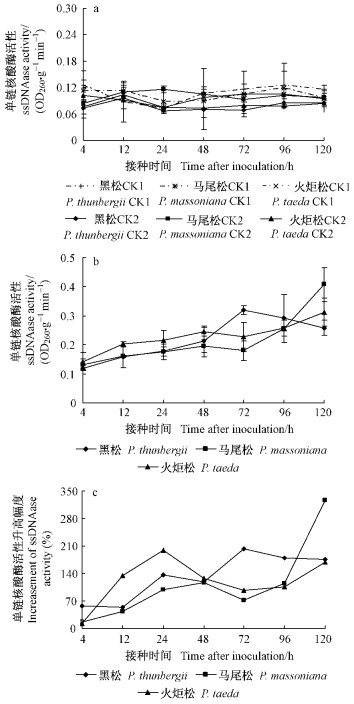
|
图 2 3种松树接种松材线虫后针叶内单链核酸酶活性 Figure 2 The activity of ssDNase activity in the leaf of three pines species inoculated with B.xylophilus |
3种松树接种松材线虫后, 4 h时针叶内单链核酸酶活性大小依次为:火炬松、马尾松、黑松, 与其各自割伤处理(CK1)相比, 黑松升高50%, 马尾松升高15%, 火炬松升高13%。12~48 h, 火炬松针叶内单链核酸酶活性的上升幅度比黑松和马尾松的都高, 48 h时3种松树体内单链核酸酶的活性大小依次为:火炬松、马尾松、黑松; 48~72 h, 黑松的单链核酸酶活性迅速升高并达到峰值(较仅割伤处理的高205%), 而马尾松和火炬松的呈下降趋势。120 h时, 火炬松和马尾松针叶内的单链核酸酶迅速升高, 而黑松则迅速下降(见图 2b, c)。由此表明, 3种松树接种松材线虫后, 其针叶内单链核酸酶的变化与松树的抗病性存在一定的相关性, 尤其在24 h时表现最为明显。
2.3 不同松树感染松材线虫后双链核酸酶的变化黑松、马尾松和火炬松健康状态下针叶内双链核酸酶活性变化幅度较小, 其平均值无显著性差异(图 3a)。3种松树割伤只接无菌水的处理双链核酸酶活性在12 h后都有所升高; 至24 h为黑松>火炬松>马尾松, 随后黑松迅速下降, 火炬松则有所升高; 48 h时为火炬松>马尾松>黑松; 48 h后3者无显著差异(图 3a)。
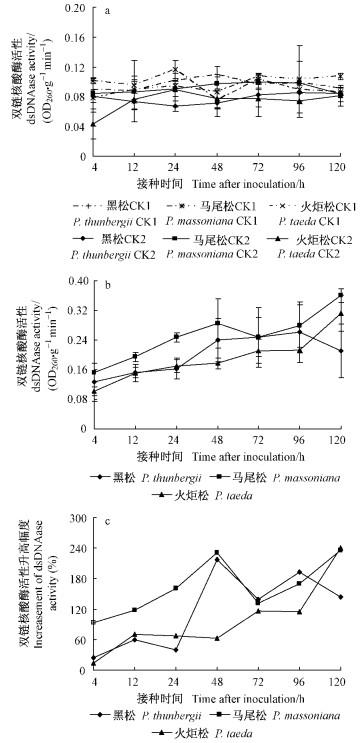
|
图 3 3种松树接种松材线虫后针叶内双链核酸酶活性 Figure 3 The activity of dsDNase in the leaf of three pines species inoculated with B.xylophilus |
3种松树感染松材线虫后, 其针叶内双链核酸酶活性变化趋势存在明显差异。4 h时, 针叶内双链核酸酶的活性大小依次为:马尾松、黑松、火炬松, 较其割伤处理(CK1)升高幅度大小亦为马尾松>黑松>火炬松。接种4 h后, 3种松树针叶内双链核酸活性迅速上升, 其上升趋势火炬松>马尾松>黑松, 接种12 h时火炬松针叶内双链核酸活性接近黑松; 这说明接种松材线虫后4~12 h, 火炬松体内双链核酸酶活性上升速度比黑松快。接种24 h后, 火炬松针叶内双链核酸酶的变化幅度平缓, 黑松和马尾松则迅速升高, 48 h时活性大小依次为:马尾松、黑松、火炬松, 此时黑松较其CK1升高幅度接近马尾松, 且明显高于火炬松。接种48 h后, 火炬松体内双链核酸酶活性迅速上升, 黑松变化平缓, 马尾松则迅速下降, 在72 h时马尾松体内双链核酸酶活性基本与黑松持平, 且均高于火炬松, 此时3种松树较割伤升高的幅度无显著差异。接种后96~120 h, 火炬松和马尾松针叶内双链核酸酶的活性迅速升高, 而黑松则迅速下降(图 3b, c)。
3 结论与讨论NO在植物中具有广泛的调节功能, 特别是在植物-病原菌互作过程引发的与抗病相关的细胞死亡和基因表达中起关键作用。NO对植物体的作用具有双重性:一方面, 可通过与有效分子反应而直接起作用或通过改变细胞氧化还原电位差而间接起作用, 参与植物的生长发育和对环境适应的信号传导过程, 是信号网络系统的关键物质(王淼等, 2005)。一方面, 高浓度NO与O2·相互作用生成大量的过氧亚硝酸阴离子, 后者经质子化形成具有强氧化性的过氧亚硝酸, 破坏生物大分子的结构与功能(Crawford, 2006), 这种作用因其浓度、作用部位及细胞的生理条件不同而异。
在3种松树与松材线虫互作过程中, 其体内NO含量在12 h时黑松>马尾松>火炬松, 且在24 ~ 48 h时达到显著差异。此时松树体内松材线虫的数量多少依次为:黑松、马尾松、火炬松(何龙喜, 2010)。吴小芹等(2008)研究发现普通黑松在接种松材线虫4 h后其皮层就发现大量线虫, 而在抗性黑松的皮层则很少线虫。有研究表明适量的NO可以抑制过氧化氢酶(CAT)和过氧化物酶(POD)的活性, 从而抑制膜脂的过氧化; 而高浓度的NO可与O2·形成ONOO-, 从而损伤蛋白质、脂、RNA和DNA(Prats et al., 2005)。由上可推测, 黑松体内较多松材线虫的侵入在早期诱发产生了较高浓度的NO, 形成具有强氧化性的过氧亚硝酸, 对细胞组织造成伤害, 这种伤害为松材线虫迁移提供了帮助。3种松树针叶内NO含量在接种48 h后的增加幅度大小依次为:火炬松、马尾松、黑松, 且火炬松NO含量上升时间较黑松和马尾松早(但其绝对值仍为黑松>马尾松>火炬松, 且后期同步跟踪观察表明, 黑松最早表现出松材线虫病症状, 马尾松次之, 火炬松最晚(何龙喜, 2010)。Guo等(2004)研究表明NO第2次峰值突增幅度大小和突增时间迟早与小麦(Triticum aestivum)的抗性密切相关。这说明随着松材线虫在火炬松体内增殖, 其NO含量迅速提高以达到合适的浓度来有效传递抗病反应信号, 从而延缓松材线虫在其体内的扩散速度。黑松和马尾松由于松材线虫大量进入树体内, 并大量增殖, NO含量在48 h后仍一直维持在高水平, 对细胞造成了严重伤害而加速了松树的死亡。由此可见, 火炬松、马尾松和黑松针叶内NO含量在接种后期升高幅度的大小及开始升高时间的早晚与其对松材线虫的抗性存在一定的相关性。
大量研究表明松树割伤后泌脂速度大小依次为火炬松、马尾松、黑松(束庆龙等, 2006)。在本研究割伤只接无菌水的处理中, 火炬松和马尾松针叶内NO在4 h时较其健康状态的含量均有所升高, 且火炬松升高幅度比马尾松大, 而黑松基本与其健康状态值持平。可见抗性强的松树对割伤的反应更敏感, NO含量在割伤早期的迅速升高可能与其诱导早期的防御反应有关。这似乎可推测, 在自然界中火炬松在天牛取食制造伤口时, 可能由于其松脂分泌迅速, 使得天牛体上携带的松材线虫不易进入松树体内, 而黑松和马尾松则可能由于未能迅速分泌大量的松脂而易受到松材线虫的侵害。
近年研究发现:核酸酶在植物细胞分化, 寄主对病原菌的过敏性反应, 寄主对环境胁迫的反应和叶片衰老等中具有重要的作用。在烟草过敏性反应中, 核酸酶NUCⅠ、核酸酶Ⅱ和核酸酶Ⅲ被诱导, 并且与烟草细胞死亡同步(Ryerson et al., 1996)。Wood等(1998)在大麦(Hordeum ulgare)叶片衰老的研究中发现黑夜能诱导核酸酶活性升高, 并导致叶片衰老, 并指出不同的植物可能存在对核酸酶不同的调控机制。本研究表明黑松、马尾松和火炬松接种松材线虫后, 其针叶内单链核酸酶活性在4 ~48 h时为火炬松>马尾松>黑松, 而双链核酸酶的活性在4~96 h火炬松却一直低于马尾松和黑松, 这表明不同松树体内单链或双链核酸酶的活性变化与其抗病性有关。葛秀春(2003)在水稻(Oryza sativa)和白叶枯细菌(Xanthomonas oryzae pv. oryzae)的互作研究中发现, 水稻在HR中单链核酸酶和双链核酸酶的活性受活性氧和NO的调控。3种松树的双链核酸酶和单链核酸酶活性变化与NO动态变化存在一定的相关性, 但不明显。在松材线虫病中核酸酶活性的变化是否还受活性氧的调控, 还需进一步研究。
陈玉惠, 叶建仁. 2002. 松材线虫对黑松、湿地松幼苗活性氧代谢的影响[J]. 南京林业大学学报, 26(4): 19-22. |
方中达. 1998. 植病研究方法[M]. 北京: 中国农业出版社.
|
葛秀春. 2003. 水稻与白叶枯病菌互作中活性氧与过敏性细胞死亡相关因子的研究. 浙江: 浙江大学博士学位论文. http://www.cnki.com.cn/Article/CJFDTOTAL-SHWU200503035.htm
|
何龙喜. 2010. 松树与松材线虫互作中的活性氧和氮自由基代谢研究. 南京林业大学森林资源与环境学院硕士学位论文. http://www.cnki.com.cn/Article/CJFDTOTAL-NJLY201102004.htm
|
金钢, 叶建仁. 2007. 不同致病性线虫在黑松体内的扩展速度与致病性[J]. 南京林业大学学报:自然科学版, 31(1): 5-9. |
厉艳, 叶建仁. 2008. 松材线虫病早期寄主薄壁细胞的死亡方式[J]. 南京林业大学学报:自然科学版, 44(4): 94-99. |
刘劼, 吴小芹, 何龙喜. 2008. 黑松与松材线虫和拟松材线虫互作早期超氧阴离子研究[J]. 南京林业大学:自然科学版, 32(6): 24-28. |
刘军民, 冯志新. 1995. 松材线虫病组织病理学研究[J]. 植物病理学报, 25(2): 171-174. |
束庆龙, 汤坚, 黄长春, 等. 2006. 松树泌脂速度对松材线虫病的抗性影响[J]. 安徽农业大学学报, 33(1): 1-4. |
王淼, 李秋荣, 付士磊, 等. 2005. 外源一氧化氮对干旱胁迫下杨树光合作用的影响[J]. 应用生态学报, 16(2): 218-222. |
吴小芹, 张艺, 陈薇诗, 等. 2008. 黑松13个抗病家系对松材线虫的抗性反应及组织病理学观察[J]. 植物病理学报, 38(1): 44-50. |
杨宝君, 胡凯基, 王秋丽, 等. 1993. 松树对松材线虫的抗性研究[J]. 林业科学研究, 6(3): 249-255. |
Clark D, Durner J, Navarre D A, et al. 2000. Nitric oxide inhibition of tobacco catalase and ascorbate peroxidase[J]. Mol Plant Microbe Interact, 13(12): 1380-1384. DOI:10.1094/MPMI.2000.13.12.1380 |
Crawford N M. 2006. Mechanisms for nitric oxide synthesis in plants[J]. J Exp Bot, 57: 471-478. DOI:10.1093/jxb/erj050 |
Durner J, Wendehenne D, Klessig D F. 1998. Defense gene induction in tobacco by nitric oxide, cyclic GMP and cyclic ADP ribose[J]. Proc Natl Acad Sci USA, 95(17): 10328-10333. DOI:10.1073/pnas.95.17.10328 |
Gouvea C M C P, Souza J F, Magalhacs A C N, et al. 1997. NOreleasing substance that induce growth elongation in maize root segments[J]. Plant Growth Regulation, 21(3): 193-187. |
Guo P, Cao Y, Li Z, et al. 2004. Role of an endogenous nitric oxide burst in the resistance of wheat to stripe rust[J]. Plant, Cell and Environment, 27: 473-477. DOI:10.1111/pce.2004.27.issue-4 |
Mittler R, Lam E. 1997. Characterization of nuclease activities and DNA fragmentation induced upon hypersensitive response cell death and mechanical stress[J]. Plant Mol Biol, 34(2): 209-221. DOI:10.1023/A:1005868402827 |
Neill S J, Desikan R, Hancock J T, et al. 2003. Nitric oxide signaling in plants[J]. New Phytol, 159(1): 11-35. DOI:10.1046/j.1469-8137.2003.00804.x |
Prats E, Murla J, Sanderson R, et al. Nitric oxide contributes both to papillabased resistance and the hypersensitive response in barley attacked by Blumeria graminis f.sp.hordei[J]. Molecular Plant Pathology, 6(1): 65-78. DOI:10.1111/mpp.2005.6.issue-1 |
Ryerson D E, Heath M C. 1996. Cleavage of nuclear DNA into oligonucleosomal fragments during cell death induced by fungal infection or by abiotic treatments[J]. Plant Cell, 8(3): 393-402. DOI:10.1105/tpc.8.3.393 |
Suga T, Ohm S, Munesada K, et al. 1993. Endogenous pine wood nematicidal substancesin pines Pinus.massoniana, P.strobus and P.palustris.[J]. Phytochemistry, 33(6): 1395-1401. DOI:10.1016/0031-9422(93)85098-C |
Wendehenne D, Durner J, Klessig D F, et al. 2004. Nitric oxide:a new player in plant signalling and defence responses[J]. Current Opinion in Plant Biology, 7(4): 449-455. DOI:10.1016/j.pbi.2004.04.002 |
Wood M, Power J B, Davey M R, et al. 1998. Factors affecting single strand-preferring nuclease activity during leaf aging and darkinduced senescence in barley(Hordeum ulgare L.).[J]. Plant Science, 131(2): 149-159. DOI:10.1016/S0168-9452(97)00253-7 |
 2012, Vol. 48
2012, Vol. 48

