文章信息
- 李晓娟, 骆有庆, 阎雄飞, 田桂芳, 年寅杰, 孙红
- Li Xiaojuan, Luo Youqing, Yan Xiongfei, Tian Guifang, Nian Yinjie, Sun Hong
- 光肩星天牛幼虫纤维素酶活性的变化趋势
- Cellulase in Larvae of Asian Longhorn Beetle Anoplophora glabripennis
- 林业科学, 2011, 47(11): 204-207.
- Scientia Silvae Sinicae, 2011, 47(11): 204-207.
-
文章历史
- 收稿日期:2010-04-18
- 修回日期:2010-09-04
-
作者相关文章
2. 安徽省林业科学研究院森林保护研究所 合肥 230031;
3. 榆林学院生命科学学院 榆林 719000;
4. 宁夏吴忠市林业局 吴忠 751100
2. Research Institute of Forest Conservation, Anhui Academy of Forestry Hefei 230031;
3. College of Life Science, Yulin University Yulin 719000;
4. Forest Bureau of Wuzhong of Ningxia Wuzhong 751100
光肩星天牛(Anoplophora glabripennis) (ALB, Asian longhorn beetle)属鞘翅目、天牛科、沟胫天牛亚科、星天牛属,是我国重要林木蛀干害虫(萧刚柔,1992)。中国东部光肩星天牛分布区位于100°—127°E、21°—43°N(阎俊杰,1985);该虫现已在美国伊利诺斯州的芝加哥市、纽约州的纽约市和长岛以及新泽西州,加拿大的多伦多和安大略建立低密度种群,奥地利、德国乃至法国亦有光肩星天牛的报道(Hajek,2007)。在我国,其主要寄主树种为杨(Populus)、柳(Salix)、榆(Ulmus)、槭(Acer)等(骆有庆等,1999)。在北美洲,光肩星天牛幼虫的寄生树种至少有12属18种(Morewood et al., 2005)。光肩星天牛幼虫蛀干危害,幼虫孵出后, 开始取食腐坏的韧皮部,2龄幼虫开始向旁侧取食健康树皮和木质部,3龄末或4龄幼虫在树皮下环食木质部表面,然后开始蛀入木质部危害;成虫羽化后还未性成熟,仍需补充营养9~15天,主要取食叶柄、叶片及小枝皮层(骆有庆等,1999;Smith et al., 2002;Keena,2002;Hajek et al., 2007)。
天牛危害树木,主要通过消化其中纤维素获得养分,而纤维素酶是其肠道内消化纤维素的重要消化酶类(索风梅等,2004)。研究光肩星天牛纤维素酶在其肠道内的分布,对阐明其消化生理、寻找防治新方法、开发利用纤维素酶的昆虫资源,乃至进一步明确光肩星天牛纤维素酶的来源,都具有重要的意义(殷幼平等,1996)。
有关天牛体内纤维素酶的研究,主要集中在对老熟幼虫的研究(殷幼平等,1996;Chen et al., 2000;索风梅等,2004),而对于不同龄期天牛幼虫体内纤维素酶的变化趋势并不明确,不利于今后基于纤维素酶抑制剂的生态防治方法的实施。
Geib等(2005)曾报道,取食人工饲料的光肩星天牛幼虫体内Cx酶和β-葡萄糖苷酶活性均有显著下降,是由于光肩星天牛幼虫以人工饲料为食,而人工饲料中的单糖含量比较高;但并没有与取食寄主植物的光肩星天牛幼虫作比较,取食寄主植物的幼虫体内纤维素酶活性的变化规律也不明确。所以光肩星天牛幼虫随着虫体的不断生长,其体内纤维素酶活性呈下降趋势,究竟是不是因为取食了人工饲料,尚无法定论。
鉴于此,本文选取寄主植物中不同龄期光肩星天牛幼虫,以及人工饲料喂养的不同日龄光肩星天牛幼虫为研究对象,以期明确自然生长与取食人工饲料2种食物条件下,光肩星天牛幼虫体内纤维素酶活性的变化趋势,为今后利用纤维素酶抑制剂防治光肩星天牛提供有力指导。
1 材料与方法 1.1 虫体来源1) 取食寄主植物幼虫来源 2008年10月在宁夏吴忠市砍伐合作杨(Populus simonii×Populus pyramidalis ‘Opera 8277’)虫害木,截成段,用劈木机劈开木段,获取不同龄期幼虫,解剖镜下测微尺测量头壳宽度,确定幼虫龄期大小。光肩星天牛幼虫头壳宽度及其对应的龄期见表 1(贺萍等,1992)。
|
|
2) 取食人工饲料幼虫来源 光肩星天牛卵的采集: 2009年9月在北京大兴区垡上村,以旱柳(Salix matsudana)上光肩星天牛刻槽为线索,挖取光肩星天牛卵粒。
饲料的配制:饲料的配制方法参考文献(贺萍等,1992;赵军等,1992a;1992b;Keena,2005)。
采集复叶槭(A. negundo)枝条,洗净,-70 ℃冷冻24 h,用植物粉碎机将其制成粉末。饲料各成分配比是:复叶槭粉末90 g,琼脂22.5 g,酵母粉10 g,山梨酸1.5 g,对羟基苯甲酸甲酯1.5 g,抗坏血酸1.5 g,蒸馏水520 mL。
加热琼脂直至完全溶解,再加其他组分,均匀搅拌,分装灭菌后备用。
幼虫的饲养:将光肩星天牛卵消毒,70%乙醇冲洗1次,1%甲醛冲洗3次,灭菌水冲洗4次;28 ℃恒温培养,待其孵化,在无菌条件下放入人工饲料中,每隔10天更换饲料,待饲养到实验所需各日龄后取出,检测其纤维素酶活性。
1.2 试剂来源羧甲基纤维素(CMC),sigma分装,北京鼎国生物技术有限责任公司生产;水杨素(Salicin),美国Alfa Aesar公司生产;3,5-二硝基水杨酸,北京笃信精细制剂厂生产;其他试剂均为分析纯。
1.3 纤维素酶液的制备将所取光肩星天牛幼虫称体质量后,-70 ℃冷冻杀死,用于纤维素酶活性检测。取天牛幼虫1头4 ℃解冻4 h,冰上解剖,取出肠道,立即分别放入盛有2 mL冰冷乙酸-乙酸钠(pH5.2,0.1 mol·L-1)缓冲液的灭菌研钵,加入0.5 g石英砂,在冰上研磨成匀浆,使其释放消化酶;将匀浆液于4 ℃离心20 min(12 000 r·min-1),上清液即为原酶液,分装后置于-30 ℃冰箱中保存备用。取食寄主植物各龄期以及取食人工饲料各日龄的幼虫,1头为1次处理,重复5次。
1.4 纤维素酶活性的测定原酶液中各纤维素酶组分活性的测定采用DNS法,Cx酶的测定用1%羧甲基纤维素(CMC)作底物,β-葡萄糖苷酶的测定用1%水杨素为底物。底物均用乙酸-乙酸钠缓冲液(pH5.2,0.1 mol·L-1)配制。
100 μL原酶液与200 μL上述底物充分混匀,40 ℃水浴中温育1 h后,加入DNS显色剂300 μL中止反应,混匀后立即沸水浴显色5 min,室温冷却,稀释5倍后于540 nm处测OD值,每处理重复3次,取平均值,同时设空白对照。以试验条件下单位虫体质量(g)单位时间(h)酶促反应生成的还原糖(葡萄糖)量(μmol)计算酶活性,即: μmol(葡萄糖)· g-1(FW) h-1(殷幼平等,1996;Chen et al., 2002;杨天赐等,2003;索风梅等,2004)。
1.5 数据分析使用软件SPSS13.0,采用单因素方差分析(ANOVA),P < 0.05表示有显著性差异。
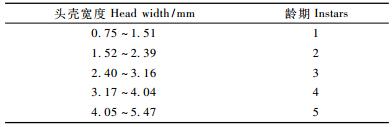
2 结果与分析 2.1 取食寄主植物不同龄期光肩星天牛幼虫纤维素酶活性Cx酶活性如图 1所示。1, 2龄幼虫Cx酶活性显著高于3, 4, 5龄幼虫,1龄幼虫与2龄幼虫之间、3龄幼虫和4龄幼虫之间、4龄幼虫和5龄幼虫之间Cx酶活性均无显著性差异。1龄幼虫Cx酶活性为42.05 μmol· g-1 h-1,5龄幼虫Cx酶活性为1.38 μmol· g-1 h-1,1龄幼虫Cx酶活性大小是5龄幼虫的30多倍。
|
图 1 取食寄主植物不同龄期光肩星天牛幼虫Cx酶活性 Figure 1 Cx-cellulase activities of ALB larvae of different instars fed on host tree 不同字母表示差异达到显著水平(ANOVA检验,P < 0.05)。 Different letter means the significant difference (P < 0.05).下同The same below. |
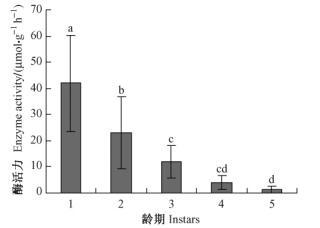
取食寄主植物不同龄期光肩星天牛幼虫β-葡萄糖苷酶活性如图 2所示:1, 2, 3龄幼虫β-葡萄糖苷酶活性显著高于4, 5龄幼虫,1, 2龄幼虫和3龄幼虫之间,4龄幼虫和5龄幼虫之间β-葡萄糖苷酶活性均无显著性差异。1龄幼虫β-葡萄糖苷酶活性为15.1 μmol· g-1 h-1,5龄幼虫β-葡萄糖苷酶活性为3.02 μmol· g-1 h-1,1龄幼虫β-葡萄糖苷酶活性是5龄幼虫的5倍多。
|
图 2 取食寄主植物不同龄期光肩星天牛幼虫β-葡萄糖苷酶活性 Figure 2 β-glucosidase activities of ALB larvae of different instars fed on host tree |
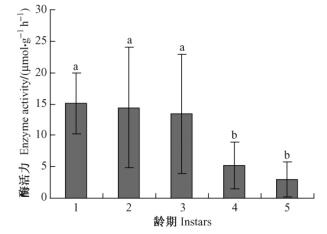
取食人工饲料不同日龄光肩星天牛幼虫Cx酶活性如图 3所示。10,20,30日龄幼虫Cx酶活性显著高于80,100,120日龄幼虫;10日龄幼虫Cx酶活性高于其他所有日龄幼虫;20,30,40,50日龄幼虫和60日龄幼虫之间Cx酶活性无显著性差异;80,100日龄幼虫和120日龄幼虫之间Cx酶活性无显著性差异。10日龄幼虫Cx酶活性为37.17 μmol· g-1 h-1,80日龄幼虫Cx酶活性为1.53 μmol· g-1 h-1,10日龄幼虫Cx酶活性是80日龄幼虫的20多倍。
|
图 3 取食人工饲料光肩星天牛幼虫Cx酶活性 Figure 3 Cx-cellulase activities of ALB larvae fed on artificial diet |
取食人工饲料不同日龄光肩星天牛幼虫β-葡萄糖苷酶活性结果如图 4所示。β-葡萄糖苷酶活性在60日龄幼虫达到最高峰,显著高于80,100,120日龄幼虫;10,20,30,40日龄幼虫和50日龄幼虫之间β-葡萄糖苷酶活性无显著性差异;80,100日龄幼虫和120日龄幼虫之间无显著性差异。60日龄幼虫β-葡萄糖苷酶活性为13.55 μmol· g-1 h-1,80日龄幼虫β-葡萄糖苷酶活性为2.36 μmol· g-1 h-1,60日龄幼虫β-葡萄糖苷酶活性大小是80日龄幼虫的5倍多。
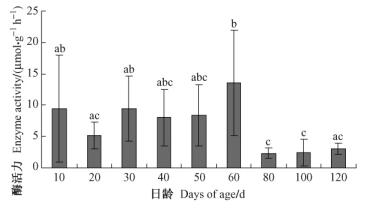
|
图 4 取食人工饲料光肩星天牛幼虫β-葡萄糖苷酶活性 Figure 4 β-glucosidase activities of ALB larvae fed on artificial diet |
Geib等(2005)以取食人工饲料的光肩星天牛幼虫为试验材料,发现其体内Cx酶和β-葡萄糖苷酶活性均有显著性下降,他们认为:光肩星天牛幼虫体内纤维素酶活性的下降,是由于光肩星天牛幼虫以人工饲料为食,因为人工饲料中的单糖含量比较高。而事实上,在取食寄主植物和人工饲料光肩星天牛体内,其纤维素酶活性均呈现下降趋势。笔者认为:光肩星天牛幼虫随着虫体的生长,其体内纤维素酶活性逐渐下降的原因,并不一定是由于取食人工饲料,这有可能是由于老熟幼虫相对取食量降低而导致,也有可能是由于随着天牛幼虫的生长,其体内的纤维素酶活性到达一个稳定的水平,但体质量却不断增加,从而使相对酶活性降低。
根据光肩星天牛的生物学特性,成虫一般于5月开始出现,6月下旬至7月上旬和8月上旬为羽化盛期,成虫补充营养后2~3天即可交尾,交尾后雌虫便可产卵,卵期一般为10天左右(骆有庆等,1999)。光肩星天牛幼龄幼虫主要出现在9—11月,主要在树木韧皮部危害,因此基于纤维素酶抑制剂的生态防治方法适于9—11月开展。
贺萍, 黄竞芳. 1992. 光肩星天牛的人工饲养[J]. 北京林业大学学报, 14(2): 81-87. |
骆有庆, 李建光. 1999. 光肩星天牛的生物学特性及发生现状[J]. 植物检疫, 13(1): 5-7. |
索风梅, 林长春, 王浩杰, 等. 2004. 松墨天牛纤维素酶的研究Ⅰ.纤维素酶性质研究[J]. 林业科学研究, 17(5): 583-589. |
萧刚柔. 1992. 中国森林昆虫[M]. 2版(增订版). 北京: 中国林业出版社.
|
阎俊杰. 1985. 中国东部光肩星天牛分布区的研究[J]. 东北林学院学报, 13(1): 62-69. |
杨天赐, 莫建初, 程家安, 等. 2003. 黄胸散白蚁纤维素酶的研究[J]. 中国森林病虫, 22(6): 4-7. |
殷幼平, 程惊秋, 蒋书楠. 1996. 桑粒肩天牛纤维素酶的性质研究[J]. 林业科技, 32(5): 454-459. |
赵军, 小仓信夫, 矾野昌弘. 1992a. 光肩星天牛的人工饲养(Ⅰ)[J]. 北京林业大学学报, 21(4): 58-61. |
赵军, 小仓信夫, 矾野昌弘. 1992b. 光肩星天牛的人工饲养(Ⅱ)[J]. 北京林业大学学报, 21(4): 62-66. |
Chen Min, Lu Mengzhu, Zhang Zhiyi. 2002. Charateristics of cellulases from Anoplophora glabripennis Motsch (Coleoptera : Cerambycidae)[J]. Forestry Studies in China, 4(2): 43-47. |
Geib S, Jones D, Sellmer J, et al. 2005.Cellulose digestion in the larvae of the Asian Longhorned Beetle (Anoplophora glabripennis)//Gottschaik K W.16th US Department of Agriculture Interagency Research Forum on Gypsy Moth and Other Invasive Species.
|
Hajek A E. 2007. Asian longhorned beetle: ecology and control//Pimentel D. Encyclopedia of Pest Management. Vol Ⅱ. Boca Ratonz: CRC Press, 2: 21-24.
|
Hajek A E, Kalb D M. 2007. Suitability of Acer saccharum and Acer pensylvanicum (Aceraceae) for rearing Anoplophora glabripennis (Coleoptera: Cerambycidae)[J]. Canadian Entomologist, 139(5): 751-755. DOI:10.4039/n06-107 |
Keena M A. 2002. Anoplophora glabripennis (Coleoptera: Cerambycidae) fecundity and longevity under laboratory conditions: Comparison of populations from New York and Illinois on Acer saccharum[J]. Environmental Entomology, 31(3): 490-498. DOI:10.1603/0046-225X-31.3.490 |
Keena M A. 2005. Pourable artificial diet for rearing Anoplophora glabripennis (Coleoptera: Cerambycidae) and methods to optimize larval survival and synchronize development[J]. Annals of the Entomological Society of America, 98: 536-547. DOI:10.1603/0013-8746(2005)098[0536:PADFRA]2.0.CO;2 |
Morewood W D, Hoover K, Neiner P R, et al. 2005. Complete development of Anoplophora glabripennis (Coleoptera: Cerambycidae) in northern red oak trees[J]. Canadian Entomologist, 137(3): 376-379. DOI:10.4039/n04-083 |
Smith M T, Bancroft J, Tropp J. 2002. Age-specific fecundity of Anoplophora glabripennis (Coleoptera: Cerambycidae) on three tree species infested in the United States[J]. Environmental Entomology, 31(1): 76-83. DOI:10.1603/0046-225X-31.1.76 |
 2011, Vol. 47
2011, Vol. 47