文章信息
- 杜娟, 赵磊, 师光禄, 王有年, 仝宝生
- Du Juan, Zhao Lei, Shi Guanglu, Wang Younian, Tong Baosheng
- 牵牛子杀螨活性物质鉴定及其作用机制初探
- A Preliminary Study on Activity Mechanism and Identification of Extract of Pharbitis purpurea Seeds against Tetranychus cinnabarinus
- 林业科学, 2011, 47(11): 199-203.
- Scientia Silvae Sinicae, 2011, 47(11): 199-203.
-
文章历史
- 收稿日期:2010-03-30
- 修回日期:2010-12-13
-
作者相关文章
2. 内蒙古永业生物技术有限责任公司 呼和浩特 010010
2. Inner Mongolia Yongye Biotechnology Co., Ltd. Huhhot 010010
朱砂叶螨(Tetranychus cinnabarinus)具有个体小、繁殖快、代数多、适应性强、为害重等特点,是世界公认的最难防治的有害生物群落(Hazan et al., 1974;何林等,2004),可危害百余种农作物和果树,并对其产量和品质造成严重的影响(Ho et al., 1997)。长期以来,大量重复使用非专一性化学杀螨剂,使许多螨类已产生抗药性(唐除痴等,1998),并且对杀螨剂出现了交互抗性(王旭等,1997),与此同时,化学农药在杀螨过程中,也杀伤了天敌及其他有益生物,破坏了生态平衡,引起害螨的再猖獗,造成了化学农药应用的恶性循环。因此,寻找新型、高效、安全的杀螨剂已成为一个重要的课题,天然杀螨活性物质的鉴定和研究就是其中之一。据Ahmed 1985年的资料,世界上有1 600多种高等植物含有控制有害生物的物质,其中具有杀虫活性的1 005种,杀螨活性的39种(赵善欢,2001),主要包括生物碱类、柠檬素类、黄酮类化合物和植物精油等,因其具有对环境污染小、害虫较难产生抗药性和对有益生物较安全等特点,使天然杀螨活性物质成为研究的热点(王有年等,2007;曹挥等,2007;师光禄等,2007;王海香等,2008;董育新等,1997;任晓霞等,2002)。
本试验采用二维薄层层析法(thin-layer chromatography,TLC)检测牵牛子提取物流分8中天然杀螨活性物质的纯度,使用NMR、GC-MS等方法对其结构进行鉴定分析,流分8中天然杀螨活性物质被初步鉴定为亚油酸甲酯,进一步采用生化方法测定了亚油酸甲酯对朱砂叶螨体内GSTs、AChE和MAO等几种酶的活性影响,初步研究了亚油酸甲酯杀螨机制,为开发安全、有效、环保的新型杀螨剂提供理论基础。
1 材料与方法 1.1 材料朱砂叶螨源于室内饲养的敏感品系,温度(25±1)℃,相对湿度RH=(50±10)%,光照L:D=18 h:6 h。
硅胶GF254购自青岛海洋化工厂;亚油酸甲酯、毒扁豆碱、2-硝基苯甲酸(DTNB)、1-氯-2,4-二硝基苯(CDNB)购于Sigma公司的上海分公司;考马斯亮蓝G-250试剂、谷胱甘肽(Glutathione, GSH)、AChE (acetyl Cholinest erase)、Ca2+-ATP酶和Na+, K+-ATP酶购自南京建成科技有限公司;磷酸缓冲液组成(Na2HPO4·2H2O,KH2PO4,pH=6.5)。
分光光度计(TU-1800)购自北京普析通用仪器有限公司,核磁共振仪(JNM ECA 600)购自日本电子株式会社,气相色谱-质谱仪(Agilent 5975B)购自美国安捷伦公司。
1.2 方法1) 牵牛子提取物流分8结构鉴定分析 采用TLC法检测流分8的纯度。用0.05 mm毛细管取该流分溶液点于硅胶GF254薄层板上,以氯仿展开,展距为5 cm,取出,晾干;然后在饱和碘蒸气中显色,观测点的数量。最后沿着与此方向垂直的方向再展开1次,再次观测点的数量。如果层析板上显示多个点,判断为混合物;显示单个点,判断似为纯净物。
采用紫外(UV)分光光度计进行全波段光谱分析。将流分8用氯仿稀释,以氯仿为空白对照在紫外分光光度计上进行全波段检测,检测最大吸收峰。
采用红外(infra-red, IR)光谱检测特征基团。将样品与KBr混合压片,液体样品直接涂片,测定样品的IR吸收峰。测定范围为400~ 4 000 cm-1,检出限85 cm-1,精度为±2 cm-1,根据IR吸收峰判断化合物具有的特征基团。
核磁共振谱(1H NMR)和核磁共振(13C NMR)用核磁共振仪测定,以氘代氯仿(CDCl3)为溶剂,四甲基硅烷(TMS)为内标,分别在600.17 MHz和150.91 MHz记录波谱数据。
气相色谱条件:石英毛细管柱HP2FFAP(30 m ×0.25 mm, 0.25 μm);程序升温:从150 ℃开始,保持3 min,以6 ℃·min-1升到250 ℃,保持5 min;载气为He,柱流量1.0 mL·min-1,进样口温度250 ℃,分流比50:1。
质谱条件: EI源,电离电压70 eV,离子源温度230 ℃,扫描范围10~500 u,进样量1.0 μL。
2) 牵牛子提取物流分8杀螨作用机制分析 酶液的制备:分别在触杀处理后的4,8,12,16,20,24 h取雌成螨500头,加0.25 mL生理盐水在冰浴中匀浆,10 000 r·min-1,4 ℃下离心15 min,取上清液备用。
蛋白含量测定:采用考马斯亮蓝G-250法(慕立义,1991),取酶液0.05 mL于测定管中,对照管中加入0.05 mL蒸馏水,标准管中加入0.05 mL标样,加入3 mL考马斯亮蓝G-250试剂,混匀,静置10 min,于595 nm波长处比色测定OD值,重复3次,计算出蛋白质含量。
GSTs活性测定:将66 mmol·L-1磷酸缓冲液2.5 mL、50 mmol·L-1 GSH 0.2 mL、0.03 mol·L-1 CDNB 0.05 mL迅速混匀作为对比,将以上试剂再加0.1 mL制备好的酶液作为试样,27 ℃下在340 nm处,以底物GSH浓度的高低来表示GSTs活力的大小,测定OD值,重复3次。
AChE活性测定:参照何玉仙等(2003)的方法,以ACh(acetyl cholinest)为底物,DTNB为显色剂,毒扁豆碱为抑制剂,反应条件为27 ℃,保温15 min,1 mmol·L-1的毒扁豆碱0.3 mL终止反应,在412 nm波长下测定OD值,重复3次。
MAO活性测定:是以MAO的特异性底物苄胺为反应底物,测定其反应产物苄醛的生成量。利用苄醛在紫外部分λ=242 nm处有一吸收高峰,测定酶作用反应后的光吸收值,重复3次,推算出MAO的酶活性,以生成苄醛的量表示酶活性。
Ca2+-ATP酶和Na+, K+-ATP酶活性测定:参照刘素媛等(1999)的方法,在636 nm波长下测定OD值,重复3次,以每小时每毫克组织蛋白的组织中ATP酶分解ATP产生的无机磷的含量来表示酶活力。
2 结果与分析 2.1 化合物结构鉴定分析TLC法检测结果是沿二维层析板的对角线只显示一个黄色的点,因此初步认定流分8是较为纯净的物质。
UV光谱的全波段光谱分析结果是流分8在224 nm波长处吸收峰最大。IR光谱检测结果如图 1所示,在可见光1 731 cm-1处有吸收,表明含有羰基ν(C=O)振动;1 053 cm-1处吸收表明Cn(n≥4)最少7个碳的直链烷烃特征;2 912,2 835 cm-1吸收极强也表明含—CH2长链。
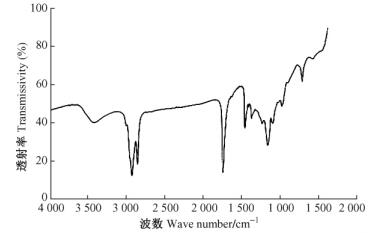
|
图 1 流分8的IR光谱 Figure 1 IR of fraction 8 |
质谱和核磁共振获得化合物氢谱和碳谱分析数据如图 2,3,4所示。1H NMR (CDCl3,600 MHz)δ: 5.37(1H,dd,J1=15.7,H-9′),5.344(1H,dd,J1=15.7,H-10′),为一对反式双键,4.24(3H,m,H-1),2.76(2H,t,J=7.5,H-8′,H-11′),2.33(2H,t,J=7.5,H-2′),1.6(2H,t,J=7.2 Hz,H-3′),1.3~1.2之间的多个质子为饱和的CH2中的H信号,0.88(3H,t,J=6.3 Hz,H-18′);13C NMR (150 MHz,CDCl3)δ: 173.4(C-1′),34.3(C-2′),29.6(C-3′),31.2(C-4′),27.4(C-5′),127.7(C-6′),128.3(C-7′),33.1(C-8′),130.2(C-9′),128.2(C-10′),62.3(C-11′),29.6(C-12′),29.3(C-13′),27.8(C-14′),31.3(C-15′),29.5(C-16′),22.7(C-17′),14.3(C-18′),31.8(C-19′),32.1~29.3之间为多个饱和的CH2中的C信号。

|
图 2 流分8的GC-MS图谱 Figure 2 GC-MS analysis of fraction 8 |
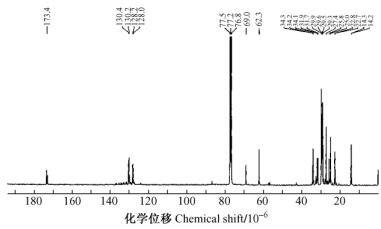
|
图 3 流分8 13C NMR光谱 Figure 3 13C NMR of fraction 8 |

|
图 4 流分8 1H NMR光谱 Figure 4 1H NMR of fraction 8 |
综上,依据UV、IR、GC-MS、1H NMR、13C NMR光谱分析,流分8被初步鉴定为亚油酸甲酯,分子式是C19H34O2。
2.2 亚油酸甲酯对朱砂叶螨体内几种酶活性的影响为研究亚油酸甲酯是否激活了与蛋白质合成有关的酶,分析亚油酸甲酯对蛋白质含量的影响(图 5)。经亚油酸甲酯处理后,朱砂叶螨体内蛋白质含量高于对照组。在作用4~8 h之间,处理组和对照组的蛋白含量均呈上升趋势,而在8~12 h之间,对照组开始下降,处理组的蛋白质含量仍呈上升趋势,直到12 h后才有所下降,20 h后又急剧升高。对照组整体蛋白质含量在8~16 h有所波动,20 h后趋于稳定。总体上处理组蛋白含量有所增高,这可能是处理后激活了与蛋白质合成有关的酶。

|
图 5 亚油酸甲酯对朱砂叶螨蛋白质含量的影响 Figure 5 Effect of methyl linoleate to protein content of T.cinnabarinus |
对GSTs活性的影响(图 6):用亚油酸甲酯处理朱砂叶螨雌成螨后,体内GSTs活性先上升后下降,处理组的活性均高于对照组,尤其在处理后8 h,对照组活性不到处理组的60%,20 h后,GSTs活性再次升高。由于GSTs是许多生物体内重要的解毒酶系之一,是昆虫体内的一类与抗性有关的初级代谢及次级代谢酶系(张宗炳等,1987), 可能是亚油酸甲酯中的某种物质在螨体内的积累,解毒代谢受抑制,导致GSTs活性有所下降。
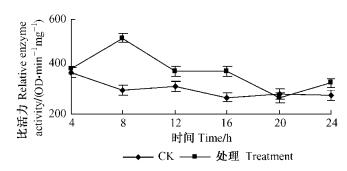
|
图 6 亚油酸甲酯对朱砂叶螨GSTs的影响 Figure 6 Effect of methyl linoleate to GSTs of T.cinnabarinus |
对AChE活性的影响(图 7):亚油酸甲酯处理后AChE活性整体表现为先升后降的趋势;处理组的酶活性与对照相比,除开始短时间内高于对照组外,其余时间均明显低于对照组;在作用后的16 h最为显著,处理组仅为对照组的23%。这说明AChE活性受到了明显的抑制,AChE可能是亚油酸甲酯在朱砂叶螨体内的重要靶标之一。
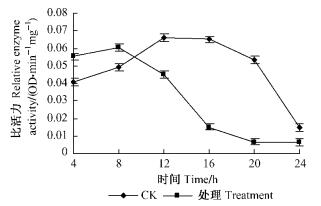
|
图 7 亚油酸甲酯对朱砂叶螨AChE的影响 Figure 7 Effect of methyl linoleate to AChE of T.cinnabarinus |
对MAO活性的影响(图 8):用亚油酸甲酯处理朱砂叶螨后的24 h中,MAO活力变化总体呈下降趋势;处理组与对照相比,在4~12 h之间MAO的活力变化较小,而12 h之后下降明显。这说明亚油酸甲酯对MAO有明显的抑制作用。
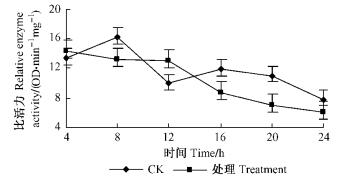
|
图 8 亚油酸甲酯对朱砂叶螨MAO的影响 Figure 8 Effect of methyl linoleate to MAO of T.cinnabarinus |
对Ca2+-ATP酶活性的影响(图 9):亚油酸甲酯处理朱砂叶螨后,在4~8 h之间,处理组酶活性呈上升趋势,而对照组一直是在下降,8 h后处理组出现明显的下降趋势,而对照组在16 h后则出现了缓慢的上升。从总体上来看,亚油酸甲酯对朱砂叶螨体内的Ca2+-ATP酶的抑制作用明显。
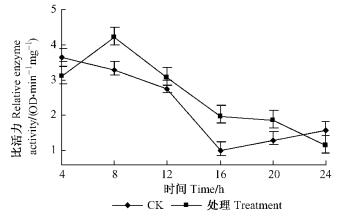
|
图 9 亚油酸甲酯对朱砂叶螨Ca2+-ATP酶的影响 Figure 9 Effect of methyl linoleate to Ca2+-ATPase of T.cinnabarinus |
对Na+, K+-ATP酶活性的影响(图 10):处理组和对照组的变化趋势基本相同,处理组出现了明显的波动,而对照组在20 h前一直趋于平缓,至24 h为止,2种酶活力都达到了最高值。从总体趋势来看,朱砂叶螨经亚油酸甲酯处理后,与对照相比,体内Na+, K+-ATP酶的活力受到一定的抑制。

|
图 10 亚油酸甲酯对朱砂叶螨Na+, K+-ATP酶的影响 Figure 10 Effect of methyl linoleate to Na+, K+-ATPase of T.cinnabarinus |
牵牛子提取物流分8中天然杀螨活性物质——亚油酸甲酯可能影响螨体内与解毒相关酶GSTs的活性。GSTs是生物体对外源有毒物质进行代谢的重要共轭酶系之一(张宗炳,1987),它能催化内源性的GSH对底物进行亲核共轭代谢,尤其在许多有机磷杀虫剂的解毒代谢中起重要作用,当外源有害物质进入生物体内时,它会以水解蛋白和结合蛋白2种方式积极参与解毒代谢,分解进入体内的外源有毒物质。从试验结果来看,亚油酸甲酯进入试螨体内可以激发GSTs的活性,对其进行解毒作用,这表明亚油酸甲酯可能与朱砂叶螨体内的某种物质通过特异性的结合,改变其活性结构,来降低解毒代谢,导致其中毒,最终死亡。
亚油酸甲酯也可能是通过干扰神经功能来发挥致死作用。有研究表明大多数杀螨剂都是通过干扰神经功能来发挥致死作用的(Dekeyser et al., 1994),从本试验处理后螨体内与神经系统有关的几种酶的变化结果来看,亚油酸甲酯对神经系统的AChE、MAO等的活性抑制作用非常明显。如AChE是昆虫体内一种与神经功能有重要关系的水解酶(王荫长,2004),其作用于神经系统,可水解乙酰胆碱,使其形成乙酸和胆碱。作为神经递质的乙酰胆碱进入突触间隙,完成生理功能后需要及时消除,从而使突触传导能持续进行,反之乙酰胆碱的积累会引起突触后膜的过度兴奋而阻断正常传导,引起神经传导的异常反应,直至最终阻断突触传递,一旦该酶被一定程度地抑制,昆虫会过度兴奋而死亡。因此,亚油酸甲酯对朱砂叶螨体内神经系统酶的作用显著,可能引起神经传递的阻断从而导致螨体的死亡,但对其是否为神经毒剂还有待进一步研究确定,并对其毒理进行深入地研究。
牵牛子在医药领域已经得到很广泛的研究与应用,且已表现出较大的开发潜力,近年来有研究表明牵牛子提取物有杀虫抑菌的作用,可见其在农业方面也极具开发价值。因此,本试验是从长远发展的角度出发,充分利用现有的植物资源,开发与生物、环境和谐的绿色植物源农药,为新杀螨农药的研制和先导化合物的发现提供理论依据和技术支持。
曹挥, 王有年, 刘素琪, 等. 2007. 地肤提取物对山楂叶螨体内几种酶活性的影响[J]. 林业科学, 43(2): 68-72. |
董育新, 吴文君. 1997. 植物杀虫剂毒理学研究新进展[J]. 昆虫知识, 34(2): 112-116. |
何林, 杨羽, 符建章, 等. 2004. 朱砂叶螨阿维菌素抗性品系选育及适合度研究[J]. 植物保护学报, 31(4): 395-400. |
何玉仙, 王长方, 陈锋, 等. 2003. 杀虫剂处理对甜菜夜蛾幼虫体内酶活性的影响[J]. 江西农业大学学报, 25(6): 896-899. |
刘素媛, 孙黎光, 邢伟, 等. 1999. 慢性染铅对大鼠海马区神经细胞Ca2+浓度及Ca2+-ATP酶活性的影响[J]. 卫生毒理学杂志, 13(1): 16-17. |
慕立义. 1991. 植物化学保护[M]. 北京: 农业出版社.
|
任晓霞, 韩召军, 王荫长. 2002. 棉铃虫乙酰胆碱酯酶cDNA片段的克隆和序列分析[J]. 动物学报, 48(1): 121-124. |
师光禄, 王有年, 王鸿雷, 等. 2007. 万寿菊根提取物对山楂叶螨谷胱甘肽-S-转移酶和蛋白酶及蛋白质含量的影响[J]. 应用生态学报, 183(2): 400-404. |
唐除痴, 李煜昶, 陈彬, 等. 1998. 农药化学[M]. 天津: 南开大学出版社.
|
王旭, 高希武, 郑炳宗. 1997. 小菜蛾抗药性的研究[J]. 世界农业, 223(11): 27-29. |
王海香, 申照静, 杜娟, 等. 2008. 核桃青皮提取物对朱砂叶螨的毒力及相关酶活性的测定[J]. 林业科学, 44(5): 16-20. |
王荫长. 2004. 昆虫生理学[M]. 北京: 中国农业出版社: 202-203.
|
王有年, 苗沛芳, 曹挥, 等. 2007. 核桃叶提取物对朱砂叶螨体内几种酶活性的影响[J]. 园艺学报, 34(5): 1297-1300. |
张宗炳. 1987. 杀虫药剂的分子毒理学[M]. 北京: 农业出版社: 219.
|
赵善欢. 2001. 植物化学保护[M]. 北京: 中国农业出版社.
|
Dekeyser M A, Downer R G H. 1994. Downer biochemical and physiological targets for miticides[J]. Pestic Sci, 40(2): 85-101. DOI:10.1002/ps.v40:2 |
Hazan A, Gerson U, Tahori A S. 1974. Spider mite webbing Ⅰ.The production of webbing under various environmental conditions[J]. Acarologia, 16(2): 68-84. |
Ho C C, Lo K C, Chen W H, et al. 1997. Spider mite (Acari: Tetranychidae) on various crops in Taiwan[J]. J Agr Res China, 46(6): 333-346. |
 2011, Vol. 47
2011, Vol. 47

