文章信息
- 王延平, 王华田, 姜岳忠, 陈鸿鹰, 倪桂萍
- Wang Yanping, Wang Huatian, Jiang Yuezhong, Chen Hongying, Ni Guiping
- 氮磷亏缺条件下杨树幼苗根系分泌酚酸的动态
- Secretion Dynamics of Phenolic Acids from Poplar (Populus×euramericana 'Neva') Seedling Roots under N, P Deficiency Conditions
- 林业科学, 2011, 47(11): 73-79.
- Scientia Silvae Sinicae, 2011, 47(11): 73-79.
-
文章历史
- 收稿日期:2010-10-13
- 修回日期:2011-03-29
-
作者相关文章
2. 山东省林业科学研究院 济南 251000
2. Shandong Academy of Forestry Jinan 251000
我国是世界上人工林面积最大的国家,其中以用材为目的的速生丰产林面积约占60%。长期以来,速生丰产林培育多采用多代连作的经营方式,由此导致的地力衰退现象非常严重(张昌顺等, 2005)。有学者认为,化感物质在林木根际土壤中的累积是引发地力衰退的重要因素之一(Fisher, 1980)。有关连作人工林的化感效应问题受到广大学者的重视,许多研究人员从化感效应角度阐释人工林地力衰退问题(Jeffrey et al., 2004; Kong et al., 2008; Catherine et al., 2008; 王延平等, 2008a)。杨树(Populus)是我国黄淮海地区适宜的速生丰产林树种之一,但由于多代连作引发的地力衰退现象也非常严重(孙翠玲等, 1995; 刘福德等, 2005)。谭秀梅等(2008)采用HPLC对不同连作代数杨树人工林根际土中的对羟基苯甲酸、苯甲酸、香草醛、肉桂酸等酚酸物质的累积规律进行研究。但关于此类物质的来源及累积机制尚不十分清楚。
土壤中化感物质的累积取决于这些物质的产生及滞留能力,杨树人工林土壤中酚酸的吸附、解吸、滞留等环境行为学特征的研究结果表明:酚酸在杨树人工林土壤中具有较强的吸附能力,但同时此类物质在土壤中的降解速率也较高,外源添加的酚酸在15天后基本降解完毕(王延平等,2010a; 2010b; 2010c)。因此,酚酸物质的产生和释放强度应是决定其在土壤中形成累积的关键因素。已有研究表明:酚酸的产生和释放与植物面临的养分胁迫环境密切相关(孔垂华, 2000)。杨树是个速生树种,其本身生长对水肥的需求很大,极易引起林地养分亏缺。对连作杨树人工林土壤养分环境的研究发现,土壤有机质和速效N, P等养分含量随连作代数增加大幅降低(刘福德, 2005)。本研究以水培杨树幼苗为试材,采用根系分泌物循环收集装置,通过构建N, P缺乏营养环境,对杨树幼苗根系分泌酚酸的动态进行检测,以阐明杨树根系分泌酚酸的特征和规律,为深入揭示连作杨树人工林地酚酸物质的累积机制提供科学依据。
1 材料与方法 1.1 试验材料与试剂吸附树脂(Amberlite XAD-16)由北京慧德易科技有限责任公司代理购买,树脂基本参数见表 1。对羟基苯甲酸、香草醛、苯甲酸和肉桂酸(色谱纯)购自上海化学试剂公司,甲醇、乙醇、冰乙酸、乙腈等试剂均选用色谱纯;试验所用纯水为美国Milli-Q Synthesis超纯水系统制备。
|
|
1) 试验材料与试验设计 在1年生欧美杨I-107(Populus×euramericana ‘Neva’)幼苗上采集长度10 cm、直径1.5 cm的插穗;自2008年5月对插穗进行水培,60天后选择分枝、根系生长一致的健康苗木用去离子水反复冲洗根系数遍后,用0.5%多菌灵灭菌10 min,分别放置于黑色避光塑料盆中并用泡沫板固定,在培养盆(规格为ϕ20 cm,高10 cm)中加入2 L营养液并置于人工气候室进行培养,温度25 ℃,空气湿度80%,光照强度1 200 lx。试验设置3种培养方式,标准营养液培养(按照标准Hoagland营养液配方配制)、缺N培养[在标准Hoagland营养液配方的基础上,去除KNO3和Ca(NO3)2,用0.01 mol·L-1的HCl,KOH和Ca(OH)2调整离子平衡]、缺P培养(在标准Hoagland营养液配方的基础上,去除KH2PO4,用0.01 mol·L-1的HCl和KOH调整离子平衡)。每处理5盆,每盆10株。
2) 树脂预处理 称取一定量Amberlite XAD-16型树脂,置于三角瓶,加无水乙醇浸泡24 h使其充分溶胀;后将树脂用灭菌水冲洗至玻璃漏斗(加滤纸)。先用纯水将乙醇冲洗干净,用2BV的丙酮冲洗树脂至流出液不再浑浊,然后用3BV无水乙醇继续冲洗,再用纯水将乙醇洗净;用4BV 2 mol·L-1的NaOH冲洗,后用纯水将树脂冲洗至中性,再用4BV 2 mol·L-1的盐酸冲洗,后用纯水将树脂冲至中性,将树脂置于65 ℃烘箱干燥,密封保存备用。
3) 根系分泌物的收集 将预处理好的树脂,称取1.0 g置于树脂柱(ϕ1.5 cm×4.0 cm),安装至循环收集装置中。每培养5天循环收集根系分泌物1次,每次3个循环,流速25 mL·min-1。每次收集完毕后,重新更换培养盆中的营养液对幼苗继续培养。18天后营养亏缺培养下杨树幼苗叶片出现枯黄现象,试验终止。根系分泌物收集共计3次。
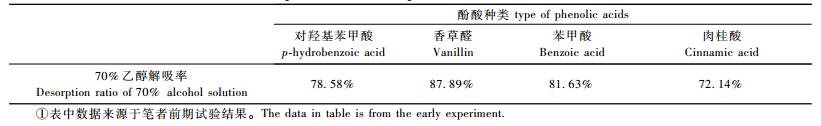
4) 根分泌物中酚酸的解吸 每次收集完毕,用去离子水将树脂柱中的XAD-16树脂全部冲至滤纸制成的V型漏斗中,再用去离子水反复冲洗数遍,充分干燥后称取0.5 g置于100 mL三角瓶,加入20 mL 70%乙醇解吸液,25 ℃振荡解吸24 h,静置后吸取上清液,经0.22 um滤膜过滤,进行色谱分析。
1.2.2 根系分泌物的液相检测1) 酚酸标样制备及标准曲线的绘制 分别准确称量对羟基苯甲酸、香草醛、苯甲酸和肉桂酸各10.0, 20.0, 30.0, 40.0, 50.0 mg,混合后置于烧杯,先用2 mL甲醇溶解后用纯水定容至100 mL,后各取溶液1 mL并稀释100倍,形成酚酸浓度梯度为1.0, 2.0, 3.0, 4.0, 5.0 μg·mL-1的混合标准液,进行色谱分析。分别以酚酸的峰面积和标样浓度作图,通过线性回归得到各酚酸浓度和图谱峰面积的线性方程,对羟基苯甲酸: y=12.324x+2.751(R2=0.998 9);香草醛: y=11.104x+0.699(R2=0.995 0);苯甲酸: y=1.397x+0.245(R2=0.961 8);肉桂酸: y=29.762x-1.709(R2=0.987 1)。
2) 色谱条件 美国Waters Acquity超高压液相色谱仪(UPLC),TUV检测器,色谱柱Diamnsil C18,流动相甲醇(A)和双蒸水(B)(用冰乙酸调pH至2.8),检测波长为270 nm,柱温25 ℃,采用自动连续梯度洗脱设置: 0~1.5 min A:B为15%:85%(v:v),1.5 min后为35%:65%(v:v);进样量2 μL,流速为0.25 μL·min-1。
1.3 数据处理 1.3.1 根系分泌酚酸量的计算首先根据解吸液中酚酸的浓度计算解吸液中酚酸的质量,然后根据70%乙醇对各酚酸的解吸能力,计算树脂对酚酸的吸附量,以此衡量杨树根系分泌酚酸物质的量。
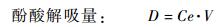
|
(1) |
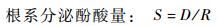
|
(2) |
式中,D为酚酸解吸量(μg);Ce为解吸液中酚酸的浓度(μg·mL-1);V为解吸液体积(20 mL);R为70%乙醇对各酚酸的解吸率(表 2);S为树脂对酚酸的吸附量(或根系分泌酚酸量,μg)。
|
|
分泌速率在一定程度上可反映杨树幼苗在营养胁迫下根系分泌酚酸的强度。为定量描述杨树幼苗在营养胁迫下根分泌酚酸强度的变化规律,本研究计算缺N和缺P培养下杨树幼苗各培养周期内酚酸的分泌速率。

|
(3) |
应用SPSS软件包中的one-way ANOVA分别进行方差分析并进行LSD多重比较。
2 结果与分析 2.1 根系分泌物中酚酸物质的液相色谱图分析从图 1B中可以看出:对70%乙醇解吸液进行液相检测,发现很多不规则吸收峰。对照酚酸标样色谱图(图 1A)。由于解吸液中并不含有酚酸类物质,所以这些波峰均为乙醇解吸液的正常系统峰。正常培养条件下,通过树脂收集,乙醇解吸,在解吸液中可检测出与酚酸标样相似的波峰(图 1C),说明正常培养条件下杨树幼苗根系也能分泌酚酸物质。同时,缺N和缺P培养液的液相色谱中检测到与酚酸标样相似的波峰(图 1D和E),说明杨树幼苗在缺N和缺P胁迫下根系也能分泌出对羟基苯甲酸、香草醛、苯甲酸和肉桂酸等酚酸物质。因此,杨树幼苗分泌酚酸物质是其正常生理活动,养分充足和缺乏状态下杨树幼苗根系均可以分泌酚酸物质。

|
图 1 各处理下杨树幼苗根系分泌物液相色谱 Figure 1 The chromatogram of roots exudates under different nutrient conditions ①对羟基苯甲酸,②香草醛,③苯甲酸,④肉桂酸;A为酚酸标样色谱图,B, C, D, E分别为乙醇解吸液及正常培养、缺N培养、缺P培养下的根系分泌物色谱图。 ①p-hydrobenzoic acid, ②Vanillin, ③ Benzoic acid, ④Cinnamic acid. A is the chromatogram of phenolic acids standard, B is the chromatogram of alcohol(desorption solution), C, D, E are the chromatogram of the poplar roots secretion under normal condition, N-deficiency condition and P-deficiency condition. |
依据对各处理液相检测结果,经公式(1)和(2)计算杨树幼苗不同培养时间段内根系分泌物中各酚酸的量(图 2)。在正常培养条件下虽然杨树幼苗根系仍分泌酚酸物质,但其中对羟基苯甲酸、香草醛、苯甲酸和肉桂酸的量存在较大差异。在一个培养周期内(5天),对羟基苯甲酸的分泌强度在12.293~12.504 μg之间,而香草醛、苯甲酸和肉桂酸的分泌强度均较小,其中苯甲酸仅有1.571~2.152 μg。各培养时间段内酚酸分泌量差异并不显著(P < 0.05)。杨树幼苗在缺N培养条件下,对羟基苯甲酸的分泌仍然最大(在28.842~45.063 μg之间),苯甲酸仍然最少(在5.172~9.119 μg之间),但缺N条件下杨树根系分泌物中各酚酸的含量分别比正常培养条件下显著增加(P < 0.05),其中对羟基苯甲酸增加125%~263%,香草醛增加201%~316%、苯甲酸增加230%~332%、肉桂酸增加138%~188%。且随着缺N胁迫时间的延长,根系分泌的各酚酸量也呈明显增加趋势(图 2),但经LSD多重比较未达到显著水平(P>0.05)。在缺P培养条件下,杨树幼苗根系分泌酚酸的量也显著增加(P < 0.05),对羟基苯甲酸为25.059~29.715 μg,较正常培养高出96%~124%;香草醛为4.67~9.172 μg,较正常高出58%~156%;苯甲酸为6.2~13.448 μg,较正常高出222%~734%;肉桂酸分泌量为6.167~13.518 μg,高出正常培养99%~328%。随P元素胁迫时间的延长,苯甲酸和香草醛的分泌量呈明显增加的趋势,而苯甲酸和肉桂酸呈现先升后降的趋势(图 2),经LSD多重比较未达到显著水平。上述结果说明: N,P缺乏均能显著促进杨树幼苗根系分泌酚酸,其中对羟基苯甲酸的分泌量显著高于香草醛、苯甲酸和肉桂酸,这与杨树根际土壤中酚酸的含量检测结果是一致的。

|
图 2 不同营养条件下杨树幼苗根系分泌物中酚酸的含量动态(平均值±标准误) Figure 2 The amount dynamics of phenolic acids in root exudates under different nutrient conditions (mean±SE) |
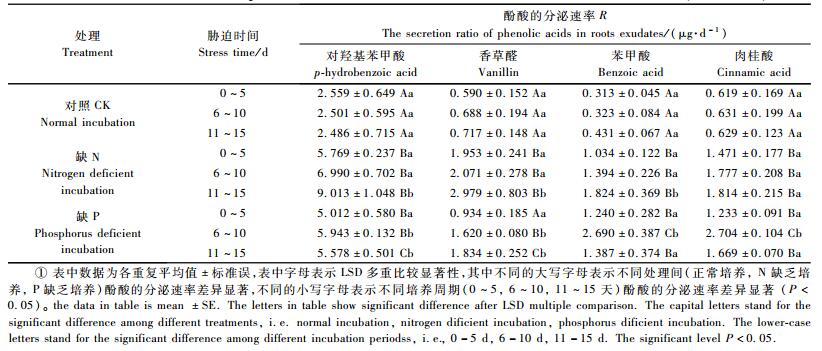
利用公式(3)对不同培养周期内酚酸的分泌速率进行计算。从表 3可以看出:在缺N条件下,杨树幼苗随胁迫时间的延长,各酚酸的分泌速率呈现逐渐增大的趋势,这说明在N素缺乏条件下,杨树幼苗根系分泌酚酸物质的强度随胁迫时间逐渐变大,其中对羟基苯甲酸分泌速率最大,在0~5天内,平均速率为5.769 μg·d-1;其次为香草醛,平均速率为1.953 μg·d-1;苯甲酸分泌速率最小,仅为1.034 μg·d-1。在11~15天,杨树根系分泌酚酸的速率显著增大,对羟基苯甲酸达到9.013 μg·d-1;其次为香草醛(2.979 μg·d-1),而肉桂酸的分泌速率增大不显著(P>0.05)。在缺P条件下,杨树幼苗随胁迫时间的延长,除香草醛呈现逐渐增大趋势外,其他3种酚酸分泌速率呈现先增大后减小的规律,其最大分泌速率出现在6~10天,其中对羟基苯甲酸的分泌速率为5.943 μg·d-1,苯甲酸为2.69 μg·d-1,肉桂酸为2.704 μg·d-1,且与0~5天酚酸分泌速率的差异达显著水平(P < 0.05)。此外,2种胁迫下,对羟基苯甲酸的分泌速率都高于香草醛、苯甲酸和肉桂酸,但不同酚酸的分泌速率也存在一定差异,缺N条件下,对羟基苯甲酸和香草醛的平均分泌速率高于缺P培养,而苯甲酸和肉桂酸的平均分泌速率低于缺P培养。
|
|
1) 酚酸分泌与植物面临的养分胁迫环境密切相关,这一过程将受植物体内生理代谢活动的调控。本研究结果表明:在正常培养和N, P缺乏培养条件下杨树幼苗根系均能分泌对羟基苯甲酸、香草醛、苯甲酸和肉桂酸等酚酸类物质,但营养缺乏可显著促进杨树根系内酚酸的分泌。对多种植物的研究均表明了这一规律,Lehman等(1972)的研究结果表明: N,K,S等营养元素的缺乏均可导致向日葵(Helianthus annuus)体内绿原酸(caffeoylquinnic acid)和东莨菪内酯(scopoletin)含量的升高。而且,缺P将导致向日葵根和枝梢分泌的酚类化合物明显高于P充足状态下的向日葵(Koeppe et al., 1976),随营养胁迫的增加向日葵分泌的酚类物质也逐渐增加(Hall et al., 1982)。水稻(Oryza sativa)在N,P,K等养分亏缺状态下根系次生代谢物中阿魏酸和肉桂酸等酚酸物质也出现大量增加的现象(Naoya et al., 1997)。缺磷胁迫导致杉木(Cunninghamia lanceolata)和马尾松(Pinus massoniana)苗木根系有机酸的分泌量显著增加(俞元春等, 2007)。人参(Panax ginseng)在营养亏缺状态下根系分泌物中酚酸类化合物种类也明显增多(李勇等, 2008)。不同磷处理对大豆(Glycine max)根系分泌有机酸有显著的影响,缺磷胁迫条件下,不论是有机酸总量还是各有机酸组分的含量均显著高于正常供磷水平(王树起, 2009)。可见,养分胁迫将促进植物体内有机酸的产生和释放。
一般情况下,根系分泌是根系固有的生理功能。酚酸作为根系分泌物种的一类小分子有机酸,在植物体内主要通过莽草酸途径代谢产生,植物体木质素合成需要的单体物质香豆醇、松柏醇和芥子醇均来源于酚酸物质(Rice, 1984)。但逆境条件下植物体内酚酸分泌增加的调控机制一直是一个比较模糊的问题(Inderjit et al., 2003)。有研究表明:磷缺乏导致羧酸化合物在鹰嘴豆(Cicer arietinum)、白羽杉豆(Lupinus album ‘Amiga’)、油菜(Brassica napus)等植物的根组织中大量累积;同时,根组织中参与莽草酸途径的主要酶,如蔗糖合成酶(sucrosesynthase)、磷酸葡糖变位酶(phosphoglucomutase)、果糖激酶(fructokinase)、PEP羧化酶(phosphoenolpyruvate carboxylase)等的活性显著升高(Hoffland et al., 1992; Neumann et al., 1999a)。硼缺乏导致烟草(Nicotiana tabacum)体内苯丙氨酸解氨酶(PAL)的活性升高,并与烟草体内酚酸的含量水平呈正相关(Camacho et al., 2002)。可见,营养缺乏促进植物体内酚酸的含量增加主要是通过影响酚酸代谢过程中某些关键酶的活性来实现,而酚酸的分泌可能受细胞膜上阴离子通道的控制(Rabotii et al., 1994; Neumann et al., 1999b)。营养胁迫对酚酸的合成和代谢调控的影响及机制是根系分泌酚酸调控机制研究的重要内容,针对杨树幼苗在养分亏缺条件下酚酸的合成及分泌机制有待进一步深入研究。
2) 连作人工林土壤养分环境的恶化可能是促进酚酸物质向根际环境释放的原因之一,从多角度研究酚酸分泌规律是必要的。
针对连作人工林的地力衰退问题,研究发现:杨树人工林连作导致林地土壤理化性质恶化,土壤有机质和速效N,P等养分含量降低(刘福德等, 2005)。笔者曾针对山东省单县和莒县2个试验点的连作杨树人工林进行了土壤养分调查,结果发现,单县试验区杨树二代人工林土壤速效N和速效P比一代林分别降低17.94%,13.64%;莒县试验林地三代、四代与二代林地相比土壤中速效N分别下降了11.64%和40.68%,速效P分别下降31.21%和37.36%。林地土壤中速效养分的逐代匮乏极大限制了杨树根系对养分的利用,使杨树长期处于养分胁迫状态。因此,养分胁迫是杨树人工林面临的重要逆境胁迫类型。从本研究的有关结果可以看出:随着营养胁迫时间的延长,杨树根系分泌酚酸的速率逐渐增大,在连续胁迫10天后从杨树根系分泌酚酸的速率可达几十μg·d-1。因此,在杨树根际酚酸的释放是相当剧烈的,这种作用将导致酚酸物质在杨树根际的逐渐累积。研究表明:连作二代杨树人工林根际土壤中酚酸的总含量是一代林的138%(谭秀梅等, 2008)。本研究的结果对这一现象的阐释提供有力证据。
本试验结果还表明:即使在养分充足的情况下杨树根系仍然能分泌出酚酸物质,养分亏缺将极大促进这一过程。王树起等(2009)的研究结果表明:在正常供磷条件下,大豆根系分泌的有机酸总量较少,随着磷浓度的降低,根系分泌的有机酸总量逐渐增加,当大豆处于完全无磷胁迫条件下,大豆根系分泌的有机酸总量显著增加,是正常供磷条件下的2~3倍。在大田条件下杨树人工林土壤中的N,P等养分含量较低,但不可能达到完全匮乏的状态,所以模拟梯度养分胁迫环境下杨树根系分泌酚酸的规律是必要的,这有待进一步研究。大田环境是极其复杂的,其他逆境类型(如水分、温度等)是否导致杨树根系内酚酸的分泌,酚酸的分泌是否也受某些生物因子的影响等问题,探索人工林土壤中酚酸的累积机制需要从多角度综合研究。总之,酚酸的释放和累积机制研究能为深入揭示杨树连作人工林地力衰退机制提供重要科学依据,相关方面的研究工作亟待深入开展。
孔垂华, 徐涛, 胡飞, 等. 2000. 环境胁迫下植物的化感作用及其诱导机制[J]. 生态学报, 20(5): 849-854. |
李勇, 黄小芳, 丁万隆. 2008. 营养元素亏缺对人参根分泌物主成分的影响[J]. 应用生态学报, 19(8): 1688-1693. |
刘福德, 刘颜泉, 王华田, 等. 2005. 杨树人工林连作效应[J]. 水土保持学报, 18(2): 102-105. |
孙翠玲, 朱占学, 王珍, 等. 1995. 杨树人工林地力退化及维护与提高土壤肥力技术的研究[J]. 林业科学, 31(6): 506-511. |
谭秀梅, 王华田, 孔令刚, 等. 2008. 杨树人工林连作土壤中酚酸积累规律及对土壤微生物的影响[J]. 山东大学学报:理学版, 43(1): 14-19. |
王树起, 韩晓增, 乔云发, 等. 2009. 缺磷胁迫条件下大豆根系有机酸的分泌特性[J]. 大豆科学, 28(3): 409-414. |
王延平, 王华田. 2008a. 连作人工林化感效应研究进展[J]. 世界林业研究, 21(4): 25-30. |
王延平, 杨阳, 王华田, 等. 2010a. 连作杨树人工林根际微域中2种酚酸的吸附与解吸行为研究[J]. 林业科学, 46(1): 48-55. |
王延平, 王华田, 杨阳, 等. 2010b. 外源酚酸在杨树人工林土壤中的吸附与滞留动态研究[J]. 水土保持学报, 24(2): 251-256. |
王延平, 王华田. 2010c. 植物根分泌的化感物质及其在土壤中的环境行为[J]. 土壤通报, 41(2): 501-507. |
俞元春, 余健, 房莉, 等. 2007. 缺磷胁迫下马尾松和杉木苗根系有机酸的分泌[J]. 南京林业大学学报, 31(2): 9-12. |
张昌顺, 李昆. 2005. 人工林地力的衰退与维护研究综述[J]. 世界林业研究, 18(1): 17-21. |
Camacho-Cristóbal J J, Anzellotti D, González-Fontes A. 2002. Changes in phenolic metabolism of tobacco plants during short-term boron deficiency[J]. Plant Physiology and Biochemistry, 40(2): 997-1002. |
Catherine F, Sébastien V, Jean-Philippe M, et al. 2008. Regeneration failure of Pinus halepensis Mill.: The role of autotoxicity and some abiotic environmental parameters[J]. Forest Ecology and Management, 255(1): 2928-2936. |
Fisher R F. 1980. Allelopathy: a potential cause of forest regeneration failure[J]. Journal of Forestry, 78(4): 346-348. |
Hall A B, Blum U, Fites R C. 1982. Stress modification of allelopathy in Helianthus annuus L[J]. debris on seed germination. American Journal of Botany, 69(5): 776-783. |
Hoffland E, Van den Boogard R, Nelemans J, et al. 1992. Biosynthesis and root exudation of citric and malic acids in phosphate-starved rape plants[J]. New Phytologist, 122(4): 675-680. |
Inderjit, Stephen O D. 2003. Ecophysiological aspects of allelopathy[J]. Planta, 217: 529-539. DOI:10.1007/s00425-003-1054-z |
Jeffrey D W, John T R. 2004. Allelochemicals of Polygonella myriophylla: Chemistry and soil degradation[J]. Journal of Chemical Ecology, 30(5): 1067-1081. DOI:10.1023/B:JOEC.0000028468.97851.7a |
Koeppe E D, Southwick L M, Bittell J E. 1976. The relationship of tissue chlorogenic acid concentrations and leaching of phenolics from sunflowers grown under varying phosphates nutrient conditions[J]. Canadian Journal of Botany, 54(7): 593-599. DOI:10.1139/b76-060 |
Kong C H, Chen L C, Xu X H, et al. 2008. Allelochemicals and activities in a replanted Chinese fir (Cunninghamia lanceolata (Lamb.) Hook.) tree ecosystem[J]. Journal of Agricultural and Food Chemistry, 56(24): 11734-11739. DOI:10.1021/jf802666p |
Lehman R H, Rice E L. 1972. Effects of deficiency of nitrogen, potassium, and sulfur on chlorogenic acid and scopoletin in sunflower[J]. American Midland Naturalist, 87(1): 71-80. DOI:10.2307/2423882 |
Naoya C, Tsuyosi H. 1997. Responses of secondary metabolism in plants to nutrient deficiency[J]. Soil Science and Plant Nutrition, 43(Special Issue): 987-991. |
Neumann G, Massonneau A, Martinoia E, et al. 1999b. Physiological adaptaions to phosphorus deficiency during proteid root development[J]. Planta, 208(3): 373-382. DOI:10.1007/s004250050572 |
Neumann G, Römheld V. 1999a. Root excretion of carboxylic acids and protons in phosphorus-deficient plants[J]. Plant and Soil, 211(1): 121-130. DOI:10.1023/A:1004380832118 |
Rabotti G, Zucchini G. 1994. Plasma membrane-bound H+-ATPase and reductase acitvities in Fe-deficient cucumber roots[J]. Plant Physilology, 90(4): 779-785. DOI:10.1111/ppl.1994.90.issue-4 |
Ri ce, E L. 1984. Allelopathy[M]. Orlando: Academic Press, Inc.: 9-10.
|
 2011, Vol. 47
2011, Vol. 47