文章信息
- 贾小明, 张焕玲, 樊军锋
- Jia Xiaoming, Zhang Huanling, Fan Junfeng
- 热激启动子控制的FT基因诱导杨树早期开花体系的优化
- System optimization of precociously flowering of poplar induced by FT gene controlled by a heat shock promoter
- 林业科学, 2011, 47(11): 37-43.
- Scientia Silvae Sinicae, 2011, 47(11): 37-43.
-
文章历史
- 收稿日期:2011-03-09
- 修回日期:2011-04-25
-
作者相关文章
杨树(Populus)是世界范围内广泛栽培的林业和农业首选树种,是我国重要的短周期工业用材林树种。杨树新品种选育一直是林木育种工作的研究热点,但杨树幼年期长开花晚的特点,限制了其遗传育种及相关研究工作进展。因此,促进杨树早期开花,缩短幼年期,对缩短杨树遗传改良周期具有积极作用(Flachowsky et al., 2009)。近年来,许多与植物花发育相关基因的克隆及在部分植物中的成功转化(Hsu et al., 2006; Böhlenius et al., 2006),使通过转基因技术调节植物花期成为可能。
FT(Flowering Locus T)基因是在拟南芥(Arabidopsis thaliana)中克隆得到的促花基因。研究表明,FT蛋白就是人们寻找多年的成花素,控制着拟南芥等植物的季节性开花(Corbesier et al., 2007)。目前,已经在杨树等多种植物中克隆了FT的同源基因(Böhlenius et al., 2006; Hsu et al., 2006; Igasaki et al., 2008),并对部分植物进行了遗传转化,转基因植物中FT类基因的过量表达均不同程度地诱导了转基因植株的早期开花。
在杨树开花基因转化研究中,获得的转基因植株诱导的花多为异常的单朵花,而非野生型的柔荑花序; 单朵花不能产生有育性的配子,这与多数研究在表达载体构建时使用组成型启动子有关(Hsu et al., 2006; Böhlenius et al., 2006; Flachowsky et al., 2009)。有研究证明,非组成型启动子——大豆(Glycine max)热激蛋白启动子HSP(heat shock promoter)构建的拟南芥FT基因表达载体诱导的拟南芥花器官变异相对较小(Crone et al., 2001; Huang et al., 2005)。因此,开展HSP控制下的FT转化杨树的研究,对于诱导杨树正常花器官、使FT基因在杨树遗传改良中真正发挥作用意义重大。
本研究以适应性强、在不同纬度地带都有分布、离体再生体系比较成熟的白杨派杂种无性系353(P. tremula ×P. tremuloides)为受体材料,对HSP控制下的来自毛果杨(P. trichocarpa)的FT同源基因FT1转化353无性系的几个主要条件进行了优化,并利用热激方法顺利诱导该无性系早期开花。研究结果对于杨属其他树种及木本植物早期开花研究具有参考价值。
1 材料与方法 1.1 材料 1.1.1 植物材料白杨派杂种无性系353无菌苗。无菌苗在1/2 MS+0.1 mg·L-1 IBA培养基中培养与增殖。培养条件为:(25±2)℃,16 h荧光灯光照,光强为45 μmol·m-2s-1。
1.1.2 农杆菌菌株与FT表达载体农杆菌菌株AGL1,每月在固体LB培养基(Weigel et al., 2002)上活化1次。植物表达载体为含有热激启动子HSP控制下的来自毛果杨的FT同源基因FT1的pK2GW7质粒,其中HSP为大豆(Glycine max)热激蛋白基因GmHsp17.6-L的启动子,选择性标记为NOS控制下的新霉素磷酸转移酶基因NPTⅡ。该表达载体(图 1)由美国Strauss实验室构建。

|
图 1 FT1基因表达载体结构 Figure 1 Structure of FT1 gene expression vector |
农杆菌侵染前活化。将农杆菌细胞在添加50 mg·L-1利福霉素(rifampicin,Sigma)、50 mg·L-1盐酸壮观霉素(spectinomycin,Sigma)和60 mg·L-1羧苄青霉素(carbenicilin,Sigma)的LB液体培养基中培养24 h,在28 ℃摇床上250 r·min-1培养2 h。细胞在3 500 r·min-1的离心机中离心30~40 min后汇集成球状,然后将沉淀悬浮在足量的农杆菌诱导培养基(IM)(Han et al., 2000)上一段时间后测定OD600值至所需(0.2~0.6)。
转化时,选取颜色深绿、质地厚实的无菌苗叶片,用打孔器打下4 mm大小的叶盘,叶盘在愈伤组织诱导培养基上黑暗条件下预培养0~7天,然后在一定浓度的农杆菌菌液(OD600=0.2~0.6)中侵染5~70 min(其间缓慢摇动)后,接种在愈伤组织诱导培养基上28 ℃黑暗条件下共培养1~5天。共培养后的外植体用无菌无离子水冲洗4次,然后用专门洗液(Han et al., 2000)冲洗1次后,转入含有200 mg·L-1特泯菌(timentin,Sigma)与100 mg·L-1卡那霉素(kanamycin,Sigma)的愈伤组织诱导培养基中培养至愈伤组织产生。然后把愈伤组织转入含有200 mg·L-1特泯菌与100 mg·L-1卡那霉素的芽诱导选择培养基中继续培养至不定芽产生,期间每15天在同样培养基上继代1次。将产生的不定芽转接在含有200 mg·L-1特泯菌与100 mg·L-1卡那霉素的芽伸长培养基中培养至2 cm长,然后转入含有25 mg·L-1卡那霉素的生根选择培养基中生根。
上述培养基均参考Filichkin等(2005)的配方。所有的培养基都是在120 ℃下灭菌20 min。植物生长调节物质和抗生素都是在过滤灭菌后再加入到培养基中。LB和IM培养基的pH分别为7.0和5.0,其他培养基的pH在灭菌前调至5.6~5.8。
在以上操作中,研究某一因素对FT1转化353的影响时,其他因素固定不变。每处理叶盘25片,接种于5个培养皿中。以最终在生根选择培养基中生根存活的卡那霉素抗性植株(Kmrp,kanamycin resistant plants)再生率作为评价转化率的间接指标。
Kmrp再生率(%)=(每处理最终生根存活的植株数量/每处理诱导的不定芽总数)×100。
以皿为单位进行数据统计,数据经平方根反正弦转换后用SPSS Statistics V17软件包(SAS Institute Inc.,1985) 进行方差分析和LSD多重比较。
1.2.2 Kmrp的PCR及PCR阳性植株的热激诱导检测Kmrp的PCR检测参考Filichkin等(2005)的方法,用于PCR扩增的2条引物分别为:引物1:5′-AGTGAAGGCATCGTATCAAGC-3′,引物2:5′-TCAGATATCTTATCGCCTCCTACC-3′。
经PCR检测阳性并扩繁移栽的转基因株系在温室培养2~3个月后,在光照培养箱(Percival Scientific,AR75L,196 cm × 195 cm ×90 cm)中37 ℃下每天1 h持续3周进行热激诱导开花。热激后,从植株上出现肉眼可见花芽时开始至开花结束,记录初始开花时间、花芽数、个体开花数目、花器官(柔荑花序、单朵花)数目与类型、花发育情况、花序长度等项目,对典型花器官拍照记录。
2 结果与分析 2.1 影响FT1基因转化353无性系的因素 2.1.1 预培养侵染前叶盘预培养对353无性系叶盘Kmrp再生率的影响达到了极显著水平(P<0.01)。在0~6天范围内,随着预培养时间的增加,叶盘产生的愈伤组织增多,Kmrp再生率呈上升趋势(表 1)。多重比较结果表明,在0.01显著水平上,培养3~7天的Kmrp再生率无显著性差异。由此确定在AGL1介导的FT1基因转化353无性系中,叶盘预培养3天以上对提高转化效果是有利的。
|
|
预培养能否提高转化率,报道不一(Sangwan et al., 1992; Mathis et al., 1994; Confalonieri et al., 1997)。一般认为在生长素浓度较高的培养基中预培养可以增加转化率(Sangwan et al., 1992; Mathis et al., 1994)。Han等(2000)研究表明,尽管预培养没有显著增加GUS基因表达率,但7天的预培养却增加了能在卡那霉素培养基上生长的绿色愈伤组织的数量。因此认为预培养对杨树转基因有利的一面可能是预培养可以增加外源DNA插入杨树染色体中的能力,而不是增加外源DNA转移到细胞的能力; 而且,预培养能否提高转化率,与使用的植物激素有关,因为在不定芽诱导中,预培养与细胞分裂素之间存在显著交互作用(Han et al., 2000)。由此推断,预培养对转化效果产生不同结果,除了树种因素之外,培养基的不同可能是另一主要原因,这在转基因研究中建立受体离体再生系统时应注意。
2.1.2 菌液浓度菌液浓度对353无性系叶盘Kmrp再生率的影响也达到了极显著水平(P<0.01)。菌液OD600值在0.2~0.6之间,随着OD600值的增加,Kmrp再生率呈上升趋势(表 2); OD600值达0.5以后,Kmrp再生率增加幅度不显著。随着农杆菌菌液浓度的增加,对叶盘的损伤程度也加重,主要症状是在后续培养过程中叶片切口部分逐渐褪绿坏死,坏死部分不能产生不定芽。OD600低于0.5时,坏死部分只占总叶盘的1/3左右; 高于0.5时,坏死部分占总叶盘的2/3还多,虽然此时的Kmrp再生率仍然较高,但前期愈伤组织产生的不定芽数量较少,导致此时的转化率统计误差增大。综合考虑对叶盘的伤害大小及Kmrp再生率的大小与可靠程度,本试验最终确定侵染菌液浓度为OD600=0.5。
|
|
杨树遗传转化中农杆菌菌液浓度OD600值多为0.2~0.4(Leple et al., 1992; Han et al., 2000; 诸葛强等,2003; Filichkin et al., 2005)。本研究中,AGL1菌株转化353需要较高的菌液浓度(OD600=0.5),这可能与受体基因型、农杆菌菌株及受体对农杆菌的敏感性有关。353无性系可能对农杆菌较不敏感,因此需要较高的菌液侵染浓度。
2.1.3 侵染时间试验结果(表 3)表明,AGL1介导的FT1基因转化353无性系所需侵染时间较长,在OD600=0.5时,侵染50 min时Kmrp再生率最高。50 min以下,随着侵染时间的延长,Kmrp再生率逐渐增加; 侵染5 min时,虽然叶盘诱导的不定芽数量最多,但未获得卡那霉素抗性植株; 5~20 min侵染时间内,Kmrp再生率均在6%以内; 30~50 min侵染时间内,Kmrp再生率平稳增加; 50~70 min内,侵染时间对Kmrp再生率影响不显著。较长的侵染时间,说明353无性系对AGL1农杆菌菌株敏感性较差。
|
|
以往的研究表明,侵染菌液浓度及侵染时间与树种、外植体类型、农杆菌菌株以及受体对农杆菌的敏感性有关(Leple et al., 1992; 周冀明等,1997; 郝桂霞等,1999)。因此,遗传转化中,在确定侵染菌液浓度及侵染时间时,应综合考虑这些因素。
2.1.4 共培养时间共培养时间对353无性系Kmrp再生率的影响达到极显著水平(表 4,P<0.01)。在1~5天共培养时间内,Kmrp再生率呈现先升高后下降的趋势,而且需要的共培养时间较短。共培养1天时的Kmrp再生率仅为15.94%,2天的共培养已经使再生率达最高值29.84%;共培养2天后,Kmrp再生率随着培养时间的延长而直线下降,这与Confalonieri等(1997)的研究结果类似。
|
|
杨树的共培养时间一般为3~5天(王善平等,1991; 郝桂霞等,1999; 樊军锋等,2002; 诸葛强等,2003; Filichkin et al., 2005)。本研究353无性系共培养时间较短,可能原因为:一是因为353无性系本身分化时间较短(24天),易于接受外源DNA的时间较快较集中; 二是因为随着共培养时间的延长,农杆菌对叶盘的伤害增大,导致叶盘不定芽分化率下降,进而间接地影响Kmrp再生率。研究发现,随着共培养时间的延长,叶盘分化平均不定芽数急剧下降(表 4),而且共培养3天后的叶盘,在后续培养过程中叶盘表面的农杆菌很难由抗生素控制,最终农杆菌会蔓延整个叶盘,叶盘褪绿坏死。
周冀明等(1997)认为不能以共培养时间长短来判断共培养是否成功,应以是否出现肉眼可见的微菌落作为结束共培养的标志。本研究中,共培养2天时大部分叶盘与培养基接触处出现可见微菌落,这与2天时Kmrp再生率最高相一致。可见,共培养中以肉眼可见微菌落的出现作为共培养结束的标志是可以普遍采用的方法。
2.2 Kmrp的PCR检测在上述试验中共获得50株Kmrp,经PCR检测获得转FT1基因的353无性系阳性植株32株。图 2中有32个植株在580 bp处出现了明显的扩增条带(FT1基因为580 bp大小的片段)。Kmrp数量与PCR检测结果表明,通过100 mg·L-1的卡那霉素不定芽再生选择压及25 mg·L-1的生根选择压之后获得的Kmrp再生率作为评价转化率的指标是比较可靠的,同PCR检测结果相比逃逸率在5%以内,这同Han等(1997)的研究结果一致。
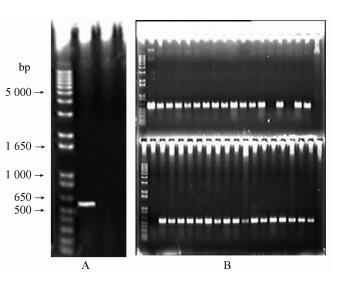
|
图 2 转FT1基因的Kmrp PCR检测结果 Figure 2 Result of PCR test to FT1 transgenic plants A. 1 kb plus DNA ladder及阳性质粒扩增结果; B.卡那霉素抗性植株扩增结果。 A. 1kb plus DNA ladder and result of PCR to positive plasmid; B. Result of PCR to kanamycin resistant plants. |
对32个PCR阳性株系扩繁后的155个个体进行了热激诱导开花试验(图 3A)。热激后第23天看到第1个植株开花,随后越来越多的植株上产生花芽,最终有12个PCR阳性株系的20个植株开花,开花株系的开花率为20%~100%。开花植株高度都在20 cm以上,低于20 cm的植株未能诱导开花。尽管32个转基因株系都是经过PCR阳性反应检测的,但不是所有株系热激后都能开花,同一株系繁殖而成的不同个体在不同时间的热激处理中也存在开花与不开花现象。造成这种结果的原因之一可能是个体本身的生理生化差异影响了热激诱导下FT1基因的顺利表达。另一原因可能是FT1基因插入杨树基因组的不同位置影响的结果,如正向或者反向序列位于插入位点的周围,导致不同的表达强度和特异性,或者插入异染色质区而非常染色质区域时,由于其与周边序列碱基组成的差异,都可以引起基因沉默,从而失去表达的能力。这种现象在杨树(Kumar et al., 2001)和其他树种的转基因研究中很常见(Beaujean et al., 1998; Miki et al., 2009)。

|
图 3 热激诱导FT1表达促进转基因植株早期开花 Figure 3 Heat shock induced expression of FT1 and promoted precociously flowering of transgenic plants A. PCR阳性植株在37 ℃下每天持续热激1 h诱导开花; B.热激诱导产生的顶端花序及腋生单朵花; C.正常的顶端花序; D.回复营养生长的顶端花序; E.诱导产生的两性花; F.诱导产生的雄花花药; G.雄花散粉后得到的花粉。 A. Flowering of PCR positive plants were induced by heat shock in the condition of 37 ℃ and 1 hour per day; B: Terminal staminate catkin and single flowers in leaf axils; C: Normal terminal catkin; D: Terminal staminate catkin on which the distal end has resumed vegetative development; E: Hermaphrodite flowers were induced; F: Anthers of male flower; G: Pollens were obtained after dehiscence of anthers. |
开花植株上一般仅产生1个很大的顶端花序(图 3B),个别植株上还会产生1~3个腋生花序。在顶端花序下面,也会产生2~5个单朵花(图 3B)。顶端花序一般能够正常发育,充分伸长后可以达到2~3 cm(图 3C)。除了在株系17和19中的部分开花植株产生正常花序外,其他植株上的顶端花序几乎都会回复营养生长(图 3D)。在株系51中还观察到了1个花序的基部产生1个两性花朵(图 3E)。尽管回复营养生长的花序数目很多,但在正常的和回复营养生长的花序中都观察到了发育成熟的正常花药(图 3F),并看到了随后的花药散粉现象(图 3G),散粉的株系有17,19和51。花粉均产生于花序,单朵花上未观察到花粉产生。
3 结论与讨论本文研究表明,预培养、侵染时间、菌液浓度以及共培养时间等因素对AGL1介导的FT1基因转化白杨派杂种无性系353叶盘Kmrp再生率的影响均达到了极显著水平。利用优化的转化方案,即:叶盘在愈伤组织诱导培养基上暗培养6天,然后用活化至OD600=0.5的菌液侵染60 min,再在愈伤组织诱导培养基上共培养2天,可使FT1基因转化353的平均Kmrp再生率达到29.84%。利用优化的转化条件最终获得了32个PCR阳性植株,其中12个阳性植株在热激条件下使FT1基因顺利表达,成功诱导了早期开花。
影响农杆菌介导的杨树转化率的外因很多,有农杆菌菌株类型、受体材料是否进行预培养、农杆菌侵染时间及侵染菌液浓度、共培养时间、培养基的添加成分如乙酰丁香酮(AS)、培养基的pH值等(Fillatti et al., 1987; Leple et al., 1992; Confalonieri et al., 1997; 周冀明等,1997; 郝桂霞等,1999; 诸葛强等,2003)。本文只是选取了4个比较重要的因素进行研究,对未涉及的因素是否也会显著影响转化率需要进一步研究确定。此外,本研究中,FT1基因转化353时,叶盘需要较长时间的AGL1侵染(60 min)及较高的菌液浓度(OD600=0.5),表明353无性系对农杆菌AGL1不敏感,但只需较短的共培养时间(2天),原因除了前面分析的可能与353叶盘分化时间较快有关外,似乎还暗示了植物表达载体可能会与农杆菌菌株产生某种互作效应,这种效应会影响外源基因向受体基因组转移的速度。因此,在转基因研究中选择农杆菌菌株时,仅仅以受体材料是否对农杆菌敏感作为中选标准可能不一定准确。遗传转化中,要考虑不同树种、同一树种的不同外植体、不同农杆菌,甚至于含不同基因的植物表达载体、不同培养基条件之间的交互作用。
FT基因诱导杨树早期开花的机制与诱导拟南芥开花的机制类似(Böhlenius et al., 2006),都与CO/FT调节元件有关。拟南芥中,当合适的光信号被叶片感知后,CO(CONSTANS)蛋白激活叶片韧皮部的FT基因(Takada et al., 2003; An et al., 2004),而后,FT蛋白从韧皮部移动到茎尖分生组织(Corbesier et al., 2007),激活FD(FLOWERING LOCUS D)基因的表达,而后FT蛋白与FD蛋白组成蛋白复合体,共同激活AP1(APETALA1),LFY(LEAFY)等花分生组织特性基因的表达,引起开花(Abe et al., 2005; Corbesier et al., 2007; Mathieu et al., 2007)。所不同的是,杨树中,CO/FT调节元件也影响短日照诱导的季节性休眠(Böhlenius et al., 2006)。这说明,FT类基因的表达主要受光周期调控。生长于长日照(14 h)下的转35S::FT2的美洲黑杨(Populus deltoides)植株,其FT2转录丰度高于生长于短日照(8 h)下的转基因植株(Hsu et al., 2006)。对生长于不同纬度地区的欧洲山杨(P. tremula)研究表明,FT1表达具有同样的模式,即,只有当日照长度高于某一纬度树种在该地区的临界日长时,FT1才出现表达峰值,低于临界日长时,FT1只有微量表达(Böhlenius et al., 2006)。因使用的是诱导型启动子,本研究未考虑353原分布区的临界日长,是否不同光周期会影响HSP启动子控制的FT类基因的表达,后续研究应予以考虑。
本研究中,高于20 cm的转基因植株才能被热激诱导开花,Hsu等(2006)也发现,转35S::FT1基因的不同年龄植株的顶芽(2~6年),其FT1表达水平呈现随年龄增加而逐渐升高的趋势。这说明,植株发育程度是影响FT基因表达的另一因素。一般认为,幼年分生组织对开花信号的反应要么被封闭要么很弱,幼年植株表现出不足以维持完整的花序分生组织活力和发育的能力,常常导致单朵花、短花序,不完整的花、配子及果实的发育(Stanton et al., 1996; Chalupka et al., 1997)。这表明,在HSP控制的FT基因促花研究中,热激诱导开花时热激材料需要达到一定的年龄或发育时期,过早的诱导会削弱正常花、配子和果实的发育。
同组成型启动子控制的开花基因转化结果相比(Hsu et al., 2006; Böhlenius et al., 2006; Flachowsky et al., 2009),热激启动子控制的转FT1基因的植株获得了较多的正常花序,而且观察到了花药的正常散粉现象。但是花器官变异类型依然较多。如前所述,这可能与热激植株的发育状态有关,也可能与热激条件有关(后续研究表明,增加热激持续的时间和热激温度,可以增加正常花序的数量,尤其可以抑制顶端花序回复营养生长),更主要可能是外源基因随机插入杨树基因组的不同位点而引起转基因植株的表型差异所致。因此,深入研究异常花产生的原因,获得更多正常花序,是FT基因在杨树等木本植物中应用的关键。比如,采用较大的转基因植株进行热激是否可以获得较多的正常花序,不同来源的FT基因是否在诱导正常花器官效果上存在差异,FT基因插入位点不同究竟如何影响花器发育等等。这些将是今后研究工作的重点。相信随着FT基因在模式植物拟南芥及其他1年生植物中的更深入研究,杨树中存在的这些问题将会得到解决,FT基因将在木本植物遗传改良中发挥重要作用。
樊军锋, 李玲, 韩一凡, 等. 2002. 84K杨树耐盐基因转化研究[J]. 西北林学院学报, 17(4): 33-37. |
郝贵霞, 朱桢, 朱之悌. 1999. 毛白杨遗传转化系统优化的研究[J]. 植物学报, 41(9): 363-940. |
王善平, 许农, 许智宏, 等. 1991. 利用PEG法对GUS基因在几种杨树原生质体中瞬间表达的研究[J]. 试验生物学报, 24(1): 71-73. |
周冀明, 卫志明, 许智宏, 等. 1997. 根癌农杆菌介导转化诸葛菜获得转基因植株[J]. 植物生理学报, 23(1): 21-28. |
诸葛强, 王婕琛, 陈英, 等. 2003. 新疆杨高效遗传转化系统的建立[J]. 植物资源与环境学报, 12(4): 6-10. |
Abe M, Kobayashi Y, Yamamoto S, et al. 2005. FD, a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex[J]. Science, 309(5737): 1052-1056. DOI:10.1126/science.1115983 |
An H, Roussot C, Suárez-López P, et al. 2004. CONSTANS acts in the phloem to regulate a systemic signal that induces photoperiodic flowering of Arabidopsis[J]. Development, 131(15): 3615-3626. DOI:10.1242/dev.01231 |
Beaujean A, Sangwan R S, Hodges M, et al. 1998. Effect of ploidy and homozygosity on transgene expression in primary tobacco transformants and their androgenetic progenies[J]. Molecular and General Genetics MGG, 260(4): 362-371. DOI:10.1007/s004380050905 |
Böhlenius H, Huang T, Charbonnel-Campaa L, et al. 2006. CO/FT regulatory module controls timing of flowering and seasonal growth cessation in trees[J]. Science, 312(5776): 1040-1043. DOI:10.1126/science.1126038 |
Chalupka W C, Cecich R A. 1997. Control of the first flowering in forest trees[J]. Scandinavian Journal of Forest Research, 12(1): 102-111. DOI:10.1080/02827589709355390 |
Confalonieri M, Balestrazzi A, Cella R. 1997. Genetic transformation of Populus deltoides and P.euramericana clones using Agrobacterium tumefaciens[J]. Plant Cell Tiss Org Clit, 48(1): 53-61. DOI:10.1023/A:1005838032153 |
Corbesier L, Vincent C, Jang S, et al. 2007. FT protein movement contributes to long-distance signaling in floral induction of Arabidopsis[J]. Science, 316(5827): 1030-1033. DOI:10.1126/science.1141752 |
Crone D, Rueda J, Martin K L, et al. 2001. The differential expression of a heat shock promoter in floral and reproductive tissues[J]. Plant Cell and Environment, 24(8): 869-874. DOI:10.1046/j.1365-3040.2001.00727.x |
Filichkin S A, Meilan R, Busov V B, et al. 2005. Alcohol-inducible gene expression in transgenic Populus[J]. Plant Cell Rep, 25(7): 660-667. |
Fillatti J J, Sellner J, Mccown B. 1987. Agrobacterium mediated transformation and regeneration of Populus[J]. Molecular and General Genetics MGG, 206(2): 192-199. DOI:10.1007/BF00333574 |
Flachowsky H, Hanke M V, Peil A, et al. 2009. A review on transgenic approaches to accelerate breeding of woody plants[J]. Plant Breeding, 128(3): 217-226. DOI:10.1111/pbr.2009.128.issue-3 |
Han K H, Meilan R, Ma C, et al. 2000. An Agrobacterium tumefaciens transformation protocol effective on a variety of cottonwood hybrids (genus Populus)[J]. Plant Cell Reports, 19(3): 315-320. DOI:10.1007/s002990050019 |
Han K H, Gordon M P, Strauss S H. 1997. High-frequency transformation of cottonwood (genus Populus ) by Agrobacterium rhizogenes[J]. Can J For Res, 27(4): 464-470. DOI:10.1139/x96-181 |
Hsu C Y, Liu Y, Luthe D S, et al. 2006. Poplar FT2 shortens the juvenile phase and promotes seasonal flowering[J]. Plant Cell, 18(8): 1846-1861. DOI:10.1105/tpc.106.041038 |
Huang T, Bohlenius H, Eriksson S, et al. 2005. The mRNA of the Arabidopsis gene FT moves from leaf to shoot apex and induces flowering[J]. Science, 309(5741): 1694-1696. DOI:10.1126/science.1117768 |
Igasaki T, Watanabe Y, Nishiguchi M, et al. 2008. The FLOWERING LOCUS T/TERMINAL FLOWER family in Lombardy poplar[J]. Plant and Cell Physiology, 49(3): 291-300. DOI:10.1093/pcp/pcn010 |
Kumar S, Fladung M. 2001. Gene stability in transgenic aspen (Populus). Ⅱ[J]. Molecular characterization of variable expression of transgene in wild and hybrid aspen. Planta, 213(5): 731-740. |
Leple J C, Pilate G, Jouanin L. 1992. Transgenic poplar trees[J]. Berlin: Springer-Verlag: 221-224. |
Mathieu J, Warthmann N, Kuttner F, et al. 2007. Export of FT protein from phloem companion cells is sufficient for floral induction in Arabidopsis[J]. Current Biology, 17(12): 1055-1060. DOI:10.1016/j.cub.2007.05.009 |
Mathis N L, Hinchee M A W. 1994. Agrobacterium inoculation techniques for plant tissues//Gelvin S B, Schilperoort R A. Plant molecular biology manual. Boston: Kluwer Academic Publ, 1-9.
|
Miki B, Abdeen A, Manabe Y, et al. 2009. Selectable marker genes and unintended changes to the plant transcriptome[J]. Plant Biotechnology Journal, 7(3): 211-218. DOI:10.1111/pbi.2009.7.issue-3 |
Sangwan R S, Bourgeois Y, Brown S, et al. 1992. Characterization of competent cells and early events of Agrobacterium-mediated genetic transformation in Arabidopsis thaliana[J]. Planta, 188(3): 439-456. |
Stanton B J, Villar M. 1996. Controlled reproduction of Populus//Stettler R F, Bradshaw H D, Heilman P E, et al. Biology of Populus. Ottawa: NRC Research Press, 113-138.
|
Takada S, Goto K. 2003. TERMINAL FLOWER2, an Arabidopsis homolog of HETEROCHROMATIN PROTEIN1, counteracts the activation of FLOWERING LOCUS T by CONSTANS in the vascular tissues of leaves to regulate flowering time[J]. Plant Cell, 15(12): 2856-2865. DOI:10.1105/tpc.016345 |
Weigel D, Glazebrook J. 2002. Arabidopsis: A laboratory manual[M]. New York: Cold Spring Harbor Laboratory Press.
|
 2011, Vol. 47
2011, Vol. 47