文章信息
- 王利, 杨洪强, 张召, 范伟国, 姜倩倩, 冉昆
- Wang Li, Yang Hongqiang, Zhang Zhao, Fan Weiguo, Jiang Qianqian, Ran Kun
- 根区酸化对平邑甜茶叶片光系统Ⅱ活性及光合速率的影响
- Effects of Rhizosphere Acidity on Activity of Photosystem Ⅱ and Photosynthetic Rate in Malus hupehensis Leaves
- 林业科学, 2011, 47(10): 167-171.
- Scientia Silvae Sinicae, 2011, 47(10): 167-171.
-
文章历史
- 收稿日期:2010-10-08
- 修回日期:2011-01-04
-
作者相关文章
2. 山东农业大学园艺科学与工程学院 作物生物学国家重点实验室 山东省果树生物学重点实验室 泰安 271018;
3. 山东农业大学农业资源利用博士后流动站 泰安 271018
2. State Key Laboratory of Crop Biology Shandong Province Key Laboratory of Fruits Biology College of Horticultural Science and Engineering, Shandong Agricultural University Tai'an 271018;
3. Post-Doctoral Mobile Station of Agricultural Resource Utilization, Shandong Agricultural University Tai'an 271018
由于环境污染、酸雨沉降及氮素化肥过度使用等原因,中国土壤已出现大规模酸化现象(Guo et al., 2010)。据报道,目前,我国土壤酸化面积已占国土面积的20%以上,随着工农业生产的不断发展,酸化面积和程度逐渐增加(易杰祥等,2006)。酸化是pH下降的结果,关于pH值对叶片生理特性研究,主要集中在酸雨影响上,如酸雨改变叶片中酶活性(倪寿清等,2008),通过喷洒酸性溶液模拟酸雨能够加剧植物叶片膜脂过氧化,破坏抗氧化系统(李志国等,2007),伤害假俭草(Eremochloa ophiuroides)、龙眼(Euphoria longan)PSⅡ反应中心及改变叶绿素荧光参数(邱栋梁等,2002;马博英等,2006),使植物光合系统遭受破坏和光合速率下降(邱栋梁等,2002;Neveo et al., 2009)。
酸雨落入土壤而导致土壤酸化,从而增加茶树(Camellia sinensis)可交换态铅的数量(章明奎等,2005),降低土壤养分的有效性(尹永强等,2008)和叶片光合作用(童贯和等,2005),但土壤酸化影响叶片光合作用的机制尚不清楚。叶片PSⅡ反应中心活性和叶绿素荧光参数等,是反映光合作用机制的重要指标,其中PSⅡ反应中心可调节植物对光能的利用和光合作用的运行,而叶片叶绿素荧光诱导动力学可以在非离体条件下快速反映PSⅡ反应中心、电子供体侧和受体侧的功能变化(Strasser et al., 1995;Schansker et al., 2003;李鹏民等,2005;Jiang et al., 2006a)。人们已根据荧光动力学曲线的特征变化,发现大豆(Glycine max)、紫叶小檗(Berberis thunbergii)和高羊茅(Festuca arundinacea)等多种植物叶片的PSⅡ活性会受到温度、光照、铅及盐胁迫等的严重干扰(van Heerden et al., 2003;李鹏民,2007;姚广等,2009a; 2009b)。但土壤酸化如何影响PSⅡ的活性以及在PSⅡ的哪个位点损伤光系统目前还不明确。
平邑甜茶(Malus hupehensis)属于湖北海棠的一个类型,是我国特有的苹果属(Malus)植物资源,喜温耐湿,具有良好的耐涝、抗病和耐盐碱能力,不仅可作为观赏植物,还常用作苹果良种和观赏海棠的砧木(束怀瑞,1999;Yang et al., 2008);此外,平邑甜茶还是一种经济价值很高的类茶植物,其嫩叶提取物对人体具有良好的保健功能(刘良忠等,2004)。土壤酸化实际是根区环境的酸化,根区环境直接干扰根系的结构和功能(杨洪强等,2007),而这必然会影响植株地上部的生理变化。本研究以平邑甜茶为试材,通过调节根区营养液的pH,探讨根区酸化对叶片光合特性的影响,为进一步揭示土壤酸化危害植物的机制奠定基础。
1 材料与方法 1.1 试验材料与处理取大小比较一致的平邑甜茶种子,经消毒层积后播在容器中进行育苗。当幼苗刚出现第2片真叶时,将生长相近的植株移至1/2Hoagland营养液(pH 6)中培养,每3天换1次培养液,至出现第6片叶,大约苗高12 cm、苗粗0.2 cm后,将1/2Hoagland营养液pH值分别调为3和4进行根区酸化处理,每处理3株,重复3次,处理后第8天测定。由于一般情况下苹果砧木生长的适宜pH值为5.5~6.7(束怀瑞,1999),故以pH为6的1/2Hoagland营养液做本试验的对照。
1.2 净光合速率、气孔导度和胞间CO2浓度的测定在室内人工控制光强1 000 μmol·m-2s-1的条件下,选取每个处理植株从上方数第4片叶,利用CIRAS-2型便携式光合作用测定系统(PP-Systems,英国),测定其净光合速率(Pn)、气孔导度(Gs)和胞间CO2浓度(Ci),重复3次,求其平均值。
1.3 荧光参数的测定各处理植株的叶片经过20 min暗处理,用FMS-2型调制式荧光仪先测定初始荧光Fo、最大荧光Fm;然后在800 μmol·m-2s-1的光下,叶片经过光化学作用后达到稳态,测得稳态荧光Fs,再启用饱和脉冲光测定最小荧光F′o,启用远红光测定光下最大荧光F′m。利用上述参数分别计算PSII最大光化学效率Fv/Fm=(Fm-Fo)/ Fm,反应中心光能捕获效率F′v/F′m=(F′m-F′o)/F′m,实际光化学效率ΦPSⅡ=(F′m-Fs)/F′m,PSⅡ的光化学猝灭系数qP=(F′m-Fs)/ (F′m-F′o) (姚广等,2009a),每处理重复测定3次,求其平均值。
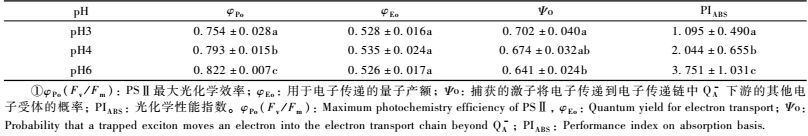
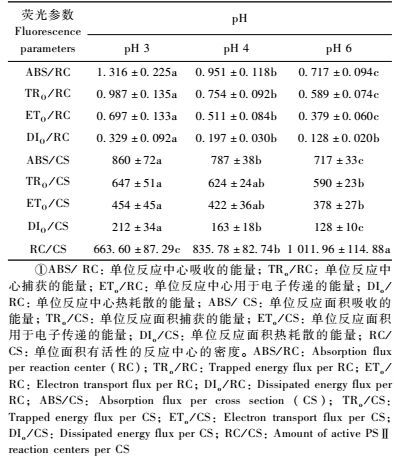
1.4 快速叶绿素荧光诱导动力学曲线的测定参考李鹏民(2001)的方法,叶片经过15 min暗适应的处理后,在饱和脉冲光(3 000 μmol·m-2s-1)下暴露1 s,再用Handy PEA (Hansatech,英国)测定叶片快速叶绿素荧光诱导动力学曲线(O-J-I-P曲线),随后对O-J-I-P曲线进行JIP-test分析,并计算PSⅡ最大光化学效率(φPo)、在J相、I相的相对可变荧光(VJ,VI)、捕获的激子将电子传递到电子传递链中QA-下游的其他电子受体的概率(Ψo)、用于电子传递的量子产额(φEo)、光化学性能指数(PIABS)、在K点的可变荧光FV占FJ-FO振幅的比例(Wk)、标准化的互补面积(Sm)和单位反应中心吸收(ABS/RC)、捕获(TRo/RC)、用于电子传递(ETo/RC)、热耗散掉的能量(DIO/RC)与单位面积吸收ABS/CS、捕获(TRo/CS)、用于电子传递(ETo/CS)、热耗散掉的能量(DIO/CS)以及有活性的反应中心的密度(RC/CS)。
1.5 数据分析对所测数据利用DPS软件进行相关数据统计分析,并用LSD法进行差异显著性检验。
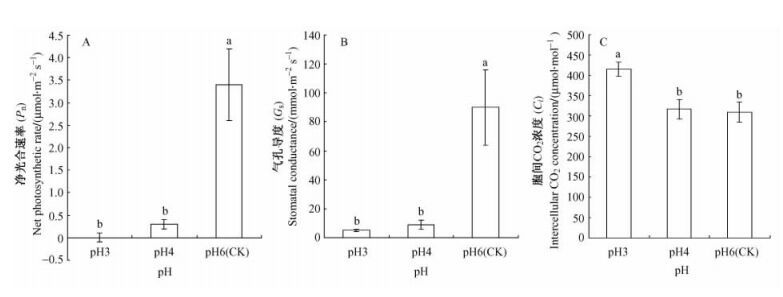
2 结果与分析 2.1 根区酸化对平邑甜茶Pn, Gs和Ci的影响从图 1可以看出:在根区溶液为酸性时(pH3, pH4)平邑甜茶幼苗净光合速率和气孔导度均显著下降,而胞间CO2浓度在pH3时显著增大。
|
图 1 根区酸化对平邑甜茶叶片Pn (A)、Gs (B)和Ci (C)的影响 Figure 1 Effects of rhizosphere acidification on Pn (A), Gs (B)和Ci (C) of leaves in Malus hupehensis 图中数据上不同小写字母表示在0.05水平有显著差异。Different letters in the figures stand for the significant difference at the 0.05 level.下同。The same below. |
由表 1可知:在根区溶液pH不同时,叶片PSⅡ反应中心光能捕获效率(F′v/F′m)、PSⅡ最大光化学效率(Fv/Fm)、PSⅡ实际光化学效率(ΦPSⅡ)和PSⅡ的光化学猝灭系数(qP)均存在明显差异,在pH6时,4种指标均最高,在pH3时最低,根区酸化显著改变平邑甜茶叶片光系统Ⅱ的光化学反应以及对所吸收光能的分配。
|
|
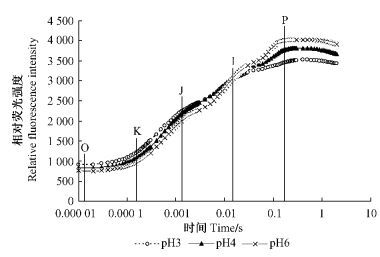
经过8天根区酸化处理后,利用Handy PEA仪器获得了平邑甜茶叶片荧光动力学曲线(图 2),曲线显示根区酸化改变了叶片荧光诱导曲线的形状,在O(t=20 μs)、K(t=300 μs)点时,荧光强度Fo、Fk随着pH值的减小而上升。
|
图 2 根区酸化对平邑甜茶荧光诱导曲线的影响 Figure 2 Effects of rhizosphere acidification on fluorescence induction curves of leaves in M. hupehensis |
1) 根区酸化对Ψo,φEo,PIABS,Sm,WK,WJ,VK,VJ,VI的影响根区酸化处理后反映PSⅡ光化学活性和电子传递的参数均发生了变化(表 2,3),其中随着pH值的降低,φPo, PIABS和Sm值减小,Ψo, WK, VJ和VI增大,而φEo无明显变化。WK值的增加意味着PSⅡ供体侧受到的伤害随着根区酸化程度的提高越来越严重,Sm的减小及VJ, VI的上升,表明PSⅡ受体侧的电子传递能力出现下降(表 3)。
|
|
|
|
2) 根区酸化对光能吸收利用的影响根区酸化也改变了平邑甜茶单位反应中心能量吸收和利用的状况、受光面积量子效率以及活性反应中心的密度(表 4),比如,随着pH值的降低,ABS/RC, TRO/RC, ETO/RC, DIO/RC, ETO/CS, ABS/CS、DIO/CS和TRO/CS值明显上升,而单位面积上有活性的反应中心的密度(RC/CS)随着处理pH值的降低而显著减少。
|
|
模拟酸雨喷洒试验表明:叶面环境酸化对植物叶片具有直接伤害作用,它会使受试植物叶片膜脂发生过氧化(Yoshida et al., 2004;李志国等,2007),改变叶片PSⅡ的反应中心和叶绿素荧光参数,降低叶片光合速率,破坏植物光合系统(邱栋梁等,2002;马博英等,2006)。酸雨沉降会使土壤逐渐酸化,土壤酸化则导致小麦光合速率下降(童贯和等,2005);土壤为根区,而根区酸化也使平邑甜茶叶片净光合速率和气孔导度明显下降,同时胞间CO2浓度升高(图 1)。Farquhar等(1982)指出:在光合速率和气孔导度同向变化而胞间CO2浓度以相反方向变化时,说明气孔不是限制光合作用的主要原因,由此可推测,根区酸化时平邑甜茶叶片净光合速率的下降主要不在于气孔。
事实上,除气孔因素外,光合速率还受非气孔因素影响。平邑甜茶叶片叶绿素荧光动力学曲线的JIP-test分析显示,Fv/Fm, PIABS,RC/CS等都随着根区酸化(pH值降低)而显著变小(表 1,2和4),进一步说明根区酸化导致光合速率的下降的原因主要不在于气孔,而是由于根区酸化破坏了光合系统的结构和功能,干扰光能的吸收和利用,随着根区溶液pH值降低,单位面积上有活性的反应中心的密度(RC/CS)却显著变小。
另外,根区酸化伤害PSⅡ供体侧和受体侧。放氧复合体(OEC)是PSⅡ反应中心氧化端最主要的结构单元,OEC被破坏的程度可由WK大小所反映(Strasser,1997;Jiang et al., 2006b),而叶绿素荧光诱导动力学曲线中K点的出现表示OEC受到伤害,OEC的破坏程度会对植物光合作用中的水裂解和电子传递产生影响。根区酸化(pH3,pH4处理)使平邑甜茶叶片WK上升,说明根区酸化改变了OEC的结构和功能,从而减弱了PSⅡ供体侧的电子传递,使PSⅡ反应中心氧化端的电子传递受到影响。平邑甜茶叶片qP在根区酸化后下降,表明根区酸化使PSⅡ受体侧的电子传递下降,这与根区酸化使VJ, VI逐渐增加所反映的事实一致,显示根区酸化也伤害了PSⅡ反应中心的还原端。PIABS是一个能够全面反映PSⅡ状态和活性的综合性指标,PIABS下降意味着PSⅡ的光合结构和功能都受到了比较大的伤害(Shcansker et al., 2003);根区酸化时平邑甜茶叶片PIABS下降,说明根区酸化使叶片PSⅡ光合结构和功能都受到了伤害。PSⅡ光合结构和功能受到损伤必然会降低PSⅡ活性,而PSII活性的降低会导致植物叶片净光合速率下降(孙建云等,2007),因此,平邑甜茶叶片PSⅡ活性的下降是根区酸化导致净光合速率变小的重要原因之一。
李鹏民. 2007. 快速叶绿素荧光诱导动力学在植物逆境生理研究中的应用. 山东农业大学博士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-10434-2007135638.htm
|
李鹏民, 高辉远, StrasserR J. 2005. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J]. 植物生理与分子生物学学报, 31(6): 559-566. |
李志国, 姜卫兵, 翁忙玲, 等. 2007. 模拟酸雨对木兰科树种叶片膜脂过氧化和抗氧化系统的影响[J]. 生态环境, 16(3): 779-784. |
刘良忠, 丁士勇, 汤丽娜. 2004. 湖北海棠叶茶饮料及其稳定性研究[J]. 湖北农学院学报, 24(4): 326-327. |
马博英, 徐礼根, 蒋德安. 2006. 模拟酸雨对假俭草叶绿素荧光特性的影响[J]. 林业科学, 42(11): 8-11. DOI:10.3321/j.issn:1001-7488.2006.11.002 |
倪寿清, 宋晓东, 崔清洁, 等. 2008. 模拟酸雨胁迫下中国北方小麦生理特性研究[J]. 山东农业大学学报:自然科学版, 39(1): 19-22. |
邱栋梁, 刘星辉, 郭素枝. 2002. 模拟酸雨对龙眼叶片气体交换及叶绿素a荧光参数的影响[J]. 植物生态学报, 26(4): 441-446. |
束怀瑞. 1999. 苹果学[M]. 北京: 中国农业出版社: 31-32, 273.
|
孙建云, 沈振国. 2007. 镉胁迫对不同甘蓝基因型光合特性和养分吸收的影响[J]. 应用生态学报, 18(11): 2605-2610. |
童贯和, 程滨, 胡云虎. 2005. 模拟酸雨及其酸化土壤对小麦幼苗生物量和某些生理活动的影响[J]. 作物学报, 31(9): 1207-1214. |
杨洪强, 束怀瑞. 2007. 苹果根系研究[M]. 北京: 科学出版社: 87-90.
|
姚广, 高辉远, 王末末, 等. 2009a. 铅胁迫对玉米幼苗叶片光系统功能及光合作用的影响[J]. 生态学报, 29(3): 1162-1169. |
姚广, 王鑫, 高辉远, 等. 2009b. 盐胁迫对高羊茅叶片光系统活性的影响[J]. 中国草地学报, 31(2): 46-52. |
易杰祥, 吕亮雪, 刘国道. 2006. 土壤酸化和酸性土壤改良研究[J]. 华南农业大学学报, 12(1): 23-28. |
尹永强, 何明雄, 邓明军, 等. 2008. 土壤酸化对土壤养分及烟化品质的影响及改良措施[J]. 中国烟草科学, 29(1): 51-54. |
章明奎, 方利平, 张履勤. 2005. 酸化和有机质积累对茶园土壤铅生物有效性的影响[J]. 茶叶科学, 25(3): 159-164. |
Farquhar G D, Sharkey T D. 1982. Stomatal conductance and photosynthesis[J]. Annual Reviews Plant Physiology, 33: 317-345. DOI:10.1146/annurev.pp.33.060182.001533 |
Guo J H, Liu X J, Zhang Y, et al. 2010. Significant acidification in major Chinese croplands[J]. Science, 327(5968): 1008-1010. DOI:10.1126/science.1182570 |
Jiang C D, Shi L, Gao H Y, et al. 2006a. Development of photosystems 2 and 1 during leaf growth in grapevine seedlings probed by chlorophyll a fluorescence transient and 820 nm transmission in vivo[J]. Photosynthetica, 44(3): 454-463. DOI:10.1007/s11099-006-0050-5 |
Jiang C D, Jiang G M, Wang X, et al. 2006b. Enhanced photosystem 2 themostability during leaf growth of elm (Ulmus pumila) seedlings[J]. Photosynthetica, 44(3): 411-418. DOI:10.1007/s11099-006-0044-3 |
Neveo N R, Oliva M A, da Cruze Centeno D, et al. 2009. Photosynthesis and oxidative stress in the restinga plant species Eugenia uniflora L[J]. exposed to simulated acid rain and iron ore dust deposition potentional use in environmental risk assessment. Science of the Total Environment, 407: 3740-3745. |
Schansker G, Srivastava A, Govindj J, et al. 2003. Characterization of the 820-nm transmission signal paralleling the chlorophyll a fluorescence rise (OJIP) in pea leaves[J]. Functional Plant Biology, 30: 785-796. DOI:10.1071/FP03032 |
Strasser B J. 1997. Donor side capacity of photosystem Ⅱ probed by chlorophyll fluorescence transient[J]. Photosynth Research, 52(2): 147-155. DOI:10.1023/A:1005896029778 |
Strasser R J, Srivastava A, Govindjee. 1995. Polyphasic chlorophyll a fluorescence transients in plants and cyanobacteria[J]. Photochemistry and Photobiology, 61: 32-42. DOI:10.1111/php.1995.61.issue-1 |
van Heerden P D R, Tsimilli-Michael M, Krüger G H J, et al. 2003. Dark chilling effects on soybean genotypes during vegetative development:parallel studies of CO2 assimilation, chlorophyll a fluorescence kinetics O-J-I-P and nitrogen fixation[J]. Physiologia Plantrum, 117(4): 476-491. DOI:10.1034/j.1399-3054.2003.00056.x |
Yang H Q, Duan K X, Zhang W. 2008. Biology and physiology of Malus hupehensis for the apogamic plant resource[J]. Acta Horticulturae, 769: 441-447. |
Yoshida K, Shibasaki R, Takami C, et al. 2004. Response of gas exchange rates in Abies firma seedlings to various additional stresses under acid fog stress[J]. The Japanese Forestry Research, 9(3): 195-203. DOI:10.1007/s10310-003-0069-4 |
 2011, Vol. 47
2011, Vol. 47