文章信息
- 苌姗姗, 胡进波, ClairBruno, QuignardFrançoise
- Chang Shanshan, Hu Jinbo, Clair Bruno, Quignard Françoise
- 氮气吸附法表征杨木应拉木的孔隙结构
- Pore Structure Characterization of Poplar Tension Wood by Nitrogen Adsorption-Desorption Method
- 林业科学, 2011, 47(10): 134-140.
- Scientia Silvae Sinicae, 2011, 47(10): 134-140.
-
文章历史
- 收稿日期:2010-06-21
- 修回日期:2010-07-10
-
作者相关文章
2. Laboratoire de Mécanique et Génie Civil,Université Montpellier 2 France 34095;
3. Institut Charles Gerhardt Montpellier,Université Montpellier 2 France 34296
2. Laboratoire de Mécanique et Génie Civil LMGC, Université Montpellier 2, Montpellier, 34095, France;
3. Institut Charles Gerhardt Montpellier, UMR 5253 Université Montpellier 2, Montpellier, 34296, France
应拉木是树木中的非正常木材,广泛存在于阔叶材倾斜树干或树枝的上侧(Isebrands et al., 1972)和部分速生阔叶材垂直树干中(刘盛全等,1996),通过产生高拉伸应力使树干或枝维持自然角度方向(Wardrop,1964;Fisher et al., 1981)。许多应拉木以含有胶质纤维为特征,而胶质层的微细结构对应拉木的材性和加工利用有重要的影响,特别是对应拉木的干缩特性有着直接的影响(Fang et al., 2008a;2008b)。有研究表明(Clair et al., 2008):由于胶质层具有凝胶胶体的一些性质,在干燥过程中,会引起应拉木微结构网络的收缩和塌陷,造成应拉木的纵向收缩异常大,致使木材多翘曲和开裂,给加工和利用带来困难。要解决这些问题,就需要详细了解应拉木内部孔径分布这个最基础的参数。目前研究木材孔隙结构主要采用电子显微镜直接观察法(王丽娟等,2005;董卫国等,2007)。TEM,HRTEM,STM,AFM等分析技术存在制样难、样品易损坏等缺点,而且只能进行定性研究,不能对孔隙分布、孔体积、孔表面积进行定量表征;而氮气吸附法在不改变材料原始特性的基础上,能定量得到微观结构的统计信息,更能揭示材料的总体特征(Valentin et al., 2005;Quignard et al., 2008)。本文在常规解剖特征分析的基础上,利用ASAP 2010型比表面积和孔径分析仪对杨木应拉木的孔径分布及比表面积特征进行测定,通过解析氮气吸附等温线,对杨木应拉木的孔隙结构进行表征,为全面认识应拉木和提高其利用价值提供理论依据。
1 材料与方法 1.1 试验材料试验材料取自杨木(Populus sp.)的倾斜树干,于2008年2月采自法国蒙彼利埃一林场。该样木树高15.8 m,胸径约23 cm,倾斜和翘曲的形状标志着正处于将树干恢复直立状态的过程中。采伐前首先测量立木的生长应变,然后进行试样采集并始终保持湿润状态,储藏于冰箱中备用。杨木树种很容易在倾斜树干上侧产生具有胶质纤维的应拉木并伴有很大的纵向生长拉应力(Fang et al., 2008b)。
1.2 试验方法 1.2.1 轴向生长应变测量目前,树木或锯材的生长应力R还不能直接用仪器测量,通常是测定与生长应力密切相关的生长应变,然后通过公式R≈-ELAL(其中:EL是轴向弹性模量;AL是纵向生长应变)换算得到生长应力(Archer,1986)。测试生长应变的方法主要有3种:Nicholson法(Nicholson,1971)、单孔法(也称法国轴向生长应变仪法、Cirad-Forêt法) (Yang et al., 2001;Clair et al., 2003)和表面粘贴应变片法(Yoshida et al., 2002;Jullien et al., 2008)。本研究采用表面粘贴应变片法测定生长应变,由于未对轴向弹性模量进行研究,根据生长应变与生长应力间的线性关系,文中直接以生长应变的变化作为轴向表面生长应力的指示值来表征轴向表面生长应力,称为生长应力指示值(growth stress indicator,GSI)。
测定时,首先目测树干的倾斜方向,选择倾斜最上部或弯曲最凹部为第1个测量点,然后在胸高处按逆时针方向等距离选定8个点。用手工凿小心地除去测试位置上的树皮、韧皮部和薄形成层,避免破坏次生木质部。随后将连接应变仪表的应变片粘贴在木质部表面,并保持其方向与树干的轴向一致。分别在距离应变片上端和下端5 mm处,且与树干轴向垂直的方向上锯槽,槽深约5 mm,直到读数基本稳定后记下数值,即为生长应力指示值GSI。GSI的单位是微应变(με=μm·m-1=strain×106),若为拉伸应力则应变值显示为负,反之压缩应力为正。根据生长应力指示值GSI选取应拉木和对应木试样,立即浸泡在水中防止干缩。
1.2.2 显微观察用滑走式切片机切出12 μm厚的横切片,经番红和固绿双重染色后制成永久切片,在400倍的光学显微镜下观察。由于胶质层松软多孔,在切片染色过程中,能较快较多地吸收金属盐类,使胞壁比其他胞壁层深一些。
1.2.3 氮气吸附-脱附测量进行氮气吸附试样的尺寸为1 mm×1 mm×5 mm(R×T×L)。首先采用乙醇溶液对试样进行脱水置换,然后在Polaron 3100型CO2超临界干燥反应釜中进行干燥预处理。干燥完成后,称取1.0~1.5 g干燥试样装入专用样品管中进行脱气处理。在400 ℃和低于6.67×10-2Pa真空度下脱气12 h以上,直到达到3.99×10-3Pa恒定压力,其目的主要是去除以物理形式黏附在孔隙表面上的气体及其他吸附杂质分子,使样品表面变得洁净,以确保比表面积及孔径测量结果的准确有效。脱气处理完成后,使样品自然冷却至室温后,准确称取“样品管+样品”的质量,计算样品净重。
使用美国Micromeritics公司生产的ASAP 2010型比表面积和孔径分析仪进行吸附等温线的测定,以氮气作为吸附介质,试验温度为77.4 K。吸附-脱附的相对压力p/p0(p为吸附压力,p0为氮在77.4 K下的饱和蒸汽压)选择在0.01~0.995之间。在每个吸附分压下,每克吸附剂有3 mL氮气的最低进气量,保证样品的初始吸附相对压力在10-8以下,确保低分压下吸附等温线的取得。
测得不同吸附氮气压力下平衡吸附量后,采用BET的多层吸附理论及其公式可计算得到单分子层饱和吸附量,然后根据氮分子在液氮沸点温度下的有效截面积、阿伏伽德罗常数推算出比表面积(As):
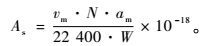
|
式中:As为被测样品比表面积(m2·g-1);vm为标准状态下氮气分子单层饱和吸附量(mL);am为氮分子等效最大横截面积(密排六方理论值am = 0.162 nm2);W为被测样品质量(g);N为阿伏伽德罗常数(6.02×1023)。
代入上述数据,得到氮吸附法计算比表面积的基本公式:
As=4.36 vm/W。
用递推法计算不同孔径区间的孔半径,常用的是Kelvin原理。Kelvin原理假设孔隙为圆柱状,计算公式为:
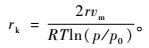
|
式中:rk为毛细管的半径;p/p0为氮气的相对压力;r是氮气沸点时的表面张力;vm是氮气的摩尔体积;R是气体常数;T是绝对温度。
中孔孔径分布使用BJH(Barrett,Joyner和Halenda)原理进行计算,计算公式为:
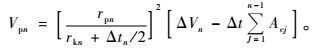
|
式中:Vpn为孔隙容积;rpn为最大孔半径;rkn为毛细管半径;Vn为毛细管体积;tn为吸附的氮气层厚度;Acj为先前排空后的面积。
孔体积依据t图法(Gregg et al., 1982)进行估算。这种方法通过把标准试样的氮吸附量除以其单分子吸附层容量,得到统计的平均吸附层数,再乘以单分子氮吸附层的厚度,得到吸附层的厚度t;然后通过和某个标准试样比较,将研究试样的吸附等温线直线化,通过分析与直线的偏离来获得微孔结构的信息。
2 结果与分析 2.1 立木表面轴向生长应变试验所用样木在胸高处周向上8个等分点的生长应力指示值GSI如图 1所示(图中显示为GSI的绝对值)。所测定的杨木立木表面轴向生长应变均为负值,即整个树干外围的生长应力形式以拉应力为主,并且以倾斜树干最上部的生长应力为最大(GSI绝对值为1 488 με),树干倾斜最下部附近的生长应力为最小(GSI绝对值为480 με)。整体上看来,沿倾斜树干周向从0°逆时针旋转,其立木表面轴向生长应变逐渐增加,到达某一位置(225°)出现最大值后又开始降低。本文得出的杨木表面轴向生长应变的数值及变异模式与其他研究学者有关杨树的研究结果较为一致(方长华,2007;周亮等,2010)。
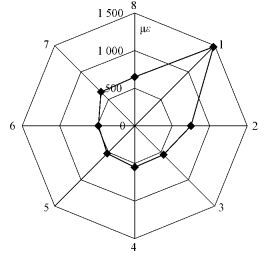
|
图 1 杨木立木胸高处围绕树干方向的GSI绝对值变化 Figure 1 GSI absolute values along trunk periphery at breast height in poplar standing tree |
由于在树干外围测得的生长应变值与相应处的生长应力成一定的比例,而且高拉伸应力总是伴随着应拉木的产生(Trénard et al., 1975),因此本研究选取拉应力最大处(第1位置点)作为应拉木试样,拉应力最小处(第6位置点)作为对应木试样,分别进行解剖观察和氮气吸附-脱附测量。
2.2 解剖特征杨木应拉木和对应木的横切显微图片如图 2所示。与对应木相比,应拉木的主要特征是它的纤维细胞内壁存在胶质层,形成胶质纤维。经染色后的胶质层呈蓝色,易于从横切面上与其他组织区分。胶质层几乎是由高结晶的纤维素组成,其他非纤维素的填充物质很少(Côté et al., 1969),应拉木中大量的中孔孔隙主要来源于具有凝胶胶体性质的胶质层(Clair et al., 2008;Chang et al., 2009)。

|
图 2 经番红/固绿染色后的杨木对应木(A)与应拉木(B)横切显微图片 Figure 2 Transverse sections of opposite wood (A) and tension wood (B) in poplar species stained with safranin/fast green |
从图 2B可以看出:胶质层与相邻壁层之间结合松弛,外貌起皱并沿同一个方向填充于细胞腔,这种分离现象主要是由于使用传统的切片方法造成的(Clair et al., 2005)。若对试样进行包埋处理,并在离试样端部150 μm处进行切片,可避免这种分离现象的产生。
胶质层的出现是应拉木形成过程中显微结构方面的一个主要变化(Dadswell et al., 1955;Wardrop,1964;Côté et al., 1969)。不同生长应力水平的应拉木,其胶质层在外形、厚度及分布上也不尽相同(Clair et al., 2006;Ruelle et al., 2006;Chang et al., 2009)。虽然应拉木的拉伸应力水平与其微观解剖形态的变异之间没有发现必然的相关关系(Clair et al., 2006;Ruelle et al., 2006;苌姗姗,2009),但是在超微结构水平上的观察可以对应拉木微观组织结构方面的一些共性进行全面的了解。
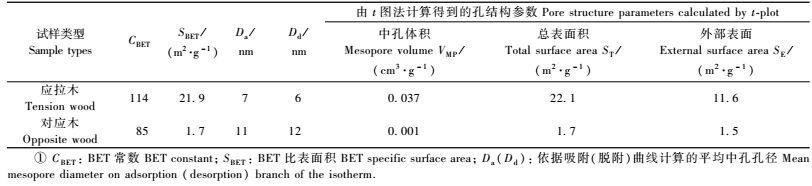
2.3 吸附等温线根据BET理论(Sing et al., 1985),BET常数是反映氮气吸附法有效性的一个重要指标,当此常数值小于80时,说明吸附质与吸附剂之间的吸附能力较弱,采用此方法对单层氮气分子吸附量等指标的确定较困难;特别是当此常数小于30时,吸附质之间的作用力占主导,采用此方法来分析试样孔径结构分布时,吸附质间的作用就不可忽略。本研究中,应拉木和对应木试样的BET常数均大于80(表 1),表明采用此方法分析试样的孔隙结构是较适合的。
|
|
图 3是在温度为77.4 K时测得的杨木应拉木和对应木的氮气吸附-脱附曲线。从吸附容量上来看,杨木应拉木的氮气吸附量为47.6 cm3·g-1,显著高于对应木的氮气吸附量(1.2 cm3·g-1),是对应木的40倍。所吸收的氮气会在吸附剂表面形成一个单吸附分子层,为估计吸附剂的总表面积提供了依据。利用BET方法计算出的试样的比表面积列于表 1。从表 1可以看出:杨木应拉木的BET比表面积为21.9 m2·g-1,是对应木的13倍,这一结果与Clair等(2008)对栗木(Castanea sativa)应拉木的研究结果一致。
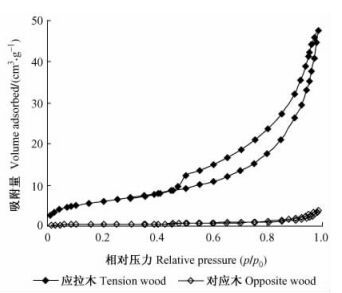
|
图 3 杨木应拉木与对应木的氮气吸附-脱附等温线 Figure 3 Nitrogen adsorption-desorption isotherm of tension wood and opposite wood in poplar species |
根据国际纯化学与应用化学联合会(IUPAC)分类(Sing et al., 1985),图 3所示的杨木应拉木吸附等温线属于Ⅱ,Ⅳ混合型吸附等温线。其特点是:吸附量在低相对压力下迅速上升,此阶段主要发生微孔的填充,表明应拉木试样中有一定的微孔结构;当p/p0超过0.1以后,吸附量随着相对压力的增大仍继续增加,但上升趋势缓慢,此阶段发生中孔和大孔的多层吸附;在相对压力p/p0约0.4时,吸附质发生毛细管凝聚,等温线迅速上升,脱附等温线与吸附等温线不重合,脱附等温线在吸附等温线的上方,产生吸附滞后;当p/p0超过0.7以后,吸附量又一次迅速上升,在较高分压处未能达到吸附饱和,并且出现吸附-脱附滞后回线,具有Ⅳ型等温线特征,由毛细凝聚而发生大孔容积填充。表明应拉木试样中存在大量的孔径范围在2~50 nm的中孔和一定量的大孔(>50 nm)。IUPAC将吸附滞后环分为H1,H2,H3和H4四种情况(Sing et al., 1985),每一类反映一定的孔结构类型。从吸附分支和脱附分支的形状来看,属H3型滞后环,其反映的是一种具有平行壁的狭缝状毛细孔。
2.4 孔形状和孔径分布一般多孔材料的孔形状极不规则,孔隙的大小也各不相同,其中很重要的、最常用的一种参数就是孔体积按孔隙有效半径大小的分布。IUPAC依据不同尺寸孔隙中分子吸附的不同,将细孔分为以下3类:孔径小于2 nm为微孔,2~50 nm为中孔,大于50 nm为大孔。
通常由吸附曲线计算出的孔径对应着孔腔尺寸,而脱附曲线计算出的孔径则对应着孔口尺寸(Groen et al., 2004)。因此,对吸附和脱附的孔径尺寸进行比较,可以得到孔形状分布的一些信息。根据吸附和脱附曲线得到的峰值孔径分别列于表 1。从表 1可以看出:杨木应拉木中具有孔腔小于2倍孔口的“墨水瓶”状的孔结构类型,而对应木中则显示了具有孔腔小于孔口的“烟囱”状孔隙,这种孔结构一定程度上降低了毛细管凝聚的能力。
图 4是根据脱附等温线绘制的杨木应拉木和对应木BJH中孔孔径分布。从图中可以看出:杨木应拉木的孔体积要远高于对应木,说明应拉木试样中含有较多的中孔孔隙。当孔径为5 nm时,应拉木和对应木试样的孔径分布均存在一个明显的波峰,表明所研究的杨木试样中存在许多孔径为4~7 nm的孔隙,但是孔体积在应拉木与对应木间相差很大。对于杨木应拉木,孔径在4~7 nm的孔体积占总孔体积的74.4%,4~15nm的孔隙体积占总体积的89.2%,孔径在15 nm以上的孔体积占10.8%。
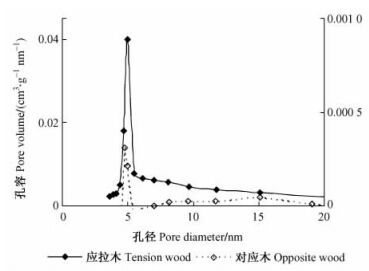
|
图 4 杨木应拉木与对应木的脱附孔径孔容关系曲线 Figure 4 Desorption mesopore size distributions of tension wood and opposite wood in poplar species 对应木孔径分布曲线位于次坐标轴Sub-axis was used for opposite wood |
本研究中有关杨木应拉木的孔隙结构参数与栗木应拉木(Clair et al., 2008)及Sextonia rubra(热带树种)应拉木(Chang et al., 2009)所测量的结果极其相似:吸附等温曲线均具有典型的中孔滞后环,且中孔体积较高,孔形状为口窄腹宽的“墨水瓶”状或狭缝状,以及存在大量孔径为4~7 nm的孔隙等。由于栗木应拉木、Sextonia rubra应拉木及本研究中的杨木应拉木均具有较高的拉应力,且均存在大量的胶质纤维,由此推测相似的孔结构参数可能与这些应拉木树种中厚壁的胶质层相关。由此引发了一个新的思考:仅仅是因为厚壁胶质层中存在大量的孔隙允许保持润胀时的高水合状态?如果是这样,无论是厚壁还是薄壁胶质层,其所有的纤维素在润胀状态时应该没有本质的区别。这也可能解释了为什么不同类型的应拉木均可以产生相似的高拉伸生长应力。因此,可以从树木成熟过程的不同阶段来进一步探究应拉木胶质层中凝胶类物质的孔结构特性,进而理解应拉木中高生长应力的产生机制。
2.5 t图法通过吸附等温线类型能定性地考察材料表面微孔结构,但不能进行定量的比较和研究,t图法较好地解决这个问题。比较图法即t图法,是以典型的多分子吸附为标准,把研究试样的等温吸附线直线化,为研究微孔结构及吸附机制提供较好的分析方法。t图在一定程度上反映出样品的孔隙情况,若t值曲线经过原点,则表明样品缺乏微孔隙,若不经过原点则往往是微孔作用的反应(Gregg et al., 1982)。杨木应拉木在77 K吸附氮的t图如图 5所示。
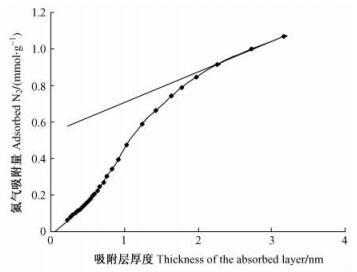
|
图 5 杨木应拉木在77 K吸附氮的t图 Figure 5 t-plot of the adsorption of N2 at 77 K on poplar tension wood |
从图 5可以看出:应拉木试样的t图呈现2条直线。在低压下,吸附量偏移直线,这是由微孔填充引起的。在t值较小时,曲线最初的部分为线性,反向延长后与纵坐标相交,说明所研究试样中均含有一定量的微孔,通过此直线的斜率线可求出试样的总表面积ST。当统计吸附层的厚度大于0.5 nm时,曲线斜率增加,不再呈线性,表明氮气分子在中孔发生毛细管凝聚。这种凝聚继续持续直到吸附层厚度达到2.5 nm,又出现了一条几乎与t轴平行的直线,将此直线往外推,在y轴上的截距对应中孔体积VMP,其斜率为外部表面积SE,分别列于表 1。
从表 1可以看出:由t图计算得到的试样总表面积与通过BET方法得到的结果一致。外部表面积SE与总表面积ST存在一定的正相关性,杨木应拉木试样孔隙的外部表面积为11.6 m2·g-1,显著高于对应木(仅为1.5 m2·g-1)。对于杨木应拉木的中孔体积VMP,也显著高于对应木,说明应拉木试样含有更多的中孔孔隙,与依据吸附等温线得到的结论一致。与Chang等(2009)的研究结果相比,本研究杨木应拉木孔隙的外部表面积SE、总表面积ST及中孔体积VMP均略低于具有厚壁胶质层的Sextonia rubra(热带树种)应拉木,但显著高于具有薄壁胶质层的其他热带树种。
胶质层几乎由纯纤维素组成,其他非纤维素的填充物质很少,因此由基本纤丝、微纤丝和纤丝相互穿插形成一些具有平行壁的狭缝状毛细孔。除主要成分纤维素之外,胶质层还包含果胶以及木葡聚糖和(1,4) -β-半乳糖糖基的半纤维素(Nishikubo et al., 2007;Arend,2008;Bowling et al., 2008;Mellerowicz et al., 2008),这些组成成分也可能存在于其他细胞壁层(如对应木细胞壁层)中以水合状态存在从而保持其多孔性。纹孔膜已被证实是由果胶状的凝胶组成(Zwieniecki et al., 2001;Van Ieperen,2007),这也可能是大量中孔存在的地方。
3 结论与讨论1) 所测定杨木立木表面轴向生长应变变化幅度为:-1 488~-480 με,树干外围的生长应力形式以拉应力为主,并且以倾斜树干最上部的生长应力最大,树干倾斜最下部附近的生长应力最小。与对应木相比,杨木应拉木具有大量的胶质纤维,胶质层与相邻壁层之间结合松弛,外貌起皱并沿同一个方向填充于细胞腔。
2) 杨木应拉木BET比表面积为21.9 m2·g-1,是对应木的13倍。杨木对应木和应拉木试样中均存在孔径为4~7 nm的孔隙,但孔体积相差很大。应拉木中存在大量孔径为2~50 nm的中孔和一定量的大孔(>50 nm),其中孔径在4~7 nm的孔体积占总孔体积的74.4%,4~15 nm的孔体积占总体积的89.2%,孔径在15 nm以上的孔体积占10.8%,并具有“墨水瓶”状和狭缝状毛细孔。
3) 应拉木中高生长应力的产生是几种机制的共同作用引起,而应拉木树种的微观结构特性及其与机械性能间的联系是研究应拉木高生长应力产生的基础。杨木应拉木具有显著高于对应木的中孔孔隙可能与大量存在的胶质纤维直接相关,因此进一步可从应拉木中胶质层的出现与其微细结构的关系及不同应力水平下应拉木的微细结构等方面进行研究。
苌姗姗. 2009. 应拉木胶质层残余生长应力及其非正常形变过程研究. 北京林业大学博士学位论文. http://d.wanfangdata.com.cn/Thesis/Y1489889
|
董卫国, 徐静, 黄俊鹏. 2007. 氮气吸附法表征棉纤维的孔结构[J]. 纺织学报, 28(6): 5-7. |
方长华. 2007. 胶质层对杨树应拉木生长应力和木材性质的影响. 安徽农业大学博士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-10364-2009023363.htm
|
刘盛全, 江泽慧. 1996. 刺楸木材应拉木材性研究[J]. 林业科学, 32(5): 470-475. |
王丽娟, 鲁安怀, 王长秋, 等. 2005. 吸附法对天然斜纤蛇纹石纳米管内径的表征[J]. 岩石矿物学杂志, 24(1): 67-72. |
周亮, 刘盛全, 刘亚梅, 等. 2010. 欧美杨107杨偏心生长应变分布规律[J]. 林业科学, 46(4): 171-177. DOI:10.11707/j.1001-7488.20100427 |
Archer R R. 1986. Growth stresses and strains in trees.Berlin:Springer-Verlag.
|
Arend M. 2008. Immunolocalization of (1, 4)-β-galactan in tension wood fibers of poplar[J]. Tree Physiology, 28(8): 1263-1267. DOI:10.1093/treephys/28.8.1263 |
Bowling A J, Vaughn K C. 2008. Immunocytochemical characterization of tension wood:Gelatinous fibers contain more than just cellulose[J]. American Journal of Botany, 95(6): 655-663. DOI:10.3732/ajb.2007368 |
Chang S S, Clair B, Ruelle J, et al. 2009. Mesoporosity as a new parameter in understanding of tension stress generation in trees[J]. Journal of Experimental Botany, 60(11): 3023-3030. DOI:10.1093/jxb/erp133 |
Clair B, Gril J, Di Renzo F, et al. 2008. Characterization of a gel in the cell wall to elucidate the paradoxical shrinkage of tension wood[J]. Biomacromolecules, 9(2): 494-498. DOI:10.1021/bm700987q |
Clair B, Jaouen G, Beauchêne J, et al. 2003. Mapping radial, tangential and longitudinal shrinkages and relation to tension wood in discs of the tropical tree Symphonia globulifera[J]. Holzforschung, 57(6): 665-671. |
Clair B, Ruelle J, Beauchêne J, et al. 2006. Tension wood and opposite wood in 21 tropical rain forest species[J]. 1. Occurrence and efficiency of the G-layer. IAWA Journal, 27(3): 329-338. |
Clair B, Thibaut B, Sugiyama H. 2005. On the detachment of the gelatinous layer in tension wood fiber[J]. Journal of Wood Science, 51(3): 218-221. DOI:10.1007/s10086-004-0648-9 |
Côté W A J, Day A C, Timell T E. 1969. A contribution to the ultrastructure of tension wood fibers[J]. Wood Science and Technology, 3(4): 257-271. DOI:10.1007/BF00352301 |
Dadswell H E, Wardrop A B. 1955. The structure and properties of tension wood[J]. Holzforschung, 9(4): 97-104. DOI:10.1515/hfsg.1955.9.4.97 |
Fang C H, Clair B, Gril J, et al. 2008a. Growth stresses are highly controlled by the amount of G-layer in poplar tension wood[J]. IAWA Journal, 29(3): 237-246. DOI:10.1163/22941932-90000183 |
Fang C H, Guibal D, Clair B, et al. 2008b. Relationships between growth stress and wood properties in poplar I-69 (Populus deltoides Bartr. cv. "Lux" ex I-69/55)[J]. Annual Forestry Science, 65(3): 307p1-307p9. |
Fisher J B, Stevenson J W. 1981. Occurrence of reaction wood in branches of dicotyledons and its role in tree architecture[J]. Botanical Gazette, 142(1): 82-95. DOI:10.1086/337199 |
Gregg S J, Sing K S W. 1982. Adsorption, surface area and porosity[M]. London: Academic Press: 218-228.
|
Groen J C, Pérez-Ramirez J. 2004. Critical appraisal of mesopore determination by adsorption analysis[J]. Applied Catalysis A:General, 268(1/2): 121-125. |
Isebrands J G, Bensend D W. 1972. Incidence and structure of gelatinous fibers within rapid-growing eastern cottonwood[J]. Wood and Fiber Science, 4(2): 61-71. |
Jullien D, Gril J. 2008. Growth strain assessment at the periphery of small-diameter trees using the two-grooves method:influence of operating parameters estimated by numerical simulations[J]. Wood Science and Technology, 42(7): 551-565. DOI:10.1007/s00226-008-0202-9 |
Mellerowicz E J, Immerzeel P, Hayashi T. 2008. Xyloglucan:the molecular muscle of trees[J]. Annals of Botany, 102(5): 659-665. DOI:10.1093/aob/mcn170 |
Nicholson J E. 1971. A rapid method for estimating longitudinal growth stresses in logs[J]. Wood Science and Technology, 5(1): 40-48. DOI:10.1007/BF00363119 |
Nishikubo N, Awano T, Banasiak A, et al. 2007. Xyloglucan endo-transglycosylase (XET) functions in gelatinous layers of tension wood fibers in poplar-a glimpse into the mechanism of the balancing act of trees[J]. Plant and Cell Physiology, 48(6): 843-855. DOI:10.1093/pcp/pcm055 |
Quignard F, Valentin R, Di Renzo F. 2008. Aerogel materials from marine polysaccharides[J]. New Journal of Chemistry, 32(8): 1300-1310. DOI:10.1039/b808218a |
Ruelle J, Clair B, Beauchêne J, et al. 2006. Tension wood and opposite wood in 21 tropical rain forest species[J]. 2. Comparison of some anatomical and ultrastructural criteria. IAWA Journal, 27(4): 341-376. |
Sing K S W, Everett D H, Haul R A W, et al. 1985. Reporting physisorption data for gas/solid systems with special reference to the determination of surface area and porosity[J]. Pure and Applied Chemistry, 57(4): 603-619. |
Trénard Y, Guéneau P. 1975. Relations entre contraintes de croissance longitudinales et bois de tension dans le hêtre (Fagus sylvatica L.)[J]. )Holzforschung, 29(6): 217-223. DOI:10.1515/hfsg.1975.29.6.217 |
Valentin R, Molvinger K, Quignard F, et al. 2005. Methods to analyse the texture of alginate aerogel microspheres[J]. Macromolecular Symposia, 222(1): 93-101. DOI:10.1002/(ISSN)1521-3900 |
Van Ieperen W. 2007. Ion-mediated changes of xylem hydraulic resistance in planta:fact or fiction?[J]. Trends in Plant Science, 12(4): 137-142. DOI:10.1016/j.tplants.2007.03.001 |
Wardrop A B. 1964. The reaction anatomy of arborescent angiosperms//Zimmermann M H. The formation of wood in forest tree. Academic, New York, 405-456.
|
Yang J L, Waugh G. 2001. Growth stress, its measurement and effects[J]. Australian Forestry, 64(2): 127-135. DOI:10.1080/00049158.2001.10676176 |
Yoshida M, Okuyama T. 2002. Techniques for measuring growth stress on the xylem surface using strain and dial gauges[J]. Holzforschung, 56(5): 461-467. |
Zwieniecki M A, Melcher P J, Holbrook N M. 2001. Hydrogel control of xylem hydraulic resistance in plants[J]. Science, 291(5506): 1059-1062. DOI:10.1126/science.1057175 |
 2011, Vol. 47
2011, Vol. 47