文章信息
- 钱路, 安榆林, 徐梅, 杨晓军, 朱宏斌
- Qian Lu, An Yulin, Xu Mei, Yang Xiaojun, Zhu Hongbin
- 舞毒蛾不同地理种群基于AFLP分子标记的遗传分析
- AFLP Analysis of Different Geographic Populations of the Gypsy Moth, Lymantria dispar (Lepidoptera: Lymantriidae)
- 林业科学, 2011, 47(10): 104-110.
- Scientia Silvae Sinicae, 2011, 47(10): 104-110.
-
文章历史
- 收稿日期:2010-03-10
- 修回日期:2010-08-04
-
作者相关文章
舞毒蛾(Lymantria dispar)属鳞翅目(Lepidoptera),毒蛾科(Lymantriidae),毒蛾属(Lymantria), 其原产地为欧亚大陆,北到瑞典、挪威、俄罗斯远东地区,南到非洲西北海岸线,东到日本岛(Giese et al., 1979)。舞毒蛾的寄主范围广,危害大,是世界性林业大害虫(王丽珍等,2006)。
Pogue等(2007)根据雌性舞毒蛾翅的有无或飞行能力的强弱,将舞毒蛾分为3个亚种,即欧美亚种(L. dispar dispar)、亚洲亚种(L. dispar asiatica)、日本亚种(L. dispar japonica)。而在这之前,欧洲亚种被称为欧洲型舞毒蛾,而亚洲亚种和日本亚种则被统称为亚洲型舞毒蛾(Keena, 1994; 1996;Wallner et al., 1994; 1995;Baranchikov, 1989)。1869年,欧洲型舞毒蛾被错误引入美国马萨诸塞州(Forbush et al., 1896),后在美国东北部和加拿大东南部迅速扩散,为害林木面积达200万hm2(钱天荣,2000)。1991年在加拿大温哥华港口附近首次发现亚洲型舞毒蛾,随后在加拿大哥伦比亚、范库弗峰,美国华盛顿、俄勒冈、北卡莱罗纳、爱达荷、得克萨斯等地也相继发现(Gibbons, 1999)。美国对发现的疫情实施了根除措施。为了防止亚洲型舞毒蛾再次传入,美国先后对来自俄罗斯远东地区、日本等地的船舶实施特别检疫措施。2007年以来,美国也曾多次与中国举行会谈,提出拟对来自中国的船舶、货物及木包装实施同类检疫措施。因此,为了应对相关技术问题的需要,避免来源地的混淆,研究舞毒蛾不同地理种群的差异,提出其鉴定方法,显得极为重要。
尽管舞毒蛾存在生物学和形态学上的差异,但至今仍没有完全可信的形态和行为特征可以用来区分舞毒蛾不同基因型。因此,生化标记和基因标记技术常被用来区分舞毒蛾不同地理种群。同工酶实验揭示了日本、欧洲、美国种群间的基因差异(Harrison et al., 1983),Bogdanowicz等(1993)报道了用线粒体DNA作为舞毒蛾来源的示踪诊断,Pfeifer等(1995)运用PCR与内切酶技术分析核糖体DNA,区分了亚洲和北美种群。近年来,RAPD技术和AFLP技术也被用来作为舞毒蛾不同种群的分子标记(Garner et al., 1996;Reineke et al., 1999)。
AFLP(amplified fragment length polymorphism)是在RAPD和RFLP的基础上发展起来的新一代分子标记技术。由于它既具有RAPD标记的随机性,方便性,又具有RFLP标记的专一性和可靠性,所以被称为“最有力的分子标记”(Zabeau et al., 1993;郑先云等, 2003)。笔者利用AFLP技术研究了采自俄罗斯远东地区、蒙古、日本、美国和中国5个地理种群、共26份舞毒蛾样品的遗传多样性,为研究舞毒蛾的起源、入侵与扩散、遗传与变异以及检疫措施的制定等方面提供科学依据。
1 材料与方法 1.1 供试昆虫选用来自俄罗斯远东地区、蒙古、日本、美国和中国5个地理种群,26份舞毒蛾成虫(卵),另2份栎毒蛾(Lymantria mathura)样品作外类群分析,详见表 1。除黑龙江和吉林品系为作者采集外,其余虫样均为美国农业部动植物检疫局王宝德博士馈赠。所有样品-70 ℃保存。
|
|
限制性内切酶EcoRⅠ、MseⅠ(MBI公司),T4-DNA连接酶、Taq DNA聚合酶(Takara公司);AFLP接头:EcoRⅠ adapter、MseⅠ adapter;AFLP引物:E0和M0(预扩增引物)、选择性扩增引物E-ACA、M-CAG、M-CAT、M-CTC,接头和引物均由英俊公司合成,序列信息详见表 2;Beckman公司CEQ试剂:DNA标准分子量(dNA Size Standard Kit-600)、分离缓冲液(separation buffer)、分离胶(separation gel)、上样缓冲液(loading buffer)。
|
|
基因组DNA的提取参照Boyce等(1989)的方法,根据实际情况对试验步骤做了部分修改。用镊子挑取舞毒蛾成虫胸部肌肉或单个卵块中挑5粒卵,用蒸馏水冲洗3遍,后将样品置于1.5 mL离心管中。加600 μL PTE浸泡液于离心管中在4 ℃条件下过夜。弃浸泡液,在解剖镜下挑取所浸泡胸部肌肉或卵粒于新离心管中,用剪刀充分剪碎后加匀浆缓冲液600 μL,55 ℃水浴过夜。取水浴材料加600 μL饱和酚,离心管上下颠倒2 min混匀后放入低温离心机8 000 r·min-1离心10 min。离心结束取上清液重复上步操作1次。取上清液加600 μL氯仿/异戊醇,颠倒2 min混匀后放入低温离心机8 000 r·min-1离心10 min。取上清液加预冷100%乙醇(预置于-7 ℃)1 mL混匀后放入-20 ℃冰箱保存2 h沉淀DNA。于低温离心机12 000 r·min-1离心5 min,弃上清液加预冷乙醇(75%)1 mL,在12 000 r·min-1离心5 min(此步重复1次)。弃上清液加预冷乙醇(100%)1 mL,在12 000 r·min-1离心5 min,弃上清液取沉淀,晾干后加30 μL 1×TE(10 mmol·L-1 Tris-Cl, pH 8.0;1 mol·L-1 EDTA, pH 8.0)溶解DNA,放入-20 ℃冰箱中保存。
1.3.2 酶切、连接采用限制性内切酶EcoRⅠ和MseⅠ对DNA进行双酶切。酶切体系包括(总体积20 μL):ddH2O 12.75 μL,10× Buffer 2.0 μL,MseⅠ (1 U·μL-1) 2.5 μL。EcoRⅠ (10 U·μL-1) 0.25 μL,模板DNA (100 ng·μL-1) 2.5 μL。37 ℃酶切3 h,65 ℃处理10 min。酶切完成的DNA加入T4-DNA连接酶和人工接头,16 ℃连接过夜。
1.3.3 预扩增反应取4 μL酶切连接产物,加人M0、E0(35 ng·μL-1)各1 μL,14 μL AFLP Core Mix,包含ddH2O 7.8 μL, MgCl2 1.6 μL, dNTPs (2.5 mmol·L-1) 1.6 μL, Taq酶(1 U·μL-1) 1 μL, 10×Buffer 2 μL, PCR反应条件:94 ℃ 2 min;94 ℃ 20 s,56 ℃ 30 s,72 ℃ 2 min,20个循环;60 ℃ 30 min;产物用0.1×TE稀释20倍备用。
1.3.4 选择性扩增反应取4 μL稀释后预扩增产物,加入选择扩增引物组合2 μL,14 μL AFLP Core Mix。反应条件:94 ℃ 2 min;94 ℃ 20 s,66 ℃ 30 s,72 ℃ 2 min,每个循环降1 ℃,共10个循环;94 ℃ 20 s,56 ℃ 30 s,72 ℃ 2 min,20个循环;60 ℃ 30 min。
1.3.5 CEQ毛细管电泳检测选择性扩增的AFLP产物在CEQ8000 Genetic Analysis System仪器上进行毛细管电泳检测。每个反应孔加人3 μL稀释10倍后的选择扩增产物,0.2 μL标准分子量,20 μL上样缓冲液和约10 μL矿物油,上机检测。电泳结束后,通过软件自动采集数据,参照分子量内标选取各引物对在50~400 bp的检测区域内的扩增片段进行分析。
1.3.6 数据分析由CEQ8000遗传分析仪采集数据分析得到“0”、“1”矩阵,将每对引物的原始矩阵合并为综合原始矩阵,用作分析。用PAUP* beta 4.0b10软件计算种群遗传距离并进行非加权组平均法(UPGMA)和邻结法(NJ)聚类树分析。
2 结果与分析 2.1 舞毒蛾AFLP试验体系的优化AFLP分析对样品DNA的质量要求较高,笔者曾尝试使用不同方法提取样品的DNA,最终使用1.3.1中描述的方法进行操作,所提样品的DNA纯度较好,OD260/280值在1.6~1.9之间, 琼脂糖凝胶电泳检测结果显示基因组DNA较为完整,适合AFLP分析。EcoRⅠ和MseⅠ同步酶切和分开酶切效果相当,建议双酶切同时进行,如图 1所示。还比较了酶切、连接1步法和2步法的效果,发现酶切后再连接比1步法更加稳定可靠。预扩增产物经琼脂糖电泳检测呈现弥散状,片段大小集中在200~1 000 bp,如图 2所示。
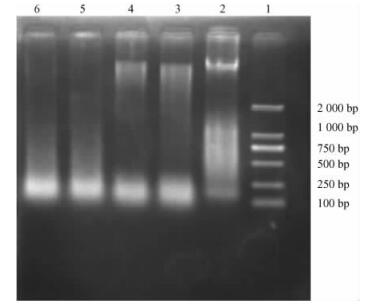
|
图 1 所提部分样品DNA及酶切电泳 Figure 1 Extraction and digestion of samples template DNA 1为DNA Marker 2000, 2为DNA样品, 3, 4为EcoRⅠ单酶切, 5, 6为EcoRⅠ/MseⅠ双酶切; 2, 3, 5为样品LM1,4, 6为样品JL1。Lane 1, DNA Marker 2000; Lane 2, LM1 DNA; Lanes 3, 4, EcoRⅠ digestion; Lanes 5, 6, EcoRⅠ/MseⅠ digestions. |
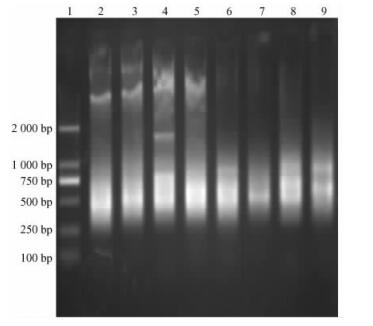
|
图 2 部分样品预扩产物电泳检测 Figure 2 Pre-amplification gel electrophoresis of Lymantria dispar samples 1:DNA Marker 2000; 2-9: RVO1, RVL1, RN1, RS, MG1, JAP1, WV1, MA1 |
试验选用了16对引物组合进行选择扩增,根据最后的毛细管电泳峰图显示,确定了E-ACA/M-CAG、E-ACA/M-CAT、E-ACA/M-CTC这3对引物组合进行AFLP分析。图 3是部分代表性样品的AFLP荧光图谱。CEQ-8000遗传分析仪是根据荧光信号强度来记录多态位点的信息,因此要比传统银染法更加灵敏、精确,检测到的多态性位点相对也更加丰富。上述3对引物分别测定到169,160,178共计507个多态性位点。
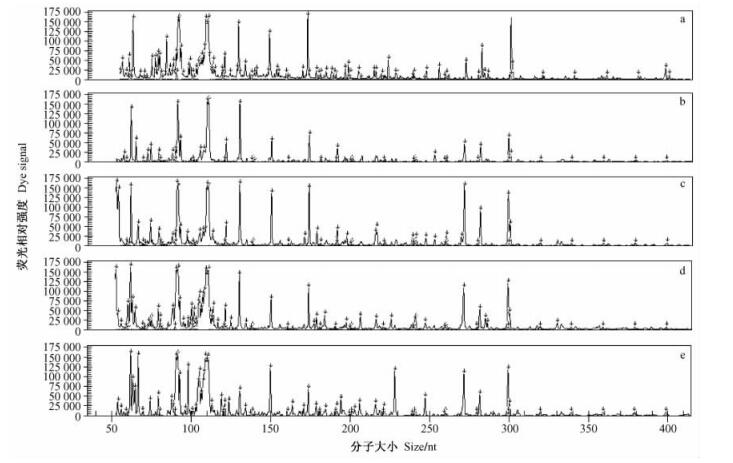
|
图 3 部分样品AFLP荧光图谱 Figure 3 Data of five L. dispar samples fluorescence spectra by AFLP analysis 引物组合:E-ACA/M-CTC;a-e依次为样品JL1, MG1, RN1, JP1, PA1. Primer combinations: E-ACA/M-CTC. a-e: JL1, MG1, RN1, JP1, PA1 |
用PAUP* beta 4.0b10软件计算26份舞毒蛾样本基于AFLP数据的遗传距离,3对引物检测的数据分析表明:俄罗斯种群内遗传距离为0.039 33~0.162 92;蒙古种群内遗传距离为0.050 56;中国种群内遗传距离为0.044 94~0.106 74;日本种群内遗传距离为0.061 80;美国种群内遗传距离0.044 94~0.247 19(表 3)。中国种群与俄罗斯、蒙古、日本和美国种群的平均遗传距离分别是0.171 74,0.087 08,0.233 14,0.296 35。以上数据表明:美国种群间遗传变异比其他种群较大,中国种群与美国种群遗传分化最大,而与蒙古种群遗传分化最小。
|
|
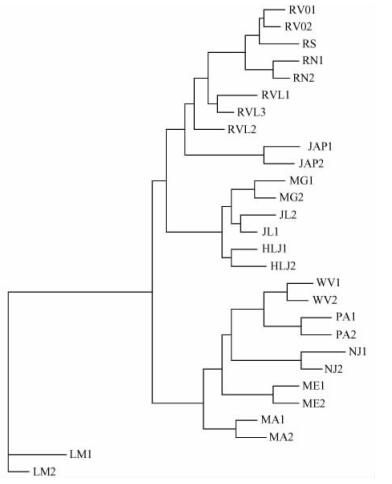
基于AFLP分子标记的0,1数据矩阵,用PAUP* beta 4.0b10软件中UPGMA和NJ法构建了本试验26份舞毒蛾和2份栎毒蛾的树状图(图 4,5)。从图 4可以看出:10份来自美国的舞毒蛾构成一个单系类群,并得到100%的支持率;余下的16份亚洲舞毒蛾聚为一类,支持率是73%。亚洲型又可细分为3个小类群,俄罗斯、日本各自聚为一支,支持率分别为62%和100%,中国和蒙古聚为一支,支持率为100%。本文使用的3对引物组合中任一对都能将不同地理种群的舞毒蛾区分开,但为了增加准确性和可信度,把3组引物所得的所有数据一同分析,最后通过2种计算方法得到的聚类树结果一致。
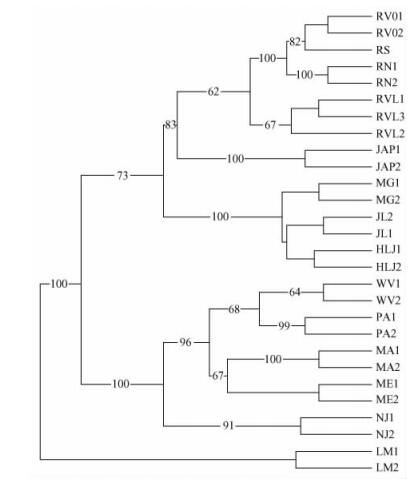
|
图 4 26份舞毒蛾样品及2份栎毒蛾样品基于AFLP分析的UPGMA聚类图 Figure 4 Dendrogram of 26 L. dispar isolates and 2 L. mathura outgroups revealed by UPGMA cluster analysis of genetic similarities |
|
图 5 26份舞毒蛾样品及2份栎毒蛾样品基于AFLP分析的NJ聚类图 Figure 5 Dendrogram of 26 L. dispar isolates and 2 L. mathura outgroups revealed by NJ cluster analysis of genetic similarities |
AFLP分子标记对于检测物种不同种群之间的遗传变异具有高的灵敏性,是一种高效的分子标记技术(成飞雪等,2005;罗倩等,2007;杜传印等,2008;上官凌飞等,2009)。Reineke等(1999)利用传统聚丙烯胺银染的方法成功对不同地理种群舞毒蛾进行遗传分析,本文利用较少的不同引物组合成功建立并优化了舞毒蛾AFLP分析体系,并利用CEQ-8000遗传分析仪对AFLP的扩增产物进行毛细管电泳,自动检测条带和分析结果,简化了传统的电泳及银染的步骤,提高了AFLP结果的灵敏性、准确性和重复性。由此可见,AFLP技术及其改良技术可以很好地应用于种群遗传分化的研究。
Reineke等(1999)分析了欧洲、亚洲、北美种群的遗传关系,聚类分析显示欧洲相同地理种群或邻近地理种群能够聚在一起,但未详细给出亚洲种群和北美种群的聚类结果,本文在此基础上利用3对荧光引物组合的AFLP多态性分析,准确测定了亚洲和北美5个不同地理来源,共26份舞毒蛾样品的基因关系,UPGM和NJ树的聚类分析均将能将这5个地理种群分为欧洲型(北美种群)和亚洲型,其中亚洲型又可分为俄罗斯、日本、中国及蒙古3个类群。聚类结果与地理来源具有明显的相关性。美国种群间遗传变异比其他种群较大,中国种群与美国种群遗传距离最大,而与蒙古种群遗传分化最小。本研究丰富了舞毒蛾不同地理种群的遗传分化研究成果,为揭示舞毒蛾的起源、入侵与扩散、遗传与变异以及检疫措施的制定等提供了科学依据。
成飞雪, 成新跃, 谢丙炎, 等. 2005. 松材线虫种群遗传多样性AFLP标记的建立及其应用[J]. 植物病理学报, 35(5): 410-419. |
杜传印, 王玉军, 李斯深, 等. 2008. 39个烤烟种质亲缘关系的AFLP分析[J]. 中国农业科学, 41(9): 2741-2747. |
罗倩, 冯夏, 吕利华, 等. 2007. 小菜蛾对阿维菌素抗性基因的AFLP连锁图谱的构建[J]. 昆虫学报, 50(5): 474-480. |
钱天荣. 2000. 舞毒蛾在美国发生危害及美国农业部采取的措施[J]. 植物检疫, 14(5): 317-318. |
上官凌飞, 李晓颖, 房经贵, 等. 2009. 果梅(Prunus mume)品种的荧光AFLP指纹分析[J]. 果树学报, 26(4): 475-480. |
王丽珍, 段立清, 特木钦, 等. 2006. 寄主植物对舞毒蛾生长发育的影响[J]. 中国森林病虫, 25(1): 21-23. |
郑先云, 马恩波, 郭亚平. 2003. AFLP分子标记技术在昆虫学研究中的应用[J]. 昆虫知识, 40(5): 405-409. DOI:10.7679/j.issn.2095-1353.2003.106 |
Baranchikov Y N. 1989. Ecological basis of the evolution of host relationships in Eurasian gypsy moth populations//Wallner W E, McManus K A. Lymantriidae: A Comparison of Features of New and Old World Tussock Moths. US Department of Agriculture, General Technical Report, NE-123, 319-338. http://europepmc.org/abstract/AGR/IND90046639
|
Bogdanowicz S M, Wallner W E, Bell J, et al. 1993. Asian gypsy moths (Lepidoptera: Lymantriidae) in North America: evidence from molecular data[J]. Annals of the Entomological Society of America, 86: 710-715. DOI:10.1093/aesa/86.6.710 |
Boyce T M, Zwick M E, Aquadro C F. 1989. Mitochondrial DNA in the bark weevils: size, structure and heteroplasmy[J]. Genetics, 123(4): 825-836. |
Forbush E H, Fernald C H. 1896. The gypsy moth[M]. Boston: Wright and Potter Press.
|
Garner K J, Slavicek J M. 1996. Identification and characterization of a RAPD-PCR marker for distinguishing Asian and North American gypsy moths[J]. Insect Molecular Biology, 5(2): 81-91. DOI:10.1111/imb.1996.5.issue-2 |
Gibbons A. 1999. Asian gypsy moth jumps ship to United States[J]. Science, 255: 526. |
Giese R L, Schneider M L. 1979. Cartographic comparisons of Eurasian gypsy moth distribution (Lymantria dispar L.; Lepidoptera: Lymantriidae)[J]. Entomological News, 90(1): 1-16. |
Harrison R G, Wintermeyer S F, Odell T M. 1983. Patterns of genetic variation within and among gypsy moth, Lymantria dispar (Lepidoptera: Lymantriidae), populations[J]. Annals of the Entomological Society of America, 76: 652-656. DOI:10.1093/aesa/76.4.652 |
Keena M A. 1994. Identification of gypsy moth larval color forms. US Department of Agriculture, Forest Service Leaflet, NE/NA-INF-123-94.
|
Keena M A. 1996. Comparison of the hatch of Lymantria dispar (Lepidoptera: Lymantriidae) eggs from Russia and the United States after exposure to different temperatures and durations of low temperature[J]. Annals of the Entomological Society of America, 89(4): 564-572. DOI:10.1093/aesa/89.4.564 |
Pfeifer T A, Humble L M, Ring M, et al. 1995. Characterization of gypsy moth populations and related species using a nuclear DNA marker[J]. Canadian Entomologist, 127(1): 49-58. |
Pogue M G, Schaefer P W, 2007. A review of selected species of Lymantria Hübner (1819) including three new species (Lepidoptera: Noctuidae: Lymantriidae) from subtropical and temperate regions of Asia, including the descriptions of three new species, some potentially invasive to North America. Washinton DC: United States Department of Agriculture, Forest Health Technology Enterprise Team. http://agris.fao.org/agris-search/search.do?recordID=US201300121871
|
Reineke A, Karlovsky P, Zebitz C P W. 1999. Amplified fragment length polymorphism analysis of different geographic populations of the gypsy moth, Lymantria dispar (Lepidoptera: Lymantriidae)[J]. Bulletin of Entomological Research, 89(1): 79-88. |
Wallner W E, Grinberg P S, Walton G S. 1994. Differentiation between gypsy moth (Lepidoptera: Lymantriidae) populations by spectral color discrimination of head capsules[J]. Environmental Entomology, 23(3): 659-664. DOI:10.1093/ee/23.3.659 |
Wallner W E, Humble L M, Levin R E, et al. 1995. Response of adult lymantriid moths to illumination devices in the Russian Far East[J]. Journal of Economic Entomology, 88(2): 337-342. DOI:10.1093/jee/88.2.337 |
Zabeau M, Vos P. 1993. Selective restriction fragment amplification: a general method for DNA fingerprinting. European Patent Application, No.0534 858A1. http://www.freepatentsonline.com/EP0534858.html
|
 2011, Vol. 47
2011, Vol. 47



