文章信息
- 杨玲, 沈海龙
- Yang Ling, Shen Hailong
- 花楸树体细胞胚与合子胚的发生发育
- Cytological and Histological Investigations on Somatic and Zygotic Embryogenesis of Sorbus pohuashanensis
- 林业科学, 2011, 47(10): 63-69.
- Scientia Silvae Sinicae, 2011, 47(10): 63-69.
-
文章历史
- 收稿日期:2010-12-27
- 修回日期:2011-03-07
-
作者相关文章
花楸树(Sorbus pohuashanensis)为我国寒温性针叶林特有的伴生阔叶树种。它集观赏、药用、食用、饲用和材用等多种价值于一身,具有很好的开发利用前景(郑万钧,1985;周德本,1986)。现有的花楸树资源主要是天然野生资源,多零散分布于深山老林和一些自然保护区中。花楸树的种子在自然条件下出苗率很低,野生实生苗极少见;同时花楸树的引种驯化、人工栽培技术尚不成熟。近几年国内学者对花楸树的人工培育相关原理与技术进行了一些研究,如种子休眠解除(沈海龙等,2006;杨玲等,2008;2009a;2009b)、扦插繁殖(苏喜廷等,2005;郑健等,2009a)、野生资源分布和更新(郑健等,2007;许建伟等,2010a;许建伟等,2010b;张秀亮等,2010),以及果实和种子的形态性状(范丽颖等,2008;郑健等,2009b;杨玲等,2009a)、遗传多样性和种源变异(郑健等,2008;范丽颖等,2008)等,为花楸树人工栽培和天然种群扩展等奠定了基础。但对花楸树离体形态发生的研究报道较少且不系统(王爱芝等,2009;杨玲等,2010)。
由于体细胞胚发生重演了合子胚形态发生的进程,因此了解合子胚的形态发生对确定体细胞胚诱导和培养条件,了解体细胞胚发生和细胞分化机制具有指导作用。反之,体细胞胚发生体系的建立和调控又可为合子胚发育机制和生殖生物学的研究提供信息资料。2种胚胎发生体系在形态学、生理学、生物化学、细胞学和分子生物学方面的比较研究已在多种植物中有报道,如海岸松(Pinus pinaster)(Jordy et al., 2003)、泰国象腿蕉(Ensete superbum)(Mathew et al., 2003)、水曲柳(Fraxinus mandshurica)(孔东梅等,2006)、向日葵(Helianthus annuus)(Fambrini et al., 2006)、玉米(Zea mays)(Zhang et al., 2002)、仙客来(Cyclamen persicum)(Schmidt et al., 2006)、凤榴(Acca sellowiana)(Pescador et al., 2008)等,但有关花楸树合子胚和体细胞胚发生的比较研究尚未见报道。本文利用石蜡切片技术对花楸树体细胞胚与合子胚的胚胎发生过程进行了组织学和细胞学上的比对分析,并利用环境扫描电子显微镜和透射电子显微镜技术对花楸树体细胞胚的细胞起源进行了超微形态和超微结构的观察。研究结果可为花楸树合子胚的生殖生物学研究奠定基础,同时可为花楸树体细胞胚培养条件的改善和人工种子的制备提供参考。
1 材料与方法 1.1 试验材料用于细胞观察和体细胞胚诱导的合子胚均采自黑龙江省森林植物园西区人工栽培的6~7年生发育良好的花楸树母树。
1.2 合子胚发生的细胞观察于2009年5月28日、29日对花楸树母树实施人工控制授粉。具体方法:对开花前1~2天的幼蕾进行破蕾、去雄、人工异花授粉和套袋。所套的袋子一面是牛皮纸(透气),一面是透明聚乙烯材料(透光)。套袋后标记去雄日期和时间。从授粉的当天开始,分别取授粉0.5, 1, 2, 4, 8, 16, 24, 32, 48, 56, 75 h;4, 5, 6, 7, 12, 14, 21, 30, 45, 60, 75, 90, 105天的花托用F.A.A.固定液固定,每次取40个花托固定,分成2份于5 ℃冰箱中密封保存。用爱氏苏木精整体染法染色,常规石蜡制片法制片,切片厚度8~10 μm,在OLPYMPUS的BX51系统显微镜下观察并照相。
1.3 体细胞胚的诱导培养和细胞观察取授粉后30天的幼果于流水下冲洗干净后经70%乙醇消毒1 min,3%的NaClO浸泡15 min,无菌水冲洗干净。在超净工作台上挤碎幼果,挑出胚珠,切破子叶端珠被,挤出合子胚,按照胚的根轴面与培养基表面平行的方式接种到MS固体培养基上诱导体细胞胚。培养基中附加1.0 mg·L-1NAA,0.1 mg·L-16-BA,500 mg·L-1水解酪蛋白,40 g·L-1蔗糖和0.6%琼脂粉。高压灭菌前将pH值调至5.8,于23~25 ℃的培养室内暗培养。初代培养4周后将培养物转至不含生长调节剂的相同培养基上继代培养。分别从初代培养第1天和继代培养第1天起,每隔7天取少量培养物,同前法固定、染色、切片、镜检,观察愈伤组织的形成及体细胞胚的发生。
1.4 体细胞胚的超微形态观察将不同培养时期的新鲜培养物用镊子从培养皿中取出,用去离子水将培养物彻底清洗,直接在低真空环境扫描电子显微镜(Quanta 200型,美国FEI公司)中、加速电压15.0 López477201220kV下观察并照相。
1.5 体细胞胚的超微结构观察将不同培养时期的培养物切割成1 mm3的样品组织块,室温下用含有2%(w/v)多聚甲醛和2.5%(v/v)戊二醛的0.1 mol·L-1磷酸缓冲液(pH7.3)固定2 h。固定后的样品经过梯度浓度的乙醇脱水、环氧树脂包埋、超薄切片机上切片并收集后,将切片在50%乙醇配制的2%(w/v)乙酸双氧铀中染色10 min,在0.4%(w/v)柠檬酸铅中染色10 min,然后用去离子水彻底清洗,利用美国FEI公司的TCNAIG2型透射式电子显微镜观察并照相。
2 结果与分析 2.1 合子胚发生发育的组织细胞观察观察表明,花楸树胚珠为倒生型胚珠,珠心和珠被的纵轴与珠柄垂直。具2层珠被-外珠被与内珠被。内外珠被的原基分别在珠心的基部产生。内外珠被均参与形成珠孔。属厚珠心型胚珠,存在周缘珠心组织。胚囊属蓼型胚囊,在珠孔端具卵器(由2个助细胞和1个卵细胞组成),合子端具3个反足细胞,胚囊中央为含2个极核的中央细胞(图 1-1)。传粉受精后,胚乳的发育早于胚的发育。受精后的初生胚乳核分裂先形成具多核仁的游离核(图 1-2),分裂达到一定程度时,胚的发育才开始。合子分裂形成一大一小2个细胞,其中靠近合点端的顶细胞体积小,胞质浓厚,靠近珠孔端的基细胞具大液泡,此时期为2-细胞原胚。2-细胞原胚进一步分裂,形成4-细胞原胚。随着合点端原胚细胞数目增多,开始出现器官分化。原胚形成后的发育很快,授粉后32 h可发育成早期球形胚,授粉后12天可发育成心形胚,授粉后21天可发育成鱼雷形胚,授粉后30天即可发育至子叶形胚,最后发育成充满胚囊腔的成熟胚(图 1-3~10)。早期原胚阶段具有发育明显的胚柄(图 1-5),至鱼雷形胚阶段胚柄消失(图 1-8)。球形胚末期时,胚乳细胞开始解体(图 1-6),当胚胎发育到心形胚时,胚体周围形成了空腔(图 1-7),推测是胚乳为胚胎发育提供营养而水解成小分子物质所致。随着胚的形态分化和体积增大,胚乳细胞的生活力下降,最后胚耗尽胚乳细胞的内含物并充满整个胚囊腔(图 1-8~10)。

|
图 1 花楸树合子胚和体细胞胚发生发育的组织、细胞观察 Figure 1 Cytological and histological investigation of zygotic embryogenesis and somatic embryogenesis of Sorbus pohuashanensis 1. 8核胚囊(ac:反足细胞;pn:极核;ea:卵器);2.胚乳游离核;3.合子;4. 4-细胞原胚;5.早期原胚具发达的胚柄(sc:胚柄细胞;pm:原胚);6.球形合子胚;7.心形合子胚;8.鱼雷形合子胚;9.子叶形合子胚;10.充满胚囊腔的成熟合子胚(cl:子叶;rc:胚根;hr:胚轴;pt:胚芽);11-14.子叶表面直接发生的体细胞胚(se:体细胞胚;ec:胚性细胞);15.外植体形成愈伤组织团;16.愈伤组织表面形成的体细胞胚;17.愈伤组织内部的体细胞胚;18.具胚柄的早期原胚(cc:与胚胎接触的胚柄细胞;i:胚柄中间细胞;b:胚柄的基细胞;ca:愈伤组织);19.球形体细胞胚(se:体细胞胚;sc:胚柄细胞);20.心形体细胞胚;21.鱼雷形体细胞胚(pvb:初生维管束);22.子叶形体细胞胚(cl:子叶;rc:胚根;pt:胚芽). 1. 8-nucleus embryo sac (ac: Antipodal cell; pn: Polar nucleus; ea: Egg apparatus); 2. Free endosperm nucleus; 3. Zygote; 4. 4-cell proembryo; 5. Proembryo with developed suspensor (sc: Suspensor cell; pm: Proembryo); 6. Globular zygotic embryo; 7. Heart-shaped zygotic embryo; 8. Torpedo-shaped zygotic embryo; 9. Cotyledonary zygotic embryo; 10. Zygotic embryo that was fully filled the embryo cavity (cl: Cotyledon; rc: Radicle; hr: Hypocotyl; pt: Plantule); 11-14. Direct somatic embryogenesis on the surface of cotyledon (se:Somatic embryo; ec:Embryogenic cells); 15.Callus formed from explant; 16. Somatic embryogenesis on the surface of embryogenic callus; 17. Somatic embryogenesis inside embryogenic callus; 18. Early proembryo with suspensor (cc: Suspensor cells connected with somatic embryo; i: Intermediate cells of suspensor; b: Basal cell of suspensor; ca: Callus); 19. Globular somatic embryo(se: Somatic embryo; sc: Suspensor cell); 20.Heart-shaped somatic embryo; 21.Torpedo-shaped somatic embryo (pvb: Primary vascular bundle); 22. Cotyledonary somatic embryo (cl: Cotyledon; rc: Radicle; pt: Plantule). |
在诱导培养基上初代培养7天时,可见到未成熟合子胚的子叶张开。初代培养10天时,可见子叶边缘出现少量愈伤组织,同时子叶表面有细胞凹陷或细胞突起产生。继续培养发现,体细胞胚可以从合子胚的子叶近轴端上表面直接发生(图 1-11~14)。在初代培养的30天内,即可分化形成子叶形体细胞胚。随着培养时间延长,部分外植体表面逐渐愈伤化,体细胞胚也可经愈伤组织细胞的再分化从愈伤组织表面或内部间接发生(图 1-15~17)。花楸树的体细胞胚具有胚柄,这种顶-基轴式的极性结构由3种类型的细胞构成:顶端是与胚胎接触的胚柄细胞,另外一端是胚柄的基细胞,其间是胚柄中间细胞(图 1-18)。
2.2.2 体细胞胚的形态发生过程观察表明,花楸树的体细胞胚发育过程像合子胚一样,经历了球形胚、心形胚、鱼雷形胚到分化出子叶、胚根及原维管束的成熟胚的形态发生过程(图 1-19~22)。体细胞胚在球形胚时期、心形胚时期均具有明显的胚柄(图 1-19, 20),鱼雷形胚时期胚柄退化,仅见部分残留(图 1-14, 21)。体细胞胚的初生维管束呈明显的“Y”字形(图 1-21, 22)。体细胞胚与原组织的连接松散,且没有维管组织的联系,具有生理隔离性,极易自行脱落(图 1-21, 22)。
2.2.3 体细胞胚的细胞起源1) 间接发生途径的细胞起源 在花楸树体细胞胚诱导培养中,外植体细胞经过脱分化产生2种愈伤组织:一种为淡黄或黄色,结构松散,表面不光滑具有球形颗粒状突起的胚性愈伤组织,可再分化出体细胞胚;一种为白色或淡黄色、质地紧密的非胚性愈伤组织,这种愈伤组织不分化或再分化出不定芽或不定根。
观察表明:胚性愈伤组织细胞染色较深,体积较小,壁厚,胞质浓厚,核大,核仁明显(图 2-1~5)。非胚性愈伤组织的细胞染色较浅,体积较大,形状不规则,胞质较稀薄,核小,细胞排列无序,没有明显的、较大的细胞间空隙(图 2-6)。体细胞胚发生于胚性愈伤组织的表面或内部(图 1-16~17;图 2-1)。发生于组织内部的体细胞胚存在单细胞起源途径(图 2-2)。胚性细胞先分裂产生2个细胞(图 2-2),进而分裂形成胚性细胞团(图 2-3),其细胞排列规则,细胞核大,核仁明显(图 2-2, 3)。此外,有的愈伤组织内部的胚性细胞团是由多个体积较小、胞质浓厚的胚性细胞和多个体积较大、胞质稀薄的非胚性细胞共同组成,其形态类似针叶树多细胞起源的胚性细胞群,因此推测花楸树体细胞胚发生可能还存在多细胞起源途径(图 2-4)。胚性细胞团的周围分布着大量体积较大、胞质稀薄、无明显细胞核的薄壁细胞(图 2-1~5),有的甚至形成较大的组织内空腔(图 2-3, 4)。进一步观察发现,这些细胞中,有的胞内充满颗粒状自溶物,有的胞内残留少量自溶物,有的甚至成为细胞壁包围的空腔(图 2-7),推测胚性细胞团周围的组织内空腔是细胞程序性死亡(PCD)后形成的。以后整个胚性细胞团形成体细胞胚,以一圈排列整齐、具明显厚壁的细胞形成界限与周围细胞隔开(图 2-5)。这种愈伤组织内部发生的体细胞胚,在发育过程中未见到明显的胚柄结构,但通常以周围或下端较大区域(由一些大而长形的细胞组成)与愈伤组织相连(图 2-4, 5),胚性细胞团中细胞的形状和位置不同,可能预示着其功能和在进一步分化中发展方向的不同。发生于愈伤组织表面的体细胞胚为单细胞起源(图 2-8~12)。胚性细胞横向分裂形成1个顶细胞和1个基细胞,顶细胞再次横向分裂,产生2个1列的细胞(图 2-9),以后胚性细胞继续分裂形成多细胞原胚(图 2-10)、球形胚(图 2-11, 12)。体细胞胚发育过程中存在明显的胚柄状结构(图 2-9~12)。
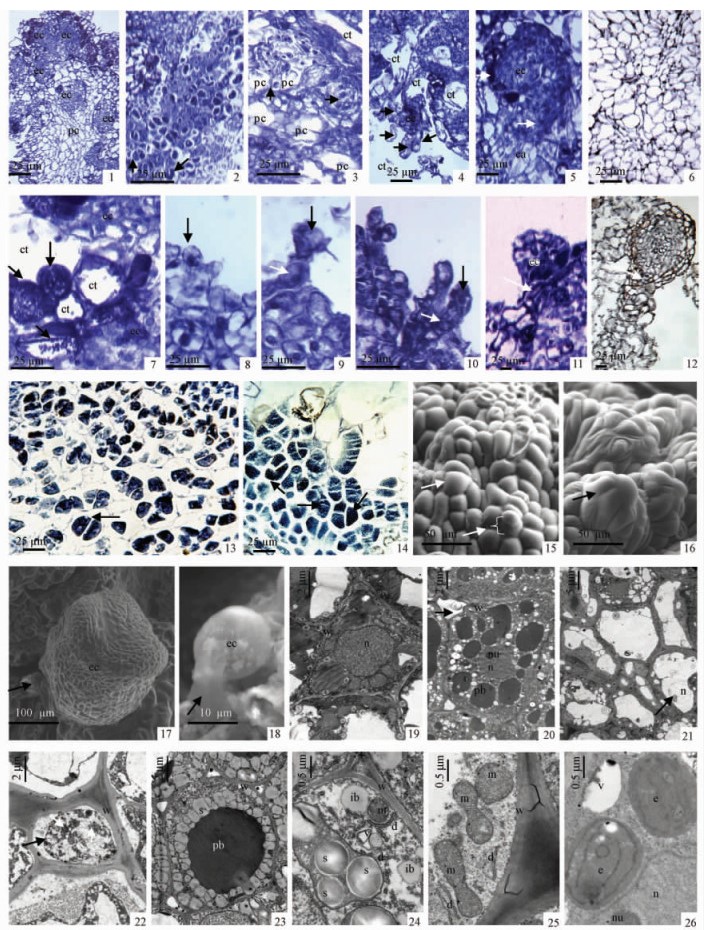
|
图 2 花楸树体细胞胚发生的细胞观察 Figure 2 Cytological and histological investigation of somatic embryogenesis of Sorbus pohuashanensis ec:胚性细胞;pc:薄壁细胞;ct:空腔;ca:愈伤组织;w:细胞壁;n:细胞核;nu:核仁;pb:蛋白体;s:淀粉粒;ib:油脂体;d:高尔基体;v:空泡;m:线粒体;e:白色体. 1.愈伤组织表面和内部的胚性细胞团;2.愈伤组织内部胚性细胞,箭头指胚性细胞分裂后形成2个细胞;3.胚性细胞团,箭头指具较大细胞核的胚性细胞;4.可能起源于多细胞的胚性细胞团,箭头指连接胚性细胞团与愈伤组织的细胞;5.体细胞胚,白色箭头指厚壁细胞,黑色箭头指体细胞胚的附加结构;6.非胚性愈伤组织;7.胚性细胞周围发生降解的细胞,箭头指残留自溶物的细胞;8.愈伤组织表面的单个胚性细胞;9.胚性细胞横向分裂形成顶细胞(黑色箭头)和基细胞(白色箭头);10.愈伤组织表面的多细胞原胚,黑色箭头指胚性细胞团,白色箭头指胚柄;11-12.具胚柄的球形胚,箭头指胚柄;13.合子胚子叶内部均等分裂的胚性细胞;14.合子胚子叶内部产生的多细胞原胚;15-18.合子胚子叶表皮细胞体细胞胚发生过程的扫描电镜照片(15.诱导培养10天的合子胚子叶表皮细胞,黑色箭头指发生平周分裂后形成的2个细胞,白色箭头指形成的多细胞突起;16.诱导培养10天时形成的多细胞原胚;17.心形体细胞胚,箭头指发达的胚柄;18.愈伤组织表面的胚性细胞,箭头指发达的胚柄);19-26.胚性细胞与非胚性细胞的透射电镜照片[19.培养前的合子胚子叶细胞;20.诱导培养10天时的胚性细胞,箭头指细胞间隙变大;21, 22.诱导培养10天时解体的细胞(21.箭头指细胞核中核仁发生了染色质凝缩,趋近核膜;22.黑色箭头指细胞质浓缩,白色箭头指胞质内出现球状物);23-26.诱导培养30天时的球形胚,细胞内有丰富的淀粉粒和细胞器]. ec: Embryogenic cell; pc: Parenchyma cell; ct: Cavity; ca: Callus; w: Cell wall; n: Nucleus; nu: Nucleolus; pb: Protein bodies; s: Starch grains; ib: Lipid bodies; d: Galgi apparatus; v: Vacuole; m: Mitochondria; e: Etioplast. 1. Embryogenic cell aggregates (ECA) on epidermal of callus and inside callus; 2. Embryogenic cells inside callus, note the bicellular proembryo (arrows); 3. ECA, note the large nucleus inside cells (arrows); 4. Proembryo formed probably from internal multi-cell aggregates, note the cells connect proembryo and callus (arrows); 5. Globular embryo, note the sclerenchymatous cell (white arrow) and the attached structures of somatic embryo (black arrow); 6. Nonembryogenic callus; 7. Degradated cells around embryogenic cells, note the cells with autolysates (arrows); 8. Single embryogenic cell on epidermal of callus; 9. Bicellular proembryo from transverse division of single embryogenic cell, note the basal cell (white arrows) and the apical cell (black arrow); 10. Multicellular proembryos on epidermal of callus, note the multicellular structures (black arrow) and suspensor (white arrow); 11, 12. Globular embryo with suspensor (arrow); 13. The two-cell formed from single embryogenic cell inside zygotic cotyledon by equational division; 14. Multicellular proembryos inside zygotic cotyledon. 15-18. Scanning electron microscopy images of epidermal surfaces of zygotic cotyledons during somatic embryogenesis: 15. Epidermis cells of zygotic cotyledon at 10 days of culture on MS medium with growth hormone, the black arrow indicated the two-cell formed from single cell by periclinal division, and the white arrow showed the formed multi-cell swell; 16. Multicellular proembryo at 10 days of culture(arrow); 17. Heart-shaped somatic embryo, note the developed suspensor (arrow); 18. Embryogenic cell on epidermal of callus, note the developed suspensor (arrow). 19-26. Transmission electron microscopy images of embryogenic and nonembryogenic cells during somatic embryogenesis: 19. Epidermis cells of zygotic cotyledon just excised from seed; 20. Embryogenic cell at 10 days of culture, note the enlarged intercellular space (arrow); 21-22. Disintergrated cell at 10 days of culture, note the chromatin condensed and approached to nuclear envelop (arrow on the image 21), the cytoplasm concentrated (black arrow on the image 22) and round structure appear in cytoplasm (white arrow on the image 22); 23-26. Globular somatic embryo at 30 days of culture, note the ample starch granules and other organelles. |
2) 直接发生途径的细胞起源 合子胚的外植体表皮细胞和表皮下几层细胞均可分化出胚性细胞(图 1-12)。胚性细胞分裂产生2个细胞(图 2-13),进而分裂形成多细胞原胚(图 2-14)。这种直接发生的体细胞胚为单细胞起源,从单个胚性细胞到多细胞原胚始终被厚壁包围,与周围细胞形成明显的界限,具有相对的独立性(图 2-13)。原胚时期以后体细胞胚的形态发生过程同2.2.2所述。
2.2.4 细胞超微形态和超微结构观察超微形态观察发现,诱导培养10天时,合子胚表皮细胞形成许多不规则的多细胞突起,有的细胞发生了平周分裂(图 2-15),同时观察到多细胞原胚的存在(图 2-16)。培养4周时,可见分化的两侧对称的体细胞胚,体细胞胚具发达的胚柄(图 2-17)。愈伤组织表面形成的胚性细胞以发达的胚柄细胞与组织相连(图 2-18)。观察结果支持了花楸树体细胞胚发生中存在单细胞起源的结论。
透射电子显微镜观察发现,培养前的合子胚子叶细胞排列规则、紧密,壁薄(图 2-19);诱导培养10天时,细胞间隙变大、排列不规则,细胞壁变厚,形成了核仁明显的胚性细胞(图 2-20)。非胚性细胞的细胞核内染色质凝聚固缩,趋近核膜(图 2-21),细胞质浓缩、内膜系统紊乱、液泡膜破裂崩溃(图 2-22),胞质内出现许多不同大小和电子致密的球状物(图 2-22)。这些变化符合细胞程序性死亡(PCD)的形态学特征,观察结果支持了胚性细胞周围的细胞发生了程序性死亡的推测。对诱导培养30天获得的球形体细胞胚进行观察发现,胚性细胞体积小,排列紧密,胞质内分布着丰富的淀粉粒(图 2-23),细胞器数量较多,可清晰见到高尔基体、油脂体、蛋白体、线粒体和白色体的分布(图 2-24~26)。
3 结论与讨论花楸树体细胞胚的发生经历了与合子胚发生类似的过程,即都经历了从辐射对称向两侧对称发育过程,经历典型的球形胚、心形胚、鱼雷形胚阶段,最终发育成分化出子叶、胚根及原维管束的成熟胚。合子胚和体细胞胚在胚胎发育早期均存在明显的胚柄结构,发育晚期胚柄退化。体细胞胚发生与合子胚发生的区别主要有以下几点:1)体细胞胚发生中胚性细胞的第1次分裂存在均等分裂,这与合子的第1次不均等分裂不同(合子横向分裂产生1个大的基细胞和1个小的顶细胞);2)体细胞胚发生除了存在单细胞起源途径外,还可能存在多细胞起源途径;3)体细胞胚的体积一般小于相同发育阶段的合子胚;4)体细胞胚在形态发生上不如合子胚精确和规范,主要表现在相同培养时间下的发育进程不同步,相同发育阶段的体细胞胚体积大小不等,畸形胚的发生比较常见。
花楸树胚性愈伤组织表面和合子胚表面发生的体细胞胚在发育早期均具有明显的胚柄,鱼雷形胚时期胚柄退化。这与Smertenko等(2003)的研究结果类似,即在对欧洲云杉(Picea abies)体细胞胚发生过程的研究中发现,胚柄通过细胞程序性死亡(PCD)在早期胚胎形成的后期消失。Correia和Canhoto(2010)的研究表明,胚柄结构在费约果(Feijoa sellowiana)体细胞胚胎发育过程中起提供营养的作用。花楸树愈伤组织内部发生的体细胞胚没有胚柄,但通常以周围或下端较大的细胞区域与愈伤组织相连。推测对于花楸树愈伤组织内部发生的体细胞胚来说,其周围与愈伤组织相连的细胞区域起到了提供营养的作用。
孤立化的没有超过细胞分化临界期的单个细胞或细胞团是胚状体发生的必要条件(崔克明,2007)。目前,关于植物体细胞胚发生过程中细胞程序性死亡(PCD)研究的报道较多。如在陆地棉(Gossypium hirsutum)体细胞胚胎发生中存在PCD(吴家和等,2003;夏启中等,2005)。Smertenko等(2003)利用欧洲云杉体细胞胚发生系统研究了细胞骨架在植物胚胎发生和PCD中的作用,认为植物的胚胎发生需要依赖PCD,微管网络和丝状肌动蛋白组织的变化可以作为判断前胚性细胞群(PEMS)的标志。Maraschin等(2005)则报道了在大麦(Hordeum vulgare)小孢子体细胞胚发生中存在PCD。本研究在切片观察中发现花楸树早期多细胞原胚的周围存在大量降解的细胞,对细胞超微结构的观察表明,这些细胞具有PCD的形态学特征。这些细胞的PCD可为体细胞胚的发育创造必需的孤立化的微环境。但这些细胞的死亡过程是否是PCD以及发生PCD的细胞与体细胞胚发生及分化的关系尚需实验证据(崔克明,2007)。
关于植物体细胞胚发生中细胞起源问题尚未定论。现在越来越多的报道支持单细胞起源的观点(崔凯荣等,2000;林荣双等,2003;刘华英等,2004;张智俊等,2004;Ghanti et al., 2010)。花楸树的体细胞胚发生存在单细胞起源途径,但其是否存在多细胞起源途径尚需实验证据。单细胞起源的体细胞胚具有基因组成完全一致的特点,是基因转化的良好受体。花楸树直接起源于合子胚子叶表皮单细胞的体细胞胚占较高比例,这预示以合子胚子叶为外植体建立体细胞胚发生系统,将在花楸树遗传育种工程中发挥巨大潜力。
崔凯荣, 戴若兰. 2000. 植物体细胞胚发生的分子生物学[M]. 北京: 科学出版社.
|
崔克明. 2007. 植物发育生物学[M]. 北京: 北京大学出版社.
|
范丽颖, 任军, 林玉梅, 等. 2008. 东北地区花楸种子质量的种源变异研究[J]. 东北师大学报:自然科学版, 40(3): 131-135. |
孔冬梅, 沈海龙, 冯丹丹, 等. 2006. 水曲柳体细胞胚与合子胚发生的细胞学研究[J]. 林业科学, 42(12): 130-133. DOI:10.3321/j.issn:1001-7488.2006.12.023 |
林荣双, 王庆华, 梁丽琨, 等. 2003. TDZ诱导花生幼叶的不定芽和体细胞胚胎发生的组织学观察[J]. 植物研究, 23(2): 169-172. |
刘华英, 萧浪涛, 鲁旭东, 等. 2004. 柑橘体细胞胚发生的组织细胞学研究[J]. 果树学报, 21(4): 311-314. |
沈海龙, 杨玲, 张建瑛, 等. 2006. 花楸种子休眠影响因素与萌发特性研究[J]. 林业科学, 42(10): 133-138. DOI:10.3321/j.issn:1001-7488.2006.10.024 |
苏喜廷, 王国义, 张淑华, 等. 2005. 黑龙江省主要阔叶树种绿枝扦插的效果[J]. 东北林业大学学报, 33(5): 13-18. |
王爱芝, 沈海龙, 张鹏, 等. 2009. 花楸组织培养中玻璃化现象的发生与防治[J]. 东北林业大学学报, 37(10): 18-22. DOI:10.3969/j.issn.1000-5382.2009.10.007 |
吴家和, 张献龙, 聂以春. 2003. 棉花体细胞增殖和胚胎发生中的细胞程序性死亡[J]. 植物生理与分子生物学学报, 29(6): 515-520. |
夏启中, 张献龙, 聂以春, 等. 2005. 撤除外源生长素诱发棉花胚性悬浮细胞程序性死亡[J]. 植物生理与分子生物学学报, 31(1): 78-84. |
许建伟, 沈海龙, 张秀亮, 等. 2010a. 我国东北东部林区花楸树的天然更新特征[J]. 应用生态学报, 21(1): 9-15. |
许建伟, 沈海龙, 张秀亮, 等. 2010b. 花楸树种子散布、萌发与种群天然更新的关系[J]. 应用生态学报, 21(10): 2536-2544. |
杨玲, 沈海龙, 刘春苹, 等. 2010. 花楸合子胚诱导体细胞胚胎发生研究[J]. 植物研究, 30(2): 174-179. |
杨玲, 崔晓涛, 沈海龙. 2009a. 外源激素与发芽温度对花楸树种子萌发的影响[J]. 植物生理学通讯, 45(6): 555-561. |
杨玲, 沈海龙, 梁立东, 等. 2009b. 不同产区野生花楸果实和种子的表型多样性[J]. 东北林业大学学报, 37(2): 8-10. |
杨玲, 沈海龙, 梁立东, 等. 2008. 人工干燥和冷层积过程中的花楸树种子中内源激素含量变化[J]. 植物生理学通讯, 44(4): 682-688. |
张秀亮, 许建伟, 沈海龙, 等. 2010. 动物对花楸树种实的取食与传播[J]. 应用生态学报, 21(10): 2677-2683. |
张智俊, 金晓玲, 罗淑萍, 等. 2004. 油茶子叶体细胞胚形成的细胞学观察[J]. 植物生理学通讯, 40(5): 570-572. |
郑健, 郑勇奇, 吴超. 2009a. 花楸树嫩枝扦插繁殖技术研究[J]. 林业科学研究, 22(1): 91-97. |
郑健, 郑勇奇, 张川红, 等. 2009b. 花楸树天然群体的异交率[J]. 林业科学, 45(11): 44-49. |
郑健, 郑勇奇, 张川红, 等. 2008. 花楸树天然群体的遗传多样性研究[J]. 生物多样性, 16(6): 562-569. |
郑健, 郑勇奇, 吴超, 等. 2007. 花楸树的地理分布及天然更新方式[J]. 林业科学, 43(12): 86-93. DOI:10.3321/j.issn:1001-7488.2007.12.015 |
郑万钧. 1985. 中国树木志:第2卷[M]. 北京: 中国林业出版社: 1021-1022.
|
周德本. 1986. 东北园林树木栽培[M]. 哈尔滨: 黑龙江科学技术出版社: 114-116.
|
Correia S M, Canhoto J M. 2010. Characterization of somatic embryo attached structures in Feijoa sellowiana Berg.(Myrtaceae)[J]. Protoplasma, 242: 95-107. DOI:10.1007/s00709-010-0130-z |
Fambrini M, Durante C, Cionini G, et al. 2006. Characterization of LEAFY COTYLEDON1-LIKE gene in Helianthus annuus and its relationship with zygotic and somatic embryogenesis[J]. Dev Genes Evol, 216: 253-264. DOI:10.1007/s00427-005-0050-7 |
Ghanti S K, Sujata K G, Srinath R M, et al. 2010. Direct somatic embryogenesis and plant regeneration from immature explants of chickpea[J]. Biologia Plantarum, 54(1): 121-125. DOI:10.1007/s10535-010-0018-y |
Jordy M N, Favre J M. 2003. Spatio-temporal variations in starch accumulation during germination and post-germinative growth of zygotic and somatic embryos of Pinus pinaster[J]. Biologia Plantarum, 46(4): 507-512. DOI:10.1023/A:1024847007935 |
Maraschin S F, Gaussand G, Pulido A, et al. 2005. Programmed cell death during the transition from multicellular structures to globular embryos in barley androgenesis[J]. Planta, 221(4): 459-470. DOI:10.1007/s00425-004-1460-x |
Mathew M M, Philip V J. 2003. Somatic embryogenesis versus zygotic embryogenesis in Ensete superbum[J]. Plant Cell, Tissue and Organ Culture, 72: 267-275. DOI:10.1023/A:1022311126043 |
Pescador R, Kerbauy G B, Kraus J E, et al. 2008. Changes in soluble carbohydrates and starch amounts during somatic and zygotic embryogenesis of Acca sellowiana (Myrtaceae)[J]. In Vitro Cell Dev Biol-Plant, 44: 289-299. DOI:10.1007/s11627-008-9118-1 |
Schmidt T, Ewald A, Seyring M, et al. 2006. Comparative analysis of cell cycle events in zygotic and somatic embryos of Cyclamen persicum indicates strong resemblance of somatic embryos to recalcitrant seeds[J]. Plant Cell Rep, 25: 643-650. DOI:10.1007/s00299-006-0130-9 |
Smertenko A P, Bozhkov P V, Filonova L H, et al. 2003. Re-organisation of the cytoskeleton during developmental programmed cell death in Picea abies embryos[J]. The Plant Journal, 33: 813-824. DOI:10.1046/j.1365-313X.2003.01670.x |
Zhang S, Wong L, Meng L, et al. 2002. Similarity of expression patterns of knotted1 and ZmLEC1 during somatic and zygotic embryogenesis in maize (Zea mays L.)[J]. Planta, 215: 191-194. DOI:10.1007/s00425-002-0735-3 |
 2011, Vol. 47
2011, Vol. 47

