文章信息
- 宋鸽, 宋福强
- Song Ge, Song Fuqiang
- AM真菌和紫穗槐苗互作早期宿主防御生理指标的响应特征
- Response Characteristics of Physiological Defense Indexes of Host Plant at Early Stage of Arbuscular Mycorrhiza Development between Amorpha fruticosa and AM Fungi
- 林业科学, 2011, 47(11): 44-50.
- Scientia Silvae Sinicae, 2011, 47(11): 44-50.
-
文章历史
- 收稿日期:2010-10-25
- 修回日期:2011-03-09
-
作者相关文章
丛枝菌根(arbuscular mycorrhiza, AM)真菌是自然界分布最为广泛的一种内生菌根菌,它能够与地球上大约90%陆生植物形成丛枝菌根共生体(Heckman et al., 2001)。在AM共生体形成过程中,AM真菌和宿主植物之间进行复杂信号分子的交换。目前控制AM共生体发育的机制绝大部分还是未知的。在AM真菌侵入宿主植物根皮层细胞时,植物的细胞质膜会发生一系列的变化,包括质膜离子透性的改变、质膜结合酶活性的变化、激酶、磷酸酶和磷脂酶的激活,以及一些防御信号分子的产生,这些现象的出现都是由于防御基因转录活性增加的结果(Bettina et al., 2005)。在AM共生体形成过程中产生一些新的与菌根共生相关的几丁质酶,推测这些几丁质酶不同于经典的植物防御反应中的几丁质酶,它们能够破坏从真菌细胞壁释放出的几丁质诱导子,将其分解形成小分子片段,使其钝化,从而促进菌根共生体的形成(Pozo et al., 1996),这种防御反应的产生可能对于菌根共生体的形成具有非常重要的作用。
目前关于AM真菌诱导和调节植物防御反应的研究较少。本文以木本豆科植物紫穗槐(Amorpha fruticosa)为宿主植物,外源接种AM真菌根内球囊霉(Glomus intraradices)和摩西球囊霉(G. mosseae),在AM真菌和宿主植物互作的早期阶段,测定紫穗槐根系保护酶苯丙氨酸解氨酶(PAL)、β-1, 3-葡聚糖酶、多酚氧化酶(PPO)和过氧化物酶(POD)活性,以及膜脂过氧化物丙二醛(MDA)、类黄酮和可溶性蛋白含量的响应情况,揭示AM真菌诱导宿主植物产生防御反应的特点,同时测定几丁质诱导子降解产物葡萄糖胺(GlcN)含量变化情况,以期为菌根形成机制的研究提供理论依据。
1 材料和方法 1.1 试验材料供试AM真菌为根内球囊霉(GI)和摩西球囊霉(GM),孢子含量约为每20 mL 1 630个,由黑龙江大学生态实验室保藏;供试植株紫穗槐种子由吉林省林业科学研究院提供。
1.2 试验方法 1.2.1 试验设计试验在温室盆栽条件下进行,将紫穗槐分别设不接种(CK)、播种时接种GI和GM 3个处理,每个处理重复10盆,共计30盆,温室随机排列。
1.2.2 苗木培养将紫穗槐种子消毒(20~30 ℃温水搓洗后用0.3%KMnO4浸泡3~4 h),然后催芽(20~30 ℃温水浸泡24 h,隔天换水1次);将草碳土、细沙、蛭石按5:2:3比例混合,121 ℃、0.1 MPa高压蒸汽灭菌2 h,用牛皮纸包起,自然晾干。将催芽后的紫穗槐种子种植在处理后的土壤中,分别进行以下3种处理:
1) 单接种GI:接种60 gGI接种物,同时加入灭菌的GM接种物60 g。
2) 单接种GM:接种60 gGM接种物,同时加入灭菌的GI接种物60 g。
3) 不接种(CK):分别加入60 g灭菌GI和GM接种物,以保证微生物区系的一致。
试验在紫穗槐出苗后11~27天进行,其中在紫穗槐出苗后11~13天, 25~29天,接种AM真菌同CK处理相比防御酶活性变化均不显著,因此选取紫穗槐出苗后15, 17, 19, 21, 23和25天作为本试验研究的时间点,在各时间点每处理随机抽取1盆,剪取幼根,将幼根用液氮速冻后,置于-70 ℃超低温冰箱保存,用于下列各项指标的测定。
1.2.3 测定方法菌根侵染率采用酸性品红的染色方法测定,其中附着孢和菌丝均能被染色观察(Phillips et al., 1970)。苯丙氨酸解氨酶(PAL)和β-1, 3-葡聚糖酶活性的测定参照李海燕等(2003)的方法,过氧化物酶(POD)和多酚氧化酶(PPO)活性测定采用愈创木酚法,各时间点每个处理3次重复。膜脂过氧化物丙二醛(MDA)含量测定参照李敏等(2003)的方法。类黄酮含量的测定参照许峰等(2008)的方法。葡萄糖胺(GlcN)含量的测定参照王英瑛等(2009)的方法,可溶性蛋白含量采用考马斯亮蓝(G-250)测定。紫穗槐根段蛋白质提取采用改良的Tris-HCl法(曾广娟等, 2008)。SDS-PAGE:分离胶浓度为12%,浓缩胶浓度为5%,采用稳压电泳,设定值为:进入分离胶前为稳压80 V,进入分离胶后为稳压120 V。当溴酚蓝指示剂迁移至距下沿约1.5 cm处即停止电泳。电泳结束后取出凝胶,在35 ℃左右的恒温振荡水浴锅中染色约3 h后脱色,并在凝胶成像系统中进行观察拍照。
1.3 数据处理数据采用Excel和SPSS13.0统计软件进行处理。SDS-PAGE图谱采用Quantity-one软件分析蛋白质分子量。
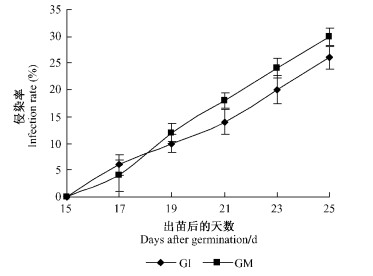
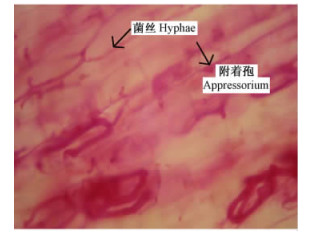
2 结果与分析 2.1 苗木菌根侵染率根据Trouvelot法计算苗木菌根侵染率变化情况如图 1所示。随着林业科学201209已修改ID并上传477201220时间的延长菌根侵染率逐渐增加,在紫穗槐出苗后17天,接种GI和GM处理均观察到附着孢的出现。附着孢的形成标志着AM真菌和宿主植物之间相互识别的成功,而且在植物根皮层细胞表面分布着大量的菌丝(图 2),此时接种GI和GM菌根侵染率分别为6%和4%,而在紫穗槐出苗后19天,在紫穗槐根内出现丛枝,丛枝是AM真菌和植物之间营养交换的场所,此时接种GI和GM处理菌根侵染率分别为10%和12%,接种GM菌根侵染率高于接种GI处理,由此说明前者同宿主植物之间的相容性更好。
|
图 1 紫穗槐苗木菌根侵染率 Figure 1 Infection rate of Amorpha fruticosa inoculated with AM fungi |
|
图 2 菌丝和附着孢 Figure 2 Hyphae and appressorium |
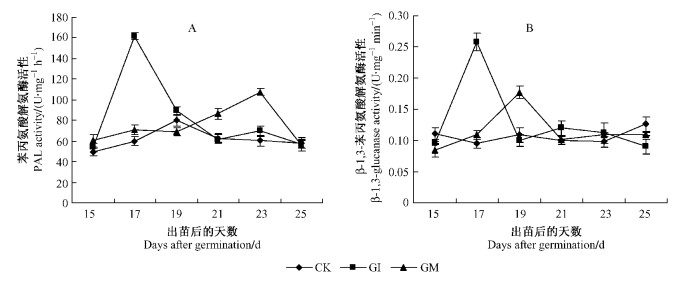
在紫穗槐出苗后15~25天,接种AM真菌处理,苯丙氨酸解氨酶和β-1, 3-葡聚糖酶活性瞬时增加。其中接种GI处理,PAL活性在紫穗槐出苗后17天达到最大值161.8 U·mg-1h-1,而接种GM处理,PAL活性在紫穗槐出苗后23天达到最大值107.6 U·mg-1h-1,2种处理达到最大值时同CK之间差异均达到极显著水平(P < 0.01),随后接种GI和GM处理PAL活性下降(图 3A)。接种GI和GM处理,β-1, 3-葡聚糖酶分别在紫穗槐出苗后17和19天达到最大值0.258和0.177 U·mg-1min-1,达到最大值时同CK之间差异均达到极显著水平(P < 0.01),随后β-1, 3-葡聚糖酶活性也下降到CK以下(图 3B)。
|
图 3 接种AM真菌后紫穗槐根部PAL(A)和β-1, 3-葡聚糖酶(B)活性的变化 Figure 3 Activities of PAL and β-1, 3-glucanase at A. fruticosa roots inoculated with AM fungi |
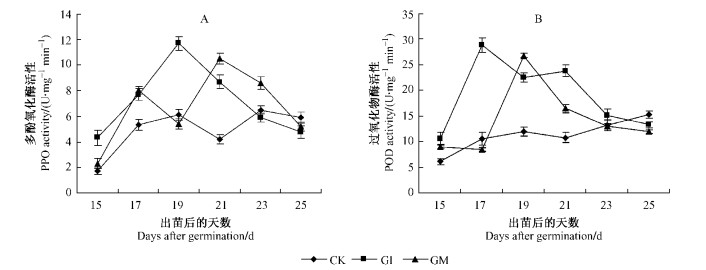
多酚氧化酶(PPO)和过氧化物酶(POD)活性呈现瞬时增加趋势,接种GI和GM处理,PPO活性分别在紫穗槐出苗后19和21天达到最大值11.7和10.5 U·mg-1min-1,而且同CK之间的差异均达到极显著水平(P < 0.01),随后PPO活性逐渐下降到CK以下(图 4A)。接种GI和GM处理,分别在紫穗槐出苗后17和19天,POD活性达最大值28.8和26.8 U·mg-1min-1,2种处理同CK之间的差异达到极显著水平(P < 0.01),此后POD活性也逐渐下降到CK以下(图 4B)。
|
图 4 接种AM真菌后紫穗槐根部POD(A)和PPO(B)活性的变化 Figure 4 Activities of POD and PPO at A. fruticosa roots inoculated with AM fungi |
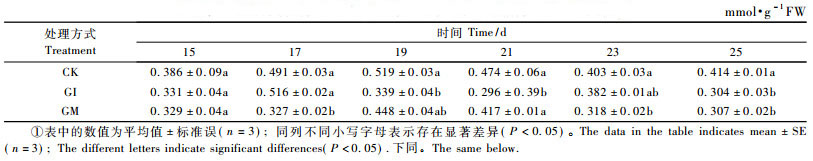
如表 1所示:接种AM真菌能够降低膜脂过氧化物MDA含量,尤其在紫穗槐出苗后25天,接种GI和GM处理MDA含量分别降低26.6%和25.8%,此时接种AM真菌处理同CK之间的差异均达到显著水平(P < 0.05),而接种AM真菌处理之间没有明显的差异,这说明在AM真菌和宿主植物互作的早期阶段,菌丝侵入宿主植物根皮层细胞并没有损伤根皮层细胞的细胞膜,相反,AM真菌能够降低MDA含量,在一定程度上增强细胞膜结构的稳定性和完整性,从而增强菌根化植物对逆境的抵抗能力。
|
|
如表 2所示,在紫穗槐出苗后15~25天,类黄酮含量瞬时增加,其中在紫穗槐出苗后21天,接种GI处理植株根系中类黄酮含量达到最大值107.8 mmol·kg-1,与CK相比类黄酮含量提高78.3%,而在紫穗槐出苗后23天,接种GM处理植株根系中的类黄酮含量达到最大值92.2 mmol·kg-1,与CK相比类黄酮含量提高23.1%,随后接种GI和GM处理类黄酮含量下降到CK以下水平。
|
|
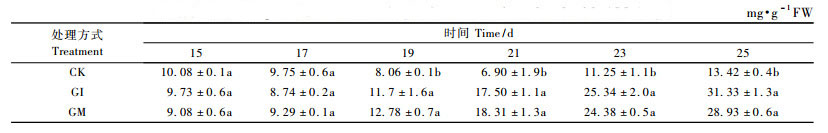
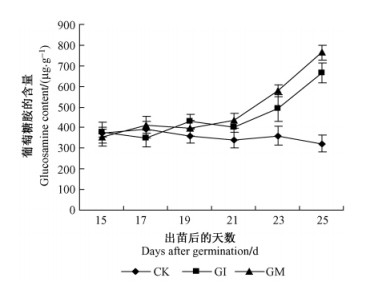
随着时间的延长,接种GI和GM处理GlcN含量逐渐增加。其中在紫穗槐出苗后15~21天,接种GI和GM处理同CK的GlcN含量之间差异均不显著(P>0.05),而在紫穗槐出苗后23~25天,接种GI和GM处理同CK的GlcN含量之间的差异均达到极显著水平(P < 0.01),尤其在紫穗槐出苗后25天,接种GI和GM处理GlcN含量分别是CK处理2.1和2.4倍,而在此时防御酶活性均已达到最大值后下降到空白对照以下,也即在防御酶逐渐失活的同时,几丁质诱导子逐渐分解为GlcN(图 5)。
|
图 5 接种AM真菌后穗槐根部葡萄糖胺(GlcN)含量的变化情况 Figure 5 Changes of GlcN content at Amorpha fruticosa roots inoculated with AM fungi |
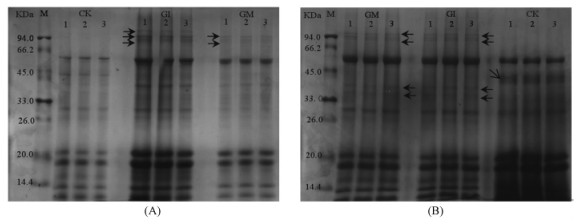
可溶性蛋白含量变化情况,在紫穗槐出苗后15~25天,接种GI和GM处理可溶性蛋白含量逐渐增加。其中从紫穗槐出苗后19天起,接种AM真菌同CK处理之间差异达到显著水平(P < 0.05),接种GI和GM处理可溶性蛋白含量同CK相比分别提高31.1%和36.9%(表 3)。紫穗槐出苗后19天可溶性蛋白SDS-PAGE图谱,其中接种GI处理检测到3条新增蛋白质条带(图 6A),其分子量从上到下分别为113.879, 89.698和78.028 ku,而接种GM处理检测到2条新增蛋白质条带,其分子量从上到下分别为89.856, 78.397 ku,而在紫穗槐出苗后25天,接种GI和GM处理可溶性蛋白同CK相比分别提高57.2%和53.6%,图 6B所示为紫穗槐出苗后25天可溶性蛋白SDS-PAGE图谱,接种GI处理检测到4条新增蛋白质条带,分子量从上到下分别为113.879, 89.698, 40.028, 36.527 ku,接种GM处理同样检测到4条新增蛋白质条带,分子量从上到下为113.855, 89.574, 40.031, 36.428 ku,同时还检测到接种AM真菌处理明显消失的1条蛋白质条带,其分子量约为42.176 ku,消失的蛋白质条带可能转变成小分子肽参与共生体双方的信号识别,也可能是共生基因抑制了某些基因的表达所致。在AM真菌和宿主植物互作的早期阶段,随着可溶性蛋白含量的增加,产生一些新的蛋白,而且在紫穗槐出苗后19~25天,新增蛋白的数目逐渐增加,而此时植物的防御反应水平呈现下降的趋势,由此推测这些新的蛋白一方面可能是构建AM共生体形成所必需的,另一方面可能是一些特异性调解植物防御反应的代谢酶类,在丛枝菌根共生体形成中起到重要的作用。
|
|
|
图 6 在紫穗槐出苗后19天(A)和25天(B)接种AM真菌可溶性蛋白SDS-PAGE分析 Figure 6 SDS-PAGE analysis of soluble protein after 19 d and 25 d of A.fruticosa roots inoculated with AM fungi |
AM真菌同宿主植物互作的早期阶段会发生复杂的生理学和生物化学的变化。本研究结果表明: AM真菌同宿主植物互作早期能够诱导宿主植物产生瞬时的防御反应,而且防御反应具备AM真菌种的差异性,在一定程度上AM真菌G. intraradices同G. mosseae相比,后者同宿主植物之间的相容性更好,共生关系更密切。Rodríguez等(2001)研究同样证实不同的AM真菌诱导宿主植物产生防御反应的强度是不同的,AM真菌G. fasciculatum同G. clarum相比,前者同宿主植物之间的相容性更好,共生关系更密切。SA途径的关键酶PAL和β-1, 3-葡聚糖酶能够催化次生代谢产物和PR蛋白的合成,JA信号转导途径的关键酶POD和PPO可能是作为抗氧化剂分解AM真菌菌丝侵入植物根皮层细胞时产生的活性氧分子,在减少对细胞毒害作用的同时,避免植物防御基因的激活(Harrison et al., 1993)。本试验中保护酶瞬时激活,一方面达到早期防御的目的,另一方面在细胞壁上产生的植保素和木质素是少量的,没有构成AM真菌进一步侵染的障碍,因此瞬时防御反应的产生并没有阻止丛枝菌根共生体的形成。MDA是膜脂过氧化作用最终产物,能影响细胞膜结构,干扰正常生理代谢,其含量的高低是膜脂过氧化程度的重要指标。本试验结果表明: AM真菌能够降低膜脂过氧化物MDA含量,在一定程度上增强了膜系统的稳定性和完整性,这与贺忠群等(2008)获得结果是相一致的,原因可能是在植物与AM真菌附着孢接触位点上出现皮层细胞壁加厚现象(李敏等, 2003),保护了细胞膜的稳定性和完整性。在AM真菌和宿主植物互作的早期阶段,菌丝的侵染在一定程度启动植物自身的防御体系,导致具有抗菌活性的类黄酮瞬时积累,作为防御代谢产物的类黄酮对AM真菌具备毒害作用,在AM共生体形成过程中可能逐渐转化为无毒的碳水化合物,作为碳消耗供体在AM共生体形成过程中发挥作用(Soares et al., 2005)。可溶性蛋白含量在植物体内代谢过程中的变化可以反映细胞内蛋白合成、变性和降解等方面的信息。本试验中,在AM真菌同宿主植物互作的早期阶段,接种AM真菌增加可溶性蛋白的含量,而且随着菌根共生体的建立,既产生一些新的蛋白,又存在消失的蛋白,原因可能是在AM真菌和宿主植物互作过程中,宿主植物细胞组织基因表达发生改变,某些基因(如共生相关基因、病程相关蛋白基因)会被诱导表达而产生相应的蛋白质,如几丁质酶基因在AM真菌和宿主植物互作过程中的诱导表达已经得到证实,同时某些相关基因的表达会被抑制或推迟,甚至使得原有的蛋白质被降解,从而达到共生的目的(Jose et al., 2002)。
AM真菌和植物病原菌具有一些相同的表面分子,包括几丁质和葡聚糖,这些普遍的诱导子概念上等同于病理相关分子(pathogen-associated molecular patterns, PAMP),在AM真菌和宿主植物初始识别过程中,可以作为诱导子诱导植物产生防御反应(Maria et al., 2005)。本研究认为外源几丁质诱导子的降解是调节植物防御反应允许建立互惠共生体的机制之一。在AM共生体发育的早期阶段植物防御反应的激活或者水平下调都是作为共生体发育的阶段而存在(Nagahashi et al., 1996)。Ikram等(2000)研究发现: AM真菌G.mosseae侵染烟草(Nicotiana tabacum ‘Tennessee’)早期阶段,过氧化氢酶和过氧化物酶瞬时激活,同时防御信号分子水杨酸(SA)发生瞬时积累。杨瑞红等(2005)认为AM真菌诱导宿主植物产生的防御反应是宿主植物调节应急抑制而允许建立互惠共生体的结果。目前有研究指出:在AM共生体形成过程中防御反应的产生和调节是与丛枝的发育时期密切相关的,防御反应下调是与丛枝初期发育相关联的(Hirsch et al., 1998)。本研究中在紫穗槐出苗后19~25天发现根皮层细胞内丛枝菌根的数量逐渐增加,同时SDS-PAGE检测发现新增蛋白数目逐渐增多,而在此时期内防御水平呈现下降的趋势,推测丛枝不仅是作为共生体双方的营养器官,还可能类似于植物病原真菌的“吸根”,能够分泌一些无毒性的蛋白抑制防御反应的产生,促进丛枝菌根共生体的形成。然而丛枝的形成贯穿共生体形成的始终,推断防御反应的调节可能是由丛枝连续介导的(Abramovitch et al., 2004),因此丛枝分泌的蛋白可能是调节防御反应允许建立互惠共生体的另一种作用机制。在共生体形成过程中防御反应的产生在一些共生细菌,如苜蓿中华根瘤菌(Sinorhizobium meliloti)侵染苜蓿(Medicago)的早期阶段是作为调节侵染和结瘤的一种机制而存在,由于目前关于丛枝菌根的研究还存在着一系列的瓶颈问题,如AM真菌不能纯培养等,对于明确阐明AM共生体中防御反应激活的作用和意义还存在着一定的困难,仍有待于进一步的研究。深入的研究AM真菌诱导宿主植物产生的防御反应及调节机制将有助于研究者深入的理解菌根共生体的形成,使其在农业和自然生态系统中发挥更大的作用。
贺忠群, 贺超兴, 任志雨, 等. 2008. 不同丛枝菌根真菌对番茄酶活性及光合作用的影响[J]. 北方园艺, (6): 21-24. |
李海燕, 刘润进, 李艳杰, 等. 2003. AM真菌和胞囊线虫对大豆根内酶活性的影响[J]. 菌物系统, 22(4): 613-619. |
李敏, 王维华, 刘润进. 2003. AM真菌和镰刀菌对西瓜根系膜脂过氧化作用和膜透性的影响[J]. 植物病理学报, 33(3): 229-232. |
王英瑛, 李俊, 曾苏. 2009. 氨基葡萄糖3种含量测定方法的比较[J]. 中国现代应用药学杂志, 26(4): 307-309. |
许峰, 朱俊, 张凤霞, 等. 2008. 国槐苯丙氨酸解氨酶基因的克隆、反义表达载体构建及遗传转化[J]. 林业科学研究, 21(5): 611-618. |
杨瑞红, 原永兵, 刘润进. 2005. 水杨酸在AM真菌侵染和诱导植物抗病性中的作用[J]. 菌物学报, 24(4): 606-611. |
曾广娟, 李春敏, 张新忠, 等. 2009. 适于SDS-PAGE分析的苹果叶片蛋白质提取方法[J]. 华北农学报, 24(2): 75-78. DOI:10.7668/hbnxb.2009.02.016 |
Abramovitch R B, Martin G B. 2004. Strategies used by bacterial pathogens to suppress plant defenses[J]. Curr Opin Plant Biol, 7(4): 356-364. DOI:10.1016/j.pbi.2004.05.002 |
Bettina H, Thomas F. 2005. Molecular and cell biology of arbuscular mycorrhizal symbiosis[J]. Planta, 221(2): 184-196. DOI:10.1007/s00425-004-1436-x |
Harrison M J, Dixon R A. 1993. Isoflavonoid accumulation and expression of defense gene transcripts during the establishment of vesicular-arbuscular mycorrhizal associations in roots of Medicago trunculata[J]. Molecular Plant-Microbe Interactions, 6(5): 643-654. DOI:10.1094/MPMI-6-643 |
Heckman D S, Geiser D M, Eidell B R, et al. 2001. Molecular evidence for the early colonization of land by fungi and plants[J]. Science, 293(5532): 1129-1133. DOI:10.1126/science.1061457 |
Hirsch A M, Kapulnik Y. 1998. Signal transduction pathways in mycorrhizal associations:comparisons with the Rhizobium-legume symbiosis[J]. Fungal Genetics and Biology, 23(3): 205-212. DOI:10.1006/fgbi.1998.1046 |
Ikram B, Pablo B, Juan A, et al. 2000. Induction of catalase and ascorbate peroxidase activitesin tobacco roots inoculated with arbuscular mycorrhizal Glomus mosseae[J]. Mycorrhiza, 104(6): 722-725. |
Jose M, Garcia-G, Ocampo. 2002. Regulation of the plant defense response in arbuscular mycorrhizal symbiosis[J]. Journal of Experimental Botany, 53(373): 1377-1386. DOI:10.1093/jexbot/53.373.1377 |
Maria J. 2005. Signaling in the arbuscular mycorrhizal symbiosis[J]. Annu Rev Microbiol, 59: 19-42. DOI:10.1146/annurev.micro.58.030603.123749 |
Nagahashi G, Douds D D, Abney G D. 1996. Phosphorus amendment inhibits hyphal branching of the VAM fungus Gigaspora margarita ditectly and indirectly through and indirectly through its effect on root exudation[J]. Mycorrhiza, 6(5): 403-408. DOI:10.1007/s005720050139 |
Phillips J M, Haymen D S. 1997. Imprived pricedures for clearing and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid, assessment of in fection[J]. Trans Br Mycol Soc, 55: 158-161. |
Pozo M J, Dumas-Gaudot E, Slezack S, et al. 1996. Induction of new chitinase isoforms in tomato roots during interactions with Glomus mosseae and/or Phytopthora nicotianaeva var.Parasitica[J]. Agronomie, 16: 689-697. DOI:10.1051/agro:19961014 |
Rodríguez Y, Pérez E, Solórzano E, et al. 2001. Peroxidase and polyphenoloxidase activities in tomato roots inoculated with Glomus clarum or Glomus fasciculatum[J]. Cultivos Tropicales, 22(1): 11-16. |
Soare A C F, Marco A M, Lêda M, et al. 2005. Arbuscular mycorrhizal fungi and the occurrence of flavonids in roots of passion fruit seedlings[J]. Sci Agric, 62(4): 331-336. DOI:10.1590/S0103-90162005000400005 |
 2011, Vol. 47
2011, Vol. 47