文章信息
- 王斌, 巨波, 赵慧娟, 张群, 朱义, 崔心红
- Wang Bin, Ju Bo, Zhao Huijuan, Zhang Qun, Zhu Yi, Cui Xinhong
- 不同盐梯度处理下沼泽小叶桦的生理特征及叶片结构
- Photosynthetic Performance and Variation in Leaf Anatomic Structure of Betula microphylla var. paludosa under Different Saline Conditions
- 林业科学, 2011, 47(10): 29-36.
- Scientia Silvae Sinicae, 2011, 47(10): 29-36.
-
文章历史
- 收稿日期:2010-09-26
- 修回日期:2011-07-26
-
作者相关文章
2. 华东理工大学 上海 200237
2. East China University of Science and Technology Shanghai 200237
土壤盐分过多会影响植物体内诸多生理过程如光合作用、呼吸作用、能量和脂类代谢及蛋白质合成等(廖岩等,2007),对植物组织产生渗透胁迫、离子毒害以及活性氧代谢失衡等破坏作用,进而引起植物生理性干旱、营养缺乏、细胞结构破坏等一系列生理生化过程的改变,是影响植物生长发育的主要逆境因子之一(Zhu, 2001;朱宇旌等,2000;廖岩等,2007)。盐生植物最主要的特点在于其对盐渍生境的适应能力,即盐渍环境下植物能够用各种方式去克服离子胁迫和渗透胁迫等因素而存活下来并维持正常生长。盐生植物对盐分胁迫通常会在形态结构和生理过程上表现出适应性特征。许多植物在受到盐胁迫时,其营养器官的解剖结构会发生一系列的变化来适应高盐环境,这属于形态学适应。渗透调节则是生理适应中最有效的措施之一,其方式有2种:一是在细胞中吸收、积累无机盐作为渗透调节剂,降低渗透势,避免细胞脱水,防止盐害;二是在细胞中合成一定数量的相溶性物质如氨基酸、有机酸、可溶性碳水化合物、糖醇类物质等(Takemura et al., 2000;Hartzendof et al., 2001),来共同进行渗透调节,以适应外界的低水势,而且还能稳定细胞质中酶分子的活性结构,保护其不受盐离子的伤害(赵可夫等,1999)。
沼泽小叶桦(Betula microphylla var. paludosa)为桦木属(Betula)植物,小乔木或灌木, 生长于潮湿盐碱地及盐沼泽附近,能大面积生于荒漠沼泽的独特生境(杨昌友等,2006)。调查发现,我国约有500余种盐生植物,其中木本植物所占比例稀少(王健,2003),由于沼泽小叶桦在改造和利用盐渍土方面特性,将可能是优良的候选树种之一。在我国广阔的东部沿海滩涂地区,如果能将沼泽小叶桦引种到这些地区, 如上海,不仅能丰富该地区的植被类型,改善生态环境,也是对珍稀植物沼泽小叶桦的有效保护利用。
沼泽小叶桦长期生长于西北地区潮湿盐碱地及盐沼泽附近,适应其所处的特殊水文地质条件及土壤环境,但目前国内外对其生理适应机制研究报道极少。有沼泽小叶桦生长的新疆荒漠沼泽地区土壤的无机盐以Ca(HCO3)2,Na2SO4为主,而华东滨海地区如上海、江苏等其土壤为滨海盐土,无机盐以NaCl,Na2SO4为主,两地区的水文及土壤条件相差很大。盐胁迫对植物的伤害,与土壤的盐分种类、盐分浓度、植物种类以及植物的生长期等诸多因素有很大的关系(赵可夫等,1999)。比如在低或中浓度盐处理下NaCl引起基质分解,电子透明度增加,使叶绿体膨胀,淀粉粒积累多;而同浓度的Na2SO4对叶绿体的伤害小,几乎不改变叶绿体的超微结构,低浓度下,不造成明显伤害(简令成等,2009)。在引种前必须了解沼泽小叶桦对滨海盐土的适应性。因此本试验研究不同盐度梯度对沼泽小叶桦生长、光合参数、叶绿素含量、叶片脯氨酸、可溶性糖、蛋白质含量、叶片超微结构等的效应,探讨沼泽小叶桦对盐性土壤适应的机制,为促进其保护利用和在滨海地区引种种植提供理论依据。
1 材料与方法 1.1 试验材料2005年将沼泽小叶桦从新疆引种到上海市园林科学研究所的苗圃内, 成活率及生长均良好。2009年4月将生长一致性较好的试验苗[高度在(60±5)cm之间]采用盆栽土培的方法,移入温室中,温室四周通风,只在顶部覆盖塑料薄膜,以防雨水进入,试验期间温度为(25±5)℃。培养盆直径为30 cm,高40 cm。将培养盆放入直径为40 cm、深度为5 cm的塑料盘中,内盛不同浓度盐溶液,培养盆底部中空,保持底部3~4 cm浸在盐溶液中。盐溶液通过培养盆底部小孔和毛细管虹吸作用渗入土壤中。盐分处理水平为0.2%,0.4%,0.6%,0.8%,另设一个盐浓度为0作为对照(CK)。盐溶液中盐分为混合盐,组成模拟上海市临港滨海盐土组成特点(朱义等,2007),按NaCl,Na2SO4,NaHCO3的质量比分别占75%,15%,10%的比例配制。每个处理(盐浓度)设置5个重复。每天对盛盐溶液的塑料盘进行清洗,并重新添加盐溶液,使盐溶液浓度每天保持一致。在试验开始、中期和结束时分别检测土壤的EC和pH。土壤盐度(EC值)用EC Testr土壤原位电导计测定,土壤pH值用Multi 340i手提式pH计测定。
试验苗4—5月在温室内适应性生长,盐胁迫试验从6月开始至9月结束。
1.2 试验方法 1.2.1 叶片叶绿素含量采用分光光度法(张志良等,2003)。
1.2.2 可溶性总糖含量采用蒽酮比色法(张志良等,2003)。
1.2.3 蛋白质含量的测定按照Bradford(1976)的方法,用考马斯亮蓝染色法。
1.2.4 脯氨酸含量的测定按照Bates(1973)的方法进行。
以上所有指标均重复测定5次。
1.2.5 光合速率测定使用Li-6400光合仪。选择健康无病虫害的功能叶(成熟叶)进行光合测定,每次测定时间选在9:00,每个盐度水平选择2~3株进行测定,每株选择3片功能叶,测量的叶面面积为6 cm2,测量时叶片温度为(35±1)℃,光合有效辐射为1 100~1 400 μmol·m-2s-1,待光合速率稳定后每片叶子连续测定8个值,取其平均值作为最终结果。试验初期、中期和末期各检测1次。测定指标包括叶片净光合速率(Pn,μmolCO2·m-2s-1)、气孔导度(Gs,molH2O·m-2s-1)、胞间CO2浓度(Ci,μmolCO2·mol-1)和蒸腾速率(Tr,mmolH2O·m-2s-1)等。
1.2.6 叶片解剖结构和超微结构观察选用试验末期沼泽小叶桦试验苗上第3~4片功能叶,叶片解剖结构参照郑国锠(1979)的石蜡切片技术。超微结构观测用试验末期沼泽小叶桦功能叶的中部近主脉处取1~2 mm2大小的样品块,用2.5%戊二醛前固定和1%锇酸进行后固定。常规系列乙醇丙酮脱水后环氧树脂浸透、包埋,超薄切片机切片,醋酸双氧铀-柠檬酸铅双染,用日立H-600透射电镜观察、拍照。
1.3 数据处理利用EXCEL进行基础数据输入,采用分析软件SPSS13.0进行统计分析,利用two-way Anova方法进行显著性检验。
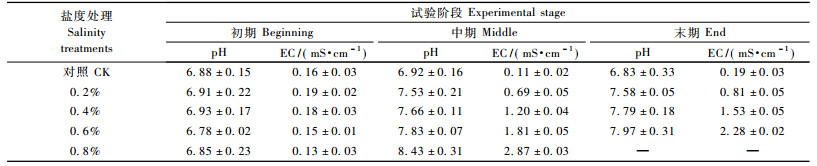
2 结果与分析 2.1 不同盐度处理下土壤的理化性质和沼泽小叶桦的生长状况如表 1所示:土壤在对照和处理前pH值为6.78,EC值为0.16 mS·cm-1,全盐量0.41g·kg-1,土壤总体偏中性、盐度低。在不同盐度处理下土壤的pH值,EC值均随盐度的增加而增大,增幅在前期增加较快,然后趋缓。0.8%盐溶液处理的土壤在30天时pH值达到8.43,EC值达2.87。
|
|
对照和0.2%,0.4%盐溶液处理的沼泽小叶桦生长良好,无死亡发生;0.6%盐溶液处理下,在试验结束时5个重复中3盆死亡,2盆生长良好;0.8%盐溶液处理1周后沼泽小叶桦叶片开始变黄而逐渐凋落,经过1个月左右逐步死亡。从植物的生长状况来看,其对盐溶液浓度在0~0.6%之间的处理和土壤pH值小于8(6.83~7.79)土壤具有一定的耐性;当盐溶液浓度>0.6%时,土壤的pH值接近8(7.97),土壤环境已不适合沼泽小叶桦生长。
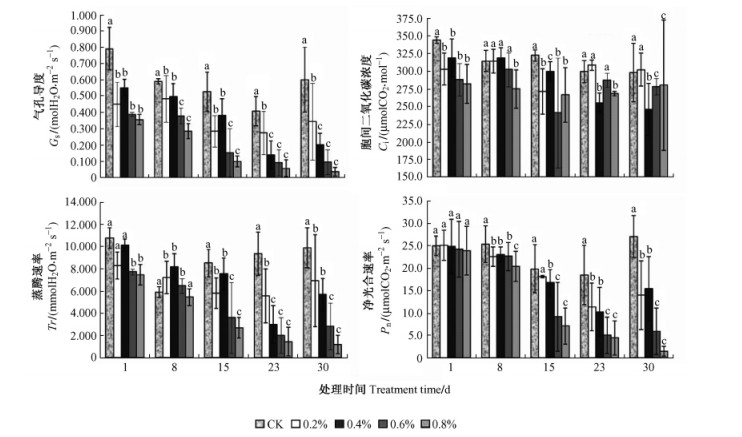
2.2 不同盐度处理对沼泽小叶桦叶片净光合速率、气孔导度、胞间CO2浓度和蒸腾速率的影响由图 1可知:沼泽小叶桦在盐处理早期(8天以内)由于气孔性因素而使得气孔导度、胞间CO2浓度和蒸腾速率显著下降,且随盐浓度升高降幅越大,但净光合速率对照组与盐处理组差异不显著。这是植物气孔结构应激的体现,同时也反映沼泽小叶桦对盐存在一定耐受性。这主要是植物受到盐分胁迫后叶片气孔保卫细胞首先受影响而关闭,继而降低蒸腾速率并阻挡外界二氧化碳进入,即气孔因素首先影响沼泽小叶桦的光合作用。在受盐胁迫15天时盐处理组净光合速率显著下降。在盐处理15天之后,根据测定结果可知:此时气孔导度、胞间CO2浓度和蒸腾速率下降幅度趋缓,而净光合速率的降幅仍随盐浓度增加而增加,差异显著,且在较高浓度组(0.6%,0.8%)个别植株有死亡现象。此后的净光合速率均显著下降,且较高盐浓度组的降幅高于低盐浓度组。而0.2%和0.4%浓度组沼泽小叶桦在23天胁迫处理后,其各项光合生理指标变化均趋于平缓,此时可能主要由于光合载体受破环等非气孔性因素成为影响光合作用的主导因素。上述结果表明沼泽小叶桦对于低盐胁迫具有一定适应性。
|
图 1 不同盐度下沼泽小叶桦叶片净光合速率、气孔导度、蒸腾速率和胞间CO2浓度的变化 Figure 1 Changes of net photosynthetic rate, stomatal conductance, transpiration rate and intercellular CO2 concentration of B. microphylla leaves under different salinity conditions 不同字母表示处理间差异显著(P < 0.05)。Different letters meant significant difference among treatments at 0.05 level.下同。The same below. |
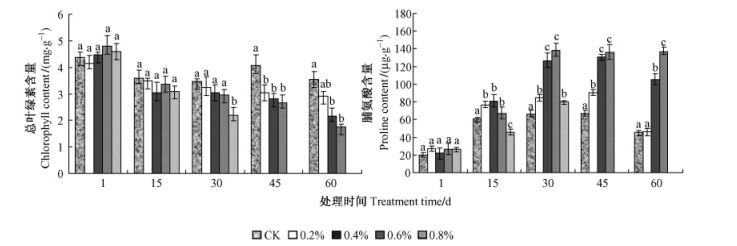
从图 2可知:在不同盐度下栽培的沼泽小叶桦叶片中叶绿素含量随着盐度的升高整体为下降趋势。对照和0.2%盐度处理中叶片叶绿素含量下降趋势比较平缓,在处理15天后含量基本稳定。0.4%,0.6%盐度处理下,在处理60天时沼泽小叶桦叶片中叶绿素含量分别为最初时48.21%,36.46%,均显著低于对照,分别是对照的49.58%,60.91%。0.8%盐度处理的沼泽小叶桦叶片中叶绿素下降最快,在第30天时仅为最初的47.61%,然后很快死亡。不同盐处理水平间叶绿素变化差异显著。由此可见:在较高的盐胁迫下,随着盐胁迫时间延长叶绿素的合成逐渐被抑制,并破坏已合成的叶绿素,使叶色变黄。
|
图 2 不同盐度处理下沼泽小叶桦叶片叶绿素、脯氨酸含量变化 Figure 2 Changes of chlorophyll and proline contents of B. microphylla leaves under different salinity conditions |
如图 2所示:沼泽小叶桦在盐处理下,叶片脯氨酸的积累逐渐增多。在15天时,对照和所有盐处理下的叶片脯氨酸含量均快速升高;15天至45天,0.2%与对照处理下的脯氨酸含量基本稳定,变化不大,但是45天后有明显的下降,到60天时0.2%与对照的脯氨酸含量基本相同;较高盐度(≥0.4%)处理中,脯氨酸不断在叶片中积累,到30天时0.4%,0.6%处理已经分别是对照的190.75%,208.63%,30天后脯氨酸基本维持在这个较高的水平。方差分析显示:各浓度梯度之间脯氨酸含量差异极显著。
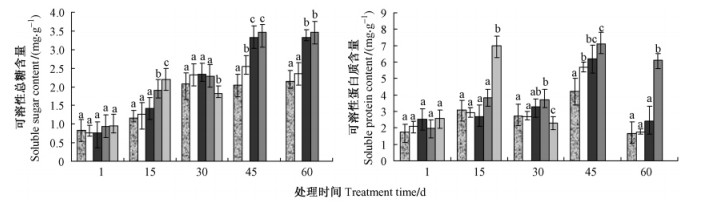
2.5 不同盐度处理对沼泽小叶桦叶片中可溶性总糖、蛋白质含量的影响图 3结果显示:对照和0.2%盐度处理的沼泽小叶桦叶片中可溶性糖含量始终以平缓的趋势升高,没有显著差异。在盐度≥0.4%时,叶片中的可溶性糖含量升高幅度加大,0.4%,0.6%处理中升高迅速,到45天时已经是最初的369.15%,是对照的170.10%。而且各浓度处理之间差异显著。这表明随着盐度的升高(0~0.8%),植物受到了盐分胁迫,为了调节液泡中的离子平衡,细胞内累积了可溶性糖等相溶性低分子化合物,它们在生化反应中代替水作为溶剂,保护细胞结构和水的流通。当盐度超过0.4%时,沼泽小叶桦叶片中可溶性糖的含量显著增加来降低植物体内细胞的渗透势,以维持水的代谢平衡。
|
图 3 不同盐度处理下沼泽小叶桦叶片可溶性糖、蛋白质含量变化 Figure 3 Changes of soluble sugar and protein contents of B. microphylla leaves under different salinity conditions |
在盐度≤0.4%时,沼泽小叶桦叶片中可溶性蛋白质含量逐渐增加,但在第45天后含量下降,在60天时含量下降到初始状态(图 3)。当盐度升高到一定程度时(盐度为0.6%),蛋白质含量增加,并维持较高的含量,达到最初的307.54%。当盐度≥0.8%时,植物叶片中可溶性蛋白质含量有一个短暂的急剧增加,随后很快下降,说明在高盐胁迫下植物生理机能受到损伤,调节能力下降,最终导致植物体死亡。各浓度处理之间差异显著。
2.6 不同盐度处理对沼泽小叶桦叶片显微和超微结构的影响在对照和0.2%盐处理的沼泽小叶桦叶片,栅栏组织发育良好,细胞间隙大,是典型的中生结构(图 4-1,2)。随着盐度增加,在0.4%,0.6%盐度下的沼泽小叶桦叶片发生叶肉质化,栅栏细胞长度不同程度纵向伸长,细胞层数也极明显地由1层增加至2~3层,多数排列紧密,胞间隙变小,下表皮气孔器下陷(图 4-3,4),这些特征可以降低蒸腾作用。
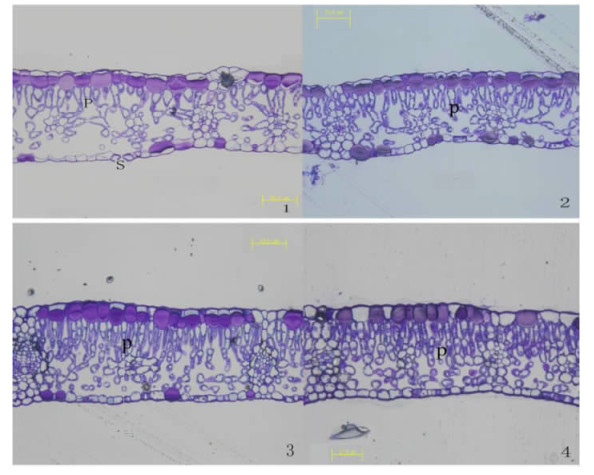
|
图 4 不同盐度处理下沼泽小叶桦叶片显微结构 Figure 4 Microstructure of B. microphylla leaves under different salinity conditions 1.CK;2.0.2%;3.0.4%;4.0.6%(×400);P:栅栏组织Palisade tissue;S:气孔器Stomata. |
沼泽小叶桦在无盐环境中其叶绿体内、外膜及类囊体正常,细胞内叶绿体贴壁分布,数量丰富,淀粉粒体积小、数量很少,脂质球少数,核大,有中央大液泡(图 5-1)。经低浓度盐处理后,植物叶绿体能维持其结构和膜的完整性,淀粉粒较对照变大,中央大液泡结构完整(图 5-2);在较高盐度处理下,沼泽小叶桦叶片细胞中叶绿体及类囊体、基粒片层和基质片层变形明显,片层与片层间排列松散,叶绿体中出现粗大颗粒的淀粉粒和脂质球,随着盐浓度的增加,淀粉粒积累变多,叶绿体从正常的椭圆形膨胀成球形,但其膜未见明显破裂(图 5-3,4)。中央大液泡的膜有溶解现象发生,核膜有解离现象发生。可见,在较高浓度盐处理下,沼泽小叶桦细胞器结构遭到破坏。

|
图 5 不同盐度处理下沼泽小叶桦叶片超微结构 Figure 5 Ultrastructure of B. microphylla leaves under different salinity conditions 1.CK;2.0.2%;3.0.4%;4.0.6%(×4 000);C:叶绿体Chloroplasts;L:脂质球Lipid droplets;N:细胞核Cell nucleus;Sg:淀粉粒Starch grains;V:液泡Vacuole |
环境中盐度对植物的生理、形态影响很大。关于盐度对植物生理学及形态的影响,盐度对光合速率、蒸腾作用和气孔导度影响的研究很多。Kotmire等(1985)、Brugnoli等(1991)和Nazaenko等(1992)发现气孔对盐度变化敏感,盐胁迫通常导致气孔关闭以减少水的蒸发损失,通过关闭气孔和部分抑制RUBISCO的活性,高盐度直接抑制了植物的光合作用。与此同时,气孔关闭影响了叶绿体光合作用和能量转换体系,因此也改变了叶绿体的活性(Iyengar et al., 1996)。几项关于红树属(Rhizophora)植物的相关研究结果也表明:盐胁迫减弱了红树植物的光合作用(Morimoto, 1991; Lichtenthaler, 1998; 廖岩等,2007)。柯裕州等(2009)研究认为0.1%NaCl对桑树(Morus alba)幼苗的光合生理生态特性没有明显影响;当NaCl浓度≥0.3%时,盐胁迫显著降低桑树幼苗的净光合速率等。低盐浓度处理时,桑树幼苗净光合速率降低主要是气孔因素控制的,而高盐浓度处理时,则主要受非气孔因素控制。但是盐胁迫下植物光合作用下降的原因尚未形成统一的认识。也有报道说在低盐浓度下光合作用甚至还有增强(Rajesh et al., 1998;Kurban et al., 1999),这可能与植物的种类有关,不同植物对盐胁迫的响应机制可能不同。本研究中沼泽小叶桦在受到盐处理后,在盐胁迫初期可能由于气孔性因素影响而使得气孔导度、胞间CO2浓度和蒸腾速率显著下降,且随盐浓度升高降幅越大。盐胁迫情况下,水分缺失会引起气孔关闭,气孔导度降低,气孔阻力增加,以减少叶片水分蒸发,保持叶片具有相对较高的水势,从而减少根系对水分的吸收和盐离子的吸收(简令成等,2009)。因此,气孔导度和蒸腾速率快速下降是植物的一种自我保护反应。但盐胁迫初期沼泽小叶桦净光合速率并没有显著下降,这一现象在较低盐浓度组表现更为明显。这可能由于早期植株叶肉中光合载体未受破坏且气孔限制影响的滞后性。在盐胁迫中、后期,根据测定结果可知:此时气孔导度、胞间CO2浓度和蒸腾速率下降幅度降低,而净光合速率的降幅仍随盐浓度增加而显著增加。这可能是植物被盐胁迫时,光合作用受到2方面影响:一是渗透胁迫,一是离子本身的毒害。反应初期主要是水分胁迫控制,经过一段时间后则主要由离子胁迫造成(赵可夫,1999)。尤其在较高的盐处理下(盐浓度≥0.4%),随着盐处理时间延长,在盐离子和渗透胁迫共同影响下沼泽小叶桦叶片细胞结构遭到破坏,叶片生理代谢受到伤害,同时盐离子胁迫会破坏叶绿体膜结构的完整性,抑制叶绿素的合成,使光合色素降解(廖岩等,2007;简令成等,2009),以至于叶绿素含量明显减少。因此,在盐胁迫中、后期,叶绿体结构被破坏、叶绿素含量下降等因素使叶绿体对光能的吸收和利用、固定CO2能力下降,抑制了光合速率,此时光合载体受破环等非气孔性因素成为影响植物光合作用的主要因素。
植物对抗高盐环境中的高渗透压的一个生物机制是在体内积聚相溶性溶质如氨基酸、有机酸、可溶性碳水化合物、糖醇类(Takemura et al., 2000;Hartzendorf et al., 2001),以降低细胞的渗透势,维持渗透平衡,提高植物的保水能力,而且可以起清除活性氧的作用,保护细胞结构和功能的完整性(Garg et al., 2002)。另外,根据Schobert等(1978)研究认为:植物在逆境条件下会积累较多的脯氨酸,脯氨酸水溶性很高,是一种优良的渗透调节剂,具有保护植物细胞中生物聚合物结构的作用,可以缓解NaCl对植物叶绿素合成的抑制作用。但也有报道认为脯氨酸的积累是胁迫对植物伤害的结果(赵可夫等,1999)。关于盐胁迫下红树(林鹏,1984)、沙棘(Hippophae rhamnoides)(阮成江,2002)、落羽杉(Taxodium distichum)(汪贵斌,2003)、盐桦(Betula halophila)(张海波,2009)的生理响应的报道表明:随着盐浓度的增加植物叶片中可溶性糖、脯氨酸含量呈上升趋势,是主要渗透剂之一,与本研究结果基本相同。本研究结果显示:当处理盐浓度小于6‰时沼泽小叶桦叶片的可溶性糖、脯氨酸、可溶性蛋白质含量均随着盐浓度增加而增加。可见盐处理下,植株叶片可溶性糖、脯氨酸、可溶性蛋白质等合成与积累,参与提高细胞渗透压,平衡细胞质与液泡间的渗透压差,从而保持相对良好的叶片水分状况。盐胁迫下,水分缺失会引起气孔关闭,以降低水分的丢失;但随着相溶性溶质的合成和积累,又会引发气孔开放(简令成等,2009)。因此,气孔的开关在平衡气体交换和水分得失上起着重要作用,相溶性溶质的合成和积累有利于促进沼泽小叶桦叶片光合作用和呼吸作用的运行。本研究中0.2%处理与对照的可溶性糖含量没有显著差异,脯氨酸和蛋白质含量在长时间盐处理(60天)时,0.2%处理与对照也相差不大;在盐度为0.4%和0.6%时,高盐度处理均使沼泽小叶桦叶片的可溶性糖、脯氨酸、可溶性蛋白质含量显著增加,但经过30~45天时间的适应,各个含量指标逐渐稳定,这是沼泽小叶桦在一定浓度范围内盐处理下的适应性表现,另一方面可能说明沼泽小叶桦的生长环境需要一定量的盐分,也说明其具有一定的耐盐能力,对滨海盐土有一定的适应性。
本研究对不同盐度处理下沼泽小叶桦叶片的显微结构比较研究,结果显示:盐处理会改变植物形态和解剖结构,盐处理下的沼泽小叶桦叶片肉质化,栅栏细胞长度不同程度纵向伸长,细胞层数也极明显地由1层增加至2~3层,多数排列紧密,胞间隙变小。与对新疆10种藜科(Chenopodiacea)植物和花花柴(Karelinia capsia)、海马齿(Sesuvium portulacastrum)等一些盐生植物叶片和同化枝的旱生和盐生结构的研究结果相同(邓彦斌等,1998;章英才,2006;李瑞梅等,2010)。这些特征可以减少体内水分的蒸发,降低蒸腾速率,这也许是适应生境中大量盐离子造成的生理干旱的表现,也可能是一种抗盐形式。叶绿体是植物光合作用的场所,也是细胞中对盐最敏感的细胞器。关于盐胁迫对叶绿体超微结构的影响研究较多,已经在枸杞(Lycium barbarum)、芦苇(Phragmites communis)、小麦(Triticum aestivum)(郑文菊等,1998;1999;刘吉祥等,2004;简令成等,2009)等植物上进行了相关研究。本研究也得到了类似的结果:沼泽小叶桦叶绿体结构的变化随盐浓度的不同而不同。低盐浓度,叶绿体的变化很不明显;当盐浓度达一定程度后,盐胁迫导致叶绿体结构完全变形,从正常的椭圆形膨胀成球形,类囊体排列紊乱、膨大,基粒排列方向改变,基粒和基质片层界限模糊不清,被膜破损或消失,甚至解体,叶绿体内淀粉粒、脂质球增大、增多。叶绿体结构的变形,破坏叶绿体膜结构的完整性,必然会导致色素蛋白复合体不稳定,会对光合作用造成负面影响,是导致光合速率等光合功能下降的原因之一。一些关于盐生植物较早的研究中也有淀粉粒的报道(郑文菊等,1998;朱宇旌等,2000)认为细胞中叶绿体中含有数目较多的淀粉粒和脂质球,这些都是盐生植物的抗盐标志。通常认为,盐胁迫下淀粉的积累是由于盐胁迫导致细胞代谢水平降低,生理活性降低,同化物的运输系统遭到破坏,造成淀粉粒大量积累,这也许是适应生境的表现,可能是一种抗盐形式(李瑞梅等,2010)。而大粒的淀粉粒大量存在,对基粒片层形成挤压,也可能影响其功能。淀粉粒的变化也较多被研究者注意,但它在抗盐胁迫中功能的尚不明确,有待深入研究。而脂质球是类囊体降解以及降解物脂质聚集的结果,叶绿体中脂质球数目多、体积大和类囊体降解等变化是衰老叶细胞和病叶细胞中普遍存在的现象(李正理等,1984)。因此,沼泽小叶桦在盐碱等外界生态因素的影响下逐渐形成了形态结构的变异,这种变异对它适应其所处的环境具有积极作用。但在较高浓度盐处理下,沼泽小叶桦细胞器结构遭到破坏,使植株的生理代谢紊乱,最终导致植物体死亡。
综上所述,沼泽小叶桦对滨海盐土具有一定的适应能力。但是盐胁迫既可以直接影响沼泽小叶桦形态、结构,也可以通过抑制为生长提供物质基础的光合作用而间接地影响植物生长,且盐浓度越大、处理时间越长,对其影响越明显。当处理的盐浓度<6‰时,沼泽小叶桦通过生理调节和改变植物形态解剖结构等方式适应盐胁迫环境;而全盐浓度超过6‰时沼泽小叶桦形态结构和生理机能受到损伤,调节能力下降,影响植物体存活率。
邓彦斌, 姜彦成, 刘健. 1998. 新疆10种藜科植物叶片和同化枝的旱生和盐生结构的研究[J]. 植物生态学报, 22(2): 164-170. |
简令成, 王红. 2009. 逆境植物细胞生物学[M]. 北京: 科学出版社.
|
柯裕州, 周金星, 张旭东, 等. 2009. 盐胁迫对桑树幼苗光合生理生态特征的影响[J]. 林业科学, 45(8): 61-66. DOI:10.11707/j.1001-7488.20090811 |
李瑞梅, 周广奇, 符少萍, 等. 2010. 盐胁迫下海马齿叶片结构变化[J]. 西北植物学报, 30(2): 0287-0292. |
李正理, 张新英. 1984. 植物解剖学[M]. 北京: 高等教育出版社.
|
廖岩, 陈桂珠. 2007. 三种红树植物对盐胁迫的生理适应[J]. 生态学报, 27(6): 2208-2214. |
廖岩, 彭友贵, 陈桂珠. 2007. 植物耐盐性机理研究进展[J]. 生态学报, 27(5): 2077-2089. |
林鹏, 陈德海, 肖向明, 等. 1984. 海滩盐度对两种红树叶碳水化合物和含氮化合物含量的影响[J]. 海洋学报, 6(6): 851-855. |
刘吉祥, 吴学明, 刘涛, 等. 2004. 盐胁迫下芦苇叶肉细胞超微结构的研究[J]. 西北植物学报, 24(6): 1035-1040. |
阮成江, 谢庆良. 2002. 盐胁迫下沙棘的渗透调节效应[J]. 植物资源与环境学报, 11(2): 45-47. |
汪贵斌, 曹福亮. 2003. 盐胁迫对落羽杉生理及生长的影响[J]. 南京林业大学学报:自然科学版, 27(3): 11-14. |
王健. 2003. 新疆发现一种抗盐桦树[J]. 植物杂志, 6: 12-13. |
杨昌友, 王健, 李文华. 2006. 新疆桦木属(Betula L.)[J]. 新分类群.植物研究, 26(6): 648-655. |
张海波, 曾幼玲, 兰海燕, 等. 2009. 盐胁迫下盐桦生理响应的变化分析[J]. 云南植物学研究, 31(3): 260-264. |
张志良, 翟伟菁. 2003. 植物生理学实验指导[M]. 3版. 北京: 高等教育出版社.
|
章英才. 2006. 几种不同盐生植物叶的比较解剖研究[J]. 宁夏大学学报:自然科学版, 27(1): 68-71. |
赵可夫, 李法曾. 1999. 中国盐生植物[M]. 北京: 科学出版社.
|
郑国锠. 1979. 生物显微技术[M]. 北京: 人民教育出版社.
|
郑文菊, 王勋陵, 沈禹颖. 1999. 几种盐地生植物同化器官的超微结构研究[J]. 电子显微学报, 18(5): 507-512. |
郑文菊, 张承烈. 1998. 盐生和中生环境中宁枸杞叶显微和超微结构的研究[J]. 草业学报, 7(3): 72-76. |
朱义, 谭贵娥, 何池全, 等. 2007. 盐胁迫对高羊茅(Festuca arundinacea)幼苗生长和离子分布的影响[J]. 生态学报, 27(12): 5447-5454. DOI:10.3321/j.issn:1000-0933.2007.12.060 |
朱宇旌, 张勇. 2000. 盐胁迫下小花碱茅超微结构的研究[J]. 中国草地, (4): 30-32. |
Bates L S, Waldren R P, Teare I D. 1973. Rapid determination of free proline for water-stress studies[J]. Plant and Soil, 39(1): 205-207. DOI:10.1007/BF00018060 |
Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
Brugnoli E, Lauteri M. 1991. Effects of salinity on stomatal conductance, photosynthetic capacity, and carbon isotope discrimination of salt-tolerant(Gossypium hirsutum L.) and salt-sensitive(Phaseolus vulgaris L.) C3 non-halophytes[J]. Plant Physiol, 95(2): 628-635. DOI:10.1104/pp.95.2.628 |
Garg A K, Kim J K, Owens T G, et al. 2002. Trehalose accumulation in rice plants confers high tolerance levels to different abiotics stresses[J]. Proc Natl Acad Sci USA, 99(25): 15898-15903. DOI:10.1073/pnas.252637799 |
Hartzendorf T, Rolletschek H. 2001. Effects of NaCl-salinity on amino acid and carbohydrate contents of Phragmites australis[J]. Aquatic Botany, 69(2): 195-208. |
Iyengar E R R, Reddy M P. 1996. Photosynthesis in highly salt tolerant plants//Pesserkali M.Handbook of photosynthesis[J]. Marshal Deller, Baten Rose, USA: 897-909. |
Kotmire S Y, Bhosale L J. 1985. Photosynthesis in Avicennia and Thespesia[J]. Indian Bot Reporter, 4: 46-49. |
Kurban H, Saneoka H, Nehira K, et al. 1999. Effect of salinity on growth, photosynthesis and mineral composition in leguminous plant Alhagi pseudoalhagi(Bieb.)[J]. Soil Sci Plant Nutr, 45(4): 851-862. DOI:10.1080/00380768.1999.10414334 |
Lichtenthaler H K. 1998. The stress concept in plants:an introduction[J]. Ann N Y Acad Sci, 851: 187-198. DOI:10.1111/j.1749-6632.1998.tb08993.x |
Morimoto R I. 1991. Heat shock:the role of transient inducible responses in cell damage, transformation, and differentiation[J]. Cancer Cells, 3(8): 295-301. |
Nazaenko L V. 1992. Effect of sodium chloride on ribulosebiphosphate carboxylase of Euglena cells[J]. Fiziologiya Rastenii(Moscow), 39: 748-752. |
Rajesh A, Arumugam R, Venkatesalu V. 1998. Growth and photosynthetic characterics of Ceriops roxburghiana under NaCl stress[J]. Photosynthetica, 35(2): 285-287. DOI:10.1023/A:1006983411991 |
Schobert B, Tschesche H. 1978. Unusual solution properties of proline and its interaction with proteins[J]. Biochim Biophys Acta, 541(2): 270-277. DOI:10.1016/0304-4165(78)90400-2 |
Takemura T, Hanagata N, Sugihara K, et al. 2000. Physiological and biochemical responses to salt stress in the mangrove, Bruguiera gymnorrhiza[J]. Aquatic Botany, 68(1): 15-28. DOI:10.1016/S0304-3770(00)00106-6 |
Zhu J K. 2001. Plant salt tolerance[J]. Trends Plant Sci, 6(2): 66-71. DOI:10.1016/S1360-1385(00)01838-0 |
 2011, Vol. 47
2011, Vol. 47