文章信息
- 陈又清, 李巧, 王思铭
- Chen Youqing, Li Qiao, Wang Siming
- 紫胶林-农田复合生态系统的蚱总科昆虫多样性
- Diversity of Tetrigoidea Insects in Lac-Plantation-Farmland Ecosystem
- 林业科学, 2011, 47(9): 100-107.
- Scientia Silvae Sinicae, 2011, 47(9): 100-107.
-
文章历史
- 收稿日期:2010-01-19
- 修回日期:2011-03-21
-
作者相关文章
2. 西南林学院保护生物学学院 昆明 650224
2. Faculty of Conservation Biology, Southwest Forestry College Kunming 650224
蚱又称菱蝗,隶属于昆虫纲(Insecta)直翅目(Orthoptera)蝗亚目(Caelifera)蚱总科(Tetrigoidea),是昆虫纲中较小的类群之一,全世界已知约1 000种,多数种类生活于潮湿的地方,以低等植物苔藓、地衣等为食,是植食性至杂食性的昆虫(梁铬球等,1998)。蚱和直翅目中的蝗虫都是草本层的主要植食性昆虫,在生态系统中作为初级消费者支持食草动物,具有较高的多样性(Gandar,1982; Gillon,1983; Gangwere et al., 1997)。由于它们便于采集以及对土地管理的敏感,已经作为指示生物来评价与土地利用相联系的生态变化(Armstrong et al., 1997; Samways,1997; Andersen et al., 2001)。和蝗虫相比,蚱身体较小,种类和数量均不太丰富,且对农林业没有大的影响,因而并不引起人们的关注。国内外关于蚱总科昆虫的研究多集中系统分类上(Perez-Gelabert,2003; Kim et al., 2004; Tsai et al., 2005; 郑哲民,2005),偶有生物地理学方面的研究(刘殿锋等,2008),关于蚱总科昆虫多样性的研究十分少见(Riede,1993)。而蝗虫多样性的研究远较蚱丰富(Gebeyehu et al., 2006; 李巧等,2006a; 刘慧等,2007)。蚱和蝗虫在指示生境或生态变化方面是否具有相同或接近的功能,尚无相关研究。
紫胶林-农田复合生态系统是广泛分布于西南山区的农林复合种植模式,系统由耕地和林地组成,耕地分为稻田和旱地2种利用方式,林地包括天然林和人工林2种利用方式,具有较高的生态经济价值(陈晓鸣等,2008; Chen et al., 2010)。为探索紫胶林-农田复合生态系统生物多样性特点及其在区域多样性保护中的意义,对该生态系统中的节肢动物群落进行了系统调查和研究(陈彦林等,2008; 李巧等,2009a; 2009b;2009c)。本文是对蚱总科昆虫群落调查的结果,拟通过揭示该复合生态系统蚱总科昆虫群落组成及多样性特点,对比该系统内蚱和蝗虫在指示不同土地利用生境方面的功能,探讨蚱类作为不同土地利用生境指示生物的可行性。
1 研究地区与研究方法 1.1 研究区概况调查样地位于云南省绿春县牛孔乡(22°53' N,101°56' E)海拔1 000~1 300 m的地段。在紫胶林-农田复合生态系统中根据土地利用类型的不同设置4个样地: Ⅰ是稻田,Ⅱ是旱地,Ⅲ是天然紫胶林,Ⅳ是人工紫胶林,每个样地设3~5个重复。样地概况见文献(李巧等,2009a; 2009b)。
1.2 调查及分析方法于2006—2007年利用网扫法在各样地内每隔半月进行1次抽样调查,2名调查人员分别在每个样地内平行扫网200次,将采集到的所有蚱总科成虫标本用75%酒精保存,带回实验室根据有关资料(梁铬球等,2008a; 2008b;1998) 进行标本鉴定。
根据紫胶林-农田复合生态系统中各样地各物种的实际数量进行物种多度分布分析,按倍程对数据进行分组,利用对数级数模型、对数正态模型和分割线段模型(孙儒泳,2001; 彭少麟等,2003)对各样地蚱总科昆虫群落物种分布曲线进行拟合,通过模型拟合精度的对比确定最佳物种多度模型,利用Excel进行相关数据分析和处理。
利用EstimateS(Version7.5.0) 软件(Colwell,2005)对24次抽样调查数据进行分析,计算物种累积曲线(species accumulation curves),并通过Excel进行曲线的绘制,通过曲线的特征判断抽样量是否充分; 运用ACE方法对紫胶林-农田复合生态系统蚱总科昆虫物种丰富度进行估计,比较物种丰富度实测值与估计值的相对大小。
根据昆虫个体数占群落中总个体数的百分比计算该昆虫的优势度,依据调查样地个体数量占群落个体总数的百分比确定优势种:>10%为优势种(李巧等,2009b; 昆虫学名词审定委员会,2001)。群落多样性测度采用物种丰富度S、Fisher α指数、Shannon-Wiener多样性指数、Simpson优势度指数(马克平等,1994),运用ACE方法对物种丰富度S进行估计,利用EstimateS(Version7.5.0) 软件完成各项指数的计算(Colwell,2005)。对24次调查数据进行合并处理,利用SPSS13.0中的One-way ANOVA程序对各组数据进行方差分析和LSD多重比较,方差分析时采用平方根形式转换个体数量,对数形式转换物种丰富度。利用R语言统计软件中的labdsv软件包的duleg函数计算各物种的IndVal值,其计算公式是: IndValij=Aij×Bij(R Development Core Team,2009; Roberts,2007); 参考相关研究以IndVal值大于等于0.5作为标准确定指示物种(Andersen et al., 2001; Mcgeoch et al., 2002; Nakamura et al., 2007)。
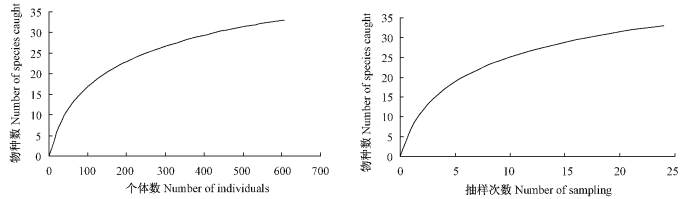
2 结果与分析 2.1 物种累积曲线在利用EstimateS软件对24次抽样数据进行分析的基础上,分别以个体数量和抽样次数为横坐标,以物种数为纵坐标,绘制物种累积曲线,结果见图 1。
|
图 1 调查样地的物种累积曲线 Figure 1 The species accumulation curves of sample plots |
从图 1可以看出:在个体数量低于400、抽样次数低于15次前,物种累积速率较快,曲线表现为急剧上升,群落中大量物种被发现; 当个体数量达到400、抽样次数达到15次时,物种累积速率变得缓慢,曲线趋于平缓,表明本研究中抽样充分。运用该物种累积曲线对整个调查样地的物种丰富度进行预测,ACE值是36.75(±3.94),即群落中89.8%的物种被抽样到。
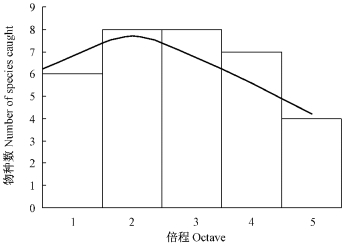
2.2 物种-多度分布经过初步鉴定和数量统计,共采集蚱总科昆虫标本606号。用log3标尺对整个调查样地个体数量数据进行并组,倍程1,2,3,4等分别对应个体数为1,2~4,5~13,14~40等的物种,根据并组后的数据进行物种多度分布曲线绘制,结果如图 2所示。
|
图 2 紫胶林-农田生态系统蚱总科昆虫物种多度曲线 Figure 2 The curve of species-abundance for Tetrigoidea insects in lac-plantation-farmland ecosystem |
根据倍程数的大小以及每一倍程内物种数的大小,可以看出紫胶林-农田生态系统蚱总科昆虫群落生物量并不很丰富,稀疏种在群落中占据一定优势,富集种较少。分别运用对数级数模型、对数正态模型和分割线段模型对紫胶林-农田生态系统蚱总科昆虫物种多度曲线进行拟合,结果显示紫胶林-农田生态系统蚱总科昆虫物种多度曲线用对数正态模型进行拟合效果(χ2=0.688<χ2(4,0.05)=8.488;R2=0.623) 优于对数级数模型和分割线段模型,其拟合公式是: S(R)=8exp-(0.2R)2,体现出紫胶林-农田复合系统蚱总科昆虫的环境条件较好,因而该昆虫群落表现为物种较丰富且分布较均匀。
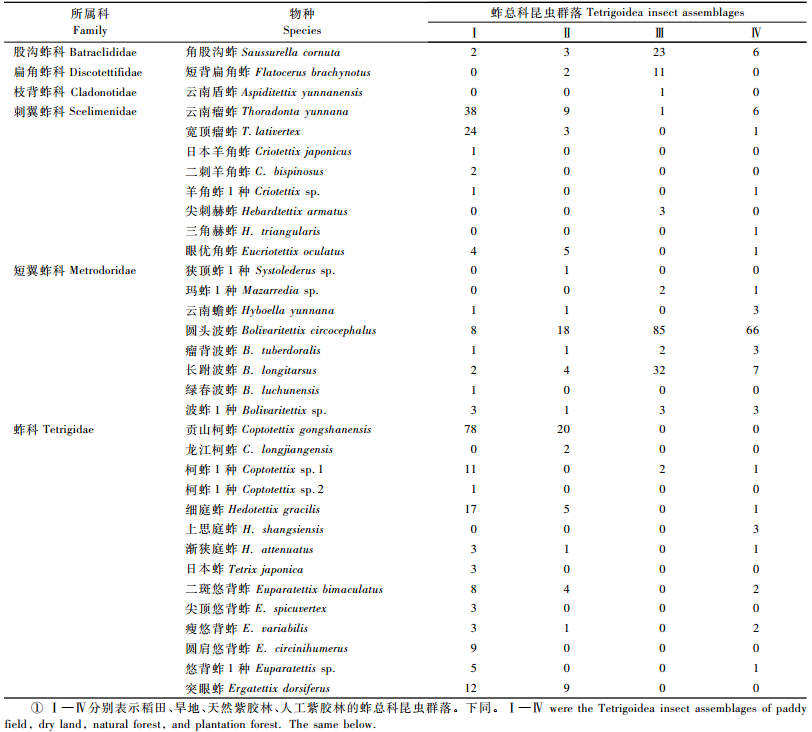
2.3 紫胶林-农田复合生态系统蚱总科主要类群及数量在紫胶林-农田复合生态系统中采集的蚱总科昆虫,有6科16属33种(表 1)。其中,蚱科种类最丰富,占全部物种的42.4%;刺翼蚱科和短翼蚱科物种较丰富,均占全部物种的24.2%;而股沟蚱科、扁角蚱科和枝背蚱科均只有1种,仅占3.0%。从物种组成上来看,短翼蚱科的圆头波蚱和蚱科的贡山柯蚱是该复合生态系统的优势种,分别占个体总数的29.2%和16.2%。
|
|
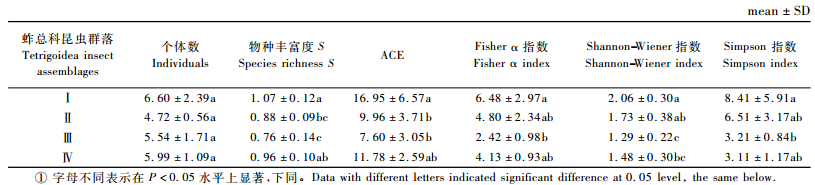
对各样地蚱总科昆虫物种多样性进行分析,结果见表 2。
|
|
从表 2可以看出,稻田蚱总科昆虫个体数量和种类在所有样地中最丰富,多样性最高; 旱地的蚱总科昆虫个体数量最少,种类较贫乏,但多样性水平仅低于稻田而居第二; 天然紫胶林蚱总科昆虫个体数量不丰富,种类最贫乏,多样性最低; 人工紫胶林蚱总科昆虫个体数量和种类较丰富,但多样性水平仅略高于天然紫胶林。方差分析及多重比较结果表明各样地之间在蚱总科昆虫数量上没有显著差异; 在物种丰富度上,稻田蚱总科昆虫种类显著多于天然紫胶林; 在多样性上,Fisher α指数、ShannonWiener指数和Simpson指数共同反映出稻田蚱总科昆虫多样性显著高于天然紫胶林,此外,ShannonWiener指数还反映出稻田蚱总科昆虫多样性显著高于人工紫胶林,旱地蚱总科昆虫多样性显著高于天然紫胶林。可见,紫胶林-农田复合生态系统不同土地利用生境蚱总科昆虫物种丰富度表现为:稻田>人工紫胶林>旱地>天然紫胶林,而昆虫多样性则表现为:稻田>旱地>人工紫胶林>天然紫胶林。
2.5 蚱总科昆虫对紫胶林-农田复合生态系统不同土地利用生境的选择对各样地蚱总科昆虫的个体数和优势度进行方差分析和多重比较,结果见表 3。
|
|
表 3显示:在33种蚱中,有13种蚱在不同土地利用生境中的个体数量分布有显著差异(P<0.05),20种蚱没有显著差异(P>0.05);有11种蚱在不同土地利用生境中的百分比有显著差异(P<0.05),22种蚱没有显著差异(P>0.05)。其中,角股沟蚱、短背扁角蚱、云南瘤蚱、宽顶瘤蚱、圆头波蚱、长跗波蚱、龙江柯蚱、细庭蚱、上思庭蚱、圆肩悠背蚱和突眼蚱在不同土地利用生境中的个体数和百分比均有显著差异,这些差异显示出角股沟蚱、短背扁角蚱和长跗波蚱偏爱天然林生境; 云南瘤蚱、宽顶瘤蚱和突眼蚱喜欢农田生境; 圆头波蚱在整个系统内数量最丰富,在各样地中均有分布,但其对林地的喜爱远胜于农田; 细庭蚱和圆肩悠背蚱偏爱稻田; 龙江柯蚱是唯一只分布于旱地且对旱地的喜爱胜于其他生境的蚱类,它显然与大多数喜欢潮湿生境的蚱不同,是干旱生境的适应者; 而上思庭蚱是唯一只分布于人工林且偏爱人工林的蚱类。
从优势种组成来看,稻田中蚱总科昆虫群落的优势种是贡山柯蚱、云南瘤蚱和宽顶瘤蚱,旱地的优势种是圆头波蚱、贡山柯蚱、云南瘤蚱和突眼蚱,天然紫胶林的优势种是圆头波蚱、长跗波蚱和角股沟蚱,人工紫胶林的优势种是圆头波蚱。显然,紫胶林-农田复合生态系统不同土地利用生境蚱总科昆虫群落具有不同的优势种组成,多数蚱对于系统内不同土地利用生境不具有选择性,表现为较大的生态适应性; 而一些优势种和常见种表现出对特定土地利用生境具有选择性。
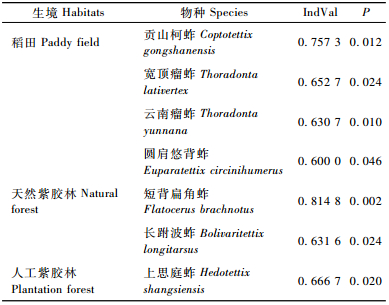
2.6 紫胶林-农田复合生态系统指示不同土地利用生境的蚱总科昆虫利用IndVal指数进行指示物种及其指示值分析,在紫胶林-农田复合生态系统不同土地利用生境中,有9种蚱的IndVal值有显著差异(P<0.05),其中7种的IndVal值大于等于0.5(表 4)。
|
|
7种蚱能作为不同土地利用生境的指示生物:贡山柯蚱、宽顶瘤蚱、云南瘤蚱和圆肩悠背蚱是稻田的指示物种,短背扁角蚱和长跗波蚱是天然紫胶林的指示物种,上思庭蚱是人工紫胶林的指示物种(表 4)。而角股沟蚱、圆头波蚱、龙江柯蚱和细庭蚱尽管其个体数量(绝对值和相对值)在紫胶林-农田复合生态系统不同土地利用生境中均有显著差异,但它们不是系统内任何生境的代表物种。究其原因,主要有2个:一是因为这些物种在各样地中出现的频数即在不同生境中出现的频率比较接近,致使其IndVal值较低,角股沟蚱、圆头波蚱和细庭蚱就属于这种情况; 二是物种的个体数占总个体数的比例极低,同时该物种在某生境中出现的频数低,致使其IndVal值低,如龙江柯蚱。旱地没有指示物种,显示出紫胶林-农田复合生态系统内尚无真正适应这种土地利用生境的物种。
3 讨论 3.1 紫胶林-农田复合生态系统蚱总科昆虫多样性特点紫胶林-农田复合生态系统具有系统内土地利用方式多样化的特点,该系统蚱总科昆虫群落物种较丰富且分布较均匀,其物种多度分布符合对数正态分布,体现出土地利用方式多样化对蚱总科昆虫多样性的积极影响,对该系统蝗虫(李巧等,2009a)、甲虫(李巧等,2009b)多样性的研究也印证了这一结论。
紫胶林-农田复合生态系统蚱总科昆虫和蝗总科相比,物种数量相等,个体数量较少; 系统内不同土地利用生境的多样性存在异同:稻田的蚱和蝗虫多样性均高,天然紫胶林的蚱多样性低,而其蝗虫多样性较高。从不同土地利用生境的多样性指数来看,各生境中蝗虫的物种丰富度S值、ShannonWiener指数值和Simpson指数值等均无显著差异(李巧等,2009a),而蚱则相反。出现这一结果的原因应该和蝗虫活动能力强、活动区域大,而蚱的活动能力相对较弱、活动区域较小有关。有研究显示生境变化或干扰常常引起蝗虫群落的变化(Gebeyehu et al., 2003; Jonas et al., 2007; 2008),一些蝗虫由于对生境变化的敏感而作为生物多样性的指示生物(Andersen et al., 2001; 陈永林,2001)。本研究表明:在紫胶林-农田复合生态系统,蚱比蝗虫能够更好的反应土地管理对昆虫多样性的影响。
3.2 蚱类作为不同土地利用生境指示生物的可行性指示生物的类群很多,其中以节肢动物作为指示生物的研究丰富,包括已经被反复证明具有良好指示作用的昆虫如蚂蚁、步甲、蝴蝶等等(Mcgeoch et al., 1998; Andersen,2004; 李巧等,2006b)。即便如此,在一个特定生境中,究竟哪些物种或类群能够很好的指示环境或生物多样性仍需通过对各个类群的考察来确定(Mcgeoch et al., 1998; Rykken et al., 1997)。
直翅目中的蚱和蝗虫在指示生境或生态变化方面应该具有相同或接近的功能。Andersen等(2001)对澳大利亚热带萨王纳地区蝗虫和蚱蜢的多样性研究,暗示了蝗虫比蚱蜢能更好的指示生境状况。这一结果是由于研究中采用目光搜索法进行抽样从而漏掉了一些具有指示价值的蚱类造成的,并不能充分证明蚱在指示生境方面的劣势。本研究运用网扫法进行调查,实现了对蚱的有效抽样。研究结果表明:在紫胶林-农田复合生态系统中,有7种蚱能作为稻田、天然紫胶林和人工紫胶林等3种不同土地利用生境的指示生物。通过和该系统内蝗虫(李巧等,2009a)、甲虫(李巧等,2009b)、蚂蚁等类群多样性研究的对比,发现以蚱作为指示生物类群具有以下优点: 1) 具有抽样上的便利,在调查样地上运用网扫法进行15次抽样或个体数量达到400头就能保证抽样的充分性,大大减少了标本整理和鉴定的工作量; 2) 具有比较丰富的指示物种,一些蚱对不同生境具有明显的选择性,这些物种对不同生境具有指示作用,它们在栖息环境中发生的数量变化可以揭示生境性质或质量的变化。
3.3 物种累积曲线和IndVal指数运用评述物种累积曲线是用来描述物种随抽样量加大而增加的状况,它记录了继续抽样下新物种出现的速率,是理解调查样地物种组成和预测物种丰富度的有效工具(Longino,2000)。抽样量可以用多种形式来表现,如样本数量、个体数量、采集时间等等。物种累积曲线具有如下特点:在一定的抽样范围内,随着抽样量的加大,群落中大量的物种被发现,物种累积速率较快,曲线表现为急剧上升; 至某一抽样量时,物种累积速率变得缓慢,曲线趋于平缓(Longino,2000; Ugland et al., 2003)。根据这一特点,可以根据曲线是否变得平缓对抽样量是否充分进行判断,曲线急剧上升表明抽样量不足,需要增加抽样量; 曲线变得平缓则表明抽样充分,可以进行数据分析。在国外,物种累积曲线被较多的用于植物及动物多样性研究中,而国内的研究十分少见(李巧等,2009d)。本文首次运用物种累积曲线对抽样量是否充分进行了判断,并在抽样量充分的前提下,运用物种累积曲线对物种丰富度进行预测。笔者期待物种累积曲线能广泛的运用到国内的生物多样性研究中。
IndVal是Dufrêne等(1997)提出的用于确定一个物种的指示值的指数,它既考虑该物种的个体数大小即相对多度,又考虑该物种在样地中出现的频数。该指数一经提出,就被广泛运用(Magura,2000; Mcgeoch et al., 1998; Schwartz,1999); 最近,De Cáceres等(2009)又对该指数及相关指数进行了分析和评价。然而,在国内的有关指示生物研究中,尚未见到IndVal的运用; 而昆虫群落组成及多样性研究中,往往只注重物种的个体数而忽略了物种的频数。本文首次运用IndVal指数确定了紫胶林-农田复合生态系统不同土地利用生境的指示物种,并对比了仅依靠物种个体数的绝对值和相对值在不同生境中的分布差异进行指示物种判断的结果。研究表明,一些物种尽管其个体数量的绝对值和相对值在不同生境中有显著差异,但因这些物种的个体数占总个体数的比例极低或者在不同生境中出现的频率比较接近,不能用于指示该生境,因为个体丰富和物种时空分布的预测性都是指示物种需满足的条件(Mcgeoch et al., 1998; Mcgeoch,2000; Jenkins,1971; Holloway et al., 1991)。而IndVal指数的运用能够确保将这些物种排除出去。因此,运用IndVal指数进行进行指示物种筛选比单独依靠物种个体数更科学。
陈晓鸣, 陈又清, 张弘, 等. 2008. 紫胶虫培育与紫胶加工[M]. 北京: 中国林业出版社.
|
陈彦林, 陈又清, 李巧, 等. 2008. 紫胶虫生境蜘蛛群落的初步研究[J]. 福建林学院学报, 28(2): 179-183. |
陈永林. 2001. 蝗虫生态种及其指示意义的探讨[J]. 生态学报, 21(1): 156-158. |
李巧, 陈又清, 陈祯, 等. 2006a. 云南元谋干热河谷直翅目昆虫多样性初步研究[J]. 浙江林学院学报, 23(3): 316-322. |
李巧, 陈又清, 郭萧, 等. 2006b. 节肢动物作为生物指示物对生态恢复的评价[J]. 中南林学院学报, 24(3): 117-122. |
李巧, 陈又清, 陈彦林, 等. 2009a. 紫胶林-农田复合生态系统蝗虫群落多样性[J]. 应用生态学报, 20(3): 729-735. |
李巧, 陈又清, 陈彦林, 等. 2009b. 紫胶林-农田复合生态系统甲虫群落多样性[J]. 生态学报, 29(7): 3872-3881. |
李巧, 陈又清, 陈彦林. 2009c. 紫胶林-农田复合生态系统蝽类昆虫群落多样性[J]. 云南大学学报, 31(2): 208-216. |
李巧, 陈又清, 徐正会. 2009d. 蚂蚁群落研究方法[J]. 生态学杂志, 28(9): 1862-1870. |
梁铬球, 陈又清, 陈彦林, 等. 2008a. 云南波蚱属二新种(直翅目:短翼蚱科)[J]. 昆虫分类学报, 30(2): 86-90. |
梁铬球, 陈又清, 陈彦林. 2008b. 云南扁角蚱属一新种(直翅目, 扁角蚱科)[J]. 动物分类学报, 31(1): 138-140. |
梁铬球, 郑哲民. 1998. 中国动物志. 昆虫纲. 第十二卷: 直翅目蚱总科. 北京: 科学出版社. http://mall.cnki.net/magazine/magadetail/DWFL201103.htm
|
刘殿锋, 董自梅, 谷延泽, 等. 2008. 中国蚱科昆虫分布格局的特有性简约性分析[J]. 生物多样性, 16(3): 298-304. |
刘慧, 廉振民, 常罡, 等. 2007. 陕西洛河流域不同生境蝗虫的群落结构[J]. 昆虫知识, 44(2): 214-218. DOI:10.7679/j.issn.2095-1353.2007.045 |
昆虫学名词审定委员会. 2001. 昆虫学名词2000[M]. 北京: 科学出版社.
|
马克平, 刘玉明. 1994. 生物群落多样性的测度方法I: α多样性的测度方法(下)[J]. 生物多样性, 2(4): 231-239. DOI:10.17520/biods.1994038 |
彭少麟, 殷祚云, 任海, 等. 2003. 多物种集合的种-多度关系模型研究进展[J]. 生态学报, 23(8): 1590-1605. |
孙儒泳. 2001. 动物生态学原理[M]. 3版. 北京: 北京师范大学出版社.
|
郑哲民. 2005. 中国西部蚱总科志[M]. 北京: 科学出版社.
|
Andersen A N, Fisher A, Hoffmann B D, et al. 2004. Use of terrestrial invertebrates for biodiversity monitoring in Australian rangelands, with particular reference to ants[J]. Austral Ecology, 29(1): 87-92. DOI:10.1111/j.1442-9993.2004.01362.x |
Andersen A N, Ludwig J A, Lowe L M, et al. 2001. Grasshopper biodiversity and bioindicators in Australian tropical savannas: responses to disturbance in Kakadu National Park[J]. Austral Ecology, 26(3): 213-222. DOI:10.1046/j.1442-9993.2001.01106.x |
Armstrong A J, van Hensbergen H J. 1997. Evaluation of afforestable montane grasslands for wildlife conservation in the north-eastern Cape, South Africa[J]. Biological Conservation, 81(1/2): 170-190. |
Colwell R K. 2005. (2005-05-04) Estimates: Statistical estimation of species richness and shared species from samples. Version 7. 5. http://purl.oclc.org/estimates. https://www.sciencedirect.com/science/article/pii/S0929139306000230
|
De Cáceres M, Legendre P. 2009. Associations between species and groups of sites: indices and statistical inference[J]. Ecology, 90(10): 3566-3574. |
Dufrêne M, Legendre P. 1997. Species assemblages and indicator species: the need for a flexible asymmetrical approach[J]. Ecological Monographs, 67(3): 345-366. |
Gandar M V. 1982. Trophic ecology and plant/herbivore energetics// Huntley B J, Walker B H. Ecology of Tropical Savannas. Berlin: Springer, 514-543. http://www.academia.edu/13750305/Comparing_biodiversity_between_protected_areas_and_adjacent_rangeland_in_xeric_succulent_thicket_South_Africa_arthropods_and_reptiles
|
Gangwere S K, Muralirangan M C, Muralirangan M. 1997. Muralirangan M. 1997. The bionomics of grasshoppers, katydids and their kin[J]. Wallingford: CAB International. |
Gebeyehu S, Samways M J. 2003. Responses of grasshopper assemblages to long-term grazing management in a semi-arid African savanna[J]. Agriculture, Ecosystems & Environment, 95(2-3): 613-622. |
Gebeyehu S, Samways M J. 2006. Topographic heterogeneity plays a crucial role for grasshopper diversity in a southern African megabiodiversity hotspot[J]. Biodiversity and Conservation, 15(1): 231-244. DOI:10.1007/s10531-004-7065-7 |
Gillon Y. 1983. The invertebrates of the grass layer// Boulière F. Ecosystems of the World 13: Tropical Savannas. Amsterdam: Elsevier, 289-311. https://link.springer.com/article/10.1007/s10980-015-0247-8
|
Holloway J D, Stork N E. 1991. The dimensions of biodiversity: the use of invertebrates as indicators of human impact∥ Hawksworth D L. The Biodiversity of Micro-Organisms and Invertebrates: Its Role In Sustainable Agriculture. London: CAB International, 37-61. https://www.cbd.int/doc/meetings/sbstta/sbstta-09/information/sbstta-09-inf-12-en.doc
|
Jenkins D W. 1971. Global biological monitoring// Matthews W H, Smith F E, Goldberg E D. Man's Impact on Terrestrial and Oceanic Ecosystems. Cambridge: MIT Press, 351-370. https://ueaeprints.uea.ac.uk/view/year/2015.default.html
|
Jonas J L, Joern A Y. 2007. Grasshopper(Orthoptera: Acrididae)communities respond to fire, bison grazing and weather in North American tallgrass prairie: a long-term study[J]. Oecologia, 153(3): 699-711. DOI:10.1007/s00442-007-0761-8 |
Jonas J L, Joern A Y. 2008. Host-plant quality alters grass/forb consumption by a mixed-feeding insect herbivore, Melanoplus bivittatus(Orthoptera: Acrididae)[J]. Ecological Entomology, 87(4): 1325-1330. |
Kim T W, Kim J I. 2004. A taxonomic study of Korean Tetrigidae(Orthoptera: Caelifera: Tetrigoidea)[J]. Entomological Research, 34(4): 261-267. DOI:10.1111/enr.2004.34.issue-4 |
Longino J T. 2000. What to do with the data∥ Agosti D, Majer J D, Alonso L E, et al. Ants: Standard Methods for Measuring and Monitoring Biodiversity. Washington and London: Smithsonian Institution Press, 186-203. http://www.academia.edu/13084219/Assessing_ant_assemblages_pitfall_trapping_versus_nest_counting_Hymenoptera_Formicidae_
|
Magura T, Tothmeresz B, Bordan Z. 2000. Effects of nature management practice on carabid assemblages(Coleoptera: Carabidae)in a nonnative plantation[J]. Biological Conservation, 93(1): 95-102. DOI:10.1016/S0006-3207(99)00073-7 |
McGeoch M A. 2000. The selection, testing and application of terrestrial insects as bioindicators[J]. Biological Reviews, 73(2): 181-201. |
McGeoch M A, Chown S L. 1998. Scaling up the value of bioindicators[J]. Trends in Ecology and Evolution, 13(2): 47-48. |
McGeoch M A, Van Rensburg B J, Botes A. 2002. The verification and application of bioindicators: a case study of dung beetles in a savanna ecosystem[J]. Journal of Applied Ecology, 39(4): 661-672. DOI:10.1046/j.1365-2664.2002.00743.x |
Nakamura A, Catterall C P, House A P N, et al. 2007. The use of ants and other soil and litter arthropods as bio-indicators of the impacts of rainforest clearing and subsequent land use[J]. Journal of Insect Conservation, 11(2): 177-186. DOI:10.1007/s10841-006-9034-9 |
Perez-Gelabert D E. 2003. A new genus and species of tetrigid(Orthoptera: Tetrigidae: Cladonotinae)from Dominican Republic, Hispaniola[J]. Journal of Orthoptera Research, 12(2): 111-114. DOI:10.1665/1082-6467(2003)012[0111:ANGASO]2.0.CO;2 |
R Development Core Team. 2009. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0, URL http://www.Rproject.org. http://www.tandfonline.com/doi/full/10.1080/02664760802366783
|
Riede K. 1993. Abundance differences of phytophagous tropical insects: the case of forest grasshoppers(Orthoptera: Caelifera)∥ Barthlott W, Naumann C M, Schmidt-Loske K, et al. Animal-PlantInteractions in Tropical Environments. Bonn: Zoologisches Forschungsinstitut und Museum Alexander König, 211-218.
|
Roberts D W. 2007. Labdsv: Ordination and Multivariate Analysis for Ecology. R package version 1. 3-1. http://ecology.msu.montana.edu/labdsv/R. http://www.academia.edu/19346874/Environmental_variability_drives_phytoplankton_assemblage_persistence_in_a_subtropical_reservoir
|
Rykken J J, Capen D E, Mahabir S P. 1997. Ground beetles as indicators of land type diversity in the Green Mountains of Vermont[J]. Conservation Biology, 11(2): 522-530. DOI:10.1046/j.1523-1739.1997.95336.x |
Samways M J. 1997. Conservation biology of Orthoptera∥Gangwere S K, Muralirangan M C, Muralirangan M. The Bionomics of Grasshoppers, Katydids and Their Kin. Wallingford: CAB International, 481-496. https://link.springer.com/chapter/10.1007/978-94-011-4337-0_3
|
Schwartz M W. 1999. Choosing the appropriate scale of reserves for conservation[J]. Annual Review of Ecology and Systematics, 30(1): 83-108. DOI:10.1146/annurev.ecolsys.30.1.83 |
Tsai M Y, Yang J T. 2005. A new species of the genus Alulatettix(Orthoptera: Tetrigidae)from Taiwan[J]. Journal of Orthoptera Research, 14(1): 53-56. DOI:10.1665/1082-6467(2005)14[53:ANSOTG]2.0.CO;2 |
Ugland K I, Gray J S, Ellingsen K E. 2003. The species-accumulation curve and estimation of species richness[J]. Journal of Animal Ecology, 72(5): 888-897. DOI:10.1046/j.1365-2656.2003.00748.x |
 2011, Vol. 47
2011, Vol. 47