文章信息
- 廖月枝, 严善春, 李小平, 曹传旺
- Liao Yuezhi, Yan Shanchun, Li Xiaoping, Chao Chuanwang
- 甲氧虫酰肼对舞毒蛾幼虫保护酶活性的影响
- Effect of Methoxyfenozide on the Activities of Protective Enzymes in Larvaes of Lymantria dispar
- 林业科学, 2011, 47(9): 93-99.
- Scientia Silvae Sinicae, 2011, 47(9): 93-99.
-
文章历史
- 收稿日期:2010-01-26
- 修回日期:2010-05-03
-
作者相关文章
2. 大兴安岭塔河林业局 塔河 165200
2. Forestry Bureau of Tahe of Daxing'anling Tahe 165200
舞毒蛾(Lymantria dispar)是一种杂食性食叶害虫,国外报道可取食300余种植物,我国文献记载可取食500余种植物,严重危害农林植物,给农林业生产造成了严重的经济损失(周贤等,2009; 胡春祥,2002; Kostic et al., 2008)。非甾醇类蜕皮激素竞争物以其独特的作用机制、良好的防治效果,对人类、天敌及环境安全而备受瞩目(Nakagawa,2005),其中甲氧虫酰肼(methoxyfenozide),又称RH-2485,是非甾醇类蜕皮激素竞争物中新型化合物,该化合物能够模拟鳞翅目幼虫蜕皮激素功能,通过作用于蜕皮激素受体而导致昆虫致死性蜕皮(Sun et al., 2003; Carlson et al., 2001); 该药剂对农作物鳞翅目害虫有强的毒杀作用,对环境和非靶标生物具有较高的安全性,已经成为替代有机磷和拟除虫菊酯类杀虫剂防治棉花(Gossypium spp.)、玉米(Zea mays)、蔬菜及其他农作物上多种鳞翅目害虫的理想药剂(Irigaray et al., 2005; 朱丽梅,2001; Schneider et al., 2004; 顾秀慧等,2004)。Zheng等(2002)研究发现蜕皮激素类似物RH-5992能诱导云杉卷叶蛾(Choristoneura fumiferana)6龄幼虫几丁质酶蛋白的表达。虫酰肼及其衍生物0593对家蚕(Bombyx mori)4龄幼虫体内多酚氧氧化酶表现为先诱导后抑制作用,对几丁质酶具有明显诱导作用(司树鼎等,2008)。用虫酰肼处理甜菜夜蛾(Spodoptera exigua)自然种群和敏感种群幼虫后,自然种群酚氧化酶、超氧化物歧化酶、过氧化物酶、几丁质酶比活力均显著高于敏感种群(周利琳等,2009)。然而尚未见利用甲氧虫酰肼防治森林害虫舞毒蛾的研究报道。为了深入了解甲氧虫酰肼对舞毒蛾的杀虫活性及作用机制,本文研究了该药剂对舞毒蛾不同龄期幼虫的毒杀效果及对其体内酶活性的影响,为其在林业上的应用提供一定的理论依据。
1 材料与方法 1.1 供试材料舞毒蛾卵于2009年3月采自东北林业大学哈尔滨示范林场,该地未使用任何药剂防治。将采回的卵在室内孵化,幼虫用健康无药剂污染的成年白桦(Betula platyphylla)叶片饲养,每天观察并更换新鲜叶片,及时清理幼虫的排泄物和食物残渣。恒温饲养条件:温度(25±1)℃,相对湿度60% ~80%,光周期16L: 8D。
1.2 毒力测定采用浸叶法。在预试验的基础上,用清水将24%甲氧虫酰肼悬浮剂稀释成系列浓度梯度,其中2龄幼虫选用的浓度为24,8,2.7,2.4,0.9,0.2,0.1 mg·L-1; 4龄和6龄幼虫选用的浓度为240,24,8,2.7,0.9,0.3,0.1 mg·L-1; 以清水作对照。将未接触过药剂的白桦叶片在稀释好的药液中浸10 s后取出,在阴凉处晾干。用蘸有充足水分的脱脂棉裹住叶柄,放入透气性良好的透明养虫瓶(直径9 cm,高14 cm)中,然后接入大小一致的舞毒蛾2龄、4龄和6龄幼虫,每瓶各放入15头,各龄均重复4次。置于恒温养虫室内饲养,分别于48,72,96 h后检查死亡数。用毛笔轻触无反应或不能活动的视为死亡。
1.3 试虫处理采用叶片药膜法。用甲氧虫酰肼LC50剂量处理白桦叶片,饲喂健康、大小一致,且饥饿12 h的2龄、4龄和6龄幼虫,其中2龄幼虫每养虫瓶放30头,4龄幼虫放15头,6龄幼虫放10头,处理方法和饲养条件同1.2,以清水处理作对照。分别于处理后6,12,24,36和48 h,取活试虫,储存于-80 ℃冰箱用于制备酶液。
1.4 保护酶活性测定 1.4.1 酚氧化酶活性测定从-80 ℃超低温冰箱中取出不同处理时间、大小一致的舞毒蛾2龄幼虫10头、4龄幼虫5头和6龄幼虫3头,解冻,经缓冲液漂洗后,置于玻璃匀浆器中,加入2 mL 0.2 mol· L-1,pH7.0磷酸缓冲液,冰浴条件下充分匀浆2~3 min,2 ℃,10 000 r·min-1下离心15 min,取上清液为待测酶液。酶活测定参考周利琳等(2009)方法进行。在试管中分别加入2 mL 0.2 mol·L-1,pH7.0磷酸缓冲液,0.3 mL酶液,立即混匀,在37 ℃水浴锅中预保温5 min,然后加入0.5 mL 0.04 mol·L-1邻苯二酚,于37 ℃振荡反应5 min,再加入0.3 mL 5% SDS溶液(十二烷基硫酸钠的去离子蒸馏水溶液)终止反应。以0.2 mol·L-1,pH7.0磷酸缓冲液为对照,于412 nm处测定OD值。酶比活力用OD· mg-1 min-1表示。蛋白质含量测定采用考马斯亮蓝G-250法(Bradford,1976)。每个处理均平行重复3次。
1.4.2 超氧化物歧化酶活性测定从超低温冰箱中分别取出处理好的舞毒蛾2龄幼虫10头、4龄幼虫5头和6龄幼虫3头,解冻,经缓冲液漂洗后,置于玻璃匀浆器中,加入3 mL 0.05 mol·L-1,pH 7.0磷酸缓冲液(含1% PVP、0.04%苯基硫脲和0.01 mol· L-1 EDTA),冰浴条件下充分匀浆2~3 min,4 ℃,10 000 r·min-1下离心15 min,取上清液为待测酶液。酶活测定参考Beauchamp等(1971)方法并略作修改。在试管中加入3 mL反应液(含50 mmol·L-1,pH7.0磷酸缓冲液,13 mmol·L-1甲硫氨酸,10 mmol· L-1 EDTA,75 μmol· L-1氮蓝四唑)和0.05 mL酶液,最后加0.6 mL 4 μmol· L-1核黄素,以不加酶液管作为最大光还原管,4 000 lx下光照20 min后,立即避光,以未光照的相同反应管为对照管,迅速测定A560值。酶比活力用OD· mg-1 min-1表示。蛋白质含量测定采用考马斯亮蓝G-250法。每处理均平行重复3次。
1.4.3 过氧化物酶活性测定酶液制备同1.4.2。酶活性测定参考Simon等(1974)方法并略作修改。在试管中分别加入1.8 mL 0.1 mol· L-1,pH 6.0磷酸缓冲液,1 mL 0.1%愈创木酚,0.3 mL酶液和1 mL 0.08% H2O2,混匀,反应20 min,以蒸馏水为对照,于470 nm处测定OD值。酶比活力用OD· mg-1 min-1表示。蛋白质含量测定采用考马斯亮蓝G-250法。每个处理均平行重复3次。
1.4.4 几丁质酶活性测定从超低温冰箱中分别取出处理好的舞毒蛾2龄幼虫10头、4龄幼虫5头和6龄幼虫3头,解冻,经缓冲液漂洗后,置于玻璃匀浆器中,加入3 mL 0.1 mol· L-1,pH 6.6磷酸缓冲液,冰浴条件下充分匀浆2~3 min,4 ℃,10 000 r·min-1下离心15 min,取上清液为待测酶液。酶活性测定参考周利琳等(2009)方法。在试管中分别加入1.0 mL酶液,1.0 mL 0.5%胶体几丁质和1.5 mL 0.1 mol· L-1,pH 6.6磷酸缓冲液,混匀,于37 ℃恒温水浴反应60 min,随后加入0.5 mL Folin-酚试剂甲,并于100 ℃加热10 min。冷却后于4 ℃,10 000 r·min-1离心15 min,以除去未分解的几丁质,取上清液。以0.1 mol· L-1,pH6.6磷酸缓冲液为对照,于400 nm处测定OD值。根据N-乙酰氨基葡萄糖(NADG)标准曲线计算几丁质酶比活力,其单位用μmol· mg-1 min-1表示。蛋白质含量测定采用考马斯亮蓝G-250法。每个处理均平行重复3次。
1.5 数据统计分析POLO软件处理分析毒力测定结果,计算致死中浓度(LC50)及其95%置信区间; 采用SPSS 13.0软件进行方差分析,差异显著性检验采用LSD方法,显著水平为α=0.05或α=0.01。
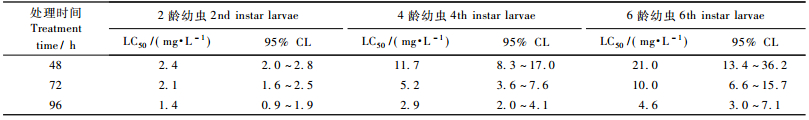
2 结果与分析 2.1 甲氧虫酰肼对舞毒蛾幼虫毒力的测定甲氧虫酰肼对舞毒蛾幼虫不同龄期的致死中浓度(LC50)及其95%置信区间见表 1。从表 1可以看出:甲氧虫酰肼对舞毒蛾2,4,6龄幼虫均表现出较高的活性,其LC50分别为2.4,11.7和21.0 mg· L-1(48 h),表明2龄幼虫对甲氧虫酰肼最为敏感,随着舞毒蛾幼虫龄期的增长,所需药量逐渐增加; 随着处理时间的延长,LC50逐渐降低。本试验选择处理48 h的LC50作为试验剂量处理舞毒蛾2,4,6龄幼虫,来测定甲氧虫酰肼对其体内酶活性的影响。
|
|
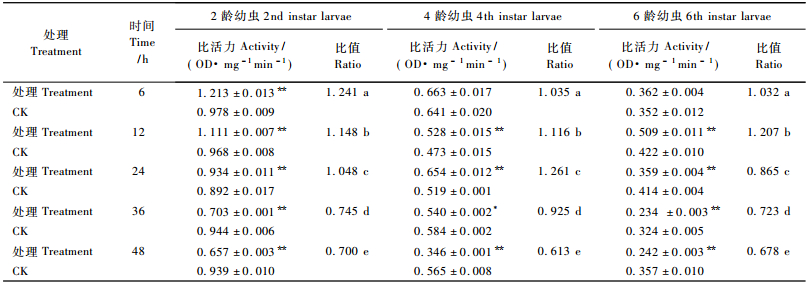
甲氧虫酰肼能明显影响舞毒蛾幼虫体内酚氧化酶活性。从表 2中可以看出:舞毒蛾2,4,6龄幼虫经甲氧虫酰肼处理后,其体内的酚氧化酶均表现为先被诱导后被抑制作用。处理12 h后,药剂对2,6龄幼虫体内该酶的诱导作用最强,分别为同期对照的1.207,1.926倍,随着处理时间的延长,该酶活性逐渐被抑制(P<0.01);在处理后6~36 h,处理组4龄幼虫体内该酶活性明显升高,36 h时达到最高,为同期对照的1.270倍,48 h后明显低于对照组(P<0.01),说明该药剂对舞毒蛾不同龄期幼虫体内酚氧化酶的诱导或抑制作用存在一定的时间效应。甲氧虫酰肼通过模拟蜕皮激素功能,短期处理能诱导舞毒蛾幼虫体内酚氧化酶活性升高,增强虫体自身防御能力,但随着处理时间的延长,药剂在虫体内富集量的提高,该酶活性逐渐被抑制,说明酚氧化酶活性与药剂的浓度及处理时间存在一定的相关性。
|
|
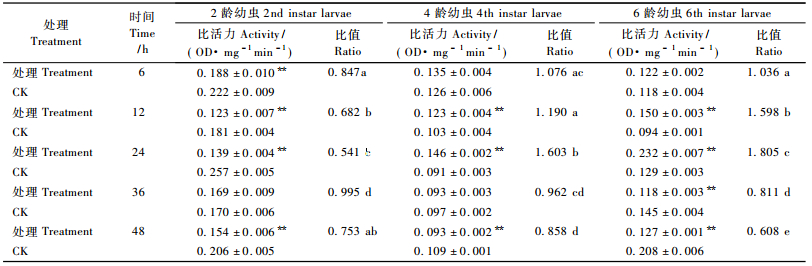
从表 3中可以看出:甲氧虫酰肼对舞毒蛾2,4,6龄幼虫体内超氧化物歧化酶具有先诱导后抑制作用。处理后6 h,对2龄幼虫体内该酶的诱导作用最强,为同期对照的1.241倍。处理后12 h,对6龄幼虫体内该酶诱导作用最强,为同期对照的1.207倍,24 h后,处理组4龄幼虫体内该酶活性最高,为同期对照的1.261倍。处理后36 h,处理组该酶活性均明显低于对照组,处理时间越长,甲氧虫酰肼对不同龄期幼虫体内该酶抑制作用越强(P<0.01)。上述结果表明舞毒蛾幼虫龄期的不同,其体内该酶对药剂的敏感性存在一定的差异,其中2龄幼虫体内该酶对药剂反应最为敏感,短期内酶活性能迅速提高,以减轻有毒自由基对虫体的毒害。但随着处理时间的延长,药剂在虫体内富集量的增大及虫体自身防卫能力下降,该酶活性逐渐降低,对有害自由基的消除能力也逐渐下降。
|
|
不同的处理时间,甲氧虫酰肼能明显抑制舞毒蛾2龄幼虫体内过氧化物酶活性,处理24 h后,对该酶抑制作用最强,为同期对照的0.541倍(P<0.01)。但是,对4,6龄幼虫体内该酶表现为先诱导后抑制作用,其中,处理后24 h,对该酶的诱导作用最强,分别为同期对照的1.603,1.805倍(P<0.01);36 h时,处理组该酶活性逐渐降低,48 h后达到最低,分别为同期对照的0.858,0.608倍(P<0.01)(表 4)。说明甲氧虫酰肼对舞毒蛾幼虫体内过氧化物酶活性的影响存在一定的龄期差异,其中,对低龄幼虫体内该酶的抑制作用较强。
|
|
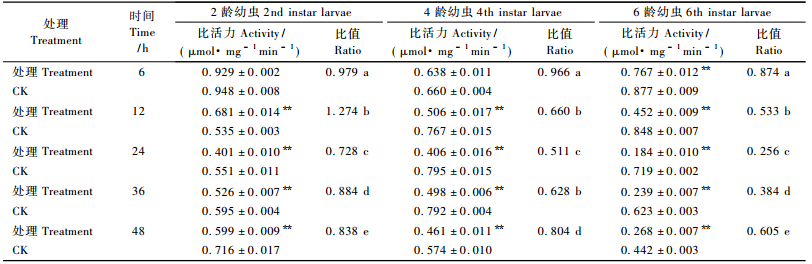
甲氧虫酰肼对舞毒蛾幼虫体内几丁质酶存在明显影响。从表 5中可以看出:处理6 h时,甲氧虫酰肼对2龄幼虫体内该酶的影响与对照组相比无明显差异; 12 h后,处理组该酶活性明显升高,为同期对照的1.274倍; 24 h后,该酶活性明显被抑制,与对照组相比,差异均极显著(P<0.01)。舞毒蛾4,6龄幼虫经甲氧虫酰肼处理后,其体内该酶活性均明显被抑制,均在处理24 h后,处理组该酶活性达到最低,分别为同期对照的0.511,0.256倍,差异均极显著(P<0.01),这说明甲氧虫酰肼对舞毒蛾幼虫体内该酶的影响也存在一定的龄期差异,对高龄幼虫体内该酶的抑制作用强于低龄幼虫。
|
|
本研究结果表明甲氧虫酰肼通过模拟蜕皮激素功能,能有效改变舞毒蛾2,4,6龄幼虫体内保护酶活性,干扰幼虫正常的生理代谢,起到毒杀作用。
酚氧化酶(PO)是昆虫表皮鞣化的重要酶系,在昆虫体壁硬化和黑化过程中起着重要作用。它参与黑色素的形成、角质硬化、伤口愈合,阻止微生物和异物的入侵,对昆虫的成活至关重要(Zufelato et al., 2004; 罗万春等,2005; Sugumaran,2002)。它通常以无活性的酚氧化酶原(prophenoloxidase,proPO)的形式存在于昆虫体内,通过特异性蛋白酶来激活(Zou et al., 2005)。Muller等(1999)研究表明20-羟基蜕皮酮(20E)能调节冈比亚按蚊(Anopheles gambiae)细胞内酚氧化酶原基因的表达; 烟草天蛾(Manduca sexta)幼虫在头壳裂开后,蜕皮激素滴度下降时,酚氧化酶原被激活变为有活性的酚氧化酶,导致黑色素的合成(Hiruma et al., 2009)。20-羟基蜕皮酮能抑制亚洲玉米螟(Ostrinia furnacalis)5龄幼虫体内PO活性(冯从经等,2004)。本研究结果表明:用甲氧虫酰肼处理舞毒蛾幼虫后,在6~12 h,2龄幼虫体内PO活性被激活; 6~36 h,4龄幼虫体内该酶活性被激活; 6~24 h,6龄幼虫体内该酶活性被激活,且均明显高于对照组。这可能是因为甲氧虫酰肼模拟了蜕皮激素的作用,低剂量甲氧虫酰肼激活了舞毒蛾幼虫体内酚氧化酶原活性,从而使PO活性升高,这也与处理组幼虫表皮表现出明显暗淡、黑化相对应。但随着处理时间的延长,该酶活性逐渐被抑制,可能与该药剂难以与蜕皮激素受体分离,持续诱导蜕皮反应,抑制了后续基因及相关酶系的表达有关(刘永杰等,2007)。随着处理时间的延长,处理组试虫表现出不能完成蜕皮、新的表皮不能硬化的症状,与酚氧化酶低于正常水平的表达也相符合。另外酚氧化酶活性也可能与该药剂在虫体内的富集量及虫体自身生理机能有关。
生物体在逆境条件下,细胞内自由基产生与清除平衡受到破坏,引起O2·-、单线态氧(1O2)、过氧化氢(H2O2)、羟自由基(HO·)等增加,这些自由基具有很强的氧化能力,对许多生物功能分子具有破坏作用(李周直等,1994)。SOD和POD是生物体内普遍存在的防御氧化损伤的重要酶类,其中SOD能清除O2·-形成H2O2,H2O2能与O2·-形成毒性更强的HO·,但POD能分解H2O2,从而使自由基维持在一个很低水平,防止自由基毒害(刘井兰等,2006; 张巍等,2008)。蒋志胜等(2003)发现光活化杀虫剂α-三噻吩处理淡色库蚊(Culex pipiens pallens)后,SOD、POD活性均表现出不同程度的增强,但随后活性均低于对照,均在近紫外光作用下的第3小时对这2种酶抑制作用最强。本研究发现甲氧虫酰肼作为蜕皮激素类杀虫剂处理舞毒蛾幼虫后,2龄幼虫体内的SOD、4龄和6龄幼虫体内SOD及POD均表现为先被诱导后被抑制作用,这表明舞毒蛾幼虫在不断受到甲氧虫酰肼选择压力的不利环境下,SOD和POD活性迅速提高,以减轻这些自由基对虫体的毒害,但随着甲氧虫酰肼在幼虫体内富集量的增大,这2种酶活性逐渐降低,造成虫体内自由基的产生和清除之间失去了平衡,自身防卫能力下降,从而引起虫体发病甚至死亡。不同的处理时间,甲氧虫酰肼对舞毒蛾2龄幼虫体内POD具有明显的抑制作用,表明甲氧虫酰肼对低龄幼虫的毒害更强,这与笔者利用甲氧虫酰肼对不同龄期幼虫的毒力测定结果相一致。以上说明甲氧虫酰肼对虫体的毒力与昆虫保护酶系统存在一定的相关性
几丁质是昆虫表皮和中肠围食膜的重要组成成分,昆虫生长发育的各个时期都需要一定量的几丁质,每一阶段都必须维持在一定的水平,过量或缺乏都将对昆虫造成致命的影响,而几丁质酶的表达水平对昆虫几丁质的代谢起着重要的调节作用(吴青君等,2007)。有研究表明几丁质酶活性的增强,使得几丁质分解代谢加快,破坏了体内原有的几丁质分解与合成的动态平衡,干扰了蜕皮过程中表皮几丁质的沉积,导致几丁质含量的减少,从而干扰新表皮的形成,而几丁质酶活性的降低,会造成新表皮的前体物质形成缓慢,导致发育历期的延长(吴青君等,1998)。Kramer等(1993)研究表明: 20-羟基蜕皮酮能诱导烟草天蛾(Manduca sexta)5龄幼虫几丁质酶基因表达。Zheng等(2003)发现虫酰肼能诱导云杉卷叶蛾(Choristoneura fumiferana)几丁质酶在表皮中表达,处理后的幼虫早期即能检测到几丁质酶,且表达高峰早于对照组。周利琳等(2009)研究发现甜菜夜蛾虫酰肼汰选种群几丁质酶比活力均比敏感种群和自然种群高。本研究表明甲氧虫酰肼能明显影响舞毒蛾2,4,6龄幼虫体内几丁质酶活性,破坏几丁质在幼虫体内的平衡,导致幼虫体内几丁质含量失衡,从而影响它们的生长发育。
冯从经, 戴华国, 符文俊. 2004. 保幼激素类似物及蜕皮甾类对亚洲玉米螟幼虫酚氧化酶活性的影响[J]. 昆虫学报, 47(5): 562-566. |
顾秀慧, 贝亚维, 高春先. 2004. 蜕皮激素类似物美满防治甜菜夜蛾田间药效试验[J]. 浙江农业学报, 16(5): 343-345. |
胡春祥. 2002. 舞毒蛾生物防治研究进展[J]. 东北林业大学学报, 30(4): 40-43. |
蒋志胜, 尚稚珍, 万树青, 等. 2003. 光活化杀虫剂α-三噻吩的电子自旋共振分析及其对库蚊保护酶系统活性的影响[J]. 昆虫学报, 46(1): 22-26. |
李周直, 沈惠娟, 蒋巧根, 等. 1994. 几种昆虫体内保护酶系统活力的研究[J]. 昆虫学报, 37(4): 399-403. |
刘井兰, 于建飞, 吴进才, 等. 2006. 昆虫活性氧代谢[J]. 昆虫知识, 43(6): 752-756. DOI:10.7679/j.issn.2095-1353.2006.185 |
刘永杰, 徐蓬军, 李艳伟, 等. 2007. 昆虫蜕皮激素受体及其类似物的杀虫机制研究进展[J]. 昆虫学报, 50(1): 67-73. |
罗万春, 高兴祥, 于天丛, 等. 2005. 栎皮酮对甜菜夜蛾酚氧化酶的抑制作用[J]. 昆虫学报, 48(1): 36-41. DOI:10.7679/j.issn.2095-1353.2005.009 |
司树鼎, 王开运, 张文成, 等. 2008. 虫酰肼及其衍生物0593对家蚕的毒性及作用机理[J]. 昆虫学报, 51(11): 1157-1163. DOI:10.3321/j.issn:0454-6296.2008.11.008 |
吴青君, 张文吉, 张友军. 2007. 昆虫几丁质酶及其在植物保护中的应用[J]. 昆虫知识, 37(5): 314-317. |
吴青君, 朱国仁, 赵建周. 1998. 小菜蛾对定虫隆德抗性生化机制初探[J]. 昆虫学报, 41(1): 42-48. |
张巍, 张志罡, 付秀芹, 等. 2008. 转Bt基因水稻对稻纵卷叶螟幼虫体内三种保护酶活性的影响[J]. 昆虫学报, 51(10): 1022-1027. DOI:10.3321/j.issn:0454-6296.2008.10.004 |
周利琳, 司升云, 汪钟信, 等. 2009. 甜菜夜蛾对虫酰肼抗性的生化机制[J]. 昆虫学报, 52(4): 386-394. |
周贤, 陈岩, 杨定, 等. 2009. 舞毒蛾种群分子系统学初步研究[J]. 植物检疫, 23(4): 7-9. |
朱丽梅. 2001. 一个新的蜕皮激素拮抗剂—甲氧酰肼[J]. 世界农药, 23(6): 50-52. |
Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein unitizing the principle of protein-dye binding[J]. Analytical Biochemistry, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
Beauchamp C, Fridovich I. 1971. Superoxide dismutase: improved assays and an assay applicable to acrylamide gels[J]. Analytical Biochemistry, 44(1): 276-287. DOI:10.1016/0003-2697(71)90370-8 |
Carlson G R, Dhadialla T S, Hunter R, et al. 2001. The chemical and biological properties of methoxyfenozide, a new insecticidal ecdysteroid agonist[J]. Pest Management Science, 57: 115-119. DOI:10.1002/(ISSN)1526-4998 |
Hiruma K, Riddiford L M. 2009. The molecular mechanisms of cuticular melanization: The ecdysone cascade leading to dopa decarboxylase expression in Manduca sexta[J]. Insect Biochemistry and Molecular Biology, 39(4): 245-253. DOI:10.1016/j.ibmb.2009.01.008 |
Irigaray F S, Marco V, Zalom F G, et al. 2005. Effects of methoxyfenozide on Lobesia botrana Den & Schiff(Lepidoptera: Tortricidae)egg, larval and adult stages[J]. Pest Management Science, 61(11): 1133-1137. DOI:10.1002/(ISSN)1526-4998 |
Kostic M, Popovic Z, Brkic D, et al. 2008. Larvicidal and antifeedant activity of some plant-derived compounds to Lymantria dispar L. (Lepidoptera: Limantriidae)[J]. Bioresource Technology, 99(16): 7897-7901. DOI:10.1016/j.biortech.2008.02.010 |
Kramer K J, Corpuz L, Choi H K, et al. 1993. Sequence of a cDNA and expression of the gene encoding epidermal and gut chitinases of Manduca sexta[J]. Insect Biochemistry and Molecular Biology, 23(6): 691-701. DOI:10.1016/0965-1748(93)90043-R |
Muller H M, Dimopoulos G, Blass C, et al. 1999. A hemocyte-like cell line established from the malaria vector Anopheles gambiae expresses six prophenoloxidase genes[J]. The Journal of Biological Chemistry, 274(17): 11727-11735. DOI:10.1074/jbc.274.17.11727 |
Nakagawa Y. 2005. Nonsteroidal ecdysone agonists[J]. Vitamins and Hormones, 73: 131-173. DOI:10.1016/S0083-6729(05)73005-3 |
Schneider M I, Smagghe G, Pineda S, et al. 2004. Action of insect growth regulator insecticides and spinosad on life history parameters and absorption in third-instar larvae of the endoparasitoid Hyposoter didymator[J]. Biological Control, 31: 189-198. DOI:10.1016/j.biocontrol.2004.04.013 |
Simon L M, Fatrai Z, Jonas D E. 1974. Study of peroxide metabolism enzymes during the development of phaseolus vulgris[J]. Biochemistry Physiology, 166: 387-392. |
Sugumaran M. 2002. Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects[J]. Pigment Cell Research, 15(1): 2-9. DOI:10.1034/j.1600-0749.2002.00056.x |
Sun X, Song Q, Barrett B. 2003. Effects of ecdysone agonists on the expression of EcR, USP and other specific proteins in the ovaries of the codling moth(Cydia pomonella L.)[J]. Insect Biochemistry and Molecular Biology, 33(8): 829-840. DOI:10.1016/S0965-1748(03)00082-1 |
Zheng Y, Zheng S, Cheng X, et al. 2002. A molt-associated chitinase cDNA from the spruce budworm, Choristoneura fumiferana[J]. Insect Biochemistry and Molecular Biology, 32: 1813-1823. DOI:10.1016/S0965-1748(02)00166-2 |
Zheng Y P, Retnakaran A, Krell P J, et al. 2003. Temporal, spatial and induced expression of chitinase in the spruce budworm, Choristoneura fumiferana[J]. Journal of Insect Physiology, 49(3): 241-247. DOI:10.1016/S0022-1910(02)00271-8 |
Zou Z, Wang Y, Jiang H B. 2005. Manduca sexta prophenoloxidase activating proteinase-1(PAP-1) gene: Organization, expression, and regulation by immune and hormonal signals[J]. Insect Biochemistry and Molecular Biology, 35: 627-636. DOI:10.1016/j.ibmb.2005.02.004 |
Zufelato M S, Lourenco A P, Simǒes Z L P, et al. 2004. Phenoloxidase activity in Apis mellifera honey bee pupae, and ecdysteroiddependent expression of the prophenoloxidase mRNA[J]. Insect Biochemistry and Molecular Biology, 34: 1257-1268. DOI:10.1016/j.ibmb.2004.08.005 |
 2011, Vol. 47
2011, Vol. 47