文章信息
- 黄志明, 吴锦程, 陈伟健, 蔡丽琴, 谢翠萍, 林良津, 黄世杰, 叶美兰
- Huang Zhiming, Wu Jincheng, Chen Weijian, Cai Liqin, Xie Cuiping, Lin Liangjin, Huang Shijie, Ye Meilan
- SA对低温胁迫后枇杷幼果AsA-GSH循环酶系统的影响
- ffects of SA on Enzymes of Ascorbate-glutathione Cycle in Young Loquat Fruits after Low Temperature Stress
- 林业科学, 2011, 47(9): 36-42.
- Scientia Silvae Sinicae, 2011, 47(9): 36-42.
-
文章历史
- 收稿日期:2010-09-27
- 修回日期:2010-12-14
-
作者相关文章
中国是枇杷(Eriobotrya japonica)的原产地,具有2 000多年的经济栽培历史,栽培面积和产量居世界首位(吴锦程,2004; 吴文毅,2005)。20世纪90年代,国内枇杷售价高,发展枇杷生产经济效益显著,受利益的驱动,果农开山种果积极性空前高涨,甚至在一些不适宜于枇杷生长的山区(特别是海拔相对较高的山区)盲目发展枇杷生产。枇杷树体可耐受-12 ℃以上低温而无明显的冻害,但其花在-6 ℃、幼果在-3 ℃时即受冻(谢钟琛等,2006),枇杷受冻程度还与幼果发育程度、树龄、栽培管理水平等有关。枇杷幼果的生长发育期处在一年中气温最低的12—次年1月,在气温较低的年份枇杷幼果受冻情况十分严重,特别是近年在福建和广东等沿海省份,许多山地枇杷产区连续发生枇杷幼果受冻,有的甚至颗粒无收(如莆田的大洋、庄边和新县等地),造成严重的经济损失。
水杨酸(salicylic acid,SA)是植物体内普遍存在的一种内源生长调节物质,可作为植物体内的信号传递分子,参与植物许多生理活动(如抗逆性等)的调节而备受学者关注,在提高植物抗逆性和防御病毒等方面起着重要作用(刘林德等,2002)。李兆亮等(1998)研究认为SA处理能提高黄瓜(Cucumis sativus)叶片超氧化物歧化酶(SOD)和过氧化物酶(POD)活性,并诱导同株的非处理叶片中SOD和POD活性增加。Raskin(1992)研究发现,一些被子植物开花过程中的产热与SA有关。李德红等(1995)认为SA能诱导产热与植物抗低温有关。现已证实SA是植物体内的产热素,可提高植物如黄瓜、番茄(Cyphomandra betacea)和西瓜(Citrullus lanatus)等农作物的抗寒性(黄爱霞等,2003; 吕军芬等,2004; 李艳军等,2006)。通过一定的技术手段提高枇杷幼果的抗冻能力,无疑是解决盲目发展枇杷生产带来的严重后果的有效途径,目前国内外未见SA在枇杷抗寒性方面研究的相关报道。针对当前枇杷生产上存在幼果受冻的突出问题,本试验研究SA对低温胁迫下枇杷幼果AsA-GSH循环酶系统的影响,以期为SA在枇杷幼果抗寒防冻方面的应用提供理论依据。
1 材料与方法 1.1 试验材料试验于2007年1月在福建省莆田市果树研究所进行。以3年生的“早钟6号”枇杷(Eriobotrya japonica cv. ‘Zaozhong No.6’)容器苗为试材(福建省莆田市果树研究所提供),选取长势整齐一致、无病、无损伤、生长正常、花后60天的枇杷容器苗,分别采用40和70 mg·L-1等不同质量浓度的水杨酸(SA)溶液(采用1.0 mol·L-1 NaOH将溶液pH调至6.5) 100 mL均匀喷施于叶面和幼果,以喷清水处理为对照(CK),每个处理5株。模拟自然冷害变温过程,将SA处理和CK容器苗置于人工气候室(相对湿度为70%,光照时间为6: 30—18: 30,光照强度为2 000 lx)中进行4 ℃下2 h,0 ℃下2 h,-1 ℃下4 h,-3 ℃下4 h的低温胁迫处理,然后于25 ℃室温下恢复生长,分别于恢复生长的0 (即在25 ℃下平衡10 h)、1和4天进行幼果混合取样,液氮速冻后保存于-70 ℃超低温冰箱,待测相关指标。
1.2 试验方法丙二醛(MDA)和相对电导率(REC)测定参照汤章城(2004)的方法。还原型谷胱甘肽(GSH)测定参照Ellman (1959)的DTNB显色法稍加修改; H2O2含量测定参照邹琦(2001)的方法; 氧化型抗坏血酸(DHA)含量测定采用2,4-二硝基苯肼比色法,测出总抗坏血酸含量减去还原型抗坏血酸(AsA)即得DHA含量(陈沁等,2000); AsA测定参照陈建勋等(2002)方法稍加修改; GSSG含量测定采用GSSG检测试剂盒(南京建成生物工程研究所生产)。谷胱甘肽转移酶(GST)活性测定参照Habig等(1981)的1-氯-2,4-二硝基苯(CDNB)显色法。谷胱甘肽还原酶(GR)活性测定参照Schaedle等(1977)的方法。谷胱甘肽过氧化物酶(GPX)活性测定参照荣征星等(1994)的DTNB显色法。抗坏血酸过氧化物酶(APX)活性测定参照陈建勋等(2002)的方法。脱氢抗坏血酸还原酶(DHAR)和单脱氢抗坏血酸还原酶(MDAR)活性测定参照宋杭泉等(2005)的方法,DHAR活性以μmolAsA·min-1 mg-1 pro)表示,MDAR活性以nmolNADH·min-1 mg-1 pro)表示。
1.3 数据分析试验数据相关性分析和显著性检验采用Excel 2003和SAS 9.0统计软件进行相关分析并作图,结果均为3次重复试验的平均值。
2 结果与分析 2.1 SA对低温胁迫后枇杷幼果MDA和H2O2含量及REC的影响膜脂过氧化是低温诱导氧化损伤的一个重要表征,MDA是检测膜损伤程度的公认指标(Hodges et al., 1999)。由图 1可见:低温胁迫后0 ~ 4天恢复期间,幼果MDA含量均呈下降趋势,且SA处理的幼果比CK低15.0%以上,差异达显著水平(P<0.05)。SA处理的幼果MDA含量下降较为迅速,而CK幼果下降则较为平缓。

|
图 1 SA对低温胁迫后枇杷幼果MDA,H2O2含量和REC的影响 Figure 1 Effects of SA on MDA, H2O2 content and REC of young loquat fruit after low temperature stress  低温胁迫加喷清水Low temperature stress and 0 mmol·L-1 SA; 低温胁迫加喷清水Low temperature stress and 0 mmol·L-1 SA;  低温胁迫加40 mg·L-1 SA Low temperature stress and 40 mg·L-1 SA; 低温胁迫加40 mg·L-1 SA Low temperature stress and 40 mg·L-1 SA;  低温胁迫加70 mg·L-1 SA Low temperature stress and 70 mg·L-1 SA。下同The same as below. 低温胁迫加70 mg·L-1 SA Low temperature stress and 70 mg·L-1 SA。下同The same as below. |
低温胁迫等逆境条件下植物细胞内由于代谢受阻而导致O2·,H2O2等大量活性氧的积累,活性氧以强氧化性加剧细胞质膜的过氧化,引起对膜系统损伤和细胞伤害。由图 1可以看出:低温胁迫后幼果恢复生长期间,CK幼果的H2O2含量比SA处理的高18.32%,表现出CK幼果细胞清除H2O2缓慢,说明适当浓度的SA处理可降低幼果H2O2含量,减轻因低温胁迫导致的组织过氧化伤害。
随低温胁迫后恢复期时间的推移,幼果相对电导率(REC)逐渐下降,CK幼果的REC高于SA处理,以70 mg·L-1 SA处理的幼果REC比CK低21.43%以上,差异达显著水平(P<0.05),说明SA处理可减轻低温胁迫所导致的细胞膜受损程度。
2.2 SA对低温胁迫后枇杷幼果GSH,GSSG,AsA和DHA含量的影响在AsA-GSH循环中,GSH是一种重要的非酶抗氧化物,在清除细胞内活性氧的同时自身被氧化生成GSSG,GSH/GSSG是反映细胞内GSH活性的指标。由图 2可见:幼果恢复生长期间GSH含量逐渐上升,经SA处理的幼果GSH含量均高于CK,以70 mg·L-1 SA处理的幼果GSH含量最高,GSH含量从大到小的处理依次是70 mg·L-1,40 mg·L-1和CK,70 mg·L-1 SA处理的幼果GSH含量比CK高45.86%,差异达显著水平(P<0.05)。经SA处理的幼果GSSG含量分别比CK低23.08%以上,差异均达显著水平(P<0.05); SA处理的幼果GSH/GSSG也显著高于CK(P<0.05),但2种SA处理的幼果之间GSH/GSSG差异并不显著(P>0.05),说明SA处理有利于低温胁迫后恢复生长期间幼果GSH的积累并促进GSSG的还原。

|
图 2 SA对低温胁迫后枇杷幼果GSH,GSSG含量及GSH/GSSG比值和AsA,DHA含量及AsA/DHA比值的影响 Figure 2 Effects of SA on GSH, GSSG content and GSH/GSSG ratio, and AsA, DHA content and AsA/DHA ratio of young loquat fruit after low temperature stress |
AsA是植物细胞内非酶促防御系统中具有多种抗氧化功能的有效抗氧化剂,AsA/DHA是衡量AsA活性的重要指标,高比值的AsA/DHA表明AsA具有较高的活性。由图 2可见:在0 ~ 4天恢复生长期间,幼果AsA含量均呈上升趋势,SA处理的幼果AsA含量均比CK高16.48%以上。在恢复生长至第4天时,40 mg·L-1 SA处理的幼果AsA含量最高,说明40 mg·L-1的SA处理更有利于AsA的积累。低温胁迫下,随着SA处理浓度的增加,其幼果DHA含量呈现下降的趋势; CK处理幼果DHA含量显著高于SA处理(P<0.05),以70 mg·L-1的SA处理幼果DHA含量最低,CK幼果的AsA/DHA低于SA处理,且达显著性差异水平(P<0.05),经70 mg·L-1 SA处理幼果AsA/DHA显著高于其他处理,说明SA处理更有利减少幼果DHA含量,促进AsA的积累。
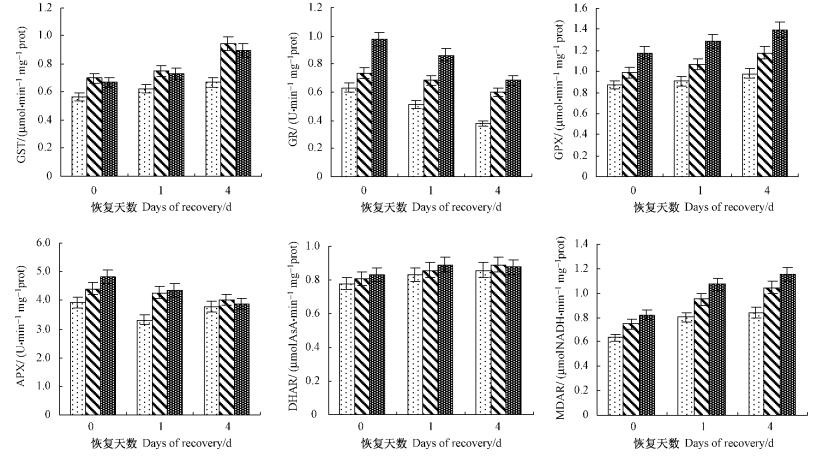
2.3 SA对低温胁迫后枇杷幼果GST,GR,GPX,APX,DHAR和MDAR活性的影响GST在GSH的协同作用下通过淬灭活性分子的活性保护细胞免受氧化损伤,减缓环境的胁迫效应(McGonigle et al., 2000)。本试验幼果GST活性从高到低的处理依次是40 mg·L-1,70 mg·L-1和CK (图 3)。恢复生长至第4天时,经SA处理的幼果GST活性比CK高33.68%以上,差异显著(P<0.05)。结果表明: SA处理有助于低温胁迫后幼果GST活性的回升,特别是在恢复生长的后期作用最为明显。
|
图 3 SA对低温胁迫后枇杷幼果GST,GR,GPX,APX,DHAR和MDAR活性的影响 Figure 3 Effects of SA on GST, GR, GPX, APX, DHAR and MDAR activity of young loquat fruit after low temperature stress |
GR利用NADPH的电子将GSSG还原为GSH,使细胞内GSH保持在还原状态,在维持AsA-GSH循环的有效运行及氧化胁迫的响应中具有重要作用(May et al., 1998)。由图 3可见:低温胁迫后恢复生长期间,幼果GR活性均呈现下降趋势,SA处理的幼果GR活性显著高于CK (P<0.05)。恢复生长至第4天时,70 mg·L-1 SA处理的幼果GR活性比40 mg·L-1的SA处理和CK分别高13.79%和82.18%; 40 mg·L-1 SA处理的幼果GR活性下降较慢。结果表明: 70 mg·L-1的SA处理对阻止幼果GR活性的衰退作用明显。
GPX是存在于高等植物体内重要的抗氧化保护性酶之一,它利用GSH清除体内的过氧化氢和脂质过氧化物等有害物质,保护生物膜结构及蛋白质核酸等生物大分子免受破坏(侯少范等,1994)。由图 3可见:低温胁迫后恢复生长期间的幼果GPX活性逐步上升,SA处理的幼果GPX活性比CK高13.79%以上,存在显著差异性(P<0.05),以70 mg·L-1 SA处理的幼果GPX活性最高。结果表明: SA处理可提高恢复生长期间幼果的GPX活性,随着SA处理浓度的增加,幼果GPX活性呈上升的趋势。
APX可以AsA为电子供体直接清除H2O2。由图 3可以看出:低温胁迫后恢复期间,SA处理幼果的APX活性下降,而CK则呈先降后升的变化规律,在0 ~ 1天期间,SA处理幼果的APX活性显著高于CK,均比CK高12.5%以上,而恢复生长至第4天时,各处理之间的幼果APX活性相近。说明低温胁迫后恢复生长的早期,SA处理对提高幼果的APX活性作用明显。
DHAR对维持细胞内的AsA水平具有重要作用。从图 3可以看出:低温胁迫后恢复期间,SA处理的幼果DHAR活性上升,SA处理的幼果DHAR高于CK,但差异不显著(P>0.05),说明SA处理可能对低温胁迫后幼果DHAR活性的影响较小。
MDAR对AsA的再生具有重要作用。恢复生长期间,SA处理的幼果MDAR活性逐步上升,SA处理的幼果MDAR活性显著高于CK,均比CK高17.82%以上,以70 mg·L-1 SA处理的幼果MDAR活性最高。结果表明: SA处理可促进低温胁迫后幼果MDAR活性的快速上升,对幼果细胞内AsA的再生具有重要作用,以70 mg·L-1 SA处理的作用最为显著。
3 讨论与结论脂质过氧化产物MDA和相对电导率(REC)是衡量膜损伤程度的重要指标。SA处理的幼果MDA和REC较低,膜的完整性较好,电解质外渗少,低温胁迫对幼果伤害较轻。CK的幼果MDA和REC较高,膜损伤较为严重,导致膜透性变大。说明SA处理可减轻低温胁迫对枇杷幼果的伤害,增加抗寒能力。
谷胱甘肽是植物体内有效的非酶抗氧化剂,能使膜蛋白结构稳定,防止与修复膜脂过氧化造成的损伤,它通过Halliwell-Asada途径清除H2O2; 可选择性地诱导防御基因的表达,在防御自由基对膜脂的过氧化中起重要作用(蒋明义等,1996; 陈沁等,2000; 麦维军等,2005)。GSH/GSSG大小是衡量谷胱甘肽氧化还原势的标志,是激活植物抗性基因表达的信号之一。嫁接黄瓜具有较高的GSH含量及GSH/GSSG比值是嫁接黄瓜比自嫁黄瓜具有较强抗冷性的重要原因(高俊杰等,2009)。本试验经SA处理的幼果GSH含量和GSH/GSSG比值显著高于CK,40和70 mg·L-1 SA处理幼果的GSH与H2O2含量之间存在显著的负相关性(r分别为-0.955和-0.962)。说明SA处理具有提高低温胁迫后幼果内源自由基清除剂的水平,降低膜脂的过氧化作用。
谷胱甘肽过氧化物酶(GPX)被认为是活性氧(reactive oxygen species,ROS)抵抗中的一种关键酶,能特异催化GSH与过氧化物的氧化还原反应,它与过氧化氢酶(CAT)和SOD等一起构成生物体内的酶性保护体系,清除细胞内的过氧化物(Larson,1988; 侯少范等,1994; 李登超等,2002)。在本试验中,经SA处理的幼果GPX活性显著高于CK (P<0.05),40和70 mg·L-1 SA处理幼果的GPX活性与H2O2含量之间呈显著的负相关性(r分别为-0.968和-0.971),GPX活性与GSH含量之间呈显著的正相关性(r分别为0.983和0.987)。说明SA处理有利于低温胁迫后枇杷幼果GPX活性的上升,并通过催化GSH与过氧化物反应,增强其清除细胞内过氧化物的能力,减轻因低温胁迫引起的膜脂过氧化作用而导致膜系统的损伤。
谷胱甘肽转移酶(GST)家族是生物解除代谢毒性物质酶系统的重要组成之一(Alscher,1989)。GST是一种能减轻活性氧损伤细胞的重要抗氧化酶,GST的表达增强已被认为是植物对胁迫响应的重要标志之一(Pickett et al., 1989; Droog,1997; Mannervik et al., 1988)。除草剂、机械损伤、低温等外界逆境条件下可以诱导GST的合成(Droog et al., 1995; Fluryt et al., 1995)。本试验结果显示:经SA处理的幼果GST活性比CK高,40和70 mg·L-1 SA处理幼果的GST活性与H2O2含量之间呈显著的负相关性(r分别为-0.892和-0.926),表明SA处理有助于低温胁迫后幼果生长恢复期GST活性的回升,减少H2O2积累及其对细胞的伤害,GST可能在枇杷幼果对低温胁迫的抵抗中起重要的调节作用。
谷胱甘肽还原酶(GR)是植物细胞AsA-GSH循环中将GSSG还原为GSH的一种关键酶,也是清除细胞内H2O2的酶催化系统的组分之一。GR活性直接影响细胞GSH库的水平,GSH含量及GR酶活性水平被认为是机体抗氧化状态的重要标志(陈沁等,2000; 尹永强等,2007)。本研究发现: SA处理的幼果GR活性显著高于CK,40和70 mg·L-1 SA处理幼果的GR活性与GSH含量之间呈显著的正相关性(r分别为0.992和0.998),表明SA处理可增强低温胁迫后幼果生长恢复期的抗氧化能力可能与GR将GSSG还原为GSH能力的提高密切相关。
AsA在抗坏血酸过氧化酶(APX)的作用下清除H2O2,APX是植物体内清除H2O2的重要酶,在逆境胁迫中具有重要的抗氧化作用(Davey et al., 2000; Jin et al., 2003; 孙红梅等,2004)。罗娅等(2007)研究低温胁迫对草莓(Fragaria ananassa)叶片SOD和AsA-GSH循环酶系统的影响,认为APX活性增加有助于植物抗性的提高。吴锦程等(2009)报道,低温胁迫环境下,APX在有效清除枇杷叶片H2O2中发挥重要作用。本试验结果显示:在幼果低温胁迫后恢复生长的早期,SA处理的APX活性显著高于CK,而恢复生长后期各处理之间没有明显差异。说明SA处理能有效清除幼果H2O2与APX活性的增加有关,且主要体现在幼果低温胁迫后恢复生长的早期。经40和70 mg·L-1 SA处理的枇杷幼果AsA含量显著高于CK,AsA含量与APX活性相关系数r分别为0.983和0.961,AsA含量与H2O2含量之间的相关系数r分别为0.916和-0.925,说明AsA在清除幼果内H2O2方面依赖于APX活性并发挥了重要作用。
逆境条件下,AsA可由MDHA和DHA分别在脱氢抗坏血酸还原酶(DHAR)和单脱氢抗坏血酸还原酶(MDAR)的催化下再生。试验结果表明: SA处理可显著提高低温胁迫后枇杷幼果MDAR的活性,但对DHAR的活性影响较小。40和70 mg·L-1 SA处理幼果的DHAR活性与AsA含量之间的相关系数r分别为0.747和0.586,而MDAR活性与AsA含量之间具有显著的正相关性(r分别为0.881和0.853),低温胁迫后SA对幼果DHAR活性无明显的调节作用,MDAR在AsA-GSH循环中对AsA的再生起主要作用,这与在番茄叶与根中叶绿体/质体比较研究中所得出的MDAR为再生AsA主要酶的结论基本相同(Valentina et al., 2000)。
SA处理对枇杷幼果GPX,GST,GR,APX和MDAR酶活性以及GSH和AsA含量具有明显的调节作用,GPX,GST,GR,APX,DHAR和MDAR等在低温胁迫后幼果生长恢复过程中的作用可能存在相互协调的关系。在低温胁迫后幼果生长恢复过程中,经SA处理幼果GSH含量的增加与GR活性的上升密切相关,而AsA含量的增加是主要来源于MDAR的再生作用,同时GSH与发挥抗氧化作用依赖于GPX,GST酶的协调作用,AsA发挥抗氧化作用需要APX酶的协调作用。
低温处理后幼果解剖观察的结果显示: CK幼果中胚完全变褐、果肉部分变褐,冻害程度最重; 40 mg·L-1 SA处理的幼果胚部分变褐、果肉轻微变褐,冻害程度较CK轻; 70 mg·L-1 SA处理的幼果胚轻微变褐、果肉正常,冻害程度最轻。说明经SA处理提高低温胁迫下枇杷幼果非酶抗氧化剂GSH和AsA含量以及AsA/DHA和GSH/GSSG比值,同时使GPX,GST,GR,APX和MDAR酶活性增加,促进GSH和AsA的再生,在低温逆境中及时清除过量的活性氧,维持其代谢平衡,保持膜结构的稳定性,从而消除或减轻伤害,增强枇杷幼果抗低温能力。各处理间幼果抗氧化能力相关指标的差异与形态解剖学初步观察的结果相一致,以70 mg·L-1的SA处理效果较好。
陈沁, 刘友良. 2000. 谷胱甘肽对盐胁迫大麦叶片活性氧清除系统的保护作用[J]. 作物学报, 26(3): 365-371. |
陈建勋, 王晓峰. 2002. 植物生理学实验指导[M]. 广州: 华南理工大学出版社: 122-127.
|
高俊杰, 秦爱国, 于贤昌. 2009. 低温胁迫对嫁接黄瓜叶片抗坏血酸—谷胱甘肽循环的影响[J]. 园艺学报, 36(2): 215-220. |
黄爱霞, 佘小平. 2003. 水杨酸对黄瓜幼苗抗冷性的影响[J]. 陕西师范大学学报:自然科学版, 31(3): 107-109. |
侯少范, 薛泰麟, 谭见安. 1994. 高等植物中的谷胱甘肽过氧化物酶及其功能[J]. 科学通报, 39(6): 553-556. |
蒋明义, 郭绍川. 1996. 渗透胁迫下稻苗中铁催化的膜脂过氧化作用[J]. 植物生理学报, 22(1): 6-12. |
刘林德, 姚敦义. 2002. 植物激素的概念及其新成员[J]. 生物学通报, 37(8): 18-19. |
李兆亮, 原永兵, 刘程连, 等. 1998. 水杨酸对黄瓜叶片抗氧化剂酶系的调节作用[J]. 植物学报, 20(4): 51-53. |
李德红, 潘瑞炽. 1995. 水杨酸在植物体内的作用[J]. 植物生理学通讯, 31(2): 144-149. |
吕军芬, 郁继华. 2004. 水杨酸对西瓜抗冷性生理指标的影响[J]. 甘肃农业大学学报, 39(1): 62-65. |
李艳军, 王丽丽, 蒋欣梅, 等. 2006. 外源水杨酸诱导对番茄幼苗抗冷性的影响[J]. 东北农业大学学报, 37(4): 463-467. |
李登超, 朱祝军, 徐志豪. 2002. 硒对菠菜抗氧化系统及过氧化氢含量的影响[J]. 园艺学报, 29(6): 547-550. |
罗娅, 汤浩茹, 张勇. 2007. 低温胁迫对草莓叶片SOD和AsAGSH循环酶系统的影响[J]. 园艺学报, 34(6): 1405-1410. |
麦维军, 王颖, 梁承邺, 等. 2005. 谷胱甘肽在植物抗逆中的作用[J]. 广西植物, 25(6): 570-575. |
荣征星, 刘慧中, 鲍景奇, 等. 1994. 小鼠全血中谷胱甘肽过氧化物酶活力的微量测定法[J]. 生物化学与生物物理进展, 21(4): 362-366. |
宋松泉, 程红焱, 龙春林, 等. 2005. 种子生物学研究指南[M]. 北京: 科学出版社: 97-100.
|
孙红梅, 景新明, 辛霞, 等. 2004. 超干贮藏对苤蓝种子抗氧化系统稳定性的影响[J]. 园艺学报, 31(6): 751-757. |
汤章城. 2004. 现代植物生理学实验指南[M]. 北京: 科学出版社: 302-306.
|
吴锦程. 2004. 枇杷的生产与科研[J]. 莆田学院学报, 11(3): 31-37. |
吴文毅. 2005. 福建枇杷产业现状、存在的问题及对策[M]. 北京: 中国农业大学出版社: 7-11.
|
吴锦程, 陈建琴, 梁杰, 等. 2009. 外源一氧化氮对低温胁迫下枇杷叶片AsA-GSH循环的影响[J]. 应用生态学报, 20(6): 1395-1400. |
谢钟琛, 李健. 2006. 早钟6号枇杷幼果冻害温度界定及其栽培适宜区区划[J]. 福建果树, (1): 7-11. |
尹永强, 胡建斌, 邓明军. 2007. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J]. 中国农学通报, 23(1): 105-110. |
邹琦. 2001. 植物生理学实验指导[M]. 北京: 中国农业出版社: 172-174.
|
Alscher R G. 1989. Biosynthesis and antioxidant function of glutathione in plants[J]. Physiol Plant, 77(3): 457-464. DOI:10.1111/ppl.1989.77.issue-3 |
Droog F. 1997. Plant glutathione S-transferases, a tale of theta and tau[J]. Journal of Plant Growth Regulation, 16(2): 95-107. DOI:10.1007/PL00006984 |
Droog F N J, Hooykaas P J J, van Der Zaal B J. 1995. 2, 4-Dichlorophenoxyacetic acid and realated chlorinated compounds inhibit tow auxin-regulated type-Ⅲ tabacco glutathione S-trandferases[J]. Plant Physiology, 107(4): 1139-1146. DOI:10.1104/pp.107.4.1139 |
Davey M W, Van M M, Inzé D, et al. 2000. Plant L-ascorbic acid: chemistry, function, metabolism, bioavailability and effects of processing[J]. Journal of the Science of Food and Agriculture, 80(7): 825-860. DOI:10.1002/(ISSN)1097-0010 |
Ellman G L. 1959. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 82(1): 70-77. DOI:10.1016/0003-9861(59)90090-6 |
Fluryt A, Damd K D. 1995. 2, 4-D-inducible S-transferase from soybean (Glycinemax), purification, characteristion and induction[J]. Planta, 94(2): 312-318. DOI:10.1111/ppl.1995.94.issue-2 |
Habig W H, Jakoby W B. 1981. Glutathione S-transferase (rat and human)[J]. Methods Enzymology, 77: 218-231. DOI:10.1016/S0076-6879(81)77029-0 |
Hodges D M, Delong J M, Fomey C F, et al. 1999. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J]. Planta, 207(4): 604-611. DOI:10.1007/s004250050524 |
Jin Yuehua, Tao Dali, Hao Zhanqing, et al. 2003. Environmental stresses and redox status of ascorate[J]. Acta Botanica Sinica, 45(7): 795-801. |
Larson R A. 1988. The antioxidants of higher plants[J]. Phytochem, 27(4): 967-978. DOI:10.1016/0031-9422(88)80253-X |
McGonigle B, Keeler S J, Lau S M C, et al. 2000. A genomics approach to the comprehensive analysis of the glutathione Stransferase gene family in soybean and maize[J]. Plant Physiol, 124(3): 1105-1120. DOI:10.1104/pp.124.3.1105 |
May M J, Vernoux T, Laver C, et al. 1998. Glutathione homeostasis in plant: Implications for environmental sensing and plant development[J]. J Exp Bot, 49(321): 649-667. |
Mannervik B, Danielson U H. 1988. Glutathione transferases: structure and catalytic activity[J]. CRC Crit Rev Biochem, 23(3): 283-337. DOI:10.3109/10409238809088226 |
Pickett C, Luayh B. 1989. Glutathione S-transferases: gene structure, regulation and biological function[J]. Ann Rev Biochem, 58: 743-764. DOI:10.1146/annurev.bi.58.070189.003523 |
Raskin I. 1992. Salicylic acid: a new plant hormone[J]. Plant Physiology, 99: 799-803. DOI:10.1104/pp.99.3.799 |
Schaedle M, Bassham J A. 1977. Chloroplast glutathione reductace[J]. Plant Physiol, 59(3): 1011-1012. |
Valentina M, Micha V, Micha G, et al. 2000. Activities of SOD and the ascorbate-glutathione cycle enzymes in subcellular compartments in leaves and roots of cultivated tomato and its wild salt-tolerant relative Lycopersicon pennellii[J]. Physiologia Plantarum, 110(1): 42-50. DOI:10.1034/j.1399-3054.2000.110106.x |
 2011, Vol. 47
2011, Vol. 47

