文章信息
- 田大伦, 王新凯, 方晰, 闫文德, 宁晓波, 王光军
- Tian Dalun, Wang Xinkai, Fang Xi, Yan Wende, Ning Xiaobo, Xiaobo Guangjun
- 喀斯特地区不同植被恢复模式幼林生态系统碳储量及其空间分布
- Carbon Storage and Spatial Distribution in Different Vegetation Restoration Patterns in Karsts Area, Guizhou Province
- 林业科学, 2011, 47(9): 7-14.
- Scientia Silvae Sinicae, 2011, 47(9): 7-14.
-
文章历史
- 收稿日期:2011-02-21
- 修回日期:2011-08-05
-
作者相关文章
2. 南方林业生态应用技术国家工程实验室 长沙 410004;
3. 国家林业局 北京 100714;
4. 贵州省林业厅 贵阳 550001
2. State Key Laboratory of Ecological Applied Technology in Forest Area of South China Changsha 410004;
3. State Forestry Administration Beijing 100714;
4. Forestry Bureau of Guizhou Province Guiyang 550001
石漠化是土地劣化演变的极端形式之一。中国喀斯特石漠化主要分布在西南地区,分布广,程度深。随着人为活动对资源需求的加剧,喀斯特地区石漠化生态系统更加恶化:水土流失、系统功能明显降低、生态平衡严重失调,威胁着当地人们的生存,成为当地农民贫困的主要根源,严重影响着社会、经济的可持续发展(周德全等,2003;王世杰等,2003;王德炉等,2004)。可见,恢复和重建喀斯特地区石漠化退化的生态环境至关重要。众多学者围绕石漠化生态系统进行了大量研究(周德全等,2003;王世杰等,2003;王德炉等,2004;龙健等,2002;李先琨等,2003;刘方等,2005;喻理飞等,2002;姚长宏等,2001;龙健等,2004),喀斯特石漠化形成原因已有定论,并提出了相应的治理对策(苏维词等,2006;司彬等,2006),但喀斯特地区不同植被恢复模式对生态系统碳储量及其空间分布的影响仍少见报道。本研究以贵州省喀斯特地区石漠化不同植被恢复模式幼林生态系统为对象,比较研究不同植被恢复模式幼林生态系统碳储量及其空间分布特征,以揭示石漠化治理过程中,不同植被恢复模式的碳固定能力,为我国乃至全球森林生态系统碳平衡估算和石漠化治理生态效益评价提供基础数据,同时也为我国石漠化治理政策制定提供科学依据。
1 研究区概况研究区位于贵州省关岭自治县的关索镇、板贵镇和上关镇(105° 15'—105° 49' E,25° 34'— 26°05'N),东西宽43.2 km,南北长57.3 km,总面积146 800 hm2,均为中度石漠化地区,岩石裸露率50% ~ 70%,地处云贵高原东斜坡,黔中西南地区,属苗岭山系,为峰峦交错的石灰岩山区,地貌切割深险,相对高差大,地势由西北向东南渐低,最高海拔1 850 m,最低海拔370 m,山地面积占78.30%,丘陵占7.40%,河谷低洼地占13.15%,水域占1.15%。气候跨越南温带和北亚热带,以中亚热带季风湿润气候为主,年均气温16.2 ℃,年均日照时数1 384.8 h,全年无霜期297天,年均降雨量1 342.2 mm,相对湿度77%,冬无严寒,夏无酷暑,四季分明,雨热同季,多雾寡照,雨量充沛,分配不均,冬春干旱,夏季多洪涝。土壤主要以石灰岩发育而成的石灰土为主。地带性原生植被为中亚热带湿润常绿阔叶林,以壳斗科(Fagaceae)、樟科(Lauraceae)和山茶科(Theaceae)植物为主,次生植被主要乔木树种有杉木(Cunninghamia lanceolata)、香椿(Toona sinensis)、楸树(Catalpa bungei)、柏木(Cupressus funebris)、马尾松(Pinus massoniana)、桃(Amygdalus persica)和梨(Pyrus spp.)等,主要灌木树种有杜鹃花(映山红) (Rhododendron simsii)、火棘(Pyracantha fortuneana)、花椒(Zanthoxylum bungeanum)、白刺花(Sophora davidii)和悬钩子(Rubus corchorifolius)等。
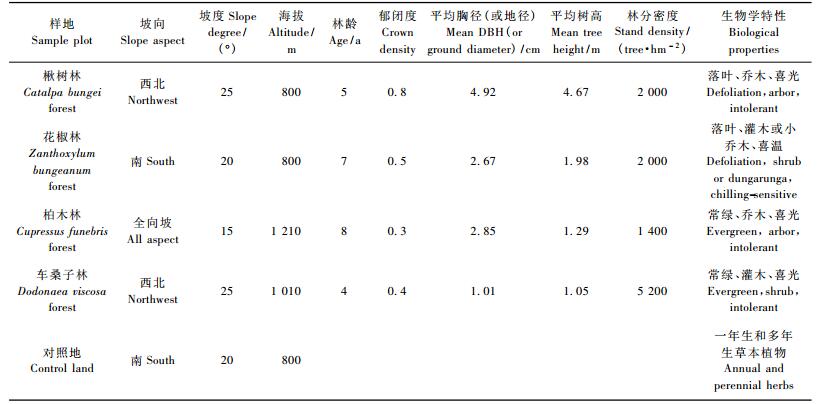
2 研究方法 2.1 植被群落调查及生物量测定在研究区选择4种人工幼林纯林:楸树林、花椒林、柏木林和车桑子(Dodonaea uiscosa)林,分别设置1块20 m × 33.3 m的标准样地,进行每木调查,4种林地类型的基本概况和林分特征见表 1。同时在4种幼林林地的中间,与4种林地相距约500 m处的无林地设置2块20 m × 33.3 m的对照样地。
|
|
对各样地分别进行测树因子调查、统计后,各样地按优势木、平均木和被压木3级选取标准木共12株,采用全挖实测法测定标准木的生物量,按林木的组织器官分别称取鲜质量,同时采集分析样品。
选取各样地对角线中心位置设置2 m × 2 m的样方,每条对角线设2个,每个样地共设4个,记录每个样方内幼树、灌木和草本植物的种类,采用全挖实测法分别测定每个样方内各种幼树、灌木和草本植物的生物量,同种植物均按地上部分(枝叶)、地下部分(根系)称鲜质量,并分别采集分析样品。将小样方内的死地被物按未分解、半分解和已分解全部选出称质量,分别采集分析样品。
植物样品置于105 ℃烘箱杀青5 min后,再置于80 ℃恒温烘至恒质量,换算各种植物、死地被物的生物量。林木单株生物量由3株标准木的平均值求得,乔木层生物量由林木单株生物量乘以林分株数求得。
2.2 土壤样品采集与处理分别在楸树林、花椒林、柏木林和车桑子林样地内按棋盘式布设8个采样点。由于车桑子林地土层浅薄,只采集0 ~ 10 cm土层的土样,其他3种林地每个采样点均按0 ~ 10和10 ~ 20 cm土层采集土样,每2个相同土层的土样混合,最终每块样地每土层共采集土壤样品4个,每个土壤样品1.0 kg。同时在样地内分别采集石灰岩样品4个,共16个。土壤样品风干后,分别过20和100目筛备用,石灰岩样品用木锤敲碎,分别过20和100目筛备用。同时用环刀法测定土壤密度。
2.3 植物样品采集与处理测定生物量的同时,按器官(树干、树枝、树皮、树叶、树根)分别采集楸树、花椒树、柏木和车桑子各3株,即每一树种每器官样品重复3次,均为1.0 kg; 灌木按同种植物分别采集地上部分(枝叶)和地下部分(根系)的混合样品1.0 kg,草本植物同样也按同种植物分别采集地上部分(枝叶)和地下部分(根系)的混合样品1.0 kg。植物样品恒温烘至恒质量后,研磨粉碎备用。
2.4 化学分析方法及数据处理植物样品中有机碳含量用重铬酸钾-硫酸容量法测定(田大伦,2004),土壤样品中有机碳含量用重铬酸钾-硫酸氧化法(水合加热法) (田大伦,2004)测定,在测定土壤有机碳含量时,没有采用HCl预先去除无机碳,因此所测得的土壤有机碳含量中可能包括了无机碳含量。
变异系数的计算公式为v=s/x× 100,v为变异系数(%),s为样品标准差,x为样品平均值。
应用EXCEL、SPSS(Statistical Package for Social Science) 10.0软件包中的均数比较分析、方差分析和相关分析等方法对数据进行统计分析与处理。
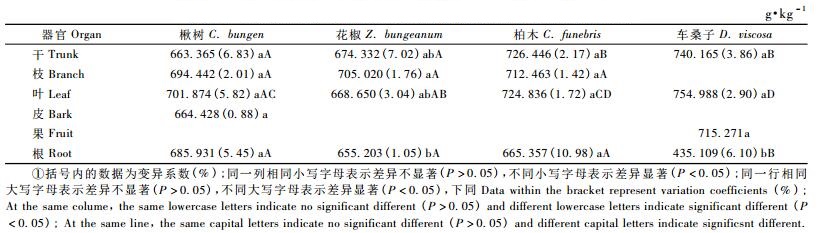
3 结果与分析 3.1 造林树种各器官碳含量从表 2可以看出,不同树种同一器官中的碳含量存在差异:树干碳含量表现为车桑子>柏木>花椒>楸树,且车桑子与花椒、楸树之间差异显著(P<0.05),柏木与花椒、楸树之间差异显著(P<0.05)车桑子与柏木之间及花椒与楸树之间差异不显著(P>0.05);树枝碳含量表现为柏木>花椒>楸树,但两两之间差异不显著(P>0.05);树叶碳含量表现为桑子>柏木>楸树>花椒,车桑子与柏木之间、柏木与楸树之间及楸树与花椒之间差异均未达到显著水平(P>0.05),但车桑子与楸树和花椒之间及柏木与花椒之间差异显著(P<0.05);树根碳含量表现为楸树>柏木>花椒>车桑子,且楸树、柏木和花椒之间不存在显著差异(P>0.05),但他们均显著高于车桑子(P<0.05)。
|
|
从表 2还可以看出,同一树种不同器官中的碳含量也不同,且不同树种各器官的碳含量由高至低排序不同。楸树表现为叶>枝>根>皮>干,各器官之间的差异均未达到显著性水平(P>0.05);花椒表现为枝>干>叶>根,枝与干、叶和根之间差异并不显著(P>0.05),干、叶和根之间差异不显著(P>0.05),但枝与根之间差异显著(P<0.05);柏木表现为干>叶>枝>根,不同器官之间的差异均不显著(P>0.05);车桑子表现为叶>干>果>根,叶、干和果两两之间差异不显著(P>0.05),但3者均显著高于根(P<0.05)。除楸树外,3种树地上部分各器官的碳含量普遍高于其地下部分(根),不同树种各器官的碳含量变化不大,变异系数为0.88% ~ 7.02%。
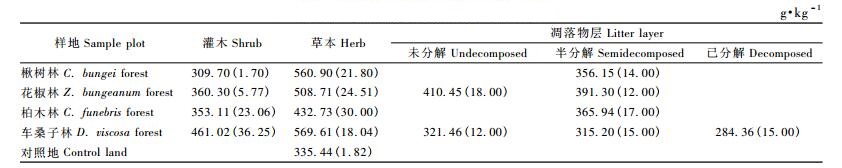
3.2 地被物层碳含量由表 3可知,不同林分中灌木层、草本层各种植物的平均碳含量不同。车桑子林下灌木层平均碳含量最高(461.02 g·kg-1),其次为花椒林(360.30 g·kg-1),再次为柏木林(353.11 g·kg-1),楸树林最低(309.70 g·kg-1); 各样地草本层平均碳含量为335.44 ~ 569.61g·kg-1,表现为车桑子林>楸树林>花椒林>柏木林>对照地,变异系数1.80% ~ 30.00%。同一林分草本层植物碳含量高于灌木层。结合表 1,2和3可见,林下灌木层、草本层各种植物的平均碳含量明显低于主要造林树种的平均碳含量,这与林下植物种类及林下环境条件有关。不同林地死地被物层平均碳含量为307.01 ~ 400.88 g·kg-1,变异系数为12% ~ 18%。
|
|
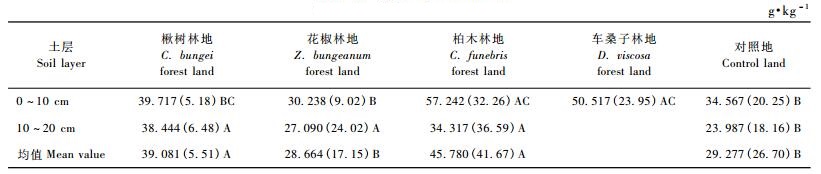
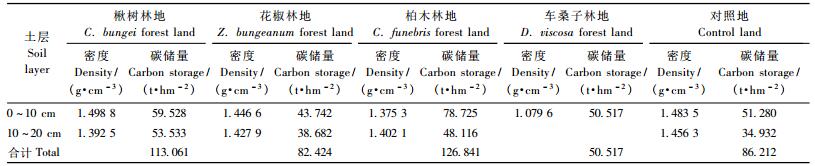
由表 4可以看出,不同植被恢复模式林地土壤有机碳含量在空间上分布不均匀。垂直空间分布上,土壤有机碳含量均随土壤深度的增加而逐渐下降,表现出明显的表聚性。水平空间分布上,3种不同植被恢复模式土壤有机碳平均含量表现为柏木林地(45.780 g·kg-1)>楸树林地(39.081 g·kg-1)>花椒林地(28.664 g·kg-1)。与对照地(29.277 g·kg-1)相比,柏木林地、楸树林地分别提高了56.37%和33.49%,而花椒林地下降了2.09%。单因素方差分析结果表明:柏木林地显著高于花椒林地和对照地(P<0.05),而柏木林地与楸树林地之间,花椒林地与对照地之间差异未达到显著水平(P>0.05)。
|
|
由表 4还可见,不同植被恢复模式之间同一土层有机碳含量也存在差异。0 ~ 10 cm土层土壤有机碳含量表现为柏木林地(57.243 g·kg-1)>车桑子林地(50.517 g·kg-1)>楸树林地(39.717 g·kg-1)>花椒林地(30.238 g·kg-1),与对照地相比,柏木林地、车桑子林地和楸树林地分别提高了65.60%,46.14%和14.90%,而花椒林地下降了12.52%,且柏木林地、车桑子林地与花椒林地、对照地之间差异均达到了显著水平(P<0.05),而柏木林地、车桑子林地与楸树林地之间差异未达到显著水平(P>0.05),楸树林地与花椒林地、对照地之间差异也不显著(P>0.05)。10 ~ 20 cm土层土壤有机碳含量表现为楸树林地(38.444 g·kg-1)>柏木林地(34.317 g·kg-1)>花椒林地(27.090 g·kg-1),且3种林地两两之间差异不显著(P>0.05),但3者均显著高于对照地(P<0.05),分别提高了60.27%,43.06%和12.94%。
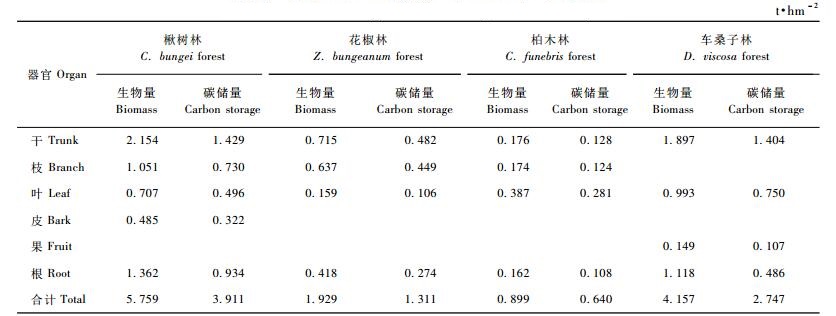
3.4 乔木层碳储量根据林木各器官的生物量及其相应的碳含量计算出不同乔木层各器官的碳储量(表 5)。由表 5可以看出,楸树林乔木层碳储量最高,为3.911 t·hm-2,而柏木林最低,仅为0.640 t·hm-2,4种林分乔木层的碳储量表现为楸树林>车桑子林>花椒林>柏木林,地上部分碳储量与地上部分生物量所占的比例基本一致,如楸树林中,地上部分生物量占总生物量的比例为76.12%,其地上部分碳储量所占的比例为76.35%。同样,碳储量在林木不同器官中的分配,基本上与各器官生物量的分配一致,如楸树林、花椒林、车桑子林以树干部分生物量占乔木层生物量的比例最大,占37.07%以上,3种林分的树干碳储量占乔木层碳储量的比例最高,达36.77%以上,柏木林以树叶部分生物量占林木生物量的比例最大,占43.05%,其碳储量所占比例也最高,为43.91%。
|
|
单位面积土层的干质量与其相应碳含量的乘积,即为各土层的碳储量。表 6表明,楸树林地、花椒林地和柏木林地土壤碳储量分别为113.061,82.424和126.841 t·hm-2,与对照地(86.212 t·hm-2)相比,楸树林地与柏木林地土壤碳储量分别提高了31.14%和47.13%,而花椒林地下降了4.39%。由于车桑子林地土壤层很薄,仅约为10 cm厚度,因此其土壤层(0 ~ 10 cm)碳储量仅为50.517 t·hm-2。
|
|
从表 6可以看出,楸树林地、花椒林地、柏木林地和对照地土壤的碳储量随土壤深度的增加而下降,下降幅度最大的是柏木林地,由0 ~ 10 cm土层至10 ~ 20 cm土层下降了38.88%,其次是对照地和花椒林地,分别下降了31.88%和11.57%,下降幅度最小的为楸树林地,仅下降了10.07%。
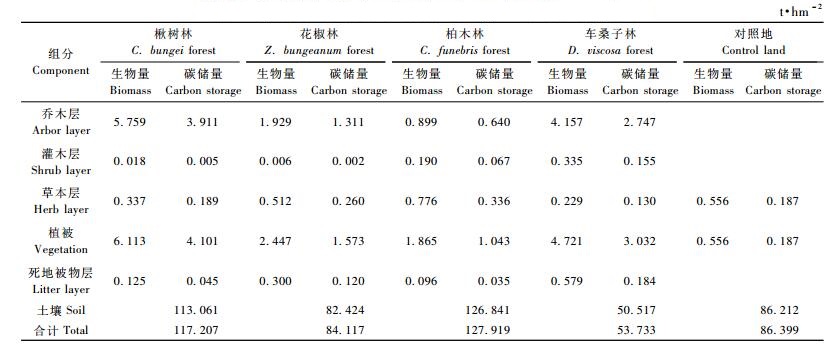
3.6 幼林生态系统碳储量空间分布由表 7可知,楸树林、花椒林、柏木林和车桑子林生态系统中的碳储量分别为117.207,84.117,127.919和53.733 t·hm-2,4种幼林生态系统中的碳储量表现为土壤层>植被层>死地被物层,在楸树幼林、花椒幼林、柏木幼林和车桑子幼林生态系统中,植被层的碳储量分别为4.101,1.573,1.043和3.032 t·hm-2,分别占整个生态系统碳储量的3.50%,1.87%,0.82%和5.64%,其中乔木层碳储量分别占植被层碳储量的95.37%,83.34%,61.36%和90.60%,表明在4种幼林生态系统中,植被层的碳储量主要取决于乔木层的碳储量。楸树幼林、花椒幼林、柏木幼林和车桑子幼林死地被物层的碳储量分别为0.045,0.120,0.035和0.184 t·hm-2,分别占整个生态系统碳储量的0.038%,0.14%,0.027%和0.34%。土壤层的碳储量是相当可观的,在楸树幼林、花椒幼林、柏木幼林土壤层(0 ~ 20 cm)碳储量均在82.424 t·hm-2以上,占整个生态系统碳储量的96.46%以上,车桑子幼林土壤层(0 ~ 10 cm)的碳储量为50.517 t·hm-2,占整个生态系统碳储量的94.01%。
|
|
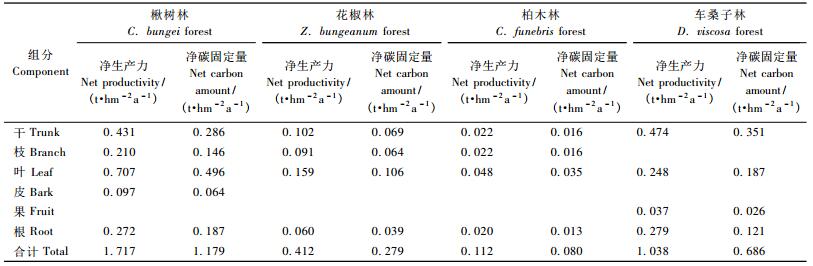
森林生态系统生产力研究的主要内容之一是要确定系统同化CO2的能力。由表 8可以看出,楸树林、花椒林、柏木林和车桑子乔木层年净生产力分别为1.717,0.412,0.112和1.038 t·hm-2 a-1,年碳净固定量分别为1.179,0.279,0.080和0.686 t·hm-2 a-1,地上部分年净固定碳量分别相当于地下部分的5.30,6.13,5.15和4.66倍,且均以树叶年净固定碳量最大。4种林分中,以楸树林乔木层年固碳能力最高,其次为车桑子林分,柏木林分最低。
|
|
本研究结果表明,针叶树种(柏木)各器官的碳含量普遍高于阔叶树种(楸树、花椒和车桑子),这与马钦彦等(2002)的研究结果基本相似。同一树种不同器官中的碳含量不同,除楸树外,3种树地上部分各器官的碳含量普遍高于地下部分(根),不同树种各器官碳含量的变异系数为0.88% ~ 7.02%,低于我国热带雨林各组分碳含量的变异系数6.5% ~ 15% (李意德等,1998)。
不同恢复模式林地土壤有机碳含量均随土壤深度的增加而逐渐下降,表现为表聚性。是因为地表上的枯枝落物和植物根系分解所形成的有机碳首先进入土壤表层,从而使得表层土壤的有机碳含量明显高于深层土壤。Jobbagy等(2002)认为,植物根系的分布直接影响土壤中有机碳的垂直分布,因为大量死根的腐解归还为土壤提供了丰富的碳源。土壤有机碳平均含量表现为柏木林地>楸树林地>花椒林地,与对照地(29.277 g·kg-1)相比,柏木林地和楸树林地土壤有机碳含量分别提高了56.37%和33.49%,而花椒林地下降了2.09%,且不同植被恢复模式之间同一土层有机碳含量也存在差异性。土壤有机碳含量主要决定于植被每年的归还量和分解速率,归还量大、分解速率缓慢会造成土壤积累较多有机碳(徐秋芳等,2003)。
喀斯特石漠化区土壤层(0 ~ 20 cm)碳储量为50.517 ~ 126.841 t·hm-2,明显低于我国森林土壤平均碳储量(193.55 t·hm-2)和世界土壤平均碳储量(189.00 t·hm-2),与同处中纬度的美国大陆土壤碳储量(108.00 t·hm-2)和湖南会同14年生杉木林地土壤(0 ~ 60 cm)碳储量(108.20 t·hm-2)相近(周玉荣等,2000;方晰等,2006),明显高于江苏南部丘陵地区的杉木人工林地(0 ~ 80 cm,48.64 t·hm-2) (阮宏华等,1997)。与对照地(86.212 t·hm-2)相比,楸树林地和柏木林地土壤碳储量分别提高了31.14%和47.13%,而花椒林地却下降了4.39%。有研究表明,造林后土壤碳储量变化受到许多因素影响,如当地的气候和土壤条件、造林前的土地利用历史、造林前的土壤处理、造林树种和林龄等(Paul et al., 2002; Zinn et al., 2002)。退耕造林后5年内,土壤碳储量约下降3.64%,30年后0 ~ 30 cm土层土壤的碳储量通常高于退耕前的农田土壤,而且不同造林树种对土壤有机碳储量的影响也不同(Paul et al., 2002)。
4种植被恢复模式幼林乔木层碳储量表现为楸树林(3.911 t·hm-2)>车桑子林(2.747 t·hm-2)>花椒林(1.311 t·hm-2)>柏木林(0.640 t·hm-2)。楸树林、花椒幼林、柏木林和车桑子林生态系统碳储量分别为117.207,84.117,127.919和53.733 t·hm-2,均低于中国森林生态系统的平均碳储量(258.83 t·hm-2),更低于中国针叶林生态系统碳储量(408.00 t·hm-2) (周玉荣等,2000)。4种幼林生态系统碳储量主要由植被层、死地被物层和土壤层组成,且土壤层碳储量占整个生态系统碳储量的94.01%以上,植被层占0.82% ~ 5.64%,表明林地土壤层和植被层是森林生态系统碳的重要贮存库。死地被物层的碳储量虽然远小于土壤层和植被层,但它对森林生态系统的碳循环发挥着重要作用。
喀斯特石漠化区实施植被恢复前后生态系统碳贮量发生了变化,恢复前碳贮量为86.399 t·hm-2,楸树林和柏木林生态系统碳贮量分别增加了30.806和41.520 t·hm-2,而花椒林、车桑子林分别下降了2.282和32.666 t·hm-2。可见,楸树林和柏木林模式更有利于提高喀斯特石漠化地区森林生态系统的碳贮量。
4种不同植被恢复模式以楸树林乔木层年固碳能力最高,为1.179 t·hm-2 a-1,其次为车桑子林分,为0.686 t·hm-2 a-1,柏木林分最低,仅为0.080 t·hm-2 a-1,地上部年净碳固定量明显高于地下部分。据报道,海南尖峰岭热带雨林生物量年净增量及年净碳固定量分别为6.92 t·hm-2 a-1和3.82 t·hm-2 a-1 (李意德等,1998);湖南省会同10年生和14年生杉木林分年净碳固定量分别为5.183和8.739 t·hm-2 a-1 (周玉荣等,2000;方晰等,2006)。
方晰, 田大伦. 2006. 杉木人工林C库与C吸存的动态研究[J]. 广西植物, 26(5): 516-522. |
李先琨, 何成新, 蒋忠诚. 2003. 岩溶脆弱生态区生态恢复、重建的原理与方法[J]. 中国岩溶, 22(1): 12-17. |
李意德, 吴仲民, 曾庆波, 等. 1998. 尖峰岭热带山地雨林群落生产和二氧化碳同化净增量的初步研究[J]. 植物生态学报, 22(2): 127-134. |
刘方, 王世杰, 刘元生, 等. 2005. 喀斯特石漠化过程土壤质量变化及生态环境影响评价[J]. 生态学报, 25(3): 639-644. |
龙健, 李娟, 江新荣, 等. 2004. 贵州茂兰喀斯特森林土壤微生物活性的研究[J]. 土壤学报, 41(4): 597-602. DOI:10.11766/trxb200305130416 |
马钦彦, 陈遐林, 王娟, 等. 2002. 华北主要森林类型建群种的含碳率分析[J]. 北京林业大学学报, 24(5): 96-100. |
司彬, 何丙辉, 姚小华, 等. 2006. 喀斯特石漠化形成原因及植被恢复途径探讨[J]. 江西农业大学学报, 28(3): 392-396. |
苏维词, 杨华, 李晴, 等. 2006. 我国西南喀斯特山区土地石漠化成因及防治[J]. 土壤通报, 37(3): 447-451. |
田大伦. 2004. 杉木林生态系统定位研究方法[M]. 北京: 科学出版社.
|
王德炉, 朱守谦, 黄宝龙. 2004. 石漠化的概念及其内涵[J]. 南京林业大学学报:自然科学版, 28(6): 87-91. |
王世杰, 李阳兵, 李瑞玲. 2003. 喀斯特石漠化的形成背景、演化与治理[J]. 第四纪研究, 23(6): 657-661. |
徐秋芳, 徐建明, 姜培坤. 2003. 集约经营毛竹林土壤活性有机碳库研究[J]. 水土保持学报, 17(4): 15-17. |
姚长宏, 杨桂芳, 蒋忠诚, 等. 2001. 岩溶地区生态系统养分平衡研究[J]. 中国岩溶, 20(1): 41-46. |
喻理飞, 朱守谦, 叶镜中, 等. 2002. 退化喀斯特森林自然恢复过程中群落动态研究[J]. 林业科学, 38(1): 1-7. DOI:10.11707/j.1001-7488.20020101 |
周德全, 王世杰, 张殿发. 2003. 关于喀斯特石漠化研究问题的探讨[J]. 矿物岩石地球化学通报, 22(2): 127-132. |
周玉荣, 于振良, 赵士洞. 2000. 我国主要森林生态系统碳贮量和碳平衡[J]. 植物生态学报, 24(5): 518-522. |
Jobbagy E G, Jackson R B. 2002. The vertical distribution of soil organic carbon and it's relation to climate and vegetation[J]. Ecological Application, 10(2): 423-436. |
Paul K I, Polglase P J, Nyakuengama J G, et al. 2002. Change in soil carbon following afforestation[J]. Forest Ecology and Management, 168(1-3): 241-257. DOI:10.1016/S0378-1127(01)00740-X |
Zinn Y L, Resck D V S, da Silva J E. 2002. Soil organic carbon as affected by afforestation with Eucalyptus and Pinus in the Cerrado region of Brazil[J]. Forest Ecology and Management, 166(1 /3): 285-294. |
 2011, Vol. 47
2011, Vol. 47