文章信息
- 马海宾, 梁军, 吕全, 张星耀
- Ma Haibin, Liang Jun, Lü Quan, Zhang Xingyao
- 松材线虫与拟松材线虫迁移能力的比较
- Comparition on Migration Ability of Bursaphelenchus xylophilus and B. mucronatus
- 林业科学, 2011, 47(8): 188-191.
- Scientia Silvae Sinicae, 2011, 47(8): 188-191.
-
文章历史
- 收稿日期:2010-03-11
- 修回日期:2010-05-05
-
作者相关文章
2. 中国林业科学研究院热带林业研究所 广州 510520
2. Research Institute of Tropitical Foresty, CAF Guangzhou 510520
松材线虫病,又称松树萎蔫病、松树枯萎病,是由松材线虫(Bursaphelenchus xylophilus)引起的一种毁灭性森林病害。松材线虫原来广泛分布于北美地区,但在原产地并未造成严重危害。1905年松材线虫病在日本发现后,导致当地松树严重死亡,日本松树林遭受了毁灭性破坏(杨宝君等,2003)。20世纪80年代初,松材线虫病在我国南京首次发现,而后快速蔓延,迄今成为我国最为严重的林业外来有害生物,给松材线虫病害发生区造成了严重的经济损失和生态环境压力(张星耀等,2003)。松材线虫病害系统存在复杂的互作关系,包括松材线虫、拟松材线虫(B. mucronatus)、寄主松树、媒介天牛、伴生细菌、树栖真菌及环境因素,目前尚无有效的控制措施。
松材线虫的致病机制一直存在争论,主要有“酶学说”、“空洞化学说”和“毒素学说”。松材线虫的行为学同“空洞化学说”有着密切关联,成为松材线虫病研究的热点问题之一。松材线虫侵入松树体内后的迁移和运动,导致木质部空洞化,乃至死亡,直接影响着松树的发病过程(Ikeda, 1996)。松材线虫通过传播媒介,如松墨天牛(Monochamus alternatus)取食的松树枝条伤口侵入健康松树体内,沿松树皮层和木质部的树脂道扩散(Mamiya, 1985;Fukuda, 1997),进而呈现不同的病理学反应。研究松树的抗病机制和松材线虫致病机制时,松材线虫的运动行为常被作为重要的考虑因素。Oku等(1989)研究不同抗性松树对松材线虫反应时发现,接种后24 h穿过煮沸过的松树枝段的松材线虫数大于穿过活的松树枝段的线虫数,后人据此用接种后24 h穿过松树枝段的线虫数量作为松树抗性或线虫致病力的评价指标(Togashi et al., 2003;Matsunaga et al., 2004)。本实验室前期研究发现,仅用这一指标并不能完整反映线虫的迁移运动能力,评价线虫的迁移行为时常出现相矛盾的结果。因此,本研究在此基础上,选用穿过松树枝段的线虫数量、线虫穿过松树枝段所需时间和枝段内繁殖能力比较松材线虫和拟松材线虫的迁移运动能力,为深入研究松材线虫在松树体内迁移扩散及致病机制奠定基础。
1 材料与方法 1.1 试验材料试验用的松材线虫、拟松材线虫株系来源见表 1,线虫繁殖用灰葡萄孢(Botrytis cinerea)菌株CXY1201。线虫株系和真菌菌株均保存在中国林科院森林生态环境与保护研究所病理室。
|
|
黑松(Pinus thunbergii)枝条采自中国林业科学研究院院内,黑松胸径约25 cm。
1.2 试验方法1) 线虫繁殖 选用本研究室分离保存的灰葡萄孢(Botrytis cinerea)接种在马铃薯葡萄糖琼脂(PDA)平板培养基上,待菌丝长满平板后备用。供试线虫选用本研究室收集保存的松材线虫和拟松材线虫株系。用混合消毒法对线虫进行表面消毒(杨宝君等,2003),贝尔曼漏斗法分离,2 000 r·min -1离心5 min或静止3 ~ 4 h, 弃上清,浓缩收集线虫;以无菌水为介质配成松材线虫液。线虫纯化后于室内用真菌培养繁殖。用无菌水调整线虫液含量为1.0 × 10 3条·mL -1,5 ℃保存备用。
2) 植物材料准备 选天气晴朗的上午采集黑松4年生枝条,松枝直径约1 cm;用无菌水冲洗枝条表面,洗净后在水中剪成5 cm长的小段,用滤纸擦干,备用。试验前用贝尔曼漏斗法确认黑松枝段内无松材线虫。
3) 线虫迁移能力 将线虫液含量调整为1.0 ×10 3条·mL -1备用。将3 cm长的乳胶管套在松枝上端,取灭菌后脱脂棉放到乳胶管内,滴入200 μL混匀的线虫液,用脱脂棉塞上乳胶管上端,滴加无菌水保湿(王翔凤,2007)。将松枝下端插到盛有1 mL无菌水的50 mL带盖锥形离心管中。置于恒温培养箱25 ℃保湿培养,每6 h收集检查1次下端水液,显微镜下观察测算线虫数量及虫龄,记录线虫各株系最早游出线虫时间。接种20天后用贝尔曼漏斗法收集枝段内线虫,计数。每个线虫株系接种3条黑松枝段,3次重复。SAS统计分析软件对各项数据进行统计分析和差异显著性检验。
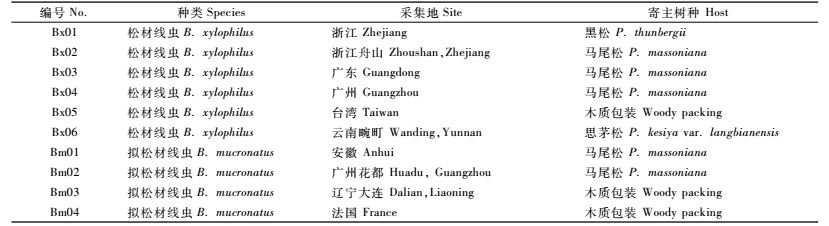
2 结果与分析 2.1 不同线虫株系穿过黑松枝段的时间不同线虫株系穿过黑松枝段的时间如图 1所示。在所有供试线虫中,松材线虫Bx02株系在接种18 h后能够穿过黑松枝段,在锥形管下端无菌水中被检出。拟松材线虫Bm03和Bm04株系穿过黑松枝段所需时间较长,直到接种后92 h才能在锥形管下端无菌水中检出线虫。供试松材线虫Bx05株系接种后72 h才能检出线虫,所需时间比拟松材线虫Bm02的68 h长。试验中Bx01,Bx02,Bx03,Bx04,Bx06共5个松材线虫株系穿过黑松枝段时间均短于所有4个拟松材线虫株系的穿过时间。
|
图 1 不同线虫株系迁移出黑松枝段时间 Figure 1 Time of nematodes passing throughP. thunbergii shoot section |
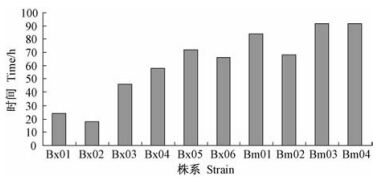
初次镜检发现有线虫从黑松枝段中迁移出来后,立即显微计数迁移出的线虫数量(图 2)。所有供试线虫中,松材线虫株系Bx01初期迁移出黑松枝段的数量最多,为(7.3 ± 1.5)条,明显高于其他线虫株系,但仅是同拟松材线虫Bm01,Bm03,Bm04迁移出数量差异显著(P<0.05);拟松材线虫Bm01初期迁移出黑松枝段数量最少,为(4.0 ± 1.0)条。除松材线虫Bx03迁移出数量为(4.7 ± 0.6)条,少于拟松材线虫Bm02的(5.0 ± 1.0)条外,松材线虫初次检出穿过黑松枝段数量均多于拟松材线虫株系。同2.1结果比较发现:最早穿过黑松枝段的Bx02株系,其迁移出数量并不是最多的;Bm03株系穿过黑松枝段时间是所有供试线虫中最长的,初期检出数量亦是最少的。
|
图 2 不同线虫株系初期迁移出黑松枝段数量 Figure 2 Number of nematodes passing throughP. thunbergii shoot section |
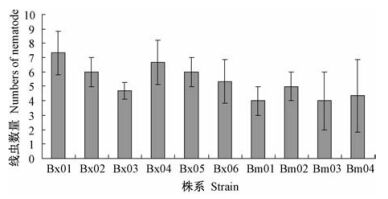
接种后20天,用贝尔曼漏斗法分离收集黑松枝段内线虫,统计分析不同线虫株系的种群繁殖结果(图 3)。松材线虫Bx02株系是供试所有线虫株系中繁殖数量最高的,其繁殖倍数达到15倍,线虫种群数量达到3 000条,繁殖倍数最低的是拟松材线虫Bm04株系,繁殖倍数仅为1.6倍,线虫种群数仅为333条。松材线虫Bx02的繁殖数量显著高于除Bx03之外的其他线虫株系(P<0.05)。供试松材线虫Bx01,Bx02,Bx03,Bx04,Bx05株系的繁殖数量亦显著高于除Bm03外的3个拟松材线虫株系繁殖数量(P<0.05)。
|
图 3 不同线虫株系在黑松枝段内繁殖数量 Figure 3 Number of nematodes multiplication inP. thunbergii shoot section |
本研究比较了松材线虫和拟松材线虫株系在黑松枝段内的迁移运动能力。运用线虫穿过黑松枝段的时间、初期迁移出线虫数量及线虫在黑松枝段内的种群繁殖数量3个指标综合评价松材线虫与拟松材线虫的迁移运动能力。结果显示:整体上松材线虫在黑松枝段内迁移运动能力比拟松材线虫强。但是具体用其中一个指标评价,不同线虫株系的表现并不一致。本试验拟松材线虫株系Bm02在穿过黑松枝段时间和初期迁移出数量2个指标上表现分别短于松材线虫株系Bx05和超过Bx03;拟松材线虫Bm03在种群繁殖指标上不仅与其他3个拟松材线虫株系繁殖数量差异达到显著水平(P<0.05),而且同一个松材线虫株系的繁殖数量也达到显著水平差异(P<0.05)。
松材线虫的致病性在病理学的范畴内具有群体效应,只有当松材线虫种群数量达到一定水平时寄主树才会表现发病症状。运动行为是松材线虫致病性的一种表现,受多种因素影响。苏胜荣等(2007)研究发现:松材线虫接种1年生抗性黑松苗,初期松材线虫在树体内的数量少于在感病黑松体内的数量,移动速度慢;随着时间的推移,线虫开始繁殖,扩散能力增强。谈家金等(2009)报道松树体内挥发物β -蒎烯能够抑制松材线虫繁殖,但同时可增强线虫活力以及具有诱集诱线虫的作用。因此,寄主松树对松材线虫的迁移运动能力有明显的影响。Odani等(1985)发现松材线虫和拟松材线虫的迁移扩散能力同线虫毒力之间有正相关性。但Togashi等(2003)的研究推翻了这一结论,发现线虫毒力同线虫迁移扩散相关性并不明显,原因可能在于线虫在枝段内轴向和径向的扩散是不同的作用机制。松材线虫重要行为之一———聚集在松墨天牛蛹室周围,其原因在于蛹室中具有较高含量的棕榈酸等不饱和脂肪酸及较高的含水率,同时寄主松树、松墨天牛和松材线虫之间存在着一些化学信息传导信号(Mamiya et al., 1972;Mayazaki, 1977)。Shota等(2000)研究发现低温能够降低松材线虫的运动能力。
本研究表明:仅以接种后24 h穿过松树枝段的线虫数量作为评价指标,并不能正确反映寄主松树抗性或者松材线虫的致病力。本实验室前期研究发现:松材线虫分泌纤维素酶活力同其致病力有着密切关系(马海宾等,2009)。因此,评价线虫迁移运动能力同线虫毒力的关系,应该综合考虑线虫分泌致病性相关酶、迁移速度、群体迁移数量及繁殖能力等。本研究结果基于试验材料为黑松枝段,并且部分线虫株系的毒力尚未接种寄主松树验证,下一步还需要开展接种松苗等相关工作,以提供进一步的科学数据支撑上述结论。
马海宾, 梁军, 吕全, 等. 2009. 松材线虫与拟松材线虫分泌的纤维素酶系研究[J]. 林业科学研究, 22(3): 397-400. |
苏胜荣, 叶健仁. 2007. 松材线虫在抗性黑松体内移动及寄主水势变化[J]. 南京林业大学学报, 31(4): 125-127. |
谈家金, 郝德君, 潘玉雯, 等. 2009. 几种松树挥发物对松材线虫行为的影响[J]. 东北林业大学学报, 37(12): 58-59. DOI:10.3969/j.issn.1000-5382.2009.12.019 |
王翔凤. 2007. 高压脉冲电流对松材线虫病主要生物因子的效应研究. 中国林业科学研究院硕士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-82201-2007173540.htm
|
杨宝君, 潘宏阳, 汤坚, 等. 2003. 松材线虫病[M]. 北京: 中国林业出版社.
|
张星耀, 骆有庆. 2003. 中国森林重大生物灾害[M]. 北京: 中国林业出版社.
|
Fukuda K. 1997. Physiological process of the symptom development and resistance mechanism in pine wilt disease[J]. Journal of Forestry Research, 2(3): 171-181. DOI:10.1007/BF02348216 |
Ikeda T. 1996. Xylem dysfunction in Bursaphelenchus xylophilus-infected Pinus thunbergii in relation to xylem cavitation and water status[J]. Ann Phytopathol Soc Jpn, 62: 554-558. DOI:10.3186/jjphytopath.62.554 |
Mamiya Y, Enda N. 1972. Transmission of Bursaphelenchus lignicola (Nematoda: Aphalenchoidae) by Monochamus alternatus (Coleopteran Cerambycidae)[J]. Nematologica, 18: 159-162. DOI:10.1163/187529272X00395 |
Mamiya Y. 1985. Initial pathological changes and disease development in pine trees induced by the pine wood nematode, Bursaphelenchus xylophilus[J]. Ann Phytopoathol Soc Jpn, 51: 546-555. DOI:10.3186/jjphytopath.51.546 |
Matsunaga K, Togashi K. 2004. Amone tree difference in the inhibition of systemic dispersal of Bursaphelenchus xylophilus by Pinus densiflora[J]. Appl Entomol Zool, 39(2): 271-277. DOI:10.1303/aez.2004.271 |
Miyazaki M. 1977. Deposit of fatty acids in the wall of pupal chamber made by Monochamus alternatus[J]. J Jpn Wood Res Soc, 23(6): 307-311. |
Odani K, Sasaki S, Nishiyama Y, et al. 1985. Early symptom development of the pine wilt disease by hydrolytic enzymes produced by the pine wood nematodes-cellulase as a possible candidate of the pathogen[J]. Journal of Japan Forestry Science, 67(9): 366-372. |
Oku H, Shiraishi T, Chikamatsu K. 1989. Active defense as a mechanism of resistance in pine against pine wilt disease[J]. Ann Phytopathol Soc Jpn, 55: 603-608. DOI:10.3186/jjphytopath.55.603 |
Shota J, Togashi K. 2000. Temperature effects on the transmission of Bursaphelenchus xylophilus (Nematoda: Aphalenchoidae) by Monochamus alternatus (Coleopteran Cerambycidae)[J]. J Nematol, 32(1): 110-116. |
Togashi K, Matsunaga K. 2003. Between isolate difference in dispersal ability of Bursaphelenchus xylophilus and vulnerability to inhibition by Pinus densiflora[J]. Nematology, 5(4): 559-564. DOI:10.1163/156854103322683274 |
 2011, Vol. 47
2011, Vol. 47