文章信息
- 王福升, 田新立, 丁雨龙, 万贤崇
- Wang Fusheng, Tian Xinli, Ding Yulong, Wan Xianchong
- 用根压法研究竹子的耐旱、耐寒性
- Drought and Cold Resistance of Bamboo Evaluated by the Root Pressure
- 林业科学, 2011, 47(8): 176-181.
- Scientia Silvae Sinicae, 2011, 47(8): 176-181.
-
文章历史
- 收稿日期:2010-07-31
- 修回日期:2011-07-11
-
作者相关文章
2. 中国林业科学研究院林业新技术研究所 北京 100091
2. Institute of New Forest Technology, CAF Beijing 100091
水分在植物体内长距离传输是植物水分研究中一个很重要的研究方向(Tyree, 1997;Steudle, 2001;Zimmermann et al.,2002;2004)。木质部管道分子(导管或管胞)是植物体内水分长距离运输的通道。植物体内的水分在张力(负压)下以液态形式向上运输,水分子之间的内聚力使得水分在输水管道中形成连续性水柱(Dixon et al.,1894)。当植物体受到干旱、低温等环境胁迫时,木质部导管水势降低,会造成管道(包括根、茎和叶脉)中的水柱张力增大,当张力超出水柱的抗张强度时就会引起水柱中断,即形成空穴(cavitation)。空穴进一步发展会使整个管道分子被气体填充,即形成栓塞(embolism) (Tyree et al.,1989)。栓塞化使管道分子失去输水功能,导致功能导管数量的减少,从而导致植物木质部导水率(hydraulic conductivity)下降(Edwards et al.,1982),进而影响叶片的气孔导度和光合作用,甚至造成落叶和植株死亡。
水分胁迫是木质部栓塞最常见的诱因。木质部栓塞在干旱或半干旱地区是很普遍的,即便是短期的大气干旱也可能会造成木质部的气穴栓塞(Tyree et al., 1989;Cochard et al.,1990;Cochard, 1992)。空穴形成机制主要有2种假说:一种认为木质部压力变负时,木质部内的水分子就克服分子间内聚力而气化、蒸发,从而形成空穴,进而栓塞,此过程所要求的负压要比实际观测到的可引起栓塞化的张力低得多(Pickard, 1981);另一种是异源气体假说,其又细分为内含气种和外侵气种2类(Zimmermann, 1983;Crombie et al.,1985;Tyree et al.,1994;2002)。前者水柱中或水柱与管壁之间有微小气泡的存在,当张力超过一定阈值后,小气泡扩展变大致使水柱断裂,形成栓塞,阻滞水分的运输;后者是在负压下,自相邻的外界大气空间或者已栓塞化的管道内的空气经由管道间纹孔膜上的微孔传送到充水管道内所形成的,造成木质部管道内的栓塞。许多研究证明异源气体是气栓塞发生的主要原因。
冬季的严酷低温使木质部树液结冰引起木质部空穴和栓塞化,空气溶于水而不溶于冰,因此溶解在木质部树液中的空气在树液结冰时就从溶液中逸出,产生气体源。当冰晶融化时,如伴随着木质部管道中张力的作用,气泡会扩大,进而栓塞化,此即为树液结冰引起木质部栓塞的冻融交替(freeze-thaw cycles)机制(Tyree, 1983;Tyree et al.,1989)。另一种机制认为结冰木质部管道内产生的栓塞是由于冰的升华作用(Sperry et al.,1988a)。在结冰所引起的栓塞过程中,升华和冻融交替很可能都起作用(Tyree, 1983)。
木质部栓塞修复机制一直以来都是人们关心的一个热点问题(万贤崇等,2007)。根压或茎压被认为是木质部栓塞的恢复主要机制(Sperry et al., 1987;Tyree et al.,1989)。在蒸腾作用很弱的情况下,根木质部导管存在正的压力(称为根压) (Fisher et al., 1997)。导管中正的压力迫使气泡变小并重新溶解在水中,致使栓塞消除。根压引起空穴化导管的重新注水主要发生在夜晚(Holbrook et al., 2001)。根压使得导管和管胞中水分由下往上推,其产生的液流速度通常要比由蒸腾拉力产生得要小许多。处在蒸腾作用的植物,从树冠或植物梢部产生蒸腾拉力,吸引水分后上运输。当蒸腾作用足够大时,导管和管胞中水分流量很大,使得根系中渗透浓度被稀释从而使得根压减弱或消失(Tyree et al., 1994)。因此木质部压力在蒸腾作用最小时最高,如在雨季期间的黎明前根压最高。木质部压力经常通过吐水现象或从茎、枝切口的木质部汁液渗出而表现出来。
有关双子叶植物及裸子植物在栓塞发生和修复方面的研究已有较多的报道(Sperry et al.,1988b;1990;Lewis, 1988),而竹子尚没有系统的研究。竹子是多年生木质化单子叶植物,其茎干缺乏次生生长,必须年复一年地使用同一套导管系统进行水分运输,因此,对于竹子气泡栓塞修复的研究具有特别重要的理论意义。有些竹子[如毛竹(Phyllostachys edulis) ]和树木一样需要将水分提到十几米以上的顶梢,在低温或者干旱的情况下,这些竹种仍能够正常生长。竹子属禾本科(Poaceae),竹亚科(Bambusoideae),全世界约有竹类植物70多属,1 200余种,主要分布在热带和亚热带地区,少数分布在温带和寒带。亚洲、非洲和拉美常见,而在欧洲和北美地区没有天然竹分布(周芳纯,1998)。这也意味着在科技发达的欧美国家从事竹子方面的研究相对较少,尤其是在植物生理学领域。由于竹子的特殊性,其用于植物生理学的研究会有重大意义(Cochard et al.,1994)。
竹子是很重要的生态成分,也具有很好的景观效应。竹子以其独特的观赏特性深受人们喜爱。从20世纪60年代开始的“南竹北移”的引种工作,在黄河流域新发展了竹林4万hm2 (周芳纯,1998)。近年来,随着城市化进程的加快,人们对城市绿化的要求也越来越高,而无论在南竹北移还是在城市绿化的过程中,经常发生北方地区大片的竹子叶片干枯、最后甚至死亡的现象。笔者推测除种植技术外,可能是由于寒害造成的干旱危害,或者是旱害本身,引起竹子的导管内产生了气泡。由此笔者提出假说:竹子的死亡可能是由于低温造成其导管中严重的气穴栓塞;开春后这些栓塞未能及时修复,阻断水分在竹子木质部导管内的传输。而气温上升后,叶面蒸腾加快从而使得枝条干枯,甚至枯死;而生长良好的竹子可能是由于抗栓塞能力较强,或开春时产生的根压足够大,使得栓塞化的导管能够很快的修复。为了检验这种假说,笔者设计了2组试验。
1 材料与方法 1.1 低温处理对于低温影响竹子水分生理及其他领域的研究,人为地控制温度是很重要的一个环节。这样可以使用需要的温度,也可以缩短自然季节的等待。而现在的人工生长箱容积一般还无法容纳不同大小的竹子,低温处理试验成为难题。为了能在人为控制条件下,对竹秆进行低温处理,笔者创立并设计一个温度处理装置。具体如下:用一个冷却水循环装置(cooler CCA-1110型),为了保证在-20 ℃不结冰,在循环水槽中加入用水稀释的甘油水溶液(10%)作为内循环液。选择柔韧性好、耐低温(-20 ℃)硅胶软管,将软管紧密缠绕在待处理的竹秆上。为防止其热交换,在软管外围及两端接口处包裹一层厚海绵,两端接口接在连接低温水槽的外接口上。用这种方法可以同时以并联的形式连接多根竹秆。将探针温度计的探针放在软管与竹秆接触面检测温度的变化,用以指示试验所需要的温度。
在低温处理过程,用气孔计或光合仪等仪器测定气孔导度、蒸腾速率、光合速率,以观测叶片气孔导度和光合作用的动态变化。在本试验中选用了-10 ℃,用Li-6400光合仪测定低温处理前后气孔导度、蒸腾速率、光合速率的变化。
低温试验于2007年5—6月在南京林业大学竹种园内进行。选孝顺竹(Bambusa multipkex)、矢竹(Pseudosasa japonica)和金镶玉竹(Phyllostachys aureosulcata f. spectabilis) 3个竹种长势健壮的1年龄竹秆,每株选定3片受光一致的叶片,且均为主梢上的功能新叶,进行气孔导度的测定,以后每次测定都用同样叶片。为避免气孔导度随时间变化对低温响应的影响,本文用相对气孔导度来表示对低温的响应,即低温处理后各时期的气孔导度和对照(未经低温处理)的气孔导度的比值。
1.2 根压测定在自然条件下,竹子经历冬季低温胁迫,不可避免地产生气穴栓塞,由于竹子是单子叶植物,缺乏茎秆根增粗生长,不会像其他树木一样每年发生新的维管组织来更新或补充输导能力。竹子生存必须依赖自身修复栓塞的能力,根压是至今为止公认的主要修复机制之一(Tyree et al.,1989;Fisher et al., 1997)。笔者在Fisher等(1997)根压测定技术的基础上,根据竹子的特点进行修改,提出适合竹子根压测定的简单而精确的气压计法,具体如下:将玻璃毛细管一端用酒精灯加热后封死,用微量进样器(100 μL)将蒸馏水注入毛细管基部(至其1 /3处),取聚乙烯软管套在毛细管入水处,软管内注满蒸馏水,软管的另外一端接大小头,大小头内也注满蒸馏水。先选取竹子,然后将选取好的竹子的枝条或秆截去,截面用新刀片削平。向枝条或竹秆内注入蒸馏水至满,选取相应规格大小的软管,套紧在竹子的秆或枝条上,往软管内注入蒸馏水至满,将根压计套在软管上。各接口要连接紧密,不能漏气、漏水。
在太阳落山以后安装气压计,让其平衡一晚。第2天黎明前,取一根“T”字型短尺量取毛细管先端气泡的长度(将尺子一端顶住毛细管的先端,读出毛细管内蒸馏水弯月面的读数)。然后用剪子剪开软管,使毛细管内压力和大气压平衡,再次量取气泡长度。前一次长度以Lpd表示,是黎明前(predawn)气泡的长度;后一次测的气泡长度是在大气压条件下测定的,以Latm表示,是大气压(atmosphere)条件下气泡的长度。
代入公式:
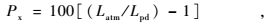
|
(1) |
得出单位为kPa的根压(Fisher et al.,1997)。
溶解栓塞所需要的最低木质部压力,或称临界压力,(Pc)根据下式计算出来:

|
(2) |
式中: τ代表水的表面张力,D为导管(或管胞)的直径。当测得的木质部压力大于-4τ/D时,栓塞中的空气压力就会大于大气压也就会溶解掉。在25 ℃时(τ值为71 kPa μm),-4τ/D = -284 kPaμm /D。
进一步可以根据称临界压力(Pc)计算出溶解栓塞的临界高度(hc, m)。根系运输水分必须克服-10 kPa·m-1的重力梯度,这样溶解栓塞的临界高度(hc)就根据实际测定得植物基部根压(Pxb)和称临界压力(Pc)差值算出来。

|
(3) |
例如,对于直径为100 μm的导管,只有当Pxb>97.2 kPa时,Px才能超过水平面10 m处气泡的Pc(Ewers et al.,1997)。
根压试验于2007年3月底—4月上旬进行,共测定了52个竹种的根压。每一竹种选取1年龄竹秆2根,每隔1天测其根压的大小,重复3次,每秆竹子选取最大根压进行统计。南京3月份底—4月上旬,气温开始上升,竹子逐渐恢复代谢和生长,生理活动增强。
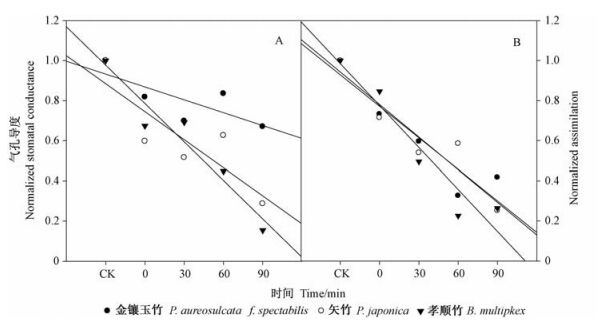
2 结果与分析 2.1 低温对气孔导度的影响在-10 ℃条件下3种竹子的气孔导度和光合作用都明显下降。图 1A中的纵坐标表示相对气孔导度,图 1B中的纵坐标表示相对光合作用。金镶玉竹的气孔导度下降最慢,其次是矢竹,然后是孝顺竹,而且孝顺竹光合作用也下降得比另外2个竹种快。从笔者以前的栽培试验可知:金镶玉竹耐寒性最强,矢竹次之,孝顺竹最差。初步试验结果和竹种的耐寒性相符。在植物旺盛生长季,低温的处理引起所有3种竹子出现水分胁迫响应,这也证明使用在茎秆的低温可以引起植物导管中产生气穴栓塞,进一步导致气孔的关闭,继而光合作用下降。
|
图 1 3个竹种的气孔导度(A)和光合作用(B)对竹秆低温处理的反应 Figure 1 Changes in stomatal conductance (A) and assimilation (B) of three bamboo species in response to low temperature treatment |
表 1结果显示: 3种竹子的根压也不同。矢竹最大根压(28.8 kPa)能够将木质部中的水柱推到3.6 m, 而矢竹的平均高度3 m, 刚好能够修复整根竹子栓塞化的导管,虽然低温很快导致其气孔关闭,说明它的导管不耐低温诱导的气穴栓塞,但是导管的栓塞可以很快被根压溶解。孝顺竹根压也比较大,但植株本身较高,而且它的木质部导管比较粗,一旦发生栓塞,不能靠根压完全修复整株中的栓塞,水分不能及时运输到植物体各个部分,因此生理指标下降较快。金镶玉竹根压较小,也不能完全依靠根压来修复整株竹秆中栓塞的导管分子。不过低温不容易导致金镶玉竹气孔关闭(图 1A),证明它的导管比较耐低温的胁迫。
|
|
本试验测定了52种竹种的根压,具体结果如表 2。表 2中结果是2根竹秆,3次测定的平均值,以及它们的标准偏差。测定结果表明植物的根压有较大的变化幅度。根压最大的为美丽箬竹,达49.9 kPa, 最小的是黄槽石绿竹,根压为-2.2 kPa。根压处于10 ~ 30 kPa的,共有22种,占总竹种数量的42%;根压处于5 ~ 10 kPa的共有17种,占总竹种的33%;根压处于2 ~ 5 kPa的共有108种,占总竹种数的194%。因此,总的来说绝大部分竹种(75%)的根压都在5 ~ 30 kPa之间。从理论上讲,在忽略摩擦阻力的情况下10 kPa水压可以将水送到1 m的高度。许多竹种都可以借助根压修复冬季低温所诱导的导管栓塞,但并不是所有竹子都能仅依靠其根压完全修复栓塞。2007年早春样地的晚间最低温度是3 ℃,而白天的最高温度为28 ℃;湿度在43% ~70%之间,此时的环境条件总体上是低温干燥的,尽管竹子开始发笋、萌动发育,但还不是生长的最佳条件。土壤温度较低,不利于根压的建立。由此推测:此时萌动所产生的茎压可能为导管栓塞修复提供压强(Tyree et al.,2002)。
|
|
此文利用笔者研制的低温处理方法对竹子,甚至高大竹种的竹秆进行低温处理,并成功地诱导所有3个处理竹种气孔关闭,继而光合作用下降,证明这种低温处理可以引起茎秆木质部导管产生气穴栓塞,降低导管水力学导度。本研究还发现不同3个耐寒性不同的竹子具有相应的抗低温栓塞的能力。抗寒的金镶玉竹气孔关闭的程度小,光合作用下降的叶少。根据竹种的根压和导管的直径可以计算出来它们的临界竹高。3个竹种中,比较抗寒的矢竹的临界高度高于它的竹秆高度,说明当它产生气穴栓塞后可以通过根压进行自我修复;而抗寒性较差的孝顺竹的临界高度低于其竹秆的高度,栓塞之后不能完全靠根压进行修复。金镶玉竹的临界高度也低于其竹秆的高度,这一结果表明抗寒性可能是由于它的导栓塞管脆弱性较小,对低温有耐性;另一方面,矢竹虽然很脆弱,容易产生栓塞,但它们的自我修复能力较强,同样可以在较低温度环境下生长。
笔者运用修改后的微型气泡压力计技术测定52种竹子的根压。除了Cochard等(1994)报道一种南美藤状丛生竹的根压外,为首次大范围的研究和报导竹子植物的根压,本研究也证明竹类植物普遍存在根压,这也可能是竹子这类单子叶多年生植物进化出的一种必备机制,它们必须使用原初发育的一套导管系统输送水分和矿质元素,以及其他物质的交换。
根压的大小与竹种的生物学特性和生活习性有较大的关系。就目前的研究来看,一些低矮的竹子(地被竹种),如阔叶箬竹、菲黄竹、黄条金刚竹、铺地竹等竹种,由于植株矮小,不需要很高的根压就能够修复整个植株栓塞化的导管。这些竹种主要分别在安徽、江苏等省,生长在山谷或树林下。一般是植株较小,根系发达。虽然它们的根压足以修复气穴栓塞,但和它们的耐寒性没有关系。对于中型大小的竹子,它们的最大根压,以及所能产生的临界高度和竹种的抗寒性有较紧密的关系,如金镶玉、矢竹等,它们的临界高与植物体本身的高度相当,抗寒性强,分布广。不耐寒的竹种,像茶秆竹、孝顺竹、凤尾竹等,它们的临界高度都远低于竹秆高度,这些竹种主要生活在华南地区。而对于比较高大的竹子,如毛竹,所观察的最高植株为10 m, 最大值根压为29.1 kPa, 临界高即能够修复栓塞的最大高度为3.2 m, 在这种压力下整个植物体的栓塞化的导管是不可能完全修复的。虽然毛竹能生活在北方大部分地区,抗寒性也较强,但不一定全部是根压作用的结果。对于比较高大的竹子,根压修复到一定高度便无法修复。在一种常绿灌木月桂(Laurus nobilis)中,即使没有正的根压,栓塞仍能够修复(Salleo et al., 1996)。对这种植物来说,修复机制还没有弄清楚。修复也可以在的木质部张力条件下进行(Canny, 1997)。不过对于负压下栓塞的修复至今为止尚无完满的解释。
万贤崇, 孟平. 2007. 植物体内水分长距离运输的生理生态学机制[J]. 植物生态学报, 31(5): 804-813. DOI:10.17521/cjpe.2007.0102 |
周芳纯. 1998. 竹林培育学[M]. 北京: 中国林业出版社: 472.
|
Canny M J. 1997. Vessel contents during transpiration-embolisms and refilling[J]. American Journal Botany, 84: 1223-1230. DOI:10.2307/2446046 |
Cochard H. 1992. Vulnerability of several conifers to air embolism[J]. Tree Physiology, 11: 73-83. DOI:10.1093/treephys/11.1.73 |
Cochard H, Tyree M T. 1990. Xylem dysfunction in Quercus: vessel sizes, tyloses, cavitation and seasonal changes in embolism[J]. Tree Physiology, 6: 393-407. DOI:10.1093/treephys/6.4.393 |
Cochard H, Ewers F W, Tyree M T. 1994. Water relations of a tropical vine-like bamboo (Rhipidocladum racemiflorum) : root pressures, vulnerability to cavitation and seasonal changes in embolism[J]. Journal of Experimental Botany, 45(8): 1085-1089. DOI:10.1093/jxb/45.8.1085 |
Crombie D S, Milbum J A, Hipkins M F. 1985. Maximum sustainable xylem sap tensions in Rhododendron and other species[J]. Planta, 163(1): 27-33. DOI:10.1007/BF00395893 |
Dixon H H, Joly J. 1894. On the ascent of sap[J]. Annals of Botany, 8: 468-470. |
Edwards W R N, Jarvis P G. 1982. Relations between water content, potential and permeability in stems of conifers[J]. Plant, Cell and Environment, 5(4): 271-277. |
Ewers F W, Cochard H, Tyree M T. 1997. A survey of root pressures in vines of a tropical lowland forest[J]. Oecologia, 110(2): 191-196. DOI:10.1007/s004420050149 |
Fisher J B, Angeles G, Ewers FW, et al. 1997. Survey of root pressure in tropical vines and woody species[J]. International Journal of Plant Science, 158(1): 44-50. DOI:10.1086/297412 |
Holbrook N M, Ahrens E T, Burns M J, et al. 2001. In vivo observation of cavitation and embolism repair using magnetic resonance imaging[J]. Plant Physiology, 126(1): 27-31. DOI:10.1104/pp.126.1.27 |
Lewis A M. 1988. A test of the air-seeding hypothesis using Sphagnum hyalocysts[J]. Plant Physiology, 87: 577-582. DOI:10.1104/pp.87.3.577 |
Pickard W F. 1981. The ascent of sap in plants[J]. Prog Biophys Mol Biol, 37: 181-229. DOI:10.1016/0079-6107(82)90023-2 |
Salleo S, Logullo M A, DePaoli D. 1996. Xylem recovery from cavitation-induced embolism in young plants of Laurus nobilis: A possible mechanism[J]. New Phytologist, 132(1): 47-56. DOI:10.1111/nph.1996.132.issue-1 |
Sperry J S, Tyree M T. 1990. Water stress induced xylem embolism in three species of conifers[J]. Plant Cell and Environment, 13(5): 427-436. DOI:10.1111/pce.1990.13.issue-5 |
Sperry J S, Donnelly J R, Tyree M T. 1988a. A method for measuring hydraulic conductivity and embolism in xylem[J]. Plant, Cell and Environment, 11(1): 35-40. DOI:10.1111/pce.1988.11.issue-1 |
Sperry J S, Tyree M T. 1988b. Mechanism of water stress-induced xylem embolism[J]. Plant Physiology, 88: 581-587. DOI:10.1104/pp.88.3.581 |
Sperry J S. 1986. Relationship of xylem embolism to xylem pressure potential, stomatal closure, and shoot morphology in the palm Rhap is excelsa[J]. Plant Physiology, 80: 110-116. DOI:10.1104/pp.80.1.110 |
Sperry J S, Holbrook N M, Zimmermann M H, et al. 1987. Spring filling of xylem vessels in wild grapevine[J]. Plant Physiology, 83(2): 414-417. DOI:10.1104/pp.83.2.414 |
Steudle E. 2001. The cohesion-tension mechanism and the acquisition of water by plant roots[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 52: 847-875. DOI:10.1146/annurev.arplant.52.1.847 |
Tyree M T, Yang S, Cruiziat P, et al. 1994. Novel methods of measuring hydraulic conductivity of tree root systems and interpretation using AMAIZED (a maize-root dynamic model for water and solute transport)[J]. Plant Physiology, 104(1): 189-199. DOI:10.1104/pp.104.1.189 |
Tyree M T. 1983. Maple sap uptake, exudation, and pressure changes correlated with freezing exotherms and thawing endotherms[J]. Plant Physiology, 73: 277-285. DOI:10.1104/pp.73.2.277 |
Tyree M T. 1997. The cohesion-tension theory of sap ascent: current controversies[J]. Journal of Experimental Botany, 48(10): 1753-1765. DOI:10.1093/jxb/48.10.1753 |
Tyree M T, Sperry J S. 1989. Vulnerability of xylem to cavitation and embolism[J]. Annual Review of Plant Physiology and Molecular Biology, 40: 19-38. DOI:10.1146/annurev.pp.40.060189.000315 |
Tyree M T, Zimmermann M H. 2002. Xylem structure and the ascent of sap[M]. 2nd Ed. Berlin: Springer-Verlag: 278.
|
Zimmermann U, Schneider H, Wegner L H. 2004. Water ascent in tall trees: does evolution of land plants rely on a highly metastable state?[J]. New Phytologist, 162(3): 575-615. DOI:10.1111/nph.2004.162.issue-3 |
Zimmermann U, Schneider H, Wegner L H, et al. 2002. What are the driving forces for water lifting in the xylem conduit?[J]. Physiologia Plantarum, 114: 327-335. DOI:10.1034/j.1399-3054.2002.1140301.x |
Zimmermann M H. 1983. Xylem Structure and the Ascent of Sap[M]. Berlin / Heidelberg / New York / Tokyo: Springer-Verlag: 143.
|
 2011, Vol. 47
2011, Vol. 47



