文章信息
- 张玉龙, 池玉杰, 闫洪波
- Zhang Yulong, Chi Yujie, Yan Hongbo
- 偏肿栓菌产锰过氧化物酶条件优化
- Optimization of Ferment Conditions of Manganese Peroxidase Produced by Trametes gibbosa
- 林业科学, 2011, 47(8): 88-94.
- Scientia Silvae Sinicae, 2011, 47(8): 88-94.
-
文章历史
- 收稿日期:2010-11-07
- 修回日期:2010-12-22
-
作者相关文章
锰过氧化物酶(MnP; EC1.11.1.13)是一种依赖H2O2的三价铁血红素糖蛋白酶,是一种常见的降解木质素的过氧化物酶,在真菌降解木质素的非特异性细胞外氧化还原酶中起着至关重要的作用。由于MnP对木质素和多环芳烃等多种异生物质具有独特和极强的降解能力,能够有效地降解废水和土壤中很难被降解的多氯联苯、多环芳烃、DDT、染料、炸药和其他氯化物等,因此这种酶在生物制浆和漂白、有毒废弃物的脱除和降解领域极具吸引力。酶的长期稳定性和大规模可行性生产是其被有效利用的前提,进一步提高MnP的稳定性,并降低酶的生产成本,使MnP成为生物技术领域中的一种多效的生物催化剂具有重要的研究意义。产酶条件的完善和优化是白腐菌(Trametes)的酶学研究基础,不同白腐菌的产酶条件具有较大差异。偏肿栓菌(Trametes gibbosa)是我国东北林区常见的多孔菌科(Polyporaceae)白腐菌,也是一种生长速度较快、对木材和木质素分解能力较强的白腐菌,本文报道了对该菌种主要木质素降解酶系统的检测及对MnP产酶培养条件的优化研究结果,为今后该酶的纯化、特性研究与商品化生产提供依据。
1 材料与方法 1.1 讨论材料 1.1.1 菌种试验前在PDA(Potato Dextrose Agar)培养基斜面上培育的偏肿栓菌菌种冷藏于4 ℃冰箱。
1.1.2 培养基综合培养基: PDA培养基。产酶基础培养基1:低氮天冬酰胺-琥珀酸培养基(LNAS,Low Nitrogen Asparagine Succinic acid)(Kirk et al., 1978)。产酶基础培养基2(L1):以LNAS培养基为产酶基础培养基1,改变部分培养基的组成,主要是对LNAS进行富营养型优化处理,得到产酶基础培养基2,用于正交试验。组分: KH2PO42.0 g,MgSO4 · 7H2O 0.5 g,琥珀酸1.18 g,CaCl2·2H2O 0.1 g,mineral solution 50 mL,vitaminsolution 5 mL,吐温-80 0.5 mL。第1次正交试验碳源种类、碳源浓度、氮源种类、氮源浓度、Mn2+的浓度可调。用4 mol·L-1 NaOH调节pH值为4.5。第2次正交试验吐温-80的浓度、MgSO4·7H2O的浓度和pH值可调。
1.2 试验方法 1.2.1 偏肿栓菌木质素降解酶系统产酶活性的检测培养方式:用5种不同的底物处理方式进行菌种培养: ① LNAS培养基不含Mn2+,即矿物元素溶液中不添加MnSO4·H2O; ② LNAS培养基含Mn2+(2.67 μmol· L-1),即矿物元素溶液中添加MnSO4·H2O; ③ LNAS培养基含Mn2+(2.67μmol·L-1),并加入2 g大青杨(Populus ussuriensis)木屑为产酶底物; ④ LNAS培养基含Mn2+(2.67μmol·L-1),并加入10 mmol·L-1 2,6-二甲氧基苯酚(2,6-DMP)0.1 mL为产酶底物。⑤同培养方式③,但只是在30 ℃静止培养,检测MnP活性,这种方式作为1.2.2中正交试验的初始培养条件。每项试验设3次重复。前4种在28 ℃下静止培养。计算酶活值后绘制出产酶活/时间曲线图,并利用PASW软件数据处理系统对前4种不同的培养液产酶的活性进行方差分析。
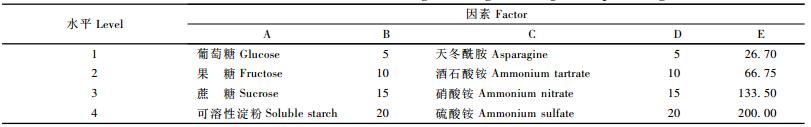
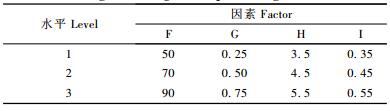
1.2.2 正交试验本试验将碳源种类(A)、B碳源浓度(g·L-1)(B)、氮源种类(C)、氮源浓度(mmol·L-1)(D)和Mn2+的浓度(μmol·L-1)(E)等5因素作为首选试验因素。选择各因素水平的原则是把参数的水平区间拉开,尽可能使最佳区域能包含在设定的水平区间内。本项正交试验的因素水平为4个等级。选用了常用的4种碳源和4种分子质量明确的氮源,对于碳源和氮源的浓度,主要考察不同碳氮比产MnP的状况(表 1)。根据因素数和水平数的要求,生物统计学设计出L16(45)的正交表,在产酶基础培养基2的基础上,改变部分培养基的组成进行16组不同配方培养基的第1次正交试验,每组试验3次重复,每次需提取48份酶样测定酶活。在250 mL三角瓶中加入70 mL产酶基础培养基2,并加入2 g大青杨木屑为产酶底物。按照1.2.1中的培养方式,将培养液pH调整为4.5,在30 ℃、静止的条件下培养,并按照1.2.1的MnP酶活测定方法进行酶活测定。通过正交试验明确偏肿栓菌对碳源、氮源以及Mn2+的需求情况。在第1次正交试验的基础上,以静止培养时装液量(mL)(F),吐温-80的浓度(mL·L-1)(G),pH值,MgSO4· 7H2O的浓度(g·L-1)(I)为因素(表 2),设计出L9(34)正交表进行第2次正交试验。
|
|
|
|
根据2次正交试验的结果,进一步探索最佳产酶条件。测试最佳组合静止培养时在不同温度(24,27,30,33,36 ℃)下的酶活性,得到最佳温度值。然后,在5组(a,b,c,d,e)不同矿质元素与维生素含量组合条件下进行静止培养试验(表 3),测试酶活性后得到最佳的矿质元素与维生素含量组合。然后在150 r·min-1下,进行不同装液量(50,70,90,110 mL)的摇瓶体系试验,以静止培养(50 mL)为对照,测试酶活以得到最佳的摇瓶装液量,探索营养物质含量与溶氧量之间的关系和最佳组合。
|
|
综合上述优化结果,确定偏肿栓菌产MnP的最优培养条件。为了使优化结果更加准确,做了3组平行试验进行验证。
2 结果与分析 2.1 偏肿栓菌木质素降解酶系统产酶活性的检测在4种不同的培养液中分别对LiP的酶活进行检测,但在310 nm处均未检测到吸光值的变化,表明偏肿栓菌不产生LiP。
在21天的培养过程中,偏肿栓菌在不含Mn2+的LNAS培养基中不加底物条件下,提取的酶液未检测到MnP的活性; 在含Mn2+的LNAS培养基中不加底物条件下,可以检测到MnP的活性,但活性很低,15天达到分泌高峰,最大酶活力仅为13 U·L-1。对比①,② 2种培养液的检测结果表明:Mn2+是偏肿栓菌产生MnP的必要因子,在诱导产生MnP的过程中起着关键作用。在含Mn2+的LNAS培养基中加入木屑为底物条件下,提取的酶液检测到MnP的活性,MnP在13天达到最大分泌量,酶活力为165 U·L-1; 在含Mn2+的LNAS培养基中加入2,6-DMP为底物的条件下,提取的酶液也检测到MnP的活性变化,MnP在11天达到最大分泌量,酶活力为42 U·L-1。对比③,④ 2种培养过程中MnP的产生结果表明:在培养过程中添加木屑和2,6-DMP为底物都可以提高MnP的产生量。在以2,6-DMP为底物时MnP达到最大分泌量的时间有缩短。以木屑为底物的产酶量要高于以2,6-DMP为底物的产量。21天内偏肿栓菌在4种培养液中产生MnP的情况见图 1。方差分析结果表明:培养液与培养时间的Sig.值都小于0.05,表明培养液之间、不同培养时间之间的MnP活性差异都显著。4种不同的培养液MnP的活性差异显著,其中培养液③与①均值差值最大; 培养液③随着时间的变化MnP在13天的均值与21天的均值差值最大。在作为初始培养条件的培养方式⑤中,MnP活性在第13天达到最高峰,酶活为37.5 U·L-1,以后逐渐下降,由此确定培养13天作为正交试验中各影响因素对酶活力影响的适宜时间。对比③,⑤ 2种培养过程中MnP的产生结果可知:偏肿栓菌对于温度的要求很高,高温强烈抑制MnP活性。
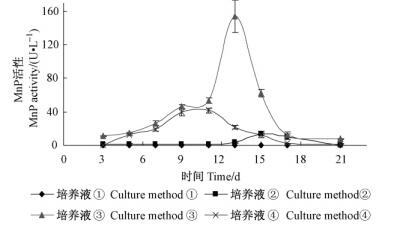
|
图 1 4种培养液中MnP活性随时间的变化 Figure 1 MnP activity of 4 kinds of different LNAS culture method |
在21天的培养过程中,偏肿栓菌在不含Mn2+的LNAS培养基中不加底物条件下,提取的酶液可以检测到漆酶的活性,在7天达到最大分泌量,酶活力仅为52 U·L-1; 在含Mn2+的LNAS培养基中不加底物条件下,提取的酶液可以检测到漆酶的活性,在9天时达最大分泌量,酶活力达38U·L-1。对比①② 2种培养液的检测结果表明:漆酶的产生不受Mn2+的制约。在含Mn2+的LNAS培养基中加入木屑为底物条件下,提取的酶液检测到漆酶的活性,漆酶在第9和13天具有2个分泌高峰,但第9天的分泌量要高于第13天的分泌量; 在含Mn2+的LNAS培养基中加入2,6-DMP为底物的条件下,提取的酶液也检测到漆酶的活性,漆酶在5,11,17天有3个分泌高峰,但以第11天分泌量最大,酶活力为382 U·L-1。对比③,④ 2种培养过程中漆酶的产生结果,表明在培养过程中添加木屑和2,6-DMP为底物都可以显著提高漆酶的产生量,底物对偏肿栓菌漆酶的产生具有明显的诱导作用。以木屑为底物时漆酶的产量要高于以2,6-DMP为底物时的产量。21天内偏肿栓菌在4种培养液中产生漆酶的情况见图 2。方差分析结果表明:培养液与培养时间的Sig.值小于0.05,表明培养液之间、不同培养时间之间的漆酶活性差异都显著。4种不同的培养液漆酶的活性差异显著,其中培养液③与②均值差值最大(为160.306 6),培养液④与②均值差值也很大(为159.916 6);培养液③随时间的变化,漆酶在9天的均值与3天的均值差值最大。

|
图 2 4种培养液中漆酶活性随时间的变化 Figure 2 Laccase activity of 4 kinds of different LNAS culture method |
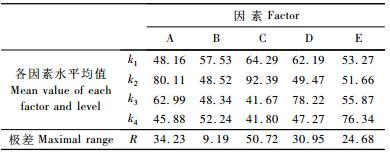
第1次正交试验的16组试验酶活力分别为56.86,39.79,26.34,21.50,133.47,41.94,35.21,29.71,40.86,35.75,45.97,66.40,32.93,28.09,37.50,39.11 U·L-1,采用直观分析法,比较各因素水平均值ki,得到每个因素的最大平均值,如表 4所示。从而得出培养基的最优配方为A2B1C2D3E4,即碳源为果糖,浓度为5 g·L-1,氮源为酒石酸铵,氮源浓度为15 mmol·L-1,锰离子浓度是200 μmol·L-1。通过极差分析,排列出各因素对指标影响大小的主次顺序为RC>RA>RD>RE>RB,即说明氮源种类对偏肿栓菌产MnP影响最大,其次是碳源种类、氮源浓度,然后是锰离子浓度和碳源浓度。
|
|
图 3为第1次正交试验的趋势图,表明了5种因素在不同水平下对产酶的贡献。果糖最有利于产酶,可溶性淀粉最不利于产酶。不同的碳源对产酶的影响比较大,但是碳源的浓度对产酶的影响不大。不同氮源对产酶的影响最大,氮源为硝酸铵和硫酸铵时情况不佳,此外氮源浓度对产酶也有一定影响,所以氮源是影响MnP酶分泌的一个重要因素。在试验范围内锰离子浓度越高越好。
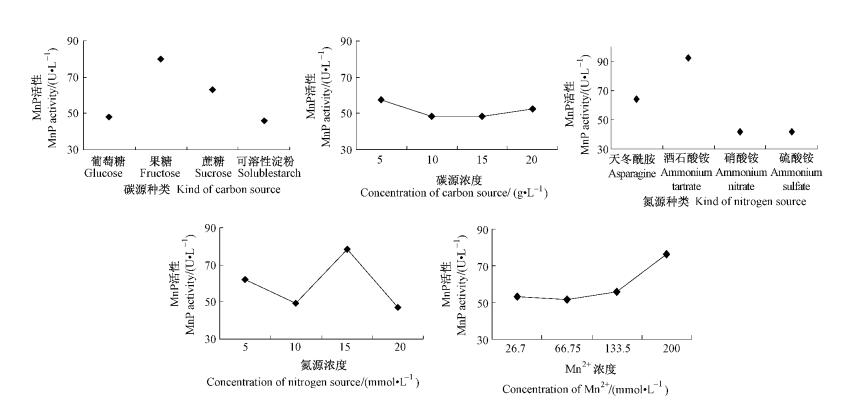
|
图 3 第1次正交试验趋势 Figure 3 Trend chart of the first time orthogonal test |
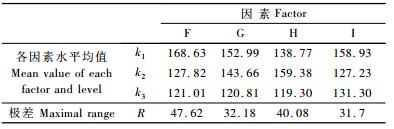
第2次正交试验的9组试验酶活力分别为201.86,181.45,122.58,154.03,132.26,97.18,103.07,117.28,142.67 U·L-1。采用直观分析法,比较各因素水平均值ki,求出每个因素的最大平均值,如表 5所示。可以得出最优方案为F1G1H2I1,即静止培养时装液量为50 mL,吐温-80浓度为0.25 mL·L-1,pH为4.5,MgSO4·7H2O浓度为0.35g·L-1。通过极差分析,排列出各因素对指标影响大小的主次顺序为RF>RH>RG>RI,即装液量和pH值对产酶影响最大,其次是吐温-80浓度和MgSO4·7H2O浓度。
|
|
图 4为第2次正交试验趋势图,表明了4种因素在不同水平下对产酶的贡献。装液量既反映营养物质,也反映相对溶氧量,可见偏肿栓菌对溶氧量的要求很大。高浓度的吐温-80不利于产酶,pH过大过小均不利,Mg2+浓度不宜太高。
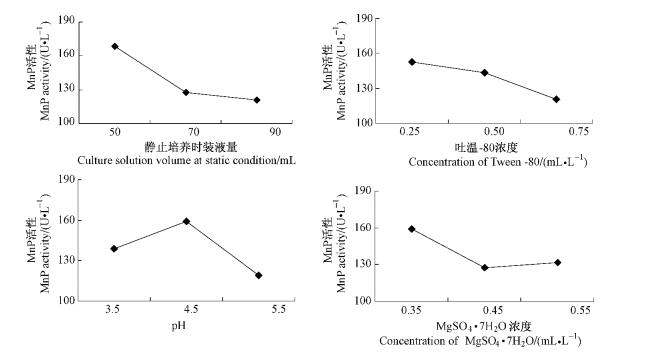
|
图 4 第2次正交试验趋势 Figure 4 Trend chart of the second time orthogonal test |
应用最佳组合A2B1C2D3E4F1G1H2I1在5种温度下静止培养时,第13天测定酶活,结果如图 5所示。27 ℃时产酶量最高,MnP活性达到168.15U·L-1,随着温度的升高酶活性急剧下降,36 ℃时几乎不产酶,可知偏肿栓菌对于温度的要求很高,高温强烈抑制产酶。不同温度下酶的产量以及达到产酶高峰时间也不相同,27 ℃下产酶高峰出现在第17天,为239.52 U·L-1,时间有滞后,这可能与静止培养溶氧量达不到要求有关,亦可能与矿质元素和维生素的含量不适宜有关(高尚等,2007)。
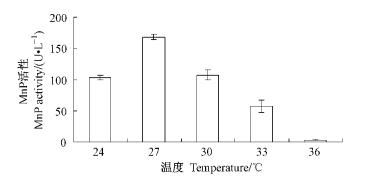
|
图 5 不同温度下的产酶结果 Figure 5 MnP activity at 5 different temperatures |
应用最佳组合A2B1C2D3E4F1G1H2I1在27 ℃下,按照表 3中的5组矿质元素与维生素含量组合条件下进行静止培养,第13天的产酶结果是b组矿质元素溶液加入10 mL·L-1、维生素溶液加入量为1 mL·L-1时产酶最高,为214.67 U·L-1,各试验组酶活性差别较小,矿质元素与维生素加入量对产酶效率影响并不大。图 6为各组试验产酶曲线图,不同试验组产酶高峰时间各不相同,但都集中在17 ~20天左右,时间也滞后,这可能也与静止培养溶氧量达不到要求有关。
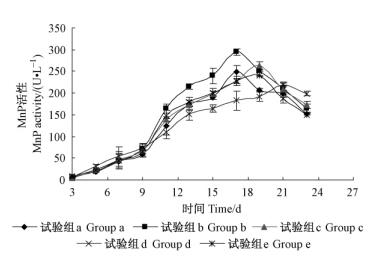
|
图 6 不同矿质元素与维生素含量组合下的产酶结果 Figure 6 MnP activity under five combinations of mineral and vitamin solution |
在150 r·min-1的摇床转速下,不同装液量第13天的产酶结果是装液量越高酶活性越高(110 mL酶活达289.5 U·L-1),推测原因是营养物质相对丰富,又有足够的溶氧量。装液量少产酶少的原因,除了营养物质不足外,还可能由于转速高液体少,培养液扰动剧烈,剪切力过大,干扰了菌丝的正常生长,从而影响了酶的分泌所致。50 mL静止培养酶活性为226.3 U·L-1,与70 mL摇瓶培养相接近,静止培养酶活较低可能是溶氧量达不到要求所致。5组试验的产酶曲线见图 7,装液量110 mL的摇瓶培养在15天产酶达到最高为318.7 U·L-1,由于溶氧量充足,比静止培养提早4天达到产酶高峰。因此,在150 r·min-1转速下,在研究范围内110 mL装液量为最佳摇瓶培养条件。
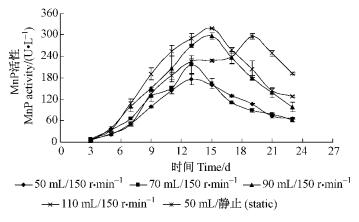
|
图 7 不同摇瓶装液量的产酶结果 Figure 7 MnP activity of different culture solution volume at shaking condition |
至此得出偏肿栓菌产MnP的最佳条件为:培养液果糖浓度为5 g·L-1、酒石酸铵浓度为15 mmol·L-1、锰离子浓度是200 μmol·L-1、吐温-80浓度为0.25 mL·L-1,MgSO4·7H2O浓度为0.35 g·L-1、矿质元素溶液加入量为10 mL·L-1、维生素溶液加入量为1 mL·L-1; 培养液pH值4.5;培养温度27 ℃; 150 r·min-1摇瓶培养条件下装液量为110 mL。在此条件下通过摇床做3组优化培养的结果如图 8所示,在15天左右产酶最高达到314.52 U·L-1,比优化前初始培养条件提高8.4倍。

|
图 8 摇床优化培养产酶结果 Figure 8 MnP activity at optimization shaking condition |
1) 以往的研究表明:不同的碳源对白腐菌MnP的产生影响不大,一般最佳碳源为葡萄糖,也有研究认为最佳碳源为果糖,或作为迟效碳源的木质纤维素和木聚糖比速效碳源葡萄糖等更加有利于产酶(官敏,2006)。碳源也存在适宜的浓度范围,一般浓度过高会抑制MnP的形成。本研究结果表明:偏肿栓菌产MnP的最佳碳源为浓度较低的果糖。今后应研究更多种类的碳源对偏肿栓菌产MnP的影响。
2) 不同菌种对氮源的敏感程度不一致,多数文献报道多数白腐菌在限氮的条件下产酶时间长,产酶量较高(Maximo et al., 2003),但限氮并非MnP合成所必需。本研究结果表明:偏肿栓菌产MnP的最佳氮源为酒石酸铵,与文献报道的黄孢原毛平革菌(Phanerochaete chrysosoporium)和变色栓菌(云芝)(Trametes versieolor)一致(浦跃武等,1998; 张连慧等,2005),但偏肿栓菌产MnP的最佳氮源浓度较其他文献报道的高(杨晓宽等,2004; 吴会广等,2008),也表明限氮并非是产MnP的必需条件。崔艳红等(2008)使用有机氮源较无机氮源产MnP高,在今后试验可进一步试验其他有机氮源对偏肿栓菌产MnP的影响。
3) Mn2+是木材中天然存在的金属离子,在白腐菌降解木质素的过程中,Mn2+可以作为MnP的反应底物及催化过程的传播媒介。多数白腐菌对Mn2+具有依赖性,即Mn2+是MnP产生的必要因子,并在一定范围内随Mn2+浓度的增加产酶量增大,但当Mn2+浓度到达一定程度后,浓度再增加,产酶能力基本不再提高(Nuske et al., 2002; Scheel et al., 2000)。但有些白腐菌产生的是不依赖于Mn2+的MnP,在无Mn2+存在的情况下也可以产生MnP活性(Steffen et al., 2002)。另外也有报道,以云芝为研究菌株,Mn2+浓度仅影响菌体自身的生长,对于MnP的产量则无重要影响(张连慧等,2005)。本研究结果表明:偏肿栓菌仅在Mn2+存在条件下产生MnP,且在试验的Mn2+浓度范围内随Mn2+浓度升高产酶量越高。更高的Mn2+浓度能否进一步提高MnP的产酶量,有待进一步试验。
4) 菌体培养温度对MnP的产生也有较大影响,不同菌株的培养最适温度不同,黄孢原毛平革菌产MnP的最适温度范围为36~40 ℃,变色栓菌为30~35 ℃,本研究结果表明偏肿栓菌产MnP的最适温度为27 ℃,对其最适温度范围还需进一步试验。
5) 白腐菌培养环境的pH值与其生长有着密切的联系,pH值影响细胞膜所带电荷,改变培养基中化合物的离子化程度,从而影响细胞对营养物质的吸收与代谢产物的分泌。黄孢原毛平革菌产MnP的最适pH值为4.5,白腐菌F2产MnP的最适pH值为3.6。本研究结果表明:偏肿栓菌产MnP的最适pH值为4.5。
6) 由白腐菌产MnP的结果可知:吐温-80等表面活性剂能明显增加产酶量,可能是水解产生一些醇残基增加了细胞膜的渗透性(Steffen et al., 2002),并解除已合成的锰过氧化物酶在细胞内对酶基因转录或mRNA翻译的阻碍,但是吐温-80并非越高越有利。本研究结果表明:偏肿栓菌在测试的吐温-80浓度范围内,随着吐温-80浓度逐渐升高酶活性呈降低趋势,今后试验还需测试不添加和较低浓度的吐温-80对偏肿栓菌产MnP的影响。
7) 有研究表明: Mg2+对MnP的生产有促进作用(Gill et al., 2003)。本研究结果表明:对Mg2+浓度的少量上下调整对偏肿栓菌产MnP的影响不显著,也不呈规律性变化,Mg2+浓度不宜过高,这与张连慧等(2005)的研究一致。
8) 在液体摇瓶培养过程中,溶氧量既与装液量的多少有关也与摇瓶转速有关,装液量多,营养物质丰富,但相对溶氧量下降。本试验目的是探索营养物质含量与溶氧量之间的关系和最佳组合。在150 r·min-1同样的摇床转速下,产酶结果是装液量越高酶活性越高,推测原因是营养物质相对丰富,又有足够的溶氧量。装液量110 mL的摇瓶培养在15天达到产酶最高为318.7 U·L-1,由于溶氧量充足,比静止培养提早4天达到产酶高峰。今后试验还需继续测试在150 r·min-1转速下再增加装液量是否还能提高酶活,以及试验一下在110 mL装液量时改变摇床转速能否进一步提高MnP的产量。
总之,通过优化培养条件可以提高偏肿栓菌MnP的产酶量。
崔艳红, 张海棠, 孟庆辉, 等. 2008. 白腐真菌产木质素降解酶的条件及酶学性质的研究[J]. 吉林农业科学, 33(2): 43-47. |
高尚, 张晶, 黄民生. 2007. 黄孢原毛平革菌摇瓶体系产锰过氧化物酶优化研究[J]. 上海化工, 32(9): 17-19. |
官敏. 2006. 好食脉抱菌(N.sitophila)产锰过氧化物酶培养条件的优化、酶的纯化以及酶学性质的分析[J]. 暨南大学硕士学位论文. |
浦跃武, 甄浩铭, 冯书庭, 等. 1998. 白腐菌产锰过氧化物酶条件的研究[J]. 菌物系统, 17(3): 251-255. |
吴会广, 蔡宇杰, 苑博华, 等. 2008. 锰过氧化物酶产生菌的发酵优化及酶学性质研究[J]. 食品与机械, 24(4): 17-21. |
杨晓宽, 路福平, 杜连祥. 2004. 黄孢原毛平革菌产锰过氧化物酶培养基优化[J]. 天津科技大学学报, 19(2): 29-32. |
张连慧, 刘卫晓, 葛克山, 等. 2005. 变色栓菌产锰过氧化物酶的条件优化[J]. 微生物学通报, 32(5): 98-102. |
Gill P K, Arora D S. 2003. Effect of culture conditions on manganese peroxidase production and activity by some white rot fungi[J]. J Ind Microbiol Biotechno1, 30(1): 28-33. DOI:10.1007/s10295-002-0002-4 |
Kirk T K, Schultz E, Connors W J, et al. 1978. Influence of culture parameters on lignin melabolism by Phanerochaete chrysosporium[J]. Arch Microbial, 117(3): 277-285. DOI:10.1007/BF00738547 |
Maximo C, Maria T, Amorim P, et al. 2003. Biotransformation of industrial reactive azo dyes by Geotrichum sp.CCMI 1019[J]. Enzyme and Microbial Technology, 32(1): 145-151. DOI:10.1016/S0141-0229(02)00281-8 |
Nuske J, Scheibner K, Hofrichter M, et al. 2002. Large scale production of manganese-peroxidase using agaric white-rot fungi[J]. Enzyme and Microbial Technology, 30(4): 556-561. DOI:10.1016/S0141-0229(02)00013-3 |
Scheel T, Höfer M, Ludwig S, et al. 2000. Differential expression of manganese peroxidase and laccase in white-rot fungi in the presence of manganese or aromatic compounds[J]. Appl Microbiol Biotechno1, 54(5): 686-691. DOI:10.1007/s002530000427 |
Steffen K T, Hofrichter M, Hatakka A. 2002. Purification and characterization of manganese peroxidase from the litter-decomposing basidiomycetes Agrocybe praecox and stropharia coronilla[J]. Enzyme and Microbial Technology, 30(4): 550-555. DOI:10.1016/S0141-0229(01)00525-7 |
 2011, Vol. 47
2011, Vol. 47