文章信息
- 曹兵, 宋培建, 康建宏, 侯晶东, 宋丽华
- Cao Bing, Song Peijian, Kang Jianhong, Hou Jingdong, Song Lihua
- 大气CO2浓度倍增对宁夏枸杞生长的影响
- Effect of Elevated CO2 Concentration on Growth in Lycium barbarum
- 林业科学, 2011, 47(7): 193-198.
- Scientia Silvae Sinicae, 2011, 47(7): 193-198.
-
文章历史
- 收稿日期:2010-06-02
- 修回日期:2010-05-02
-
作者相关文章
以大气CO2浓度和温度升高为主要特征的全球气候变化对农业生态系统、森林生态系统产生显著的影响。自20世纪90年代以来,气候变化,特别是大气CO2浓度升高对植物的生理影响及植物的响应已成为一个重要的生理生态学研究热点问题(张晶晶等,2006; 邓可洪等,2006; 贾夏等,2005; Jach et al., 2004; Lewis et al., 2004),有诸多关于CO2浓度升高对植物光合作用、生长,土壤C、N过程等方面的工作(贾夏等,2005; Jach et al., 2004; Lewis et al., 2004; Graaff et al., 2004; Brucea et al., 1999; Stephen et al., 2004)。气候变化对植物产量的影响因植物种类、品种、土壤条件、其他环境因子以及植物适应能力的不同而存在差异,而CO2浓度升高产生的正效应只有在光照、水分、营养状况等条件满足时才能体现(白莉萍等,2003; Morison et al. 1999),CO2浓度升高对诸如干物质量、产量等方面影响尚有待更多试验与研究(Taub et al., 2008; Reid et al., 2008)。宁夏枸杞(Lycium barbarum)是我国重要的特种经济植物资源,为宁夏的特色经济林树种,枸杞产业是宁夏农业优势特色产业的重要组成部分。本研究通过测定倍增大气CO2浓度下宁夏枸杞植株的生长指标与果实有效成分枸杞多糖、胡萝卜素、牛磺酸等的含量,探讨宁夏枸杞对大气CO2浓度升高的响应与适应机制,为宁夏枸杞栽培与良种选育提供参考; 对揭示全球气候变化条件下,木本植物果实有效成分的变化规律具有一定的指导意义。
1 材料与方法 1.1 试验材料宁夏枸杞的优良品种宁杞1号1年生扦插苗。
1.2 试验设计本试验为单因素试验,大气CO2浓度设置2个水平:自然环境大气CO2浓度(对照,CK) ≈(350±20) μmol·mol-1; 倍增的大气CO2浓度(处理,TR) ≈(700±20) μmol·mol-1。采用开顶气室法进行CO2浓度控制。每处理重复3次(共6个气室)。
1.3 开顶式气室与环境控制开顶式气室(open top chamber)由金属框架和厚度为0.38 cm的无色透明玻璃制成,气室总高2.5 m,底部为边长1.10 m的正八边形(内径3 m),上部0.5 m向内倾斜呈45°,即顶部开口直径为2 m; 在顶部装有风扇,气室侧面留有通风口,以确保气室内的温湿、CO2环境均匀。开发了一种基于射频通讯模块nRF2401的CO2浓度自动控制系统,通过气源(CO2钢瓶)、CO2传感器、控制器、PC机的协调工作,实现CO2浓度自动控制。
1.4 植株布置与管理试验于2009年4月下旬至10月上旬在宁夏大学实验农场进行。每个气室均匀种植9株枸杞移植苗(普通农田土壤,共54株),与大田相同的常规肥水管理。自5月上旬开始,每天8:00—20:00向倍增CO2浓度的气室通气,控制CO2浓度在要求的范围内。
1.5 测定指标与方法形态指标:每10天测量1次各植株的株高、地径、新梢长度与粗度(直径) (每个气室里选择4株生长一致的植株,在每株随机选择2个新梢,挂牌标记)。详细记录各处理下植株的物候期。
果实有效成分:在结果植株上采集夏果、秋果,测定果实枸杞多糖、β-胡萝卜素、牛磺酸、甜菜碱等有效成分的含量(王振宇,2003; 杨涓等,2005; 许兴等,2005)。
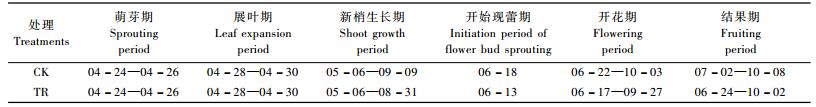
2 结果与分析 2.1 大气CO2浓度倍增对枸杞生长的影响由表 1可知:在大气CO2浓度升高的持续处理下,枸杞苗木的新梢生长期略有缩短,但开花、现蕾与果实成熟期均提前,延长枸杞的生长期,有利于枸杞的生长与发育。由图 1可知:大气CO2浓度升高,枸杞植株新梢加粗生长略高于对照; 特别是在6—7月间,加粗生长的速度比对照快,增加幅度较为明显; 同样,在速生期(5月下旬至7月下旬)新梢加长生长的增幅明高于对照,之后生长速度减缓,与对照相近,到试验结束时两者的新梢长度基本一致(图 2)。在试验期间,CO2浓度升高处理与对照的新梢加粗生长、加长生长的净生长量没有显著差异(图 3,P=0.906 6<0.05,P=0.762 8<0.05)。
|
|

|
图 1 枸杞植株新梢粗度生长比较 Figure 1 The comparison of shoot diameter in L.barbarum under ambient or elevated CO2 concentration |

|
图 2 枸杞植株新梢加长生长比较 Figure 2 The comparison of shoot length in L.barbarum under ambient or elevated CO2 concentration |
|
图 3 CO2倍增对枸杞新梢粗度、长度净生长量的影响 Figure 3 The effedct of elevated CO2 concentration on net growth of shot diameter and length in L.barbarum |
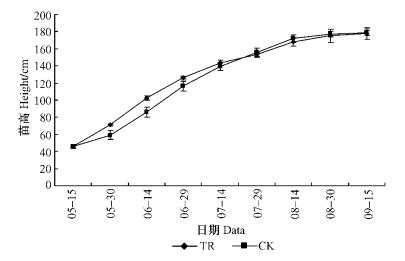
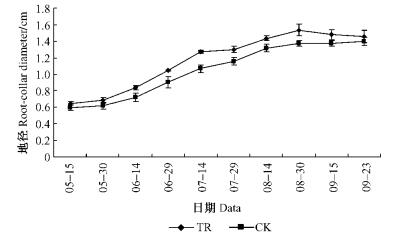
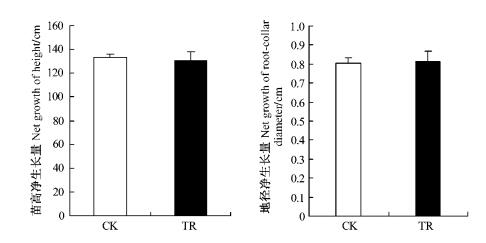
在整个生长季节内,CO2浓度升高处理下的苗高生长与对照差异不大,植株地径生长均高于对照(图 4,5,6),在7月中旬以前,株高生长速率高于对照; 在速生期6—8月间,地径生长高于对照。但试验结束时,处理与对照的苗高与地径生长量接近。进一步对其净生长量进行方差分析表明:CO2浓度升高处理与对照间的苗高、地径净生长量差异不显著(P=0.953>0.05,P=0.903 4>0.05)。
|
图 4 枸杞植株高生长比较 Figure 4 The comparison of plant height in L.barbarum under ambient or elevated CO2 concentration |
|
图 5 枸杞植株地径生长比较 Figure 5 The comparison of root-collar diameter in L.barbarum under ambient or elevated CO2 concentration |
|
图 6 CO2倍增对枸杞苗高、地径净增长量的影响 Figure 6 The effect of elevated CO2 concentration on net growth seedling height and root-collar diameter in L.barbarum |
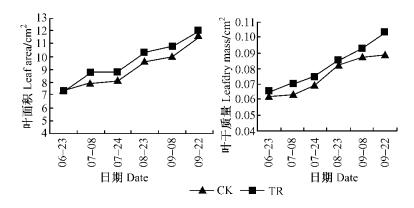
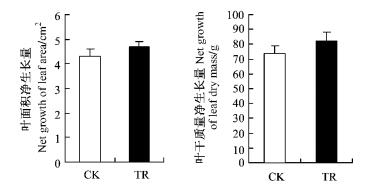
由图 7,8可知:CO2浓度升高,枸杞单叶面积和叶干质量在整个生育期内的生长速度较对照高,在试验期间,处理的单叶面积净增量较对照高6.51%,单叶干质量的净增量较对照高11.90%,但两者的差异不显著(P=0.565 6>0.05,P=0.160 7>0.05)。
|
图 7 CO2浓度倍增对枸杞单叶面积及干质量的影响 Figure 7 Effects of elevated CO2 concentration on leaf area and leaf dry mass in L.barbarum seedling |
|
图 8 CO2浓度倍增对枸杞单叶面积、干质量净生长量的影响 Figure 8 Effects of elevated CO2 concentration on net growth of leaf area and leaf dry mass in L.barbarum seedling |
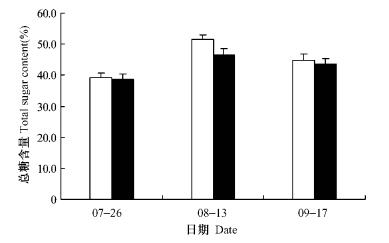
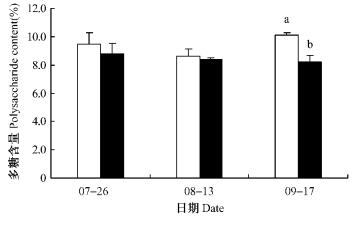
枸杞果实具有增强免疫、降血脂、抗脂肪肝、抗肿瘤、抗衰老、抗应激等多种生理功效,这与其含有枸杞多糖、游离氨基酸、牛磺酸、甜菜碱、维生素、类胡萝卜素、矿物质元素等有关。枸杞多糖、总糖、牛磺酸、黄酮、类胡萝卜素等均是枸杞果实的主要生理活性成分,其含量的高低影响到枸杞果实的品质和生理功效。测定结果表明:倍增大气CO2浓度处理下,枸杞果实多糖与总糖含量略有下降,其中秋季采收的果实降幅较大趋势(图 9,10)。对7,8,9月不同时期采集的枸杞果实多糖、总糖含量分别进行方差分析,9月份采摘的秋果的多糖含量在2种大气CO2浓度处理下差异显著(P=0.043 8<0.05),其他时期采摘果实的多糖、总糖含量在处理与对照间的差异均不显著(P=0.839 7>0.05,P=0.244 2>0.05,P=0.858 5>0.05)。
|
图 9 枸杞果实总糖含量 Figure 9 Total sugar content in L.barbarum fruit under ambient or elevated CO2 concentration  |
|
图 10 枸杞果实多糖含量 Figure 10 Polysaccharide content in L.barbarum fruit under ambient or elevated CO2 concentration |
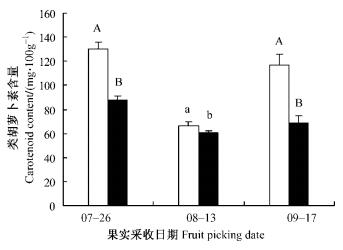
由图 11~13可知:大气CO2浓度升高处理下,不同时期采集枸杞果实的牛磺酸、黄酮、类胡萝卜素的含量比对照均有所降低。其中牛磺酸含量平均比对照降低4.7%,特别是夏季头茬果牛磺酸含量降低幅度为8.52%,但不同处理间的差异不显著(P=0.148 5>0.05,P=0.964 4>0.05,P=0.489 0>0.05);而黄酮含量和类胡萝卜素含量的平均降幅分别达22.1%和30.8%。处理与对照间7,9月采集果实的黄酮、类胡萝卜素含量间差异均极显著(P=0.000 1<0.01,P=0.005 6<0.01; P=0.000 1<0.01,P=0.006 6<0.01)。从一个生长季的试验结果来看:大气CO2浓度倍增,黄酮、类胡萝卜素活性成分含量降低,对枸杞果实品质有一定影响。

|
图 11 枸杞果实牛磺酸含量比较 Figure 11 The comparison of taurine content in L.barbarum fruit under ambient or elevated CO2 concentration |

|
图 12 枸杞果实黄酮糖含量 Figure 12 The comparison of flavonoids content in L.barbarum fruit under ambient or elevated CO2 concentration 图中标有不同大写字母者表示差异显著(P<0.01),下同。 The different capital letters mean significant different at 0.01 level.The same below. |
|
图 13 不同处理下枸杞果实类胡萝卜素含量比较 Figure 13 Comparison of carotenoid content in L.barbarum fruit under ambient or elevated CO2 concentration |
气候变化的显著特征是CO2浓度和温度升高,研究其对植物生长发育的影响及其生理响应极为重要,目前已经有许多这方面的研究报道(Daniel et al., 2008; 白莉萍等,2003; Jach et al., 2000; Reddy et al., 2010)。升高的CO2浓度和温度通过对植物光合作用和其他生理代谢的作用而影响到植物生长和生产力,但这种影响的大小、正负取决于树种、环境等多因素。大气CO2浓度升高,植物光合作用的底物供应增加,会加快光合作用进行,从而促进植物的生长; 但这些作用与物种、生长发育时期、土壤肥力和年份等因素有关(Naumburg et al., 2001; Takeuchi et al., 2001; Morison et al., 1999; 白莉萍等,2003)。本试验在开顶气室内采用倍增CO2浓度处理枸杞苗木4个月,测定结果表明:大气CO2浓度升高,速生期植株地径生长和新梢加粗生长速率加快,生长量没有显著差异; 对株高生长和新梢加长生长的影响,则呈前期促进、后期缓慢降低的趋势,但差异不显著; 枸杞单叶面积、单叶干质量有增加的趋势。总体来讲,大气CO2浓度倍增,对枸杞苗木新梢、植株高于地径生长的影响不显著。多数研究认为:短期内CO2浓度升高,促进植物叶较早并迅速发育,叶面积增大植物净光合速率增大,植物生长加快(张雪海,2009)。蒋跃林等(2006)发现在CO2浓度增加时促进了大豆(Glycine max)根系生长,根体积、主根长、根鲜质量和根冠比; 林伟宏等(1998)对水稻(Oryza sativa)的研究表明:CO2浓度倍增在生长前期对地上和地下生物量均有显著促进作用,生长后期对根系的生长促进较大; 刘娟娟(2009)研究表明:大气CO2浓度升高,油松(Pinus tabulaeformis)、侧柏(Platycladus orientalis)、刺槐(Robinia pseudoacaia)、元宝枫(Acer truncatum)、丁香(Syringa sp.)、大叶黄杨(Euonymus japonicus)和白蜡(Fraxinus americana)等7个树种的苗高、地径、叶面积、生物量(叶片、枝条和根)、根茎比、光合速率、胞间CO2浓度等均增加,对地径的影响大于苗高。然而,也有些植物是在生长前、中期加速生长,后期出现缓慢生长或停止生长(严雪等,2003),生长速率明显降低。本试验中的枸杞苗木生长就表现出这样特点,其原因可能与叶绿体中出现过量的淀粉积累、影响其正常光合功能及出现合成代谢的不平衡有关(李军营,2006),也可能是后期光合产物向地下大量运输引起地上生长缓慢(严雪等,2003); 但高CO2浓度的正生长响应是否将通过生活史得以维持还需进一步研究。
CO2浓度升高,许多植物开花提早、花多、脱落少、雌花较多、植物体衰老加快、生活周期缩短,加速了果实的成熟和着色过程(Hamld et al., 2003); 在高浓度CO2处理下,枸杞植株的生殖物候(开花结实时间)略有提前,但果实中黄酮、类胡萝卜素等活性成分含量比对照明显降低,这说明大气CO2浓度升高影响了枸杞果实生理生化代谢。韩文军等(2003)研究表明:长期高体积分数CO2处理使闽楠(Phoebe bournei)叶片单位鲜质量可溶性糖含量、单位鲜质量可溶性蛋白含量、植物生物量都有所降低; CO2浓度增加使玉米(Zea mays)、小麦(Triticum saestivum)、水稻等作物籽粒的蛋白质含量下降,这与高CO2浓度处理下植株的N缺乏有关(Thomas et al., 1994; Cao et al., 2007)。滕年军等(2006)研究认为:随着植物相对生长速率加快,植株达到有性生殖所需形体大小的时间变短,开花期提前,生殖器官的生物量也相应提高,其主要表现为开花数量、花粉和花蜜产量、果实数量与大小、种子大小与产量等均有不同程度的增加。宁夏枸杞由于果实富含枸杞多糖、牛磺酸、类胡萝卜素、多种维生素与氨基酸等而具有独特的生理功效。若气候变化降低其果实中某些活性成分含量,势必影响枸杞果实的品质与生理功能。本试验是一个生长季节的测定结果,持续大气CO2浓度倍增处理对枸杞生长,特别是果实活性成分含量的影响还需进一步试验与研究。
白莉萍, 林而达. 2003. CO2浓度升高与气候变化对农业的影响研究进展[J]. 中国生态农学报, 11(2): 132-134. |
邓可洪, 居辉, 熊伟, 等. 2006. 气候变化对中国农业的影响研究进展[J]. 中国农学通报, 22(5): 439-441. |
董桂春, 王余龙, 黄建晔, 等. 2004. 稻米品质性状对开放式空气二氧化碳浓度增高的响应[J]. 应用生态学报, 15(7): 1217-1222. |
韩文军, 廖飞勇, 何平. 2003. 大气二氧化碳浓度倍增对闽楠光合性状的影响[J]. 中南林学院学报, 23(2): 62-65. |
贾夏, 韩士杰, 周玉梅, 等. 2005. 不同二氧化碳浓度条件下红松和长白赤松幼苗根际土壤微生物数量[J]. 应用生态学报, 16(7): 1295-1298. |
蒋跃林, 张庆国, 张仕定, 等. 2006. 大豆根系生理特性对大气二氧化碳浓度升高的反应[J]. 作物杂志, (2): 40-43. |
李军营. 2006. 二氧化碳浓度升高对水稻幼苗叶片生长、蔗糖转运和籽粒灌浆的影响及其机制[J]. 南京农业大学博士学位论文: 19-25. |
刘娟娟. 2009. CO2浓度升高与干旱胁迫对苗木水分运输安全的影响[J]. 北京林业大学博士学位论文: 144-154. |
林伟宏, 王大力. 1998. 大气二氧化碳升高对水稻生长及同化物分配的影响闭[J]. 科学通报, 43(21): 2299-2302. DOI:10.3321/j.issn:0023-074X.1998.21.013 |
滕年军, 陈彤, 林金星. 2006. 植物有性生殖对大气浓度变化响应的研究进展[J]. 植物生态学报, 30(6): 1054-1063. |
王振宇. 2003. 不同地域宁夏枸杞活性成分的研究[J]. 植物研究, 23(3): 337-339. |
许兴, 郑国琦, 杨娟, 等. 2005. 宁夏不同地域枸杞多糖和总糖含量与土壤环境因子关系的研究[J]. 西北植物学报, 25(7): 1340-1344. |
杨涓, 魏智清, 庞伟. 2005. 分光光度法测定宁夏枸杞中牛磺酸含量[J]. 农业科学研究, 26(2): 28-30. |
严雪, 于丹, 李永科. 2003. CO2浓度升高对沉水克隆植物生长速率及营养元素积累的影响[J]. 植物生态学报, 27(4): 435-440. DOI:10.17521/cjpe.2003.0062 |
张晶晶, 陈爽, 赵昕奕. 2006. 近50年中国气温变化的区域差异及其与全球气候变化的联系[J]. 干旱区资源与环境, 20(4): 1-6. |
张雪海. 2009. CO2浓度增加与干旱胁迫对植物水分生理生态的影响[J]. 北京林业大学博士学位论文: 2-4. |
Brucea H, Dijkstra P, Johnson D, et al. 1999. Elevated CO2 increases nitrogen fixation and decreases soil nitrogen mineralization in Florida scrub oak[J]. Global Change Biology, 5(7): 781-789. DOI:10.1046/j.1365-2486.1999.00275.x |
Cao B, Zhang S R, Dang Q L. 2007. Relationship between photosynthesis and leaf nitrogen concentration in ambient and elevated [CO2] in white birch seedlings[J]. Tree Physiology, 27(6): 891-899. DOI:10.1093/treephys/27.6.891 |
Graaff M A D E, Six J, Harris D. 2004. Decomposition of soil and plant carbon from pasture systems after 9 years of exposure to elevated CO2:impact on C cycling and modeling[J]. Global Change Biology, 10(11): 1922-1935. DOI:10.1111/gcb.2004.10.issue-11 |
Hamld A, Haque M M, Khanam M, et al. 2003. Photosynthesis, growth and Productivity of trice under elevated CO2[J]. Indian Journal of Plant Physiology, 8(3): 253-258. |
Jach M E, Ceulemans R. 2000. Effects of season, needle age and elevated CO2 on photosynthesis in Scots pine (Pinus sylvestris)[J]. Tree Physiology, 20(3): 145-157. DOI:10.1093/treephys/20.3.145 |
Lewis J D, Lucash M, Olszyk D M, et al. 2004. Relationships between needle nitrogen concentration and photosynthetic responses of Douglas-fir seedlings to elevated CO2 and temperature[J]. New Phytologist, 162(2): 355-364. DOI:10.1111/nph.2004.162.issue-2 |
Morison J I L, Lawlor D W. 1999. Interactions between increasing CO2 concentration and temperature on plant growth[J]. Plant Cell Environment, 22(6): 659-682. DOI:10.1046/j.1365-3040.1999.00443.x |
Naumburg E, Ellsworth D S, Pearcy R W. 2001. Crown carbon gain and elevated CO2 responses of under story saplings with differing allometry and architecture[J]. Functional Ecology, 15(2): 263-273. DOI:10.1046/j.1365-2435.2001.00518.x |
Reddy A R, Rasineni G K, Raghavendra A S. 2010. The impact of global elevated CO2 concentration on photosynthesis and plant productivity[J]. Current Science, 99(1): 46-57. |
Reid C D, Fiscus E L. 2008. Ozone and density affect the response of biomass and seed yield to elevated CO2 in rice[J]. Global Change Biology, 14(1): 60-76. |
Stephen P L, Ainsworth E A, Alistair R, et al. 2004. Rising atmospheric carbon dioxide:plants FACE the future[J]. Annu Rev Plant Biology, 55(1): 591-628. DOI:10.1146/annurev.arplant.55.031903.141610 |
Takeuchi Y, Kubiske M E, Isebrands J G, et al. 2001. Photosynthesis, light and nitrogen relationships in a young deciduous forest canopy under open-air CO2 enrichment[J]. Plant Cell Environment, 24(12): 1257-1268. DOI:10.1046/j.0016-8025.2001.00787.x |
Taub D R, Miller B, Allen H. 2008. Effects of elevated CO2 on the protein concentration of food crops:a meta-analysis[J]. Global Change Biology, 14(3): 565-575. DOI:10.1111/gcb.2008.14.issue-3 |
Thomas R B, Lewis J D, Strain B R. 1994. Effects of leaf nutrient status on photosynthetic capacity in loblolly pine (Pinus taeda L[J]. ) seedlings grown in elevated atmospheric CO2.Tree physiology, 14(7): 947-960. |
 2011, Vol. 47
2011, Vol. 47