文章信息
- 魏志刚, 钱婷婷, 张凯旋, 刘关君, 刘桂丰, 杨传平
- Wei Zhigang, Qian Tingting, Zhang Kaixuan, Liu Guanjun, Liu Guifeng, Yang Chuanping
- 外源GA3对白桦成花基因影响的定量PCR分析
- Effect of Exogenous GA3 on Flowering Genes Expression of Betula platyphylla by Real-Time Fluorescent Quantitative PCR
- 林业科学, 2011, 47(7): 187-192.
- Scientia Silvae Sinicae, 2011, 47(7): 187-192.
-
文章历史
- 收稿日期:2010-10-09
- 修回日期:2011-03-26
-
作者相关文章
植物开花是高等植物由营养生长向生殖生长转变的重要生理过程,是个体发育和后代繁衍的中心环节。赤霉素是调节植物生长发育的五大激素之一(Takahashi et al., 1991),赤霉素处理也是人工调控植物成花的最有效途径之一,因而成为近年来成花机制研究领域的一个热点。虽然对模式植物拟南芥(Arabidopsis thaliana)成花相关基因调控机制的研究已经比较成熟,但对高等植物成花研究多集中在生理生化水平。因此,运用分子生物学手段,从基因水平研究外源赤霉素对木本植物白桦(Betula platyphylla)成花的影响具有重要意义。
Langridge(1957)发现用赤霉素(GA)处理拟南芥可促进其提前开花。Luckwill(1970)首次提出了植物体内激素的某种平衡调控成花的假说,认为GA / CTK或CTK / GA的平衡影响花芽分化,苹果(Malus pumila)短枝上花芽的形成取决于来自短枝叶片的促花因子(CTK)和来自种子的抑花因子(GA)。该假说得到了其他学者的证实(Koshita et al., 1999; 曹尚银等,2000; 2001; 苏明华等,1998)。随后的研究表明,赤霉素对花芽分化的影响随植物种类而异,1983年Zeevuart发现赤霉素作用可替代春化作用促进开花。研究表明,外施GA3后,花发育期茎尖中对成花起促进作用的赤霉素含量迅速升高,同时一些响应赤霉素的基因及成花关键基因的表达量也随着增加(King et al., 2003; Eriksson et al., 2006; Gocal et al., 1999; 2001)。然而木本果树在成花诱导期喷施GA3显著抑制花芽分化(McArthey et al., 1998; 周学伍等,1981)。赤霉素影响植物成花机制的研究虽较深入,但大多集中在一些模式植物及草本植物上,在木本植物上的研究还多采用外施赤霉素及对整体器官内源激素水平进行检测的方法,这虽然为了解其功能积累了大量的基础资料,但未能阐述其机制。
白桦具有良好的经济价值和生态效益,国家已将白桦列为东北及内蒙古四省区天然林保护工程的重要造林树种。其分布面积广,蓄积量大。作为一种次生林演替的优势速生用材树种,研究其生殖特性,对于发展和利用白桦种群具有重要意义(陈之端,1994; 孙冰等,1994)。天然状态下白桦开花结实需17~20年,常规的育种手段不可能在较短时期培育出材质好、生长快的优良白桦种质。因此,如何缩短白桦的育种周期和加快良种化进程是我国林木遗传改良工作者急待解决的难题。成花是植物有性生殖的重要阶段,因此研究白桦开花时间的调控机制及探索开花时间的决定因素具有重要意义。
实时荧光定量PCR是在PCR定性基础上发展起来的核酸定量技术,具有灵敏度高、特异性和可靠性更强、能实现多重反应、自动化程度高、无污染性、实时性和准确性等特点。目前该技术在生物医学领域有着广泛的应用,近年来也被逐渐运用于农作物的转基因检测和基因差异表达的研究(杨帆等,2010),如玉米(Zea mays)中的水分胁迫诱导基因(张中保等,2007)的表达,转基因玉米的检测(陈颖等,2004)。本试验运用实时荧光定量PCR技术SYBR Green Ⅰ法,通过研究成花诱导期外源GA3处理对白桦成花相关基因表达量的影响,进而为从分子水平揭示外源GA3影响成花的机制和人工调控白桦成花时间奠定基础。
1 材料与方法 1.1 材料的处理与采集试验于2009年5—7月在东北林业大学林木遗传育种实验基地进行。为排除花器官生长分化对开花诱导基因表达的影响,采用3年即可开花的2年生强化育种白桦植株,分4区组,A组喷洒清水,其余3组用不同浓度等体积赤霉素(GA3)溶液进行叶面喷洒处理:50 mg·L-1 (B组),100 mg·L-1 (C组),200 mg·L-1 (D组)。从5月7号到7月6号每隔10天处理1次并采样,顺序为先采样后处理,因此5月7号样品均为未处理状态下样品。样品用液氮保存带回实验室,用于RNA的提取。
1.2 引物设计进一步筛选白桦花期调控基因,东北林业大学林木育种实验室构建了白桦花期时序消减文库,确定了一些有价值的EST序列。从中选择LFY,GI,ELF3,LD及FLC基因作为目标基因进行分析。根据已知EST序列合成引物。以编码18S rRNA的基因作为内参基因。采用PRIMER 5.0软件进行引物设计,引物由上海生工提供(表 1)。
|
|
1) RNA提取采用CTAB法(王玉成等,2001)提取样品总RNA。通过紫外分光光度计(Eppendort)和0.8%琼脂糖凝胶电泳对总RNA进行浓度和纯度测定。
2) cDNA合成使用Takara公司的Primescript RT reagent Kit,以2μg总RNA为材料反转录获得dsDNA。将其稀释10倍作为模板待用。
3) 荧光定量PCR分析实时定量PCR反应的试剂盒为SYBR Green Realtime PCR Mastermix (Toyobo Co.,Ltd,Osaka,Japan)。PCR反应体系:L2×SYBR premix Ex Taq 6 μL,上、下游引物(10 μmol·L-1)各0.3 μL,cDNA模板1 μL,加去离子水补足12 μL。试验设置3次重复。使用实时数据采集模式,反应在OPTIONⅡ荧光定量PCR仪上完成。循环反应参数为:94℃预变性30 s; 94℃变性12 s,退火45 s (各基因温度不同),72℃延伸45 s,45次循环,55~99℃,每0.5℃读板1次。以76℃和85℃读板数据绘制溶解曲线。利用Opticon Monitor2软件保存和分析。
4) 基因表达差异的分析以不同处理的cDNA模板混合样进行梯度稀释,对于每一个稀释样本,用目标基因和内参基因的引物进行扩增。计算出它们的平均CT值以及ΔCT值,通过cDNA浓度梯度的lg值对ΔCT值作图,如果所得直线斜率接近于0,说明反应优化较好,目标基因和内参基因的扩增效率相同,可以通过比较CT值的方法进行相对定量,分析基因表达的差异。优化好反应条件后,将参照样本(5月7号样品)基因表达设为1,其余各样品基因表达量的倍数可用2ΔΔCT来表示,其中ΔΔCT = ΔCT (参照)-ΔCT (处理),ΔCT = CT (目标基因)-CT (内参基因) (Livak et al., 2001)。
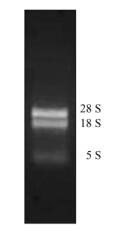
2 结果与分析 2.1 提取的总RNA检测情况由图 1可见:CTAB法提取的总RNA清晰地显出2条主带,28S rRNA和18S rRNA亮度比约为2:1,表明RNA完整性较好。经过紫外分光光度计测定,各样品总RNA的OD260/OD280均在1.9~2.1之间,纯度较高,能满足反转录要求。
|
图 1 RNA电泳 Figure 1 RNA eletrophoregram |
采用3孔平行试验,且每板均设置内参,得出3个CT值并进行方差分析,标准偏差均小于0.4 (表 2),说明试验建立的定量PCR反应具有较强的准确性和可重复性。根据1.3的试验方法进行扩增效率分析,所得斜率都接近0,说明本试验反应优化较好,内存与目标基因扩增效率相同,可以进行相对定量分析。
|
|
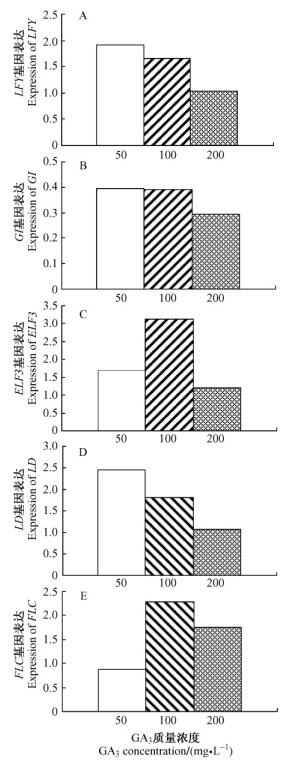
1) LFY基因的表达由图 2A CK组可以看出LFY基因表达量在5月下旬明显升高,在5月27号出现峰值,之后表达量维持在较低水平。受东北气候的影响,哈尔滨春天来得比较晚,在5月初气温才明显转暖,白桦抽出新芽,因此5月下旬是营养生长向生殖生长转变的关键时期。但在这一时期,处理组LFY基因的表达量较对照组明显偏低,说明GA3抑制了这一时期LFY基因的表达。由图 3A看出:在成花转变的关键时期(5月下旬),随着GA3浓度的增加,LFY基因的表达量降低,说明这一时期,在一定的GA3浓度范围内,外源GA3浓度越高,LFY基因的表达量越低。

|
图 2 不同浓度GA3处理下LFY,GI,ELF3,LD,FLC基因相对表达差异 Figure 2 Relative expression of LFY, GI, ELF3, LD and FLC under different concentrations of GA3 |
|
图 3 5月27日各处理组基因的表达情况 Figure 3 Expression of genes in different control group on May 27 |
2) GI和ELF3基因的表达GI和ELF3都是光周期途径中的上游基因,从图 2B,C和图 3B,C中可以看出它们的表达情况和LFY相似,CK组仍在5月下旬(即营养生长向生殖生长转变的关键时期)出现峰值,其后表达维持在相对低的水平。同样在这一时期,GA3处理的植株GI和ELF3的表达量都相对较低。将这一时期处理组的情况单独来看,200 mg·L-1的GA3处理对这2个基因的抑制作用最明显。与LFY不同的是,GI和ELF3的处理组表达量并不是随GA3浓度增大而增加,50 mg·L-1比100 mg·L-1的抑制作用更强些。抑制效果虽不同,但在白桦成花转变的关键时期,GA3对光周期上游基因GI与ELF3也起抑制作用。
3) LD基因的表达LD基因是植物开花途径中自主途径的一个重要基因,它负控FLC的表达,进而有利于解除FLC对成花转变的抑制作用,促进开花。对LD定量研究显示(图 2D),5月下旬正是LD大量表达以促进成花的关键时期。在6月初以后这一基因的表达明显降低。图 3D显示:GA3处理的3个区组与上述结果类似,在5月下旬表达量都受到了抑制。这一时期处理组LD表达情况如图所示,与LFY结果相似,GA3浓度越高,LD基因的表达量越低。
4) FLC基因的表达在植物开花调控网络中,开花抑制基因FLC处于枢纽地位。FLC的表达受许多来自环境和生长发育信号的调控,其中包括自主途径和春化作用。春化作用通过抑制FLC,来解除FLC对开花的抑制作用。图 2 E中可以看出:5月FLC已经处于并持续处于较低水平,这与前期的春化作用密不可分; 但是图 3E对照组与处理组之间FLC的表达量并没有明显差别,因此成花转变期,外源喷洒GA3对FLC并无太大影响。各处理组成花转变期FLC的表达量虽有差异,但差异并不显著。
3 结论与讨论不同物种在特定时期外施GA3对成花的影响不同。一些非成花诱导条件下的长日照草本植物,花诱导期喷施GA3能代替长日照促进植物开花(Metzger et al., 1987),侯雷平等(2009)研究表明赤霉素促进白菜(Brassica pekinensis)的开花。赤霉素对花芽分化和开花的影响在果树中的报道却相反,周学伍等(1981)报道,外源赤霉素可有效抑制甜橙(Citrus sinensis)花芽的形成,且GA3浓度的差异对花芽的抑制效应有影响。Prang等(1997)用放射免疫测定表明,在花芽孕育期间正在发育的‘明星’、‘金冠’和‘乔纳金’苹果(Malus pumila)种子大量输出GA3抑制花芽孕育。王庆成等(2001)报道,外源GA3可有效地抑制小黑杨(Populus×xiaohei)雌株的花芽分化过程。本试验发现一定浓度范围GA3对白桦成花有抑制作用,这与前人研究中,多数情况下外源GA3抑制木本植物开花,促进草本植物开花相符。
高等植物的开花过程受自身遗传因子和外界环境因素两方面决定,是开花基因在时间和空间上顺序表达的结果。植物开花分别由4个途径的多种基因复杂控制。LFY是赤霉素途径中的关键基因,赤霉素途径通过GAMYB激活LFY基因的表达已普遍接受。研究发现,LFY基因表达量的改变相应地影响顶端成花转变的能力(Blazquez et al., 1997)。ELF3与GI是光周期调节的关键基因。ELF3属于昼夜节律类基因。这类基因位于光周期途径的上游(Doyle et al., 2002; Hazen et al., 2005; Imaizumi et al., 2003),它们感受昼夜变化而引起自身表达量的变化,最终在叶中激活CO基因的表达(Ayre et al., 2004),GI基因在昼夜节律类基因和下游基因CO之间起到了桥梁的作用。GI感受昼夜节律基因的变化,并把信号传递给CO (Doyle et al., 2002)。CO表达量超过一定值时有利于开花。LD是自主途径中的关键基因之一,LD对FLC起负控作用,与春化作用途径一样,通过抑制FLC进而来促进开花。在开花调控网络中,MADS-box类的转录因子FLC处于枢纽地位。FLC是开花的负调控因子,是植物开花调控的关键基因。自主途径、春化作用途径中有许多控制开花的基因,其功能都是通过调节FLC的表达来实现的。本研究中显示,CK组在5月下旬即成花诱导时期,LFY,ELF3,GI,LD基因的表达量都明显增加,其表达模式与前人研究相符。而GA3处理后这些基因的表达量明显降低,表明外源GA3抑制了促开花相关基因的表达。CK组与处理组FLC表达量从5月初开始就持续较低,与春化作用结果相符。但是各组的表达量差别并不明显,且FLC受众多因素共同调节,因此GA3处理对其影响的具体机制还有待进一步研究。
综上所述,5月下旬为白桦营养生长向生殖生长转变的关键时期,外源GA3对白桦开花起抑制作用。这种抑制作用不是作用于单独某个开花途径,而是对多个开花途径的一些关键基因表达都有影响而共同抑制成花转变,但是这其中的具体作用原理还有待进一步研究。
陈颖, 徐宝梁, 苏宁, 等. 2004. 实时荧光定量PCR技术在转基因玉米检测中的应用研究[J]. 作物学报, 30(6): 602-607. |
曹尚银, 汤一卒, 江爱华. 2001. GA3和PPP333调控苹果花芽孕育的机理研究[J]. 园艺学报, 28(4): 339-341. |
曹尚银, 张俊昌, 魏立华. 2000. 苹果花孕育过程中内源激素的变化[J]. 果树科学, 17(4): 244-248. |
陈之端. 1994. 桦木科植物的系统发育和地理分布(待续)[J]. 中国科学院研究生院学报, 32(1): 1-31. |
侯雷平, 王丽, 李梅兰. 2009. 赤霉素处理促进白菜开花的效应分析[J]. 中国农学通报, 25(6): 171-174. |
苏明华, 刘志成, 庄伊美. 1998. 水涨龙眼结果母枝内源激素含量变化对花芽分化的影响[J]. 热带作物学报, 18(2): 66-71. |
孙冰, 杨国亭, 李弘, 等. 1994. 白桦种群的年龄结构及其群落演替[J]. 东北林业大学学报, 22(3): 43-48. |
王庆成, 徐德兰. 2001. 赤霉素(GA3) 对杨树开花结实的效应[J]. 植物生理学通讯, 37(6): 510-512. |
王玉成, 杨传平, 姜静. 2001. 紫丁香、糖槭总RNA的快速提取方法[J]. 东北林业大学学报, 29(6): 90-91. |
杨帆, 丁菲, 杜天真. 2010. 盐胁迫下构树DREB转录因子基因表达的实时定量荧光PCR分析[J]. 林业科学, 46(4): 146-150. DOI:10.11707/j.1001-7488.20100422 |
周学伍, 陈清亮, 曾凡哲, 等. 1981. 赤霉素对甜橙花芽形成的影响研究[J]. 植物生理学通讯, (1): 43-47. |
张中保, 李会勇, 石云素, 等. 2007. 应用实时荧光定量PCR技术分析玉米水分胁迫诱导基因的表达模式[J]. 植物遗传资源学报, 8(4): 421-425. |
Ayre B G, Turgeon R. 2004. Graft transmission of a floral stimulant derived from CONSTANS1[J]. Plant Physiol, 135(4): 2271-2278. DOI:10.1104/pp.104.040592 |
Blazquez M A, Soowal L N, Lee I, et al. 1997. LEAFY expression and flower initiation in Arabidopsis[J]. Developmen, 124(19): 3835-3844. |
Doyle M R, Davis S J, Bastow R M, et al. 2002. The ELF4 gene controls circadian rhythms and flowering time in Arabidopsis thaliana[J]. Nature, 419(6902): 74-77. DOI:10.1038/nature00954 |
Eriksson S, Böhlenius H, Moritz T, et al. 2006. GA4is the active gibberellin in the regulation of LEAFY transcription and Arabidopsis floral initiation[J]. The Plant Cell, 18(9): 2172-2181. DOI:10.1105/tpc.106.042317 |
Gocal G F, Poole A T, Gubler F, et al. 1999. Long-day up-regulation of a GAMYB gene during Lolium temulentum inflorescence formation[J]. Plant Physiology, 119(4): 1271-1278. DOI:10.1104/pp.119.4.1271 |
Gocal G F W, Sheldon C C, Gubler F, et al. 2001. GAMYB-like genes, flowering, and gibberellin signaling in Arabidopsis[J]. Plant Physiology, 127(4): 1682-1693. DOI:10.1104/pp.010442 |
Hazen S P, Schultz T F, Pruneda-Paz J L, et al. 2005. LUX ARRHYTHMO encodes a Myb domain protein essential for circadian rhythms[J]. Proc Natl Acad Sci USA, 102(29): 10387-10392. DOI:10.1073/pnas.0503029102 |
Imaizumi T, Tran H G, Swartz T E, et al. 2003. FKF1is essential for photoperiodic-specific light signalling in Arabidopsis[J]. Nature, 426(6964): 302-306. DOI:10.1038/nature02090 |
King R W, Evans L T, Mander L N, et al. 2003. Synthesis of gibberellin GA6and its role in flowering of Lolium temulentum[J]. Phytochemistry, 62(1): 77-82. DOI:10.1016/S0031-9422(02)00447-8 |
Koshita Y, Takahara T, Ogata T, et al. 1999. Involvement of endogenous plant hormones(IAA, ABA, GAs)in leaves and flower bud formation of satsuma mandarin(Citrus unshiu Marc.)[J]. Scientia Horticulturae, 79(3): 185-194. |
Langridge J. 1957. Effect of day-length and gibberellic acid on the flowering of Arabidopsis[J]. Nature, 180(4575): 36-37. DOI:10.1038/180036a0 |
Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Method, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
Luckwill L C.1970.The control of growth and fruitfulness of apple trees∥Luckwill L C, Cutting C V.The physiology of tree crops.New York:Academic Press, 237-254.
|
Metzger J D.1987.Hormones and reproductive development∥Davis P J.Plant Hormones and their role in plant growth and development.Dordrecht:Kluwer Academic Publishers, 431-462.
|
McArthey S J, Li S H. 1998. Selective inhibition of flowering in Braebu apple trees with gibberellins[J]. HortScience, 33(4): 699-700. |
Prang L, Stephon M, Schneider G, et al. 1997. Gibberellin signals originating from apple fruit and their possible involvement in flower induction[J]. Acta Horticulturae, 463: 235-241. |
Takahashi N, Phinney B O, Macmillan J. 1991. Gibberellins[J]. New York:Springer Verlag Inc: 363-364. |
 2011, Vol. 47
2011, Vol. 47

