文章信息
- 贾之春, 孙一铭, 秦志超, 肖训焰, 齐代华, 罗克明
- Jia Zhichun, Sun Yimin, Qing Zhichao, Xiao Xunyan, Qi Daihua, Luo Keming
- 转抗菌肽基因毛白杨的培育及其对溃疡病的抗性
- Transformation of an Antimicrobial Peptide Gene LJAMP2 into Populus tomentosa and Resistance of the Transgenic Poplar to Canker Disease
- 林业科学, 2011, 47(7): 123-127.
- Scientia Silvae Sinicae, 2011, 47(7): 123-127.
-
文章历史
- 收稿日期:2010-03-26
- 修回日期:2010-05-18
-
作者相关文章
毛白杨(Populus tomentosa)是我国特有的乡土树种,其树干高大、适应性强、纤维较长,是重要的民用和工业用材。近年来,随着毛白杨的广泛栽培,各种病害(尤其是真菌病)的发生越来越严重,导致其生长不良,丧失绿化和防护的效果,甚至出现大面积死亡。单纯依靠常规育种和喷洒化学农药的方法不能有效地解决杨树病害的问题。因此,利用植物基因工程技术培育毛白杨抗病新品种已成为当务之急。
随着越来越多的抗病基因被克隆,植物抗病基因工程得到了迅速发展。一些抗病基因被转化到杨树中,获得了抗病转基因植株。如孟亮等(2004)把来自于菜豆(Phaseolus vulgaris)的几丁质酶基因(CHSB)导入杨树基因组中,提高了杨树的抗病性。邹维华等(2006)将几丁质酶基因CH5B转入美洲黑杨(Populus deltoides)中,在转基因植物获得了几丁质酶基因的表达。抗菌肽是一类具有广谱抗菌活性的抗菌蛋白,在已利用的抗病基因中,阳离子抗菌肽由于其独持的抗菌机制,在抑制真菌病害方面显示出了一定优势。在抗病过程中,抗菌蛋白两性分子形成α螺旋或β折叠,在靶标细胞膜上形成电势依赖通道,从而改变细胞膜的通透性,使靶标细胞因内容物泄漏而死亡,因而病原菌难以产生抗性(Yeaman et al., 2003)。方宏筠等(1999)已开展了抗菌肽基因转化樱桃(Prunus pseudocerasus)的研究,并获得了抗根瘤病的转基因植株。Yang等(2008)研究了来自益母草(Leonurus japonicus)的脂质转移酶基因LJAMP2在烟草中的抗病效果,结果转基因植株对病原真菌的抗性显著增强。该类抗菌蛋白在毛白杨中超量表达能否提高其抗病效果,目前还未见报道。
本研究选取组成型启动子CaMV 35S和来自益母草的阳离子抗菌肽LJAMP2基因构建的35S : : LJAMP2表达载体,将其通过根癌农杆菌导入毛白杨后,检测了转基因植株抗溃疡病的能力,以期获得抗病转基因优良品种,为杨树抗病基因工程提供实验依据。
1 材料与方法 1.1 试验材料和菌种根癌农杆菌(Agrobacterium tumefaciens)菌株LAB4404和遗传转化中所用植物材料毛白杨均为本实验室保存。杨树溃疡病菌种Cytospora chrysosperma由西北农林科技大学胡景江教授惠赠。植物表达载体35S : : LJAMP2由西南大学生物技术中心裴炎教授提供,详细资料见文献(Yang et al., 2006)。
1.2 方法 1.2.1 根癌农杆菌的培养根癌农杆菌的培养过程详见邓伟等(2009),离心后用添加乙酰丁香酮(100 μg·L-1 acetosyringone,AS)的WPM液体培养基(Lloyd et al., 1980)重悬后即可用于转化。
1.2.2 遗传转化与转基因植株获得转化方法采用根癌农杆菌介导的叶盘法(邓伟等,2009)。待生根幼苗长至8 cm时取出幼苗,洗净根部琼脂,移栽至温室土壤中培养。
1.2.3 GUS组织染色GUS染色按照Jefferson (1987)的方法进行,将再生植株的叶片浸入GUS染色液的离心管中,于37 ℃下保温过夜,用100% (V/V)乙醇脱色处理2 h,去除叶绿素等干扰。GUS染液配方为: 1.0 mg·L-1 5-溴-4-氯-3-吲哚-D-葡萄糖苷、2% (V/V)甲醇、1.0 mg·L-1 K4Fe(CN)6、0.1% (V/V) Triton X-100和0.1 mol·L-1磷酸钠缓冲液,pH 7.0。
1.2.4 转基因植株的PCR检测毛白杨基因组DNA提取采用改良的CTAB法(Doyle et al., 1987)。
转基因植株PCR检测以GUS阳性植株的基因组DNA为模板,通过扩增标记基因NPTII和目的基因LJAMP2进行筛选。根据Yang等(2008)报道,分别设计特异引物,NPTII基因上游引物序列为: 5'-AGGCTATTCGGCTATGACTGG-3';下游引物序列为: 5'-TCGGGAGCGGCGATACCGTA-3'。LJAMP2基因上游引物序列为: 5'-ATGGCTGCCTTGATCAAGTTG-3';下游引物序列为: 5'-CAGTGCACCTTTGAGCAATC-3'。PCR反应条件为94 ℃预变性3 min,然后94 ℃变性30 s、56 ℃退火30 s、72 ℃延伸1 min,共35个循环,最后72 ℃延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测。
1.2.6 毛白杨总RNA的提取和RT-PCR检测转基因杨树总RNA的提取按照Qiagen公司的RNeasy Plant Mini Kit试剂盒操作说明书进行,cDNA的合成使用TaKaRa公司PrimeScript RT reagent Kit试剂盒,-20 ℃保存备用。以反转录产物为模板进行RT-PCR扩增LJAMP2基因,扩增引物同上。PCR反应条件为94 ℃预变性1 min,然后94 ℃变性30 s、56 ℃退火30 s、72 ℃延伸1 min,共25个循环,最后72 ℃延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测。
1.2.7 转基因毛白杨离体抑菌试验离体抑菌实验按照王玲等(2000)方法进行。选取生长状态一致的转基因植株及非转基因植株,用TES缓冲液(100 mmol· L-1 Tris-Cl,0.1 mmol· L-1 EDTA,30 mmo·L-1 NaCl,pH调至7.0)提取其细胞粗体液备用,将28 ℃暗培养2~4天的杨树病原真菌的菌丝体及连带培养基用打孔器取6 mm圆块,将有菌丝的一面黏贴在PDA培养基(马铃薯200 g·L-1 +葡萄糖20 g·L-1 +琼脂15 g·L-1)正中央,在距菌丝边缘2 cm处放上无菌的滤纸片(直径6 mm),取200 μL细胞粗提液滴加在纸片上,28 ℃继续培养2~3天后观察抑菌圈大小。
1.2.8 转基因植物活体接菌试验选取大小一致的转基因植株和野生型植株,将28 ℃暗培养2~4天的杨树溃疡病病原真菌的菌丝体及连带培养基用打孔器取6 mm圆块,用保鲜膜将生长菌丝的培养基固定在第2或第3片幼叶之间的茎段上,将其置于室外阴凉处,并保持湿润状态,30天后观察感病情况。
2 结果与分析 2.1 转基因植株的获得用含有35S : : LJAMP2载体的农杆菌菌液侵染毛白杨叶片,经过25 mg·L-1卡那霉素筛选,获得大量分化幼苗(图 1A)。待抗性芽长至2 cm左右时,将其切下并转移到生根培养基中进行生根,炼苗后移栽至土壤中,共获得独立的卡那霉素抗性植株50株。由于植物表达载体35S : : LJAMP2上含有GUS报告基因,因此首先对再生植株的叶片进行GUS组织染色,结果所有检测的毛白杨再生植株均呈蓝色,而未转化植株未显示出蓝色(图 1B),该结果初步表明外源目的基因已整合到毛白杨基因组中。

|
图 1 转基因毛白杨中GUS基因组织化学染色 Figure 1 Histochemical analysis of GUS activity in transgenic plants A.再生植株Regenerated plants; B.转基因植物叶片的GUS染色GUS staining of leaves from transgenic plants. WT:野生型植株Wild type plants; L1,L2:不同转基因植株Transgenic lines |
选取15株GUS阳性的再生植株,采用CTAB法(Doyle et al., 1987)从叶片中提取的毛白杨基因组DNA做模板,以35S: : LJAMP2质粒DNA为阳性对照,非转基因植株基因组DNA为阴性对照,设计特异引物,PCR扩增卡那霉素抗性基因NPTII和抗菌肽基因LJAMP2。扩增产物的电泳结果如图 2所示。当以转基因植株基因组DNA和载体质粒为模板,以NPTII基因特异引物进行扩增,获得一条与预期大小一致的片段(749 bp),而野生型植株未扩增出特异条带。当对LJAMP2基因进行PCR检测时,GUS阳性植株均得到一条与质粒做模板扩增条带大小相同的条带,而非转化毛白杨基因组做模板则未获得PCR扩增产物。上述结果证明外源目的基因已成功整合到毛白杨基因组上。
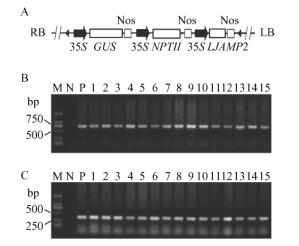
|
图 2 转基因毛白杨PCR检测LJAMP2、NPTII基因结果 Figure 2 PCR detection of LJAMP2, NPTII genes of transgenic Chinese white poplar plants A.表达载体35S : : LJAMP2的T-DNA区域The T-DNA region of vector 35S : : LJAMP2; B. NPTII基因的PCR检测PCR assay of NPTII gene; C. LJAMP2基因的PCR检测PCR assay of LJAMP2 gene。M: DNA marker DL2000; N:野生型植株(阴性对照) Wild type plants as negative control; P:质粒(阳性对照) Plasmid DNA as positive control; 1-15:转基因植株Transgenic plants |
为了确定转基因毛白杨中LJAMP2基因在mRNA水平上的表达水平,选取6个转基因株系提取总RNA,反转录成cDNA后,以LJAMP2基因的特异引物进行RT-PCR扩增,同时以各株系总RNA电泳结果确定其浓度。RT-PCR检测结果如图 3所示,所有转基因株系均扩增出1条特征条带,表明LJAMP2基因在转基因毛白杨中均成功转录并表达,其中株系3和4中LJAMP2在mRNA水平上表达量最高,株系1和2次之,株系5和6相对较低。

|
图 3 RT-PCR检测转基因毛白杨中LJAMP2基因的表达水平 Figure 3 RT-PCR analysis of LJAMP2 expression in transgenic plants CK:野生型植物Wild type plants; 1-6:转基因植物Transgenic plants. |
为了验证转抗菌肽基因LJAMP2的毛白杨是否对溃疡病具有抗性,将病原真菌接种到PDA培养基上培养2天,结果发现:在经野生型植株细胞粗提液浸泡过的滤纸片周围未形成抑菌圈,而在经转基因植株细胞粗提液浸泡过的滤纸片周围形成了明显的抑菌圈(图 4)。该结果初步证明:在毛白杨中超量表达转抗菌肽基因LJAMP2,转基因植株能不同程度地抑制溃疡病菌的生长。
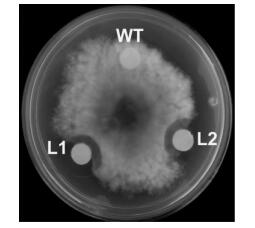
|
图 4 转基因植株体外抑菌分析 Figure 4 Inhibition of fungal growth by the cell extacts from transgenic plants in vitro WT:非转基因植株Non-transgenic plants; L1,L2:转基因植株Transgenic plants. |
进一步对转基因毛白杨进行活体抗病效果分析,选取上述RT-PCR检测过的转基因植株,在其茎段接种溃疡病菌,培养30天后,发现非转基因毛白杨发病严重,茎段出现明显的腐烂症状,多数植株最终枯死; 而各转基因株系表现出高抗,叶片枯斑很少,茎段感病症状显著缓解,植株整体生长情况良好(图 5)。

|
图 5 转基因毛白杨抗溃疡病病活体分析 Figure 5 Anti-fungal assay of transgenic plants in vivo A.转基因植株茎段抗病结果Anti-fungal assay of shoots from transgenic plants; B.转基因毛白杨抗病结果Anti-fungal assay of transgenic plants in vivo。WT:非转基因植株Non-transgenic plants; L1,L2,L3,L4,L5,L6:转基因植株Transgenic plants. |
结合前面RT-PCR结果分析发现:所检测的6个转基因毛白杨株系中,抗菌肽基因LJAMP2表达水平高的株系3和4病情指数较低,表现出最强的抗病能力,与之相反,株系5和6中LJAMP2基因表达水平较低,导致其低抗溃疡病,病情指数较高。上述结果表明,抗菌肽基因LJAMP2在毛白杨中能有效表达,其表达水平与转基因植物的抗溃疡病能力呈显著的正相关。
3 讨论本研究将益母草阳离子抗菌肽LJAMP2基因转入毛白杨中超量表达,RT-PCR检测发现,该基因能在转基因毛白杨体内有效表达(图 3)。离体抑菌试验证实,转基因植株能明显抑制溃疡病菌丝的生长(图 4)。进一步接菌试验显示,与野生型毛白杨相比,转基因植株均表现出对溃疡病有明显的抗性(图 5),统计病级指数发现,转基因植株病情指数均低于非转化植株(图 6)。上述结果表明:超量表达益母草抗菌肽基因LJAMP2能显著提高毛白杨对溃疡病的抗性。
在植物抗病基因工程中,随着越来越多的抗病基因被克隆,许多抗病基因都被转化到植物体中,并已获得了多种抗病的转基因植物,展现了良好的应用前景。在已利用的抗真菌基因中,几丁质酶和阳离子抗菌肽显示出一定的优势。究其原因在于:几丁质酶能专一酶解由N-乙酰葡萄糖胺通过β-1,4糖苷键连接形成的几丁质,从而抑制真菌的生长增殖(Fukamizo,2000)。Grison等(1996)利用组成型表达的几丁质酶基因转化油菜(Brassica campestris),转基因植株对一些真菌性病害的抗性增强。病原真菌在与植物几丁质酶基因之间的长期共进化过程中,病原菌产生了能抑制寄主植物几丁质酶的抑制物,可造成转基因植物抗病水平低的现象; 但植物几丁质酶也能通过改变几丁质酶的活性区域的序列而不受病原菌抑制物的影响(Bishop et al., 2000)。阳离子抗菌蛋白是一类由生物产生的具有广谱抗菌活性的蛋白多肽,广泛分布于植物、动物和微生物中,其抗菌机制独持,致使病原菌难以产生抗性(Yeaman et al., 2003)。因此,抗菌肽作为一种新型抗菌蛋白在植物抗病领域中有着广泛的应用前景。
近年来,不同来源的抗菌肽被分别导入植物基因组中,获得了抗病转基因植株。张清杰等(1995)将人工合成的抗菌肽D基因通过根癌农杆菌介导,获得了转基因植株。方宏筠等(1999)将Cecropin B和Shiva A基因成功转入樱桃(Cerasus pseudocerasus),获得的转基因抗病品种已进入田间试验。上述基因也被导入新会橙(Citrus sinensis cv. Xinhuicheng)、锦橙(C. sinensis cv. Jincheng)等柑橘主栽品种(何永睿等,2004),获得了抗病新材料。抗真菌肽LHAFP和Sp-CEMA转化棉花(Gossypium spp.)、油菜等后,转基因株表现出不同程度的抗病性(肖月华等,2002; 罗小英等,2005)。来自益母草的脂质转移酶基因LJAMP2在烟草中表达,结果转基因植株对病原真菌的抗性显著增强(Yang et al., 2008)。在本研究中,笔者将LJAMP2基因导入毛白杨,转基因株表现出不同程度的抗病性,甚至发现少数转基因植株无明显抗病效果。推测其原因,可能是这些转基因植株中,LJAMP2基因表达水平不高(图 2),或是由于蛋白活性不强,不能在低浓度时有效抑制病原真菌的生长。另外,就抗菌肽而言,可能是真菌和细菌细胞壁的存在降低了以细胞膜为靶标的抗菌肽的作用。Mourgues等(1998)认为:植物防卫反应是多种基因协同作用的结果,单个基因的作用可能是有限的。因此,将来在毛白杨抗病基因工程的策略上,应该考虑多种基因或多种抗菌机制的协同作用。
邓伟, 吕立堂, 罗克明, 等. 2009. 毛白杨二次遗传转化的建立[J]. 生物技术通报, (4): 77-81. |
方宏筠, 王关林, 王火旭, 等. 1999. 抗菌肤基因转化樱桃矮化砧木获得抗根瘤病的转基因植株[J]. 植物学报, 41(11): 1192-1198. DOI:10.3321/j.issn:1672-9072.1999.11.010 |
何永睿, 邹修平, 彭爱红, 等. 2004. 根癌农杆菌介导的柑桔遗传转化技术[J]. 热带作物学报, 5(1): 11-16. |
罗小英, 曾雪嘉, 杨星勇, 等. 2005. 抗菌肽和几丁质酶基因提高烟草对黑胫病菌和赤星病菌的抗性研究[J]. 植物病理学报, 35(3): 249-255. |
孟亮, 李红双, 金德敏. 2004. 转几丁质酶荃因黑杨的获得[J]. 生物技术通报, (3): 48-51. |
王玲, 张富宝. 2000. 中药大黄提取色素的抑菌作用研究[J]. 食品工业科技, (6): 27-28. |
肖月华, 侯磊, 裴炎, 等. 2002. 植物Ⅴ类几丁质酶苦瓜同源基因(McChi5)的克隆及特征分析[J]. 遗传学报, 29(11): 1028-1033. |
张清杰, 张景宁, 黄自然, 等. 1995. 柞蚕抗菌肽对柑桔黄龙病及溃疡病病原菌的杀菌作用[J]. 蚕业科学, 21(2): 76-81. |
邹维华, 赵强, 崔德才, 等. 2006. 反义磷脂酶Dγ基因与几丁质酶基因转化美洲黑杨G2[J]. 林业科学, 42(1): 38-42. |
Bishop J G, Dean A M, Mitchell-Olds T. 2000. Rapid evolution in plant chitinases: Molecular targets of selection in plant-pathogen coevolution[J]. Proc Natl Acad Sci USA, 97: 5322-5327. DOI:10.1073/pnas.97.10.5322 |
Grison R, Grezes-Besset B, Schneider M, et al. 1996. Field tolerance to fungal pathogens of Brassica napus constitutively expressing a chimeric chitinase gene[J]. Nature Biotechnol, 14: 643-646. DOI:10.1038/nbt0596-643 |
Doyle J J, Doyle J L. 1987. A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J]. Phytochem Bull, 9(1): 11-15. |
Fukamizo T. 2000. Chitinolytic enzymes: catalysis, substrate binding, and their application[J]. Curr Protein Peptide Sci, 1(1): 105-124. DOI:10.2174/1389203003381450 |
Jefferson R A. 1987. Assaying chimeric genes in plants: the GUS gene fusion system[J]. Plant Mol Biol Rep, 5: 387-405. DOI:10.1007/BF02667740 |
Lloyd G, McCown B. 1980. Commercially feasible micropropagation of mountain laurel, Kalmia latifolia, by use of shoot-tip culture[J]. Proc Intl Plant Prop Soc, 30: 421-427. |
Mourgues F, Brisset M N, Chevreau E. 1998. Strategies to improve plant resistance to bacterial diseases through genetic engineering[J]. Trends Biotechnol, 16: 203-210. DOI:10.1016/S0167-7799(98)01189-5 |
Yang X, Li J, Pei Y, et al. 2006. Isolation and characterization of a novel thermostable non-specific lipid transfer protein-like antimicrobial protein from motherwort (Leonurus japonicus Houtt) seeds[J]. Peptides, 27(12): 3122-3128. DOI:10.1016/j.peptides.2006.07.019 |
Yang X, Wang X, Pei Y, et al. 2008. Characterization and expression of an nsLTPs-like antimicrobial protein gene from motherwort (Leonurus japonicus)[J]. Plant Cell Rep, 27(4): 759-66. DOI:10.1007/s00299-008-0506-0 |
Yeaman M, Yount N. 2003. Mechanisms of antimicrobial peptide action and resistance[J]. Pharmacol Rev, 55(1): 27-55. DOI:10.1124/pr.55.1.2 |
 2011, Vol. 47
2011, Vol. 47

