文章信息
- 王艳丽, 李正楠, 李会平, 冉隆贤
- Wang Yanli, Li Zhengnan, Li Huiping, Ran Longxian
- 桉树抗青枯病的鉴定技术
- Determination of Disease Resistance of Eucalypt against Bacterial Wilt Caused by Ralstonia solanacearum
- 林业科学, 2011, 47(6): 101-107.
- Scientia Silvae Sinicae, 2011, 47(6): 101-107.
-
文章历史
- 收稿日期:2009-11-18
- 修回日期:2010-04-11
-
作者相关文章
2. 河北农业大学河北省山区研究所 保定 071000
2. Mountain Area Research Institute of Hebei Province, Agricultural University of Hebei Baoding 071000
桉树(Eucalyptus spp.)青枯病是由茄拉尔氏菌(Ralstonia solanacearum)引起的一种系统性的维管束病害,其病原在世界范围内广泛分布,在我国主要是生理小种1号、生化型Ⅲ侵染为害,导致整株枯死,被称为桉树的“绝症”。此病最早于1982年发现于我国广西的柳桉(E. saligna)和巨桉(E. grandis)等幼树上(曹季丹,1982)。此后,在广东、云南、海南、福建和台湾等桉树大面积栽植的地区也相继发现(黄晖,2004; 伍慧雄等,2006; 李逸,2006; 李伟东,1992),损失巨大,严重制约了桉树产业的发展。在国外,桉树青枯病于1983年在巴西报道发生后,澳大利亚、乌干达及南非的一些国家陆续也有报道(Coutinho et al., 2000; Roux et al., 2001)。此病危害桉树的维管束系统,林木一旦发病,尚无有效的药剂可以防治,其中造成桉树青枯病大流行的主要原因之一就是大面积单一无性系的推广应用。因此,如何选育和推广应用抗病无性系是防治青枯病的关键技术之一。
目前,顶尖包扎、伤根灌淋菌液(方中达,1998)是筛选桉树抗青枯病无性系的常用人工接种方法,沈文生等(2000)等应用WFT法也能较好地测定桉树对青枯病的抗性。这些接种技术虽然能够得到较好的筛选结果,但是它们均以整株的桉树移栽苗或实生苗为试验材料,同时必须配合后期的重病区造林试验,不仅费时费力,且容易受环境条件的影响,因此找到一种快速、简便的接种技术是成功筛选桉树抗青枯病无性系的基础和前提。
在植物抗病性筛选的研究中发现,不同植物种类和不同基因型的植物根系分泌物不同(陈宏宇等,2005),根系分泌物与植物抗病性有着密切关系(冯洁等,1991; 王汝贤等,1995; 铃木直治,1985),黄奔立等(2007)研究发现黄瓜(Cucumis sativus)的感病品种根系分泌物促进了黄瓜枯萎病菌(Fusarium oxysporum f. sp. cucurmerinum)的生长,而抗病品种和云南黑籽南瓜(Cucurbita ficifolia)根系分泌物则抑制了病菌生长,其他学者也有类似的报道(李洪连等,1998; 王守正等,2001)。不同抗性桉树无性系的根系分泌物对青枯病菌生长的影响并将其应用于桉树无性系抗病性筛选方面的研究报道很少。有研究表明,植物组织成分及其副产物中含有对病原真菌和细菌有抑制作用的活性物质(王贻莲,2008; Cimanga et al., 2002),但不同桉树无性系组织成分对青枯病菌的作用是否与桉树自身的抗病性相关还未见报道。本文将不同桉树无性系根系分泌物和自身组织成分作为其抗病性能力强弱的重要参考和验证指标,为桉树无性系抗病性筛选提供了新的思路。
本研究采用茎段浸泡法、顶端接种法,对来源不同的桉树无性系盆栽苗和生根组培苗进行抗青枯病性能测定,筛选桉树抗青枯病无性系,为林业生产合理利用优质、高产、抗病无性系提供依据,并将筛选出来的不同抗性桉树无性系的根际分泌物和组织研磨过滤液用于培养青枯病菌,作为检测和验证桉树抗病性高低的指标,为进一步研究不同桉树无性系抗青枯病的机制开辟新的途径。
1 材料与方法 1.1 青枯菌的培养与菌悬液的制备试验用青枯病菌由河北农业大学林木病理室保存。病菌的培养采用改良Kelman培养基(Kelman,1954) (葡萄糖10.0 g,蛋白胨10.0 g,水解酪蛋白5.0 g,琼脂12.0 g),菌种活化时在培养皿内选取不规则圆形,外围乳白色,易流动扩散的菌落,扩大培养36~48 h后,用无菌水洗下菌体,在10 000 r· min-1下离心10 min,去除上清液,无菌水稀释后在波长660 nm下用分光光度计测定光密度,配制成浓度为109 CFU·mL-1的菌悬液备用。
1.2 试验材料的收集温室盆栽4~6个月的桉树无性系雷2,雷9,bd1,bd2,南宁广9,南宁巨尾桉(E. grandis × E. urophylla),南宁尾叶桉,钦32-22,钦32-29,DH32-29,DH32-27,钦广9,钦8,钦9,邓恩桉(E. dunnii),巨桉,赤桉(E. camaldulensis)和尾叶桉(E. urophylla),苗高约20~25 cm,苗木生长健壮,无病虫。以上材料由广东省雷州市林业局林业科学研究所、广西钦州市林业局、广西林业科学研究院组培苗工厂提供。试验用桉树无性系组培苗由河北农业大学林木病理室提供。
1.3 青枯病菌接种浓度的测定在容积为500 mL的玻璃瓶内加入150 mL无菌1/10MS营养液,121 ℃高压灭菌30 min。将已配制好的青枯病菌菌悬液梯度稀释,使玻璃瓶内的青枯菌终浓度分别为105,106,107 CFU·mL-1浓度梯度备用,并设对照,对照瓶盛装灭菌的1/10MS培养液。
以桉树无性系DH32-29为试验材料,剪取顶部长约15 cm幼嫩枝条,放入盛有青枯菌液的玻璃瓶内,每处理5瓶,每瓶7~8个桉树茎段,每处理3个重复。将接种后的桉树茎段放入光照培养箱中培养,保持白天温度30~33 ℃,晚上温度25~28 ℃,相对湿度90%以上,接种后第3~7天,分别统计存活株数并计算死亡率。供试桉苗出现感染青枯病症状后,除记录发病株数外,还进一步对部分病株作病原菌的分离培养,包括对照可能出现的死亡株,以排除非青枯病死亡的干扰,使试验准确无误(施仲美等,2000)。
1.4 茎段浸泡法进行桉树无性系抗病性测定 1.4.1 温室盆栽苗以抗病树种赤桉和感病树种尾叶桉为参照进行测定。从温室中培养4~6个月桉树各无性系幼苗上取长约15 cm顶部幼嫩枝条,剪去下端叶片,插入含有107 CFU·mL-1青枯病菌的玻璃瓶中,每处理5瓶,每瓶放入7~8株,3~5次重复。发病条件及培养条件同1. 3节。
1.4.2 室内组培苗将供试的各桉树无性系组培苗洗净培养基,轻微损伤根尖,插入含有107 CFU· mL-1青枯病菌的安培瓶中,每处理10瓶,每瓶1株,3次重复。发病条件及培养条件同1. 3节。
1.5 顶尖接种法进行桉树无性系抗病性测定根据茎段浸泡法的筛选结果,选取桉树无性系雷9,bd2,南宁广9,钦8为试验材料进行抗病性测定。剪取约15 cm长的各桉树无性系顶端幼嫩茎段,在顶尖至第3片幼叶处剪一斜切口,将含有表面活性剂(1%的洗涤灵)的107 CFU·mL-1青枯菌液均匀涂抹于切口处,涂抹菌液量约为2~3 μL。每处理5瓶,每瓶5~6株,3次重复,同时设对照。培养条件同1. 3节。接种后每天观察记录各处理发病情况,以从接种点向下变黑的长度为标准记录病级,计算病情指数。病情指数= [Σ (各级病株数×相应级的代表数值)/ (试验总株数× 3) ] × 100。病害分级标准: 0级为无症状; 1级为变黑茎段长度小于0. 5 cm; 2级为变黑茎段长度0. 5~2 cm; 3级为变黑茎段长度2 cm以上或整个茎段全部变黑、死亡。
1.6 不同抗性桉树无性系根系分泌物对青枯病菌生长的影响 1.6.1 不同抗性桉树无性系根系分泌物的获取根据桉树抗青枯病无性系的筛选结果,以bd2为抗性无性系,雷9为中感无性系,钦广9和钦32-22为感病无性系。取温室中已栽培4~6个月的各桉树无性系,移栽进行水培试验,移栽时,将桉树苗整株取出,洗净根部泥土,先用清水浸洗4次,再用蒸馏水淋洗根系4次,然后再用去离子水淋洗1次,最后将幼苗植入1 L烧杯中,加1/10 MS培养液至根颈,培养7天后收集培养液,用滤纸进行粗过滤,将含有根系分泌物的培养液做2部分使用,其中一部分用0. 45 μm滤膜过滤,剩余培养液不作处理,均置于4 ℃冰箱中冷藏备用(解文科等,2005)。每个处理设3个重复。
1.6.2 根系分泌物对桉树青枯病菌生长的影响1) 滤纸片法 将Kelman培养基加热溶解,快速倒入培养皿中,待凝固后即成平板。然后在每个平板上面均匀涂抹108 CFU·mL-1的青枯菌200 μL。表面吹干后每皿放置1个直径约60 mm无菌滤纸片,然后加入用滤膜过滤过的桉树无性系根系分泌物15 μL,用无菌水作对照,30 ℃下培养。48 h后观察。2)液体培养法 取浓度为104 CFU·mL-1的青枯菌0. 1 mL加入到9. 9 mL的各桉树无性系的无菌根系分泌物中,使各桉树无性系根系分泌物内的青枯菌终浓度为102 CFU·mL-1。以无菌水作对照。30 ℃,120 r·min-1摇床培养,于1,2,3,4天后在波长660 nm下测OD值,并分别以不加青枯菌的根系分泌物为对照。
1.7 不同抗性桉树无性系组织研磨液对青枯病菌生长的影响根据抗病性测定结果,选取雷2,雷9,bd2,钦广9为试验材料,取顶端茎段同一位置的茎、叶组织0. 5 g,加定量无菌水进行研磨,同时为防止氧化加入3%的聚乙烯基吡咯烷酮,将研磨液定量至25 mL,4 ℃,900 r·min-1离心5 min,取出上清液,用孔径0. 45 μm滤膜过滤,滤液作2部分处理,一部分接种青枯菌液,使得滤液中的青枯菌终浓度为102 CFU·min-1; 另一部分滤液不作处理,均置于30 ℃,125 r·min-1的摇床中进行液体培养,分别于接种后1,2,3,4天后在波长660 nm下测定OD值,测定时以不接种青枯菌的组织研磨液为对照,并同时以接种相同浓度青枯菌的无菌水为对照。
1.8 林间抗病性测定2007年至2009年,分别在广东湛江、肇庆,广西南宁和钦州等桉树青枯病发病区定点调查,每个样地内对各无性系调查50株桉树,重复5次。
1.9 数据处理统计分析方法,采用方差分析和相关分析等方法统计各处理平均值的差异,并在SPSS数据处理系统中采用Duncan新复极差法进行多重比较和显著性测验。
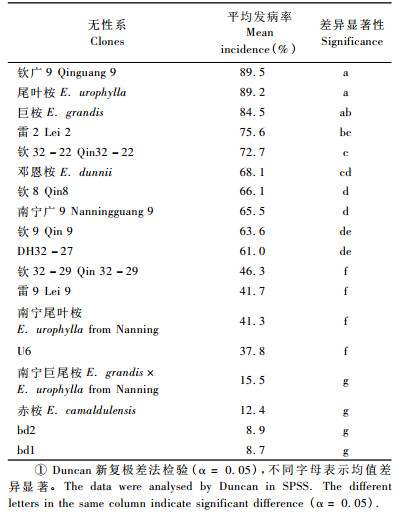
2 结果与分析 2.1 青枯病菌接种浓度的测定结果由图 1可知,3个浓度梯度处理的DH32-29都有不同程度的发病,在青枯菌浓度为105 CFU·min-1和106 CFU·min-1时,出现症状的时间晚,持续的时间长; 当浓度达到107 CFU·min-1,桉树出现症状的时间早,而且到第7天发病率平均为100%,发病时间集中。根据此结果,在后续试验中选取107 CFU·min-1作为青枯病菌的接种浓度。
|
图 1 DH32-29无性系在不同青枯菌浓度中的发病率 Figure 1 Incidence of clone DH32 - 29 in different population densities of R. solanacearum |
由表 1可以看出,供试18个桉树无性系盆栽苗接种后均发病,叶片、嫩梢从顶部开始青枯萎垂,茎基由下向上变褐,发黑,且随着接种时间的延长,发病症状日益严重。接种3天后部分感病无性系开始发病,4~7天为发病高峰期,10天后所有供试桉树无性系全部发病,发病率达100%。桉树各无性系接种5天后,方差分析结果表明,发病率差异显著,处理间的差异达到极显著水平,可以进行平均值多重比较。bd1、bd2、赤桉和南宁巨尾桉病株最少,平均发病率分别为8. 7%,8. 9%,12. 4%和15. 5%,表明对青枯病的抗性最强,与其他14个无性系比较差异性均达到显著水平; 钦广9的抗性最差,青枯病的平均发病率达89. 5%,与尾叶桉、巨桉、雷2、钦32-22、邓恩桉、钦8、南宁广9、钦9、DH32-27的发病率接近,这10个无性系的发病率都显著高于其他无性系,属于感病无性系。根据各桉树无性系的发病率,供试18个无性系的抗青枯病等级划分为:bd1、bd2、赤桉和南宁巨尾桉为抗病无性系; U6、南宁尾叶桉、雷9、钦32 - 29为中抗无性系; DH32-27、钦9、南宁广9、钦8、邓恩桉、钦32-22、雷2、巨桉、尾叶桉和钦广9为感病无性系。经邓肯法统计分析,抗病无性系,中抗无性系和感病无性系之间差异显著。
|
|
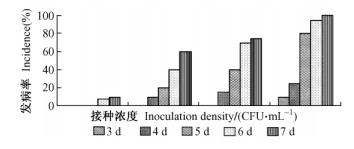
室内组培苗法进行的桉树不同无性系抗病性测定见图 2。各无性系组培苗接种7天后,经方差分析,无性系间的发病率差异显著。所选材料的抗病性强弱次序依次为:bd2、雷9、钦32-29、钦广9、钦32-22,结果与温室栽培苗法得出的结果基本一致。
|
图 2 不同桉树无性系组培苗接种后第7天的发病情况 Figure 2 Incidence of bacterial wilt in different clones at 7th day |
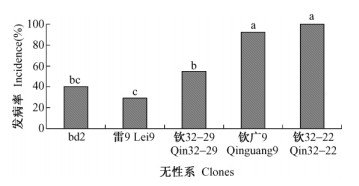
用浓度为107 CFU·mL-1的青枯菌液通过顶尖接种的方法进行桉树无性系抗病性测定,各供试无性系茎段在接种2天后开始出现发病症状,随着接种时间的延长,病情指数呈增加趋势,接种11天后发病情况趋于稳定(数据未给出)。如图 3所示,接种后第5天,bd2,雷9,钦8,南宁广9的病情指数分别为35,43,75,74,在α = 0. 05水平下,bd2、雷9和钦8、南宁广9差异显著,而bd2与雷9、钦8与南宁广9之间差异不显著。方差分析结果可知,bd2,雷9为抗病无性系,钦8,南宁广9为感病无性系。
|
图 3 顶尖接种法进行桉树无性系抗病性测定 Figure 3 Determination of resistance ability against bacterial wilt by shoot tip inoculation |
采用平板法研究不同抗性桉树根系分泌物对青枯病菌生长的影响,加有经过0. 45 μm滤膜过滤的根系分泌物的小滤纸片与对照上均无抑菌圈出现。
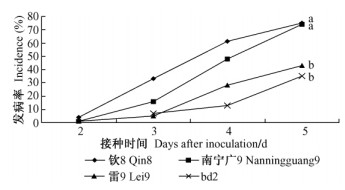
2.4.2 液体培养法从图 4可以看出,接种青枯菌1天后,不同根系分泌物中青枯菌浓度增大,但青枯菌在各桉树无性系根系分泌物中的增加量较对照的增长并不明显。接种3天后,各根系分泌物中的青枯菌量较对照均有较大幅度增长,青枯菌在钦32-22、雷2两个感病无性系的根系分泌物中增长较快,其光密度对数值分别达到0. 60和0. 52,而在抗病无性系雷9和bd2的根系分泌物中增长相对较慢,光密度对数值分别为0. 44和0. 36,均显著高于对照0. 03。
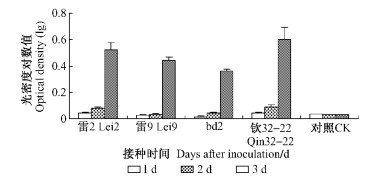
|
图 4 根系分泌物对青枯病菌生长的影响 Figure 4 The proliferation of R. solanacearum in root exudate |
不同抗性桉树无性系组织研磨液对青枯病菌生长的影响见图 5。接种青枯菌1天后,不同抗性组织研磨液中青枯菌的浓度较对照均有一定量的增大,接种4天后增殖显著。青枯菌在接种4天后,其在bd2,雷9,钦广9,雷2组织研磨液中的光密度对数值分别达到了0. 19,0. 19,0. 29和0. 35,均显著高于对照的0. 017。
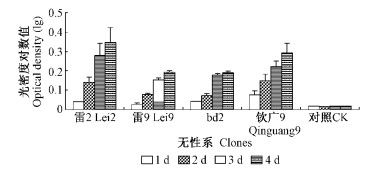
|
图 5 组织研磨液对青枯病菌生长的影响 Figure 5 The proliferation of R. solanacearum in supernate of triturated tissue from different clones |
为了验证实验室筛选的结果,对雷2,雷9,bd2,DH32-22,DH32-27,DH32-29,U6,广9进行林间抗病性调查,结果见图 6。林间雷2和DH32-22发病率最高,分别达到47. 6%和47. 2%,其次为广9,发病率为41. 6%,DH32-27,DH32-29和U6的发病率分别为37. 6%,38%,37. 2%,雷9发病率中等,为24. 4%,bd2为4. 5%,发病率最低。根据方差分析和多重比较,发病率差异显著,处理间的差异达到极显著水平,即:bd2为抗青枯病无性系; 雷9为中抗无性系; 雷2,DH32-22,DH32-27,DH32-29,U6和广9为感病无性系。
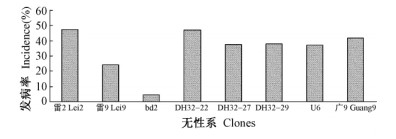
|
图 6 林间抗病性测定 Figure 6 Determination of disease resistance in eucalypt plantations |
目前我国桉树造林大多选用单一无性系大面积造林,而生产上种植的无性系抗病能力参差不齐,在青枯病大流行的年份就可能造成大面积的发病,给生产上造成无法挽回的损失,所以生产种苗单位在推广桉树无性系前,必须进行严格的抗病性测定。本试验首先利用茎段浸泡法对供试的各桉树无性系进行了初筛,试验结果表明,桉树不同种和无性系之间的抗病能力差异很大。bd1、bd2、赤桉和南宁巨尾桉为抗病无性系; U6、南宁尾叶桉、雷9、钦32-29为中抗无性系; DH32-27、钦9、南宁广9、钦8、邓恩桉、钦32-22、雷2、巨桉、尾叶桉和钦广9为感病无性系。赤桉和尾叶桉的抗病能力与前人测定结果一致,根据初筛试验结果,选择雷9、bd2、钦8、南宁广9采用顶端接种进行复筛及验证,所得试验结果与采用茎段浸泡法测定其抗病性结果基本一致,即bd2属于抗病无性系,雷9属于中抗无性系,钦8和南宁广9属于感病无性系。
在进行桉树无性系抗病性测定中,本试验所采用的茎段浸泡法与顶端接种、伤根灌淋菌液法、WFT法等常用接种方法相比,具有操作更加简便直观,测定更加快速的特点,且测得的结果比较符合林间桉树青枯病发生的实际情况。同时,该接种方法,在经过顶端接种、组培苗伤根浸泡接种进行比较和验证后,更加充分证明了茎段浸泡法接种测定桉树抗病性高低的准确性,可直接用于生产上桉树无性系的抗病性测定,为生产上抗病、优质、高产无性系的合理利用提供了新的测定方法。
对于采用相同的接种方法但由不同的繁殖方式得到的桉树无性系,其发病症状存在着很大的差异。采集的温室盆栽桉苗顶部幼嫩枝条接种3天后表现出典型的发病症状,而室内生根组培苗需在4 ~ 5天后表现症状,潜育期较长; 茎段发病时幼叶萎蔫,维管束变褐,症状明显,而组培苗则全株萎蔫,维管束变褐不够明显,容易造成发病率记录上的误差。综合考虑以上2方面的因素,在进行桉树无性系抗病性测定时最好采集茎段进行测定,该材料容易得到,且降低培养扩繁成本。在筛选桉树抗青枯病无性系时,个别无性系出现抗病性不稳定现象,原因可能与测定季节和苗木本身的生长势有关,因此,每种无性系的抗性测定必须进行多次重复,同时尽量保证试验条件的相同及每天的发病记录时间,从而得出可靠数据,进行综合评判。
植物根系分泌物很早就为人们所研究,潘凯等(2008)等发现黄瓜根系分泌物对抗病黄瓜品种根区土壤中的真菌数量有促进作用,黄瓜植株的根系分泌物对黄瓜根区土壤的尖孢镰刀菌(Fusarium oxysporum)的增加具有明显的促进作用,且感病品种的促进作用强于抗病品种。Buxton (1962)认为,抗、感品种的生化性质的差异在抗病中发挥作用,并且这种差异可通过根系分泌物反映出来。本试验采用平板法研究不同抗性桉树无性系根系分泌物对桉树青枯病菌生长的影响中,抗青枯病无性系bd2,中抗无性系雷9,感病无性系钦广9,钦32-22的无菌根系分泌物对于青枯菌均没有抑菌圈出现,表明抑菌圈法不适合测定桉树抗青枯病的能力; 而对于液体培养法,青枯菌浓度增加的多少反映了各无性系抗青枯病能力的强弱,即青枯菌在抗青枯病能力强的桉树无性系根系分泌物中增殖量小,反之青枯菌在抗青枯病能力弱的桉树无性系根系分泌物中增殖量大。供试的桉树无性系抗病能力强弱依次为bd2,雷9,雷2,钦32 - 22,结果与茎段浸泡法测定桉树无性系抗青枯病筛选结果相一致,验证了采用茎段浸泡菌液法进行抗病性筛选的准确性。在组织研磨液对青枯菌生长的影响方面,多年的研究发现,瑞香狼毒(Stellera chamaejasme) (温哲屹等,2008),厚朴(Magnolia officinalis) (赵纯森等,1994),青刺果(Rosa henryi) (朱正良等,2002)及多种中药类植物(李永刚等,2003)均含有抗菌物质,且该类物质主要集中在植物的茎、叶、根、花和种子内。方舟(2007)研究发现大叶桉(E. robusta)叶精油对大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphyloccocus aureus)有较明显的抑制作用,单萜和含氧单萜是大叶桉叶精油的主要化学成分。本试验利用桉树无性系组织研磨液与青枯菌相互作用,观察其对青枯菌生长的影响,试验结果与根系分泌物对青枯菌的生长影响基本一致,即青枯菌在抗性强的桉树无性系组织研磨液的增殖显著低于感病无性系中青枯菌的增殖量,青枯菌增殖量的大小反映了各无性系抗青枯病能力的强弱,增殖量小则组织研磨液对青枯菌的抑制作用大,抗性强; 增殖量大,抑制作用小,则抗青枯病能力弱,同时,验证了抗病性筛选的准确性,即bd2为抗病无性系,雷9为中抗无性系,钦广9、雷2为感病无性系,因此,根系分泌物法和组织研磨液法进行的桉树抗青枯病测定结果与茎段浸泡法测定桉树无性系抗病性筛选结果相一致。本文将桉树青枯病菌在桉苗根系分泌物和组织研磨液中增殖的速率作为测定桉树抗病性高低的指标,为桉树抗青枯病机制的研究提供了新的线索。
曹季丹. 1982. 巴西柳桉、巨桉青枯病调查初报[J]. 广西林业科技, (4): 30-31. |
陈宏宇, 李晓鸣, 王敬国, 等. 2005. 抗病性不同大豆品种根面及根际微生物区系的变化.Ⅰ.非连作大豆(正茬)根面及根际微生物区系的变化[J]. 植物营养与肥料学报, 11(6): 804-809. DOI:10.11674/zwyf.2005.0616 |
方中达. 1998. 植病研究法[M]. 北京: 中国农业出版社.
|
方舟. 2007. 大叶桉叶精油化学成分及其抑菌活性[J]. 福建林学院学报, 27(1): 48-51. |
冯洁, 陈其煐, 石磊岩. 1991. 棉花幼苗根系分泌物与枯萎病关系的研究[J]. 棉花学报, 3(1): 89-96. |
黄奔立, 许云东, 伍烨, 等. 2007. 两个不同抗性黄瓜品种和云南黑籽南瓜根系分泌物对黄瓜枯萎病发生的影响[J]. 应用生态学报, 18(3): 559-563. |
黄晖. 2004. 我国营造桉树人工林的现状与发展对策[J]. 广西林业科技, (6): 42-43. |
李洪连, 袁红霞, 王烨, 等. 1998. 根际微生物多样性与棉花品种对黄萎病抗性关系研究.Ⅰ.根际微生物数量与棉花品种对黄萎病抗性的关系[J]. 植物病理学报, 28(4): 341-345. |
李伟东. 1992. 桉树青枯病在海南的发病现状与防治措施[J]. 海南林业科技, (3): 21-22. |
李逸. 2006. 如何预防和防治桉树绝症[J]. 热带林业, 9(3): 45-46. |
李永刚, 文景芝. 2003. 30种中药抑菌活性的筛选试验初报[J]. 植物保护学报, 3(1): 109-110. |
铃木直治. 1985. 近代植物病理化学. 齐显章, 许泳峰, 张际中, 等译. 上海: 上海科学技术出版社.
|
潘凯, 姚友. 2008. 不同黄瓜品种根系分泌物对根际土壤微生物及土壤养分的影响[J]. 北方园艺, (8): 18-20. |
沈文生, 黄乃秀. 2000. 桉树抗青枯病的筛选技术[J]. 广西植保, 13(4): 34-36. |
施仲美, 奚福生, 何贵整, 等. 2000. 桉树品系对青枯病抗性及其稳定性的研究[J]. 广西林业科学, 29(1): 1-6. |
王汝贤, 杨之为, 宗照锋, 等. 1995. 棉花枯萎病抑菌土成因初探.Ⅰ.棉花根系分泌物对枯萎病菌的影响[J]. 西北农业学报, 4(4): 63-68. |
王守正, 王海燕, 李洪连, 等. 2001. 植物微生物区系和植物抗病性研究[J]. 河南农业科学, (5): 20-23. |
王贻莲, 陈燕平, 黄伟, 等. 2008. 苦瓜活性组分物质抑菌活性测定[J]. 植物保护, 34(2): 67-71. |
温哲屹, 师光禄, 苏学友, 等. 2008. 瑞香狼毒提取物对病原菌及桃酶的生物活性研究[J]. 北京农学院学报, 23(1): 25-29. |
伍慧雄, 王胜坤, 孙思. 2006. 桉树青枯病的发生与防治[J]. 广东林业科技, 22(3): 53-55. |
解文科, 王小青, 李斌, 等. 2005. 植物根系分泌物研究综述[J]. 山东林业科技, (5): 63-67. |
赵纯森, 黄俊斌, 周茂繁. 1994. 厚朴叶中抑菌活性成分鉴别及其防病效果[J]. 华中农业大学学报, 13(1): 373-377. |
朱正良, 樊建, 赵天瑞, 等. 2002. 青刺果提取液的抑菌对比研究[J]. 云南师范大学学报, 22(6): 49-54. |
Buxton E W. 1962. Root exudates from banana and their relationship to strains of the Fusarium causing Panama wilt[J]. Annals of Applied Biology, 50(2): 269-282. DOI:10.1111/aab.1962.50.issue-2 |
Cimanga K, Kambu K, Tona L, et al. 2002. Correlation between chemical composition and antibacterial activity of essential oils of some aromatic medicinal plants growing in the Democratic Republic of Congo[J]. Journal of Ethnopharmacology, 79(2): 213-220. DOI:10.1016/S0378-8741(01)00384-1 |
Coutinho T A, Roux J, Riedel K H, et al. 2000. First report of bacterial wilt caused by Ralstonia solanacearum on eucalypts in South Africa[J]. Forest Pathology, 30(4): 205-210. DOI:10.1046/j.1439-0329.2000.00205.x |
Kelmen A. 1954. The relationship of pathogenicity in Pseudomonas solanacearum to colony appearance on a terazolium medium[J]. Phytopathology, 44(12): 683-685. |
Roux J, Coutinho T A, Byabashaija D M, et al. 2001. Diseases of plantation eucalyptus in Uganda[J]. South African Journal of Science, 97(1-2): 6-18. |
 2011, Vol. 47
2011, Vol. 47