文章信息
- 翟俏丽, 范桂枝, 詹亚光
- Zhai Qiaoli, Fan Guizhi, Zhan Yaguang
- 真菌诱导子促进白桦悬浮细胞三萜的积累
- Accumulation of Triterpenoids in Betula platyphylla Suspension Culture Induced by a Fungal Elicitor
- 林业科学, 2011, 47(6): 42-47.
- Scientia Silvae Sinicae, 2011, 47(6): 42-47.
-
文章历史
- 收稿日期:2010-05-04
- 修回日期:2010-07-29
-
作者相关文章
近年来研究表明, 三萜类物质是白桦(Betula platyphylla)树皮的主要活性成分之一(范桂枝等, 2008; 尹静等, 2009), 具有镇咳祛痰, 清热利湿, 降血脂、抗肿瘤和抗HIV等功效(Alakurtti et al., 2006; Chen et al., 2009; Kessler et al., 2007; Laszczyk et al., 2006), 且高效低毒。然而, 从白桦树皮中分离和提取白桦三萜, 不仅造成资源的破坏, 而且作为新型药剂的临床研究和推广应用其数量受到限制。因此, 研究如何利用白桦细胞工程技术生产三萜物质对工业化生产白桦三萜具有现实意义。
前期研究表明, 白桦三萜物质可以在白桦愈伤组织中积累(王博等, 2008; 尹静等, 2009), 同时, 在白桦多种内生真菌中已经筛选出能有效提高三萜积累的真菌诱导子种类。而真菌诱导子对植物次生代谢产物合成的诱导效果不仅与诱导子的种类有关, 也与诱导条件有关, 如诱导子的添加浓度、诱导时间和植物细胞的生长状态等。因此本研究在实验室已有研究的基础上, 期望明确真菌诱导子的最佳诱导方案, 此外, 由于真菌诱导子的作用机制尚不明确, 且存在种属特异性, 因此本文对真菌诱导子诱导三萜积累的防御生理机制也进行了探讨。该研究将为利用细胞工程技术工业化生产白桦三萜奠定理论和技术基础, 具有潜在的应用价值和良好的推广前景。
1 材料与方法 1.1 白桦悬浮细胞用白桦组培苗茎段进行愈伤组织诱导, 使用NT固体培养基, 附加0.1mg·L-16-BA(6-benzyladenine)和0.01mg·L-1TDZ(thidiazuron), 20g·L-1蔗糖, 5.3g·L-1琼脂, pH6.0~6.5。每20~25天继代1次, 3次继代后将松散愈伤组织接入不加琼脂的NT液体培养基中悬浮培养。100mL摇瓶中盛有60mL培养液, pH5.5~6.0, 每瓶接种1g鲜质量的愈伤组织, 每隔15天继代1次。培养温度25~27℃, 光照强度2000lx, 光照16h·d-1, 摇床转速120r·min-1。待悬浮细胞生长稳定后进行诱导子处理。
1.2 真菌诱导子的制备和添加真菌诱导子的制备参照Farmer(1985)的方法, 将分离出的白桦内生真菌拟茎点霉属(Phomopsis)的菌丝在PDA液体培养基中发酵培养10天, 将菌体匀浆, 121 ℃高压灭菌20min后作为诱导子加入白桦悬浮培养液中。诱导子浓度以糖浓度表示, 糖含量用蒽酮比色法测定, 以葡萄糖为标准。分别在细胞生长的第3天(细胞处于生长初期)、第8天(细胞处于指数生长期)和第13天(细胞处于生长末期)添加诱导子, 在每个阶段的试验中都添加40, 100, 400 μg·mL-1 3种浓度的诱导子, 每种浓度诱导子分别与白桦细胞共培养1天、2天和3天。对照加入等体积的无菌水, 每种处理重复3次。
1.3 样品中三萜类化合物的提取和测定三萜类物质含量用紫外分光光度法测定(孙宏等, 2005)。将收获的白桦细胞烘干、研磨, 称取0.1g样品加入4 mL 95%乙醇浸泡过夜, 70℃水浴提取1h, 10kHz超声提取40min, 10000r·min-1离心10min, 移取100~200μL上清, 70℃水浴蒸干。加入200μL新配制的5%香草醛-冰醋酸溶液和800μL高氯酸, 摇匀, 70℃水浴15min, 流水冷却至室温, 加乙酸乙酯定容至5mL, 用1cm比色皿测定551nm处的吸光值。以白桦酯醇为标准品作标准曲线定量。在所测试的0.02~0.1 mg浓度范围内具有良好的线性关系, 回归方程为y=0.0871x +0.000 2, 相关系数R2=0.9995。
1.4 培养液pH值和电导率的测定向培养8天的白桦悬浮细胞中添加40μg·mL-1的真菌诱导子, 分别诱导2, 4, 6, 8, 10, 12, 24 h后过滤细胞, 在25℃条件下使用PHS-3C pH酸度计测定培养液的pH值, 使用DDS-11 A型电导率仪测定培养液的电导率。对照加入等体积的灭菌水, 每种处理重复3次。
1.5 苯丙氨酸解氨酶和过氧化物酶活性测定在培养8天的白桦悬浮细胞中添加40μg·mL-1的真菌诱导子, 分别诱导2, 4, 6, 8, 10, 12, 24h后收获细胞, 测定苯丙氨酸解氨酶(PAL)和过氧化物酶(POD)的活性。对照加入等体积的灭菌水, 每种处理重复3次。
PAL活性测定参考Koukol等(1961)的方法。取1g鲜质量的白桦悬浮细胞, 加入少量PVP和石英砂4℃研磨, 加入5mL预冷的酶提取液(0.1 mol·L-1磷酸盐缓冲液pH6.0, 含2 mmol·L-1 EDTA, 4 mmol·L-1 DTT)匀浆, 混匀后10000 g 4℃离心15 min, 上清为胞内酶待测液。1 mL酶待测液, 加入2 mL 0.01 mol·L-1, pH8.8的硼酸缓冲液, 1 mL 0.02 mol·L-1苯丙氨酸, 混匀, 测定290 nm处的吸光值。30 ℃保温30 min后, 测定290 nm处的吸光值。以每30 min吸光值增加0.01所需酶量为1个酶活性单位(U)。
POD活性测定参考李合生(2000)的方法, 反应体系包括:2.9 mL 0.05 mol·L-1磷酸缓冲液, 1.0% H2O2, 1.0 mL 0.05 mol·L-1愈创木酚和0.1 mL酶液。34 ℃保温3min后测定3 min内470 nm处吸光值的变化, 以每分钟吸光值变化0.01所需酶量为1个酶活性单位(U)。
1.6 统计分析每个处理重复3次, 采用Excell和SPSS软件处理数据, 用Tukey法对同一批取样后的数据进行多重比较分析。
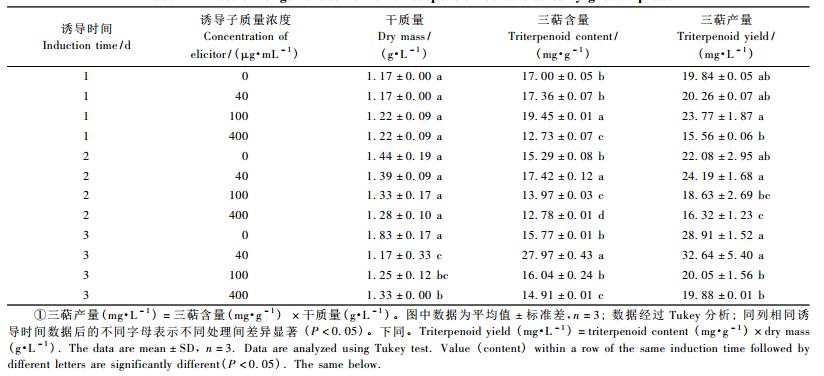
2 结果与分析 2.1 真菌诱导子对生长初期白桦悬浮细胞中三萜积累的影响将40, 100, 400 μg·mL-13种质量浓度的真菌诱导子添加到培养3天的白桦悬浮培养体系后发现, 诱导子处理1天和2天后细胞的干质量与对照相比变化不显著, 而处理3天后干质量与对照相比分别由1.83 g·L-1降低至1.17, 1.25和1.33 g·L-1, 差异达到显著水平, 其中40 μg·mL-1的诱导子抑制程度最大, 干质量仅是对照的64%。
白桦三萜的含量和产量对真菌诱导子的诱导浓度和诱导时间的响应程度不同:随着40 μg·mL-1的诱导子处理时间的延长, 三萜含量和产量呈增长趋势, 在处理3天后分别达到27.97 mg·g-1和32.64 mg·L-1; 而随着100和400 μg·mL-1的真菌诱导子处理时间的延长, 三萜含量和产量基本上都低于对照。由此可见, 40 μg·mL-1的诱导子有利于生长初期细胞中三萜的合成。
|
|
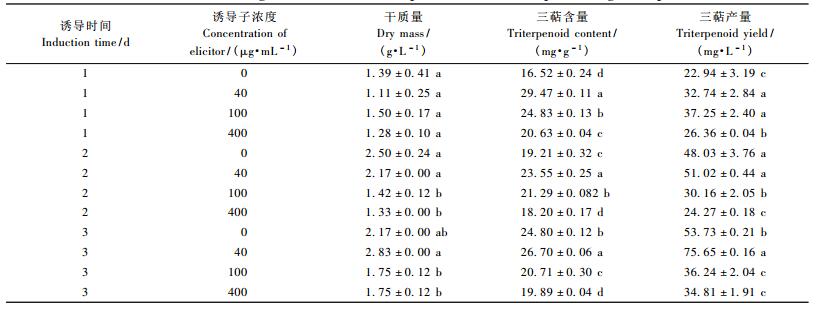
在白桦悬浮细胞培养的第8天, 分别加入40, 100, 400 μg·mL-13种浓度的真菌诱导子后发现, 细胞干质量积累呈下降趋势。其中, 400μg·mL-1的诱导子处理2天后, 干质量降幅最大, 由对照的2.50 g·L-1降为1.33 g·L-1, 降低了47%。
不同的诱导处理对白桦三萜含量和产量的影响不同, 诱导1天后, 三萜含量和产量均呈增长趋势, 40 μg·mL-1诱导子处理使三萜含量由对照的16.52 mg·g-1增长到29.47 mg·g-1, 提高了78%, 增幅最大。随着诱导时间的延长, 100和400μg·mL-1的诱导子抑制了三萜产量的积累, 与同期对照相比差异显著, 而40μg·mL-1诱导子处理3天后三萜产量达最大值75.65 mg·L-1, 比同期对照增长了41%。可见, 此阶段最好的诱导条件是添加40 μg·mL-1的诱导子诱导1天。
|
|
在培养13天的白桦悬浮细胞中分别添加40, 100, 400μg·mL-1的真菌诱导子, 结果表明:100和400μg·mL-1的诱导子分别处理2天和3天后均显著抑制了细胞, 其中400μg·mL-1的诱导子处理2天后对干质量的抑制程度最大, 由对照的5.08 g·L-1下降到2.92 g·L-1, 降低了43%。其他处理后干质量与对照的差异并不显著。
与白桦悬浮细胞的干质量变化相反, 诱导后细胞的三萜含量均呈上升趋势。但此时期的干质量积累却被较高浓度诱导子显著抑制了, 因此三萜产量却不是整个生长阶段的最大值。如100 μg·mL-1的诱导子诱导3天后三萜含量增幅最大, 由对照的12.50 mg·g-1升高到18.59 mg·g-1, 增长了49%, 而产量却为60.41 mg·L-1, 比对照降低了6.5%。对于综合细胞干质量和三萜含量的三萜产量而言, 其变化表现为:生长末期的对照细胞中三萜产量达到整个生长阶段的最大值, 而诱导处理后三萜的产量反而降低了, 其中40 μg·mL-1诱导子的影响并不明显, 400 μg·mL-1的诱导处理均显著降低了三萜的产量, 而100 μg·mL-1诱导处理2天后三萜产量降低最多, 由对照的64.87 mg·L-1降为47.02 mg·L-1, 降低了28%。
|
|
在诱导子处理的24h内, 培养液的pH值和电导率均高于对照(图 1), 差异达到显著水平, 其中诱导6h后培养液的pH值与同期对照相比增长最多, 由4.08升高到5.29, 是对照的1.30倍, 6h之后增长率有所降低。而随着诱导时间的延长, 培养液电导率与对照相比增长率逐渐增大, 至诱导后10h电导率达到最大, 是对照的1.73倍。

|
图 1 真菌诱导子对培养液pH值和电导率的影响 Figure 1 Effect of fungal elicitor on pH and conductivity |
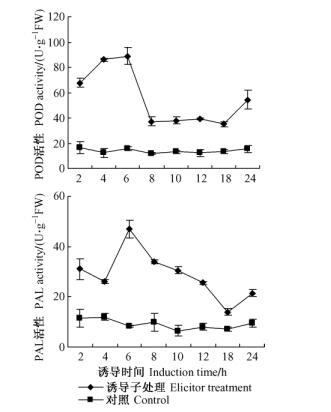
真菌诱导子对细胞防御酶POD和PAL活性的影响在诱导子处理的24h内, 细胞POD和PAL酶活性均显著高于对照(图 2)。POD和PAL酶活性均在诱导后6h达最高值, 分别为89, 47 U·g-1FW, 分别是对照的5.74倍和5.70倍。与诱导细胞相比, 对照细胞的POD和PAL酶活性在培养的24h内变化相对恒定, 分别为11.5~16.5 U·g-1 FW和6.5~12.0 U·g-1FW。
|
图 2 真菌诱导子对细胞POD和PAL活性的影响 Figure 2 Effect of fungal elicitor on POD and PAL activity |
真菌诱导子能有效促进植物次生代谢产物的积累(Xu et al., 2009; Conceicao et al., 2006), 其作用效果与细胞的生长阶段(Vasconsuelo et al., 2003; Kombrink et al., 1986)、诱导子的浓度(Kombrink et al., 1986; Namdeo et al., 2002)和作用时间等多种因素有关(刘长军等, 1996; Roewer et al., 1992)。本研究结果表明:处于生长初期、指数生长期和生长末期的白桦悬浮细胞对真菌诱导子的响应, 其中指数生长期白桦细胞对真菌诱导子的响应程度高于其他, 诱导后三萜含量增长了78%, 产量增长了62%;不同浓度的诱导子作用效果也不同, 40和100μg·mL-1诱导子适合于生长初期和指数生长期细胞的诱导, 而400μg·mL-1的诱导子对生长末期细胞的诱导效果好; 时间效应在对指数生长期细胞的诱导中最为明显, 诱导1天效果较好, 3天反, 最佳诱导条件为在指数生长期的白桦细胞中添加40 μg·mL-1的真菌诱导子诱导1天, 诱导后细胞中的三萜含量达29.47 mg·g-1, 比对照增长了78%。究其原因可能为:1)生长初期的细胞由于刚接入新营养液, 处于适应期, 真菌诱导对其生长和代谢损伤可能较大, 此阶段的细胞不易受到诱导, 较高浓度的诱导子可能抑制了细胞内正常的酶活性和代谢反应, 反而不利于次生代谢产物的积累。2)指数生长期的细胞处于生长和代谢旺盛期, 次生代谢产物积累较快, 未受诱导的细胞培养11天三萜含量达到最高峰。这个时期的细胞最容易接受诱导, 这也与其他学者的报道一致(Vasconsuelo et al., 2003; Kombrink et al., 1986), 本研究发现此阶段低浓度诱导子短期的诱导效果较好, 高浓度诱导子处理3天反而抑制了三萜的积累。3)生长末期细胞密度较大, 各种代谢活动减弱, 培养基中积累的一些代谢产物对细胞的生长不利, 因此三萜的积累较低, 但由于干质量积累较多, 三萜的产量反而高于前2个阶段。这个阶段的细胞接受诱导的能力减弱, 高浓度较长时间的诱导效果较好。
真菌诱导后培养液发生了明显的碱化, 诱导6h培养液碱化程度最大, pH值是对照的1.30倍。培养基碱化是诱导后的早期反应之一, 是植物产生防卫反应的最初标志(Boller, 1995)。Blein等(1991)在研究烟草(Nicotiana tabacum)细胞对真菌诱导子的响应时就发现诱导早期发生了培养液碱化和质膜去极化, 并指出这可能是因为膜功能的紊乱或者形成了变性的蛋白质。Zhao等(2005)研究也指出诱导子能激活植物细胞膜的离子泵, 发生K+/H+的交换, 伴随着Ca2+的内流和Cl-的外流, 导致培养基碱化和细胞质酸化, 细胞质酸化是引起信号转导所必须的, 继而引起了氧迸发和次生代谢产物的合成。
培养液电导率的升高代表了离子的渗透, 是病原菌引起植物细胞产生防御反应的一个生理表征, 可能是由于细胞坏死导致了电解质释放。辣椒疫霉(Phytophthora capsici)侵染胡椒(Capsicum annuum)悬浮细胞6 h后培养液电导率显著升高并持续至24 h(Garcia-Perez et al., 1998)。本研究同样也发现, 诱导处理增加了细胞膜的通透性, 培养液电导率高于对照, 诱导10h后电导率达到最大, 而电导率的升高滞后于pH值的升高。可能的解释是真菌诱导先引发培养液碱化, 培养液的碱化激发了质膜去极化和细胞膜的离子泵, 引发氧迸发和膜质过氧化, 从而导致了离子渗透的增加, 表现为电导率的升高(Blein et al., 1991)。
苯丙氨酸解氨酶(PAL)是苯丙烷类代谢途径的关键酶, 如植物植保素的形成要经过该途径(Kruger et al., 2003)。过氧化物酶(POD)是植物细胞抵抗各种物理、化学和生物胁迫的保护酶(Huckelhoven et al., 1999; Kristensen et al., 1999), 它通过调控O2-和H2O2的浓度来调节防御反应, 进而介导脂质过氧化反应, 促进次生代谢产物的合成(Xu et al., 2007)。许多研究表明诱导后防御酶活性的提高与次生代谢产物合成有密切的关系, 如真菌诱导子处理后, 云杉(Picea abies)悬浮细胞中PAL和POD活性都迅速升高, 分别是对照的10倍和1.5倍, 均参与了木质素的合成(Messner et al., 1993); 真菌诱导子也诱导了南方红豆杉(Taxus chinensis var.mairei)悬浮细胞中PAL的活性和天然二萜化合物紫杉醇的合成(Yuan et al., 2002; 徐茂军等, 2004)。本研究同样也发现, 真菌诱导6h后, POD和PAL活性都迅速升高, 之后有所下降, 而对照细胞中酶的活性一直处于较低的水平, 说明细胞受到真菌诱导后发生了防御反应, 由此推测苯丙烷类代谢途径和氧迸发可能参与了真菌诱导三萜的合成。
范桂枝, 詹亚光, 王博, 等. 2008. 激素配比对白桦悬浮细胞中三萜积累的影响[J]. 农业科学与技术, 2(12): 1-4. |
李合生. 2000. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社: 164-165.
|
刘长军, 侯嵩生, 李新明, 等. 1996. 真菌诱导子对悬浮培养西洋参细胞的生理效应[J]. 武汉植物学研究, 14(3): 240-246. |
孙宏, 张泽. 2005. 分光光度法测定白桦三萜类物质总量[J]. 南京林业大学学报:自然科学版, 29(1): 110-112. |
王博, 范桂枝, 詹亚光, 等. 2008. 不同碳源对白桦愈伤组织生长和三萜积累的影响[J]. 植物生理学通讯, 44(1): 97-99. |
徐茂军, 董菊芳, 朱睦元. 2004. NO参与真菌诱导子对红豆杉悬浮细胞中PAL活化和紫杉醇生物合成的促进作用[J]. 科学通报, 49(7): 667-672. |
尹静, 詹亚光, 李新宇, 等. 2009. 不同树龄白桦的不同器官及其组培苗诱导的愈伤组织中白桦酯醇和齐墩果酸的分布和含量变化[J]. 植物生理学通讯, 45(6): 610-614. |
Alakurtti S, Mäkelä T, Koskimies S, et al. 2006. Pharmacological properties of the ubiquitous natural product betulin[J]. European J Pharmaceutical Sci, 29(1): 1-13. DOI:10.1016/j.ejps.2006.04.006 |
Blein J P, Milat M L, Ricci P. 1991. Responses of cultured tobacco cells to cryptogein, a proteinaceous elicitor from Phytophthora cryptogeal[J]. Plant Physiol, 95(2): 486-491. DOI:10.1104/pp.95.2.486 |
Boller T. 1995. Chemoperception of microbial signals in plant cells[J]. Annu Rev Plant Physiol Plant Mol Biol, 46(1): 189-214. DOI:10.1146/annurev.pp.46.060195.001201 |
Chen Qihe, Liu Jing, Zhang Haifeng, et al. 2009. The betulinic acid production from betulin through biotransformation by fungi[J]. Enzyme Microb Tech, 45(3): 175-180. DOI:10.1016/j.enzmictec.2009.06.005 |
Conceicao L F R, Ferreres F, Tavares R M, et al. 2006. Induction of phenolic compounds in Hypericum perforatum L[J]. cells by Colletotrichum gloeosporioides elicitation.Phytochemistry, 67(2): 149-155. |
Farmer E E. 1985. Effects of fungal elicitor on lignin biosynthesis in cell suspension cultures of soybean[J]. Plant Physiol, 78(2): 338-342. DOI:10.1104/pp.78.2.338 |
Garcia-Perez M D, Egea C, Candela M E. 1998. Defence response of pepper(Capsicum annuum)suspension cells to Phytophthora capsici[J]. Physiol Plantarum, 103(4): 527-533. DOI:10.1034/j.1399-3054.1998.1030411.x |
Huckelhoven R, Fodor J, Preis C, et al. 1999. Hypersensitive cell death and papilla formation in barley attacked by the powdery mildew fungus are associated with hydrogen peroxide but not with salicylic acid accumulation[J]. Plant Physiol, 119(4): 1251-60. DOI:10.1104/pp.119.4.1251 |
Kessler J H, Mullauer F B, Roo G M, et al. 2007. Broad in vitro efficacy of plant-derived betulinic acid against cell lines derived from the most prevalent human cancer types[J]. Cancer Lett, 251(1): 132-145. DOI:10.1016/j.canlet.2006.11.003 |
Kombrink E, Hahlbrock K. 1986. Responses of cultured parsley cells to elicitors from phytopathogenic fungi[J]. Plant Physiol, 81(1): 216-221. DOI:10.1104/pp.81.1.216 |
Koukol J, Conn E E. 1961. The metabolism of aromatic compounds in higher plants[J]. Ⅳ.Purification and properties of the phenylalanine desaminase of Hordeum vulgare.J Biol Chem, 236: 2692-2698. |
Kristensen B K, Bloch H, Rasmussen S K. 1999. Barley coleoptile peroxidases[J]. Purification, molecular cloning, and induction by pathogens.Plant Physiol, 120(2): 501-512. |
Kruger W M, Szabo L J, Zeyen R J. 2003. Transcription of the defense response genes chitinase IIb, PAL and peroxidase is induced by the barley powdery mildew fungus and is only indirectly modulated by R genes[J]. Physiol Mol Plant P, 63(3): 167-178. DOI:10.1016/j.pmpp.2003.10.006 |
Laszczyk M, Jager S, Simon-Haarhaus B, et al. 2006. Physical, chemical and pharmacological characterization of a new oleogelforming triterpene extract from the outer bark of birch(Betulae cortex)[J]. Planta Med, 72(15): 1389-1395. DOI:10.1055/s-2006-951723 |
Messner B, Boll M. 1993. Elicitor-mediated induction of enzymes of lignin biosynthesis and formation of lignin-like material in a cell suspension culture of spruce(Picea abies)[J]. Plant Cell Tiss Org, 34(3): 261-269. DOI:10.1007/BF00029715 |
Namdeo A, Patil S, Fulzele D P. 2002. Influence of fungal elicitors on production of ajmalicine by cell cultures of Catharanthus roseus[J]. Biotechnol Prog, 18(1): 159-162. DOI:10.1021/bp0101280 |
Roewer I A, Colutier N, Nessier C L, et al. 1992. Transient induction of tryptophan decarboxylase(TDC)and strictosidine synthase(SS)genes in cell suspension cultures of Catharanthus roseus[J]. Plant Cell Rep, 11(2): 86-89. DOI:10.1007/BF00235259 |
Vasconsuelo A A, Giuletti A M, Picotto G, et al. 2003. Involvement of the PLC/PKC pathway in chitosan-induced anthraquinone production by Rubia tinctorum L[J]. cell cultures.Plant Sci, 165(2): 429-436. |
Xu Chunming, Zhao Bing, Ou Yuan, et al. 2007. Elicitor-enhanced syringin production in suspension cultures of Saussurea medusa[J]. World J Microbiol Biotechnol, 23(7): 965-970. DOI:10.1007/s11274-006-9321-3 |
Xu Maojun, Dong Jufang, Wang Huizhong, et al. 2009. Complementary action of jasmonic acid on salicylic acid in mediating fungal elicitorinduced flavonol glycoside accumulation of Ginkgo biloba cells[J]. Plant Cell Environ, 32(8): 960-967. DOI:10.1111/pce.2009.32.issue-8 |
Yuan Yingjin, Li Chun, Hu Zongding, et al. 2002. Fungal elicitorinduced cell apoptosis in suspension cultures of Taxus chinensis var.mairei for taxol production[J]. Process Biochem, 38(2): 193-198. DOI:10.1016/S0032-9592(02)00071-7 |
Zhao Jian, Davis L C, Verpoorte R. 2005. Elicitor signal transduction leading to production of plant secondary metabolites[J]. Biotechnol Adv, 23(4): 283-333. DOI:10.1016/j.biotechadv.2005.01.003 |
 2011, Vol. 47
2011, Vol. 47