文章信息
- 赵丽娟, 李淑娟, 于金海, 王柏臣, 杨传平
- Zhao Lijuan, Li Shujuan, Yu Jinhai, Wang Baichen, Yang Chuanping
- 小黑杨花粉离体萌发和细胞学分析
- n Vitro Germination and Cytology Analysis of Populus simonii×P.nigra Pollen
- 林业科学, 2011, 47(6): 36-41.
- Scientia Silvae Sinicae, 2011, 47(6): 36-41.
-
文章历史
- 收稿日期:2010-11-25
- 修回日期:2011-03-10
-
作者相关文章
2. 黑龙江省农业科学院作物育种所 哈尔滨 150086
2. Crop Breeding Institute, Heilongjiang Academy of Agricultural Sciences Harbin 150086
小黑杨(Populus simonii×P.nigra)是从小叶杨(P.simonii)与欧洲黑杨(P.nigra)的杂交组合中选育出的优良品种, 具有抗寒、抗旱、耐盐碱、速生等优良特性, 已成为黑龙江省平原地区普遍栽培的杨树品种。研究小黑杨花粉的离体萌发特性, 优化其离体培养基组分, 不仅可以揭示营养细胞、生殖细胞以及花粉管的生长发育过程, 而且对于杂交育种及花粉培养等具有理论和现实意义。
花粉离体萌发因其数据可靠并可完全定量而成为目前杂交育种中花粉生活力测定的首选方法(左丹丹等, 2007)。蔗糖、H3BO3和Ca2+作为花粉离体培养的基本组成成分在风信子(Hyacinthus orientalis)(李玉萍等, 2010)、唐菖蒲(Gladiolus gandavensis)(黄蓓丽等, 2009)、苦瓜(Momordica charantia)(张福平等, 2009)、核桃(Juglans regia)(吴开志等, 2008)、月季(Rosa chinensis)(王岚岚等, 2008)、水仙(Narcissus)(罗凤霞等, 2007)、青杄(Picea wilsonii)(田翠婷等, 2007)等很多植物中均有应用, 但不同植物所需的适宜浓度范围及培养条件有一定的差异。前人对杨树花粉离体萌发的主要影响因素也进行了研究, 结果概括为以下几个方面:温室水培花枝和采集花粉的适宜温度应保持在15~25 ℃; 开花后第1天和第2天采集的花粉质量最好; -20~-18 ℃下花粉贮藏效果比较好, 超低温保存是目前长期保存花粉的最理想方法之一; 升温解冻时, 在4 ℃下吸水2 h效果最好(杨志敏, 1990; 杜克兵等, 2007; 张亚利等, 2006; 艾鹏飞等, 2004; 朱湘渝等, 1982)。杨树花粉萌发培养基配方的研究很少, 都是利用固体培养基, 有的培养基中只加了10%~20%的蔗糖, 有的培养基中最佳蔗糖、H3BO3和Ca2+浓度分别为15%~20%, 100 mg·L-1和300 mg·L-1, 并认为适量的蔗糖与硼酸明显促进了杨树花粉的萌发, 但过量的蔗糖与硼酸对花粉的萌发均起到抑制作用; 适宜的pH值在5.5~6.5之间; 不同杨树花粉萌发对温度的要求不一样, 萌发的适宜温度为20~25 ℃; 花粉在培养基上的散布密度中等较好(Rajora et al., 1986; 杜克兵等, 2007; 朱湘渝等, 1982)。受自身遗传特性的影响, 要根据树种对各自适宜的条件稍做调整。
花粉的萌发和花粉管生长是实现受精作用的关键。另外, 花粉管的伸长具有典型的极性顶端生长模式, 因此, 国内外不少报道均以花粉管作为模式体系, 对细胞运动(Engel et al., 2005)、顶端或极性生长(Cole et al., 2006; Lee et al., 2008)、囊泡运输、细胞骨架变化及信号传导(Brown et al., 2000; Samaj et al., 2006)、细胞壁的力学特性(Geitmann, 2009; Zerzour et al., 2009)等进行了深入的研究。然而花粉能否正常萌发和花粉管能否正常生长则是进行上述各项研究的重要前提。目前, 还未见关于小黑杨花粉萌发液体培养基的相关报道。本研究首先对蔗糖、H3BO3、CaCl2、温度、pH值等进行了单因子试验, 确定了液体培养各因素的梯度范围; 然后利用正交试验设计, 探讨小黑杨花粉离体萌发的最适液体培养基配方, 以及适宜的培养温度和pH值, 优化了液体培养基的组分, 找出小黑杨花粉离体萌发的最适培养条件; 同时对花粉萌发的动态过程进行了细胞学的观察。本研究为小黑杨的杂交育种及花粉培养等研究提供理论依据。
1 材料与方法 1.1 花粉材料2009年4月14日采集东北林业大学校园内小黑杨含苞待放的雄花枝, 进行修剪, 每个枝条叶芽保留2~3个, 不好的花芽剪掉, 然后进行水培, 室温(17 ± 1)℃。5天后开花, 收集盛花期当天的花粉, 室温自然晾干24~48 h, 贮藏于-20 ℃冰箱备用。
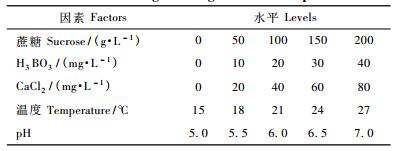
1.2 试验设计及方法 1.2.1 花粉的离体萌发小黑杨花粉萌发采用液体培养法, 液体培养基主要成分:蔗糖、H3BO3、CaCl2。试验设计: 1)单因素试验:为摸索花粉萌发的基本条件, 对蔗糖、H3BO3、CaCl2、温度及pH进行单因素试验(表 1); 除了温度因子, 其他因子的试验均在20 ℃下进行; 除蔗糖因子外, 其他因子试验在100 g·L-1的蔗糖浓度下进行。2)正交试验:在单因素试验的基础上, 为探讨花粉萌发和花粉管生长的最佳培养条件, 采用5因素4水平的正交试验。共配置16个组合, 每个组合3个重复。
|
|
将贮存于-20 ℃冰箱的花粉转移至5 ℃, 将花粉平摊于小培养皿内, 再将小培养皿放入盛适量水的稍大的培养皿中吸水复苏2 h, 在双孔凹型玻片孔内滴入0.08 mL的培养液, 用解剖针将复苏后的花粉点入培养液中, 将玻片放入保湿的培养皿内, 暗培养7 h。摸索出最佳培养条件后大量培养时, 可将5 mg花粉经300目的不锈钢网均匀地撒在5 mL液体培养基中。利用DPSv2.00对试验数据进行方差分析。
1.2.2 花粉萌发率的观察和统计在花粉培养1, 2, 4, 6, 7, 9 h时分别取样进行观察, 统计花粉的萌发率。萌发率=(萌发的花粉数/总的花粉数)×100%。每个组合重复3次, 每次所统计的花粉粒数目不少于300粒。
1.2.3 花粉细胞的荧光染色及观察DAPI为4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole), 是一种能够与DNA强力结合的荧光染料。对小黑杨成熟花粉粒进行DAPI染色:用离心机旋下液体培养的花粉细胞, 弃上清; 用DAPI-甲醇初染(工作浓度1 μg·mL-1), 旋下细胞, 弃染色液; 用DAPI-甲醇重悬细胞, 37 ℃温育15 min; 旋下细胞, 弃染色液; 加PBS重悬细胞; 制片, 在荧光显微镜(ZEISS Axioskop 40)下观察拍照, 最大的激发和发射波长分别为358, 461 nm, 整个过程要注意避光。花粉萌发的动态过程在光学显微镜下观察。
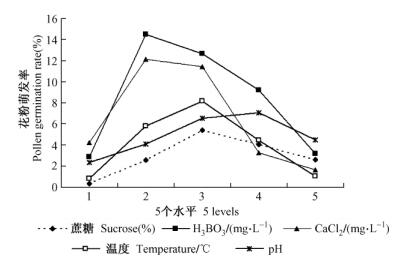
2 结果与分析 2.1 5个单因素对小黑杨花粉萌发的影响单因素试验结果表明:蔗糖、H3BO3、CaCl2、温度、pH值5个单因素方差分析均表现差异极显著(P<0.01)。如图 1所示, 总体的趋势是随着蔗糖、H3BO3、CaCl2浓度的增加, 温度和pH值的升高, 花粉的萌发率先增后减。蔗糖浓度为0时, 花粉几乎无萌发; 当蔗糖质量浓度增至100 g·L-1时, 萌发率达到最高; 100 g·L-1时显著下降。H3BO3质量浓度为10~20 mg·L-1时, 萌发率显著高于对照; 10 mg·L-1时萌发率最高; 40 mg·L-1时萌发率和对照差异不显著(P<0.05)。CaCl2质量浓度为20~40 mg·L-1时, 萌发率显著高于对照; 20 mg·L-1时萌发率最高, 但与前者差异不显著(P<0.05);当质量浓度增至60 mg·L-1时, 萌发率低于对照。温度为15 ℃时, 花粉萌发率极低; 当温度提高到25 ℃时, 花粉萌发率达到最高; 30 ℃时, 花粉萌发的速度明显加快, 但萌发率显著降低。当pH为6.0时, 萌发率显著高于对照; pH为6.5时, 萌发率最高, 但与pH为6.0时差异不显著(P<0.01);当pH增至7.0时, 萌发率显著下降。根据单因素试验得出小黑杨花粉萌发的最适条件为:蔗糖100 g·L-1, H3BO310 mg·L-1, CaCl220~40 mg·L-1, 温度25 ℃, pH 6.0~6.5。
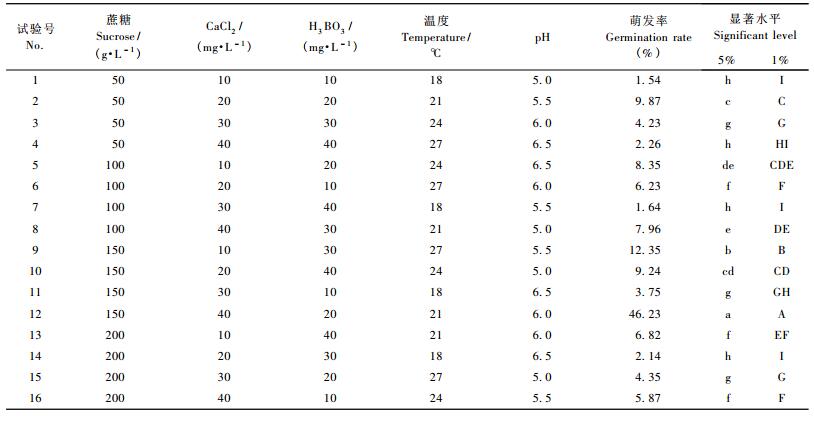
在单因子试验基础上, 为寻求蔗糖、H3BO3、CaCl2、温度和pH值单因子的最佳组合, 进行L16(4 5)正交试验(表 2)。对表 2中数据进行方差分析, 结果表明, 5个因子均对小黑杨花粉萌发具有极显著的影响:蔗糖F=1 158.80, P<0.01; H3BO3 F=1 013.30, P<0.01; CaCl2 F=740.28, P<0.01;温度F=1 224.38, P<0.01; pH值F=766.10, P<0.01。极差分析得出, 5因素对小黑杨花粉萌发的影响为:温度>蔗糖>H3BO3>CaCl2>pH。正交试验平方和比较分析的结果表明:蔗糖各种浓度下的花粉萌发率以150 g· L-1最高, CaCl2以40 mg·L-1最高, H3BO3以20 mg·L-1最高, 温度各个梯度下的花粉萌发率以21 ℃最高, pH以6.0最高。由此推论5个因子最适培养条件为:蔗糖150 g· L-1+ CaCl240 mg· L-1+ H3BO320 mg·L-1, 温度21 ℃, pH值6.0。这个组合在正交试验中已经出现, 是第12个处理组合, 用该培养条件进行培养时, 花粉的萌发率达到46.23%, 而且花粉管生长良好, 无异常现象。
|
|
通过光学显微镜观察小黑杨成熟花粉的离体萌发过程。用正交试验筛选出的第12组处理来培养花粉, 分别在暗培养了1, 2, 4, 6, 7, 9 h时取样, 统计萌发率。当培养到1 h的时候, 花粉粒已经吸水膨大, 进入萌动状态, 极个别的花粉已经微微伸出花粉管, 此时的花粉在形态上没有明显的改变, 但这时细胞内可能已经发生了生理生化的改变; 当培养到2 h的时候, 花粉的萌发率达到10.33%, 花粉管的长度平均达到30~50 μm; 随着培养时间的延长, 花粉萌发率逐渐提高, 花粉管不断伸长, 到6 h时花粉萌发率显著提高; 从6~9 h, 萌发率的增长趋于平缓, 此时花粉管的平均长度200~300 μm, 花粉管的生长状态良好(图 2)。通过整个动态过程的观察, 可以获悉:如果收集花粉管供研究使用, 培养到7 h左右就可以了, 萌发率好的情况能达到70%以上。

|
图 2 小黑杨花粉萌发过程的细胞学观察 Figure 2 TCytological observation of P.simonii × P. nigra pollen germination process A,B,C.分别为花粉萌发2,4,6 h的萌发状态; D -K.花粉萌发的动态过程。D.成熟花粉粒; E.吸水花粉粒; F.萌动的花粉粒; G.萌发的花粉粒; H -K.花粉管生长过程。 A, B, C. Pollen germination state at 2, 4, 6 h respectively; D -K. Dynamic process of pollen germination.D. Mature pollen; E. Hydrated pollen; F. Germinating pollen; G. Germinated pollen; H -K. Pollen tube growth |
通过荧光显微镜观察经DAPI染色的小黑杨成熟花粉粒, 利用紫外光波长的光线激发, 观察到小黑杨成熟花粉粒呈圆球状, 属2-细胞型, 1个大的营养细胞和1个小的生殖细胞。但在试验中也观察到有3-细胞型的花粉粒存在, 即含有1个营养细胞2个精细胞, 但所占比例很低, 统计1 500多个细胞, 3-细胞型的花粉大约占0.089%(图 3)。

|
图 3 小黑杨成熟花粉粒的DAPI荧光观察 Figure 3 DAPI fluorescent observation of P.simonii × P. nigra mature pollen A,B分别为普通光和DAPI荧光下的成熟花粉粒。 A, B are bright-field and DAPI fluorescence image of mature pollen, respectively. |
蔗糖是花粉粒萌发及花粉管壁合成的主要营养物质, 又是参与花粉代谢与跨膜运输的碳源, 在培养过程中不断被消耗以保持培养基的物理、化学稳定性(Fei et al., 2003)。在体外萌发过程中, 花粉中储存的营养物质对蔗糖浓度的调控非常重要, 所需要的蔗糖浓度随花粉所储存的营养物质发生变化(Feruzan et al., 2004)。蔗糖单因子和在正交试验中的结果均表明, 蔗糖对小黑杨花粉萌发有极显著的影响(P<0.01)。在培养基里未加蔗糖时, 小黑杨花粉几乎不萌发, 蔗糖质量浓度为50 g· L-1时, 很多花粉壁破裂, 花粉中的内容物被析出; 在0~150 g· L-1的质量浓度范围内, 随着蔗糖浓度的增加, 花粉的萌发率也逐渐提高, 当质量浓度为100~150 g· L-1时, 花粉管生长健壮, 花粉的内外渗透压平衡, 维持了花粉正常的生活力。小黑杨花粉萌发最适的蔗糖质量浓度为150 g· L-1, Richer等(2007)的研究也发现15%的蔗糖溶液为最优萌发条件。当蔗糖质量浓度为200 g· L-1时, 有近70%的细胞发生质壁分离。因而蔗糖浓度过高会抑制花粉萌发, 这与唐菖蒲(黄蓓丽等, 2009)、梨(Pyrus pyrifolia)(张绍铃等, 2005)、小麦(Triticum aestivum)(朱展望等, 2007)花粉萌发的试验结果一致。
H3BO3能增加糖的吸收、运转和代谢, 促进构成花粉管壁的成分果胶物质的合成(田翠婷等, 2007)。一般在自然条件下, 花粉自身硼的含量是不足的, 往往需要由柱头和花柱内的硼来补偿。Wang等(2003)认为硼离子浓度不足会降低花粉的萌发和阻碍花粉管生长, 而且会使花粉管的形态异常。H3BO3单因子和正交试验的结果均表明, H3BO3对小黑杨花粉萌发具有极显著的影响。硼是小黑杨花粉萌发必需的一种营养物质, 对花粉的萌发有显著的促进作用, 小黑杨花粉萌发适宜的H3BO3质量浓度为20 mg·L-1。不同植物种类的花粉萌发和生长所需的最适H3BO3浓度不同, 如核桃的最适H3BO3质量浓度为10 mg·L-1(吴开志等, 2008), 风信子适宜的H3BO3质量浓度为20~30 mg·L-1(李玉萍等, 2010)。
离体培养时花粉萌发需要适当的外源钙, 缺钙或钙浓度过高都会导致花粉萌发和花粉管生长受阻(龚明等, 1995; Sun et al., 2001)。姚成义等(2004)认为外源Ca2+可能通过花粉管上的钙通道调节花粉管内的动态来影响花粉管的生长, 尤其在花粉管的极性、顶端和定向生长过程中, Ca2+过高时, 由于牵拉型的Ca2+通道受到伤害, 致使花粉管生长受到抑制。在本研究中, CaCl2单因子和正交试验的结果均表明, CaCl2对小黑杨花粉萌发具极显著的影响。小黑杨花粉萌发适宜的CaCl2质量浓度为40 mg·L-1, 当CaCl2质量浓度达到60 mg·L-1时, 花粉的萌发率低于对照。由此看来, 小黑杨花粉细胞内游离钙较少, 补充一定的外源钙, 可促进花粉萌发和花粉管生长; 但过高浓度必定抑制花粉的萌发和花粉管的生长。培养基中的硼和钙是相互作用的, 在缺硼培养过程中, 花粉管胞质Ca2+的浓度发生变化, 并破坏花粉管顶端的Ca2+梯度, 最终抑制了花粉管的伸长(田翠婷等, 2007)。
3.2 温度和pH值对小黑杨花粉萌发的影响pH值和培养温度对花粉萌发和花粉管生长都有显著的影响。不同植物最适的pH值和培养温度存在差异。凯特杏(Prunus armeniaca ‘Katy’)花粉萌发的最适pH 6.0, 最适温度20 ℃(黄家兴等, 2008); 梨花粉萌发的适宜pH 6.5(张绍铃等, 2005); 陆地棉(Gossypium hirsutum)花粉萌发的适宜温度32 ℃(Kakani et al., 2005), 果梅(Prunus mume)花粉培养的适宜温度25 ℃(杜玉虎等, 2006)。单因素和正交试验结果表明, pH值及培养温度都对小黑杨花粉的萌发有极显著的影响。小黑杨花粉萌发的最适pH 6.0, 当pH7.0时, 花粉的萌发率急剧下降。小黑杨花粉萌发最适宜温度为21 ℃, 此温度与小黑杨授粉期的外界温度接近, 这与前人对杨树花粉离体萌发培养温度的研究结果相近(朱湘渝等, 1982; 杨志敏等, 1990)。过高或过低的pH值和温度都不利于小黑杨花粉的萌发和生长。
3.3 小黑杨成熟花粉粒的观察结果分析利用DAPI对小黑杨成熟花粉的核进行染色, 观察结果显示小黑杨的成熟花粉是2-细胞型花粉, 含有1个大的营养细胞和1个小的生殖细胞, 这是由于小孢子有丝分裂过程中纺锤体不对称而形成不均等分裂的结果。营养细胞内含大量淀粉、脂肪等物质, 营养细胞以后与花粉管的生成和生长有关; 而生殖细胞的作用是产生2个精子细胞, 直接参与生殖。在双细胞的花粉内形成了营养核包围生殖细胞结构形式的雄性生殖单位(Twell et al., 2006)。很明显, 与营养核相比较, 生殖核的染色质更加压缩, 精核仍旧保持着这种染色质压缩的本性。在进行观察的时候也看到了这种情况, 绝大多数花粉的2个核挨得很近, 或是重叠在一起, 但是生殖核的荧光信号比营养核强, 所以, 也能分辨出是2个核。试验中还观察到了较低比例的3-细胞型花粉粒, 可能是环境因素影响造成的(如水培花枝时的温度为17 ℃左右, 温度稍低, 正好赶上阴雨天, 光线不足), 真正的原因还需要进一步的分析研究。
艾鹏飞, 罗正荣. 2004. 柿品种—禅寺丸花粉超低温保存研究[J]. 华中农业大学学报, 23(5): 563-565. |
杜克兵, 沈宝仙, 许林, 等. 2007. 不同贮藏条件下杨树花粉活力变化及隔年杂交授粉应用的可行性研究[J]. 华中农业大学学报, 26(3): 385-389. |
杜玉虎, 张绍铃, 姜雪婷, 等. 2006. 果梅花粉离体萌发及花粉管生长特性研究[J]. 西北植物学报, 26(9): 1846-1852. |
龚明, 曹宗巽. 1995. 钙和钙调素对花粉萌发和花粉管生长的调控[J]. 植物生理学通讯, 31(5): 321-328. |
黄蓓丽, 耿兴敏, 胡凤荣, 等. 2009. 唐菖蒲花粉离体萌发的液体培养基研究[J]. 安徽农业大学学报, 36(4): 593-597. |
黄家兴, 吴杰, 安建东, 等. 2008. 凯特杏花粉的离体培养及影响因子分析[J]. 西北植物学报, 28(1): 52-58. |
李玉萍, 王春彦, 汤庚国, 等. 2010. 培养基组分和培养温度对风信子花粉萌发的影响[J]. 江苏农业科学, (1): 66-68. |
罗凤霞, 周威, 杨春起, 等. 2007. 水仙花粉离体萌发温度和培养液研究.[J]. 辽宁林业科技, (5): 13-14, 25, 57. |
田翠婷, 吕洪飞, 王锋, 等. 2007. 培养基组分对青杄离体花粉萌发和花粉管生长的影响[J]. 北京林业大学学报, 29(1): 47-52. |
王岚岚, 游捷, 俞红强, 等. 2008. 月季花粉离体萌发液体培养基组分的优化[J]. 河北农业大学学报, 31(3): 42-45. |
吴开志, 肖千文, 廖运洪, 等. 2008. 核桃花粉离体萌发的培养基研究[J]. 果树学报, 25(6): 941-945. |
杨志敏. 1990. 环境条件对杨树花粉生活力的影响[J]. 林业科学研究, 3(4): 388-392. |
姚成义, 赵洁. 2004. 钙和硼对蓝猪耳花粉萌发及花粉管生长的影响[J]. 武汉植物学研究, 22(1): 1-7. |
张福平, 王绿敏. 2009. 不同矿质营养对苦瓜花粉萌发和花粉管生长的影响[J]. 广东农业科学, (8): 72-74. |
张绍铃, 陈迪新, 康琅, 等. 2005. 培养基组分及pH值对梨花粉萌发和花粉管生长的影响[J]. 西北植物学报, 25(2): 225-230. |
张亚利, 尚晓倩, 刘燕. 2006. 花粉超低温保存研究进展[J]. 北京林业大学学报, 28(4): 139-147. |
朱湘渝, 王瑞玲. 1982. 杨树花粉生活力测定和贮藏试验[J]. 林业实用技术, (3): 1-4. |
朱展望, 张改生, 牛娜, 等. 2007. 小麦花粉的离体萌发研究[J]. 麦类作物学报, 27(1): 12-15. DOI:10.7606/j.issn.1009-1041.2007.01.007 |
左丹丹, 明军, 刘春, 等. 2007. 植物花粉生活力检测技术进展.[J]. 安徽农业科学, 35(16): 4742-4745. DOI:10.3969/j.issn.0517-6611.2007.16.015 |
Brown R C, Lemmon B E.. 2000. The cytoskeleton and polarizationduring pollen development in Carex blanda(Cyperaceae).[J]. American Journal of Botany, 87(1): 1-11. DOI:10.2307/2656679 |
Cole R A, Fowler J E. 2006. Polarized growth: maintaining focus on thetip[J]. Current Opinion in Plant Biology, 9(6): 579-588. DOI:10.1016/j.pbi.2006.09.014 |
Engel M L, Holmes-Davis R, Mccormick S. 2005. Green sperm:Identification of male gamete promoters in Arabidopsis[J]. PlantPhysiology, 138(4): 2124-2133. |
Fei S, Nelson E. 2003. Estimation of pollen viability, shedding pattern, and longevity of creeping bentgrass on artificial media[J]. CropScience, 43(6): 2177-2181. |
Feruzan D, Göksel O, Özlem D. 2004. In vitro pollen germination ofsome plant species in basic culture medium[J]. Journal of Cell andMolecular Biology, 3: 71-76. |
Geitmann A. 2009. How to shape a cylinder: pollen tube as a modelsystem for the generation of complex cellular geometry[J]. Sex PlantReprod, 23(1): 63-71. |
Kakani V G, Reddy K R, Koti S, et al. 2005. Differences in in vitropollen germination and pollen tube growth of cotton cultivars inresponse to high temperature[J]. Annals of Botany, 96: 59-67. DOI:10.1093/aob/mci149 |
Lee Y J, Yang Z B. 2008. Tip growth: signaling in the apical dome.[J]. Current Opinion in Plant Biology, 11(6): 662-671. DOI:10.1016/j.pbi.2008.10.002 |
Rajora O P, Zsuffa L. 1986. Pollen viability of some Populus species asindicated by in vitro pollen germination and tetrazolium chloridestaining[J]. Canadian Journal of Botany, 64(6): 1086-1088. DOI:10.1139/b86-148 |
Richer C, Poulin M, Rioux J A. 2007. Factors influencing pollengermination in three explorer TM roses[J]. Canadian Journal of PlantScience, 87(1): 115-119. DOI:10.4141/P05-247 |
Samaj J, Müller J, Beck M, et al. 2006. Vesicular trafficking, cytoskeleton and signalling in root hairs and pollen tubes[J]. Trends inPlant Science, 11(12): 594-600. DOI:10.1016/j.tplants.2006.10.002 |
Sun Y, Sun D Y. 2001. Signal transduction in pollen germination andtube growth[J]. Acta Botanica Sinica, 43(12): 1211-1217. |
Twell D, Oh S A, Honys D. 2006. Pollen development, a genetic andtranscriptomic view[J]. Plant Cell Monographs, 3: 15-45. DOI:10.1007/11493198 |
Wang Qinli, Lu Longdou, Wu Xiaoqin, et al. 2003. Boron influencespollen germination and pollen tube growth in Picea meyeri[J]. TreePhysiology, 23(5): 345-351. |
Zerzour R, Kroeger J, Geitmann A. 2009. Polar growth in pollen tubes isassociated with spatially confined dynamic changes in cellmechanical properties[J]. Developmental Biology, 33(4): 437-446. |
 2011, Vol. 47
2011, Vol. 47