文章信息
- 燕丽萍, 夏阳, 毛秀红, 刘翠兰, 王太明, 李丽, 李双云
- Yan Liping, Xia Yang, Mao Xiuhon, Liu Cuilan, Wang Taiming, Li Li, Li Shuangyun
- 邓恩桉的组织培养
- Tissue Culture of Eucalyptus dunnii
- 林业科学, 2011, 47(5): 157-161.
- Scientia Silvae Sinicae, 2011, 47(5): 157-161.
- DOI: 10.11707/j.1001-7488.20110526
-
文章历史
- 收稿日期:2010-03-30
- 修回日期:2010-05-10
-
作者相关文章
为了满足人们对木材与木质纤维的需求,桉树已成为南方工业原料林的主要造林树种,并不断北移扩大栽植。因大多数桉树不耐寒,限制了许多速生桉树的北移栽植。邓恩桉(Eucalyptus dunnii)原产澳大利亚,抗寒,速生,树干通直,木质粗细均匀,耐干旱,抗病性强,用途广泛,可作刨花板材、纸浆材、木片材等,已成为推广扩大桉树人工林种植范围的首选树种,抗寒性是选择该树种向北引种的重要因子。但从目前市场形势看,国内大面积种植邓恩桉还有很多问题尚待解决。由于邓恩桉在澳大利亚分布有限,产种量少,而国内邓恩桉难以开花结实,不能生产种子,种子价格昂贵,纯度较高的种子平均售价高达7万元·kg-1,且遗传性状不稳定,严重制约了该树种的发展。因此,进行邓恩桉组培快速繁殖对开发和利用桉树资源具有重要的意义。
Cortezzi Graça等(1989)首先用茎段诱导获得邓恩桉组培再生植株。Termignoni等(1996)以3日生种苗为材料诱导了体细胞胚胎的发生,陈研华等(2004)、易敏等(2005)、马英等(2006)、易霭琴等(2007)、王以红等(2005;2008)、宋建英(2008)主要采用下胚轴、萌芽条的茎段、半木质化的带芽茎段、种子实生苗的带芽茎段和种子等为外植体,通过不同基本培养基、不同激素组合、谷氨酸、抗氧化剂以及不同的光源和光强对邓恩桉组培试管苗不定芽的分化和增殖进行研究,芽的增殖系数较低,为2~4。欧阳磊(2006)和林彦等(2007)研究了生长素(ABT,IBA,NAA)、活性炭、大量元素、微量元素、有机物、蔗糖、温度及光照等对组培苗生根的影响,结果表明不同无性系之间的生根率差别非常大,大部分株系生根率很低,约为20%。彭信海等(2002)申请了“邓恩桉组培育苗方法”的专利,试管苗的繁殖系数仅为3,生根率未见报道。虽然近几年关于邓恩桉已做了不少的研究,无论组织培养还是扦插育苗,至今还未能应用于生产实践,培育无性系苗一直是该树种生产上的一大难题。尤其是邓恩桉生根极为困难,已成为目前国内外组培中的难点。本文对邓恩桉的增殖培养、壮苗培养和生根进行了研究,通过三步诱导,探索出了一套邓恩桉的离体快速繁殖体系,解决了培养中遇到的顶端死亡等问题,为邓恩桉无性快繁工厂化育苗提供了有力的理论与实践基础,同时为下一步的转基因育种工作提供重要的试材。
1 材料与方法 1.1 试验材料由中国林业科学研究院提供的邓恩桉种子。
1.2 试验方法1) 无菌材料培养 选无病害饱满邓恩桉种子,放入经过灭菌处理的1.5 mL离心管中,70%乙醇处理30 s,再用0.1% HgC12处理3 min,用无菌水漂洗4次。将灭菌后的种子转入无菌培养皿中,用无菌滤纸吸干多余水分后,将种子放于MS培养基上,每瓶5粒,12瓶,共60粒种子,置于(23±2) ℃培养室内黑暗培养。
2) 芽增殖和壮苗试验 以改良WPM为基本培养基,添加30 g·L-1的葡萄糖和5 g·L-1的琼脂,pH值5.6(下同)。进行3因素3水平设计L9(34)正交试验,共9个处理,每一处理接入5个不定芽,重复6次。25天左右统计增殖系数、平均苗高等生长情况,筛选最适继代培养基及激素配比。培养条件(下同)为:温度(25±2) ℃,光照强度2 000~3 000 1x,光照时间12~14 h·d-1,培养室空气相对湿度70%左右。
3)生根培养 将壮苗培养中生长一致、株高3~4 cm的苗接种于改良1/2 MS和1/2 MS各种培养基上,每一处理15瓶,每瓶4株,20天后统计生根情况。
4) 炼苗与移栽 试管苗生根后,将生根苗的瓶盖逐渐打开,在驯化培养室内过渡培养,取出小苗,洗净根部培养基,将生根的试管苗移植于用0.15%多菌灵预处理的不同混合基质中,保湿培养,移栽于大田,25天后调查成活率。
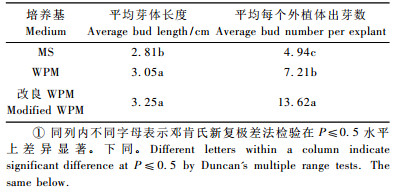
2 结果与分析 2.1 增殖培养1) 邓恩桉增殖基本培养基的筛选 从表 1可以看出,增殖培养过程中,培养基大量元素的种类直接影响试管苗发芽的数量以及质量,最佳的增殖培养基是改良WPM,其试管苗生长良好,粗壮,不定芽褐化明显减轻,增殖系数达到13倍以上。而MS则是生长情况最差的培养基,不仅整个试管苗的增殖系数较低,并且试管苗伴随着一定的玻璃化,不定芽褐化较重。
|
|
2) 碳源对邓恩桉茎顶端死亡的影响 在3种碳源的对比试验中,在葡萄糖作为碳源的培养基上,顶端死亡的现象得到了很好的控制,97.8%植株生长良好。而使用蔗糖以及果糖的培养基试管苗则出现明显的顶端死亡现象,死亡率达到20%以上,二者无显著差异。因此在下一步的试验中碳源使用葡萄糖作为邓恩桉离体培养的碳源。
综上所述,邓恩桉最佳的增殖生长的基本培养基为改良WPM培养基,即WPM大量元素+MS微量元素+MS铁盐+SC有机成分+30 g·L-1葡萄糖。该培养基解决了组培苗褐化、顶端死亡等组培中比较严重的问题。
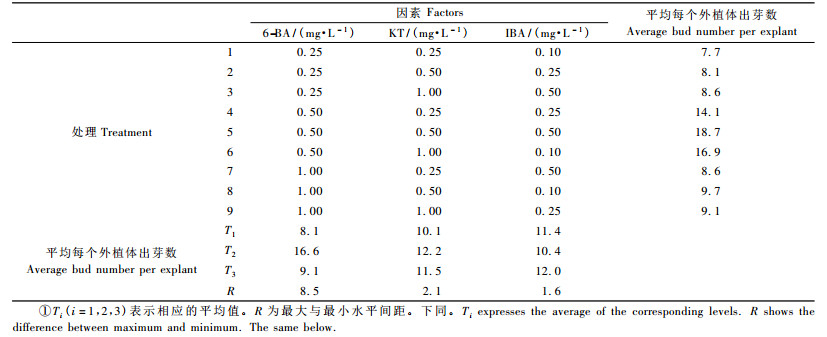
3) 不同生长调节剂对芽增殖的影响 将获得的无菌实生苗接种到芽增殖培养基上,培养7天后,每组芽都有所增殖,并且多组茎段基部切口处出现少量绿色砂砾状或小米粒状愈伤组织。当培养到第15天时,芽增殖率最高与芽质量最优的分别是第4,5,6组,愈伤组织变化不大。由表 2可以看出3因素极差的大小,对芽增殖率高低产生的效应由主到次的因素顺序依次是6-BA,KT,IBA,对其进行方差分析,得出6-BA表现差异显著,KT与IBA均不显著,说明6-BA浓度的变化会引起芽增殖率的显著变化,而KT与IBA浓度的变化不会引起芽增殖率的显著变化。极差分析表明3个因素的最佳水平组合为6-BA2KT2IBA3,刚好是试验的第5组合改良WPM+0.5 mg·L-1 6-BA+0.5 mg·L-1 KT+ 0.5 mg·L-1 IBA+30 g·L-1葡萄糖+5 mg·L-1琼脂,其平均芽增殖率最高,是18.7(图 1a),且芽质量良好,为最佳芽增殖培养基配方。
|
|

|
图 1 邓恩桉组织培养体系的建立 Figure 1 Establishment of Eucalyptus dunnii tissue culture system a.芽增殖; b.壮苗培养; c,d.组培完整的植株; e,f.定植组培苗。 a. Shoot multiplication; b. Growing culture; c, d. Successfully rooted plantlets; e, f. Plantlets transplanted into pots. |
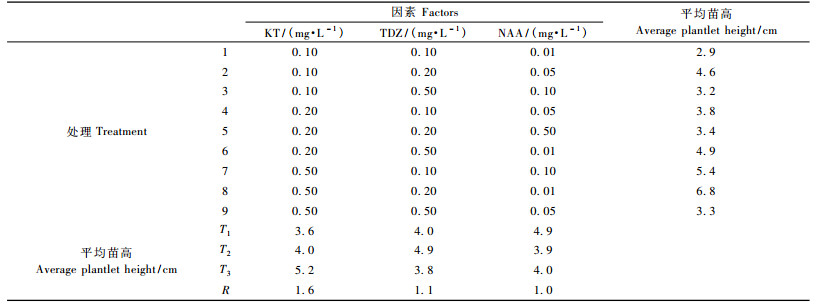
在增殖培养基上长期继代,形成大量丛芽,不长高,叶边缘出现白色的颗粒。为了提高生根效率,进一步进行壮苗培养(图 1b)。由表 3极差结果可知,极差R最大的因素是KT,其水平变化对邓恩桉苗高的影响最大,是影响邓恩桉苗高的主要因素,3个因素对邓恩桉苗高影响的主次关系为: KT>TDZ>NAA。从试验结果来看,9个处理中以第8号处理即改良WPM+0.5 mg·L-1 KT+0.2 mg· L-1 TDZ+ 0.01 mg·L-1 NAA为最佳壮苗培养基,苗高可达6.8 cm。经极差分析后,3个因素的最佳水平组合为KT3TDZ2NAA1。
|
|
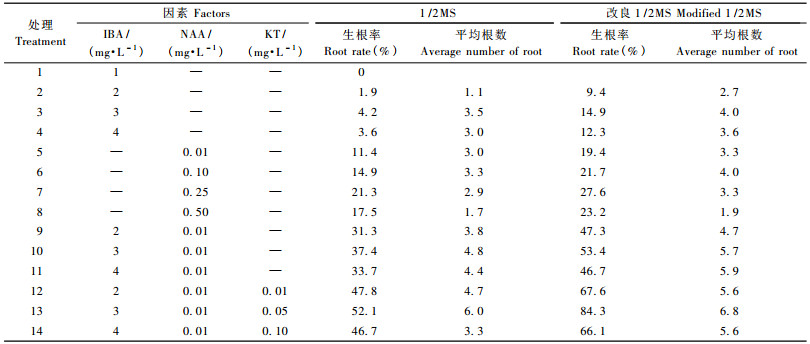
壮苗培养15~18天后,将苗高4 cm左右的芽接种于附加不同浓度IBA,NAA,KT的1/2MS或改良1/2MS培养基上(表 4),6天后在基部切口处产生浅黄色愈伤组织,13天开始产生白色不定根。有的小根产生于茎段基部,有的产生于茎段产生的愈伤组织内部(图 1c,d)。说明不定根可以直接产生也可以经脱分化再分化途径产生。由表 5看出,基本培养基和IBA,NAA,KT浓度对根的诱导率影响很大,在同一激素水平上,改良1/2MS生根率、生根数明显高于1/2 MS,单独使用IBA,NAA生根率很低,最高为27.6%。最适生根培养基为改良1/2 MS+ 3.0 mg·L-1 IBA+0.01 mg·L-1 NAA+0.05 mg·L-1 KT+20 mg·L-1蔗糖+5 mg·L-1琼脂。
|
|
|
|
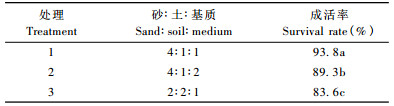
当根长达O.5~1.0 cm时,把生根的瓶苗移到遮光度80%~90%遮荫网塑料大棚温室条件下适应1天,逐渐打开瓶苗封口膜降低湿度,2~3天后用镊子将苗夹出,用清水洗去基部残留的培养基,移栽到装有混合基质育苗盘中,利用间歇喷雾装置或人工喷水保持相对湿度在80%以上,经驯化炼苗5~6天,栽入盆栽基质(沙壤土:炉灰:育苗基质= 5:1:1的体积比,育苗基质购于寿光市恒先育苗基质加工厂)中继续培养3~4天后,然后转移到遮光度约50% ~ 60%遮荫网通风棚内培养8~12天定植于大田。由表 5可知,以细砂:土:基质= 4:1:1的体积比混合基质中成活率最高,为93.8%(图 1e,f)。
3 结论与讨论邓恩桉属于离体难以生根、组织培养困难的顽拗型植物类型。目前邓恩桉的一个重要的育种方向就是培育能够在北方地区种植的耐寒品种。培育途径为:从邓恩桉品系中选择耐寒的品种,或者采用转基因育种技术导入抗寒基因。无论常规育种还是分子育种,必须有一个完整的离体快繁体系作为基础的技术支撑。因此,本研究建立的邓恩桉组织培养对于工厂化育苗和育种工作来说有着重要的意义。
邓恩桉一般在接种12 h后就开始出现褐变,最后导致外植体死亡。不同种类的培养基营养元素不同,不定芽的诱导率及诱导的不定芽质量差异很大。本研究发现改良WPM培养基诱导率最高,表明适当降低无机盐含量有利于不定芽分化诱导,褐化减轻,生长健壮,这可能是改良WPM培养基含有50 mg·L-1抗坏血酸Vc和较高的CaCl2的缘故,与平榛(Corylus heterophylla)加入Vc降低褐化比率、提高成活率的结果一致(程云清等,2008)。
植物生长调节物质在试管苗增殖中起决定性作用,由于内源激素难以测定,因此,外源激素的加入靠一系列的试验来验证。本试验采用正交设计方法,减少了试验次数和试验分析方法的繁杂,克服在培养及配方设计上的盲目性,提高了试验效率和准确性。在邓恩桉芽增殖试验中,筛选出的培养基配方有效芽增殖系数高达18.73,远远高于6.368(易霭琴等,2007)和3.4(蒋淑磊等,2008)。然而,随着继代培养次数的增加,试管苗分化出的芽小且多,有效芽变少,植株茎尖出现坏死。进一步调节培养基激素种类和配比,在改良WPM+0.5 mg·L-1 KT+ 0.2 mg·L-1 TDZ+0.01 mg·L-1 NAA壮苗培养基上,发现这些植株又重新抽出正常的叶和茎来,茎粗壮,且株高达6.8 cm,KT在丛芽高生长方面起主导作用,能使丛芽节间伸长。
邓恩桉试管苗生根培养过程中发现,不经过壮苗培养的大多数根是从植株下端愈伤组织分化出来的,而这些愈伤组织阻滞上下之间的畅通,导致发出的根和茎之间无维管组织的直接联系,养分水分上下运输困难,造成移栽成活率低,且生根率很低。通过壮苗培养后的试管苗,生根率达84.3%。因此,本研究通过芽增殖培养、壮苗培养后,再诱导生根,此三步是邓恩桉组织培养体系成功的关键。
提高生根试管苗成活率,是快繁技术能否大量应用于生产,是否有效益的关键。试管苗一般在高湿、弱光、恒温下异养培养,其根无根毛或根毛极少,叶表无保护组织或不发达,易于失水萎蔫。因此,需打开瓶口炼苗驯化,再出瓶移栽,初期保持高湿、弱光、适当通气和较低温度。本试验采用炼苗3~4天,在装有细砂:土:育苗基质= 4:1:1育苗盘中过渡移栽到大田的成活率达93.8%。细砂具有很强的吸水性,可防止由于根部水分过多,而造成的烂根现象,土质中含有丰富的营养物质可为成活苗的生长提供必需的营养元素。
陈研华, 林文革, 李海花, 等. 2004. 邓恩桉的组培技术[J]. 林业科技开发, 18(1): 34-35. |
程云清, 刘剑锋, 陈智文. 2008. 平榛组织培养与快速繁殖[J]. 林业科学, 44(12): 57-61. DOI:10.3321/j.issn:1001-7488.2008.12.010 |
蒋淑磊, 徐刚标. 2008. 邓恩桉丛生芽的诱导[J]. 经济林研究, 26(2): 69-27. |
林彦, 谢耀坚. 2007. 邓恩桉组织培养技术研究[J]. 桉树科技, 24(1): 16-21. |
马英, 刘友全, 欧阳磊. 2006. 邓恩桉组培中影响继代增殖条件的研究[J]. 林业科技开发, 20(1): 16-18. |
欧阳磊. 2006. 邓恩桉组培生根影响因子的研究[J]. 福建林学院学报, 26(1): 78-82. |
彭信海, 蒋利媛, 夏晓敏, 等. 2002. 邓恩桉组培育苗方法: 中国, CN02114142. 8.
|
宋建英. 2008. 邓恩桉种子组织培养的研究[J]. 中南林业科技大学学报, 28(6): 75-80. |
王以红, 吴幼媚, 蔡玲. 2005. 邓恩桉下胚轴培养和植株再生的研究[J]. 广西林业科学, 34(4): 167-169. |
王以红, 吴幼媚, 蔡玲. 2008. 几种因子对邓恩桉组培中不定芽培养影响的研究[J]. 西部林业科学, 37(1): 25-29. |
易霭琴, 童方平, 宋庆安, 等. 2007. 邓恩桉继代增殖培养条件研究初报[J]. 中国农学通报, 23(12): 154-157. DOI:10.3969/j.issn.1000-6850.2007.12.035 |
易敏, 冉隆贤, 汤历. 2005. 邓恩桉的组织培养技术研究[J]. 广东林业科技, 21(2): 19-21. |
Cortezzi Graça M E, Mendes S. 1989. Micropropagation of Eucalyptus dunnii Maid[J]. Forest Tree Physiology, 46(suppl.): 140-144. |
Termignoni R R, Wang P J, Hu C Y. 1996. Somatic embryo induction in Eucalyptus dunnii[J]. Plant Cell, Tissue and Organ Culture, 45(2): 129-132. DOI:10.1007/BF00048755 |
 2011, Vol. 47
2011, Vol. 47