文章信息
- 郑元, 赵忠, 周慧, 周靖靖
- Zheng Yuan, Zhao Zhong, Zhou Hui, Zhou Jingjing
- 晴天和阴天对刺槐光合生理特性的影响
- Effects of Sunny and Cloudy Days on Photosynthetic and Physiological Characteristics of Black Locust
- 林业科学, 2011, 47(5): 60-67.
- Scientia Silvae Sinicae, 2011, 47(5): 60-67.
-
文章历史
- 收稿日期:2010-05-21
- 修回日期:2010-12-08
-
作者相关文章
光合作用是植物物质生产的基础,也是碳循环及生态水文循环的关键环节(Tuittila et al., 2004),在植物界甚至全球生态系统能量与物质循环中都具有重要的作用(潘瑞炽,2001; 周广胜等,2003)。林木的光合作用也是决定森林生产力的最重要的生理过程,它不仅取决于树木自身的光合特性,更不可避免地受到外界自然环境的影响(张小全等,2000)。其中,天气条件作为直接导致外界环境变化的重要因素,与林分的光合作用之间联系密切(彭少兵等,2007; 王广军等,2008; 郑文君等,2007; Alton,2008; Wu et al., 2009),但是其表现因不同地区、不同类型森林而异(Alton,2008; Hollinger et al., 1994; Letts et al., 2005),因此关于天气条件对植物光合生理特性的影响程度,至今仍存在较大的争议。
渭北地区的生态环境脆弱,刺槐(Robinia pseudoacacia)由于具有较强的适应性与抗逆性,是黄土高原水土保持先锋树种的代表,近几十年在陕西省大面积种植,在黄土高原的植被恢复和生态建设中起到关键的作用,也逐渐成为黄土高原的一个重要碳库(Cao et al., 2009)。而对于刺槐在晴天和阴天光合生理特性差异研究尚未见报道。本文分别比较分析不同季节晴天和阴天条件下,刺槐的光合作用日进程、光合参数日均值、光合光响应曲线的差异,探讨刺槐在年生长初期和旺盛期的晴天和阴天对光合生理特性的影响程度和季节对比,以期为渭北地区林分光合生产力的评估和模拟提供理论参考,也为该区刺槐林的生产管理提供科学依据。
1 材料与方法 1.1 研究地概况研究地位于陕西省永寿县马莲滩流域,地处黄土高原南部的残塬沟壑区,108°07’E,34°48’N,海拔1 196 m。研究地的年均气温为10.8 ℃,年均降水量为601.6 mm,多集中于7,8,9月,占全年雨量的52.2%~52.6%。年均自然植被蒸腾蒸发量807.4 mm。地带性土壤为淋溶性褐土和黑垆土等。土壤平均有机质含量1.0%,碱解氮44.2 mg·kg-1,速效磷1.9 mg·kg-1,速效钾189.1 mg·kg-1。
在研究地的19年生刺槐人工林中,在阳向缓坡立地条件下,选择3个林相整齐的林分,每个林分中设置3块样地(20 m×20 m),进行每木检尺,确定平均木并从中筛选1株样木。样地内刺槐的树高用测高计测量,胸径用测径器测量。光照辐射、冠层气温和空气相对湿度由便携式光合作用系统(Li-Cor 6400;Li-Cor Inc.,Lincoln,NE,USA)自动记录,其日均值由全天实测点的平均值表示。刺槐林样地概况见表 1。
|
|
由于刺槐是落叶树种,每年4月叶片开始萌发至11月叶片凋落,年生长时期约为6个月(邹年根,1986; Feldhake,2001)。选择刺槐的年生长初期和旺盛期,分别于2009年6月3,4,6日和8月9,10,12日的典型晴朗基本无云天气条件,以及2009年6月10,11,14日和8月2,4,5日的典型阴天多云天气条件,利用脚手架工作平台到达冠层高度,原位测量刺槐叶片的气体交换进程。在晴天的测量过程中,偶尔也会遇到云层短时间遮住太阳的情况,为了保证太阳光强的相对稳定,此时暂停测量该叶片,等到云层移出后太阳直射光照射叶片时,重新测量并待仪器读数稳定后记录数值。在阴天的测量过程中,太阳在全日进程中几乎一直被云层遮盖,绝大多数时刻以散射光形式照射叶片。
在确定刺槐树冠中层西方的光合作用可以代表整个冠层的光合作用的基础上(郑元等,2010),选取树冠中层西方生长正常的枝条上前端第5~7片的成熟健康叶片,每个测定日从6: 00—18: 00,每2 h采用便携式光合作用系统测定叶片的光合生理生态指标。
净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)、水汽压亏缺(VPD)、光合有效辐射(PAR)、空气温度(Ta)、空气CO2浓度(Ca)、空气相对湿度(RH)被便携光合作用系统同时自动记录,瞬时光能利用率(LUE)=Pn/PAR×1 000,单位为μmol CO2 · mmol-1 photon(Penuelas et al., 1998)。
1.3 光合光响应曲线测量从每个林分已选定的3株样木中,选择1株同时测定刺槐叶片净光合速率(Pn)对光合有效辐射(PAR)的响应。考虑到植物本身的生物钟会影响其气孔开闭及光合酶的活性,并为了避免A/PAR曲线受到一天中环境波动的影响,因此测定时间选择在每个测定日的上午9:00—11:00进行,利用光合仪器上的红蓝光源,设定光合有效辐射梯度为2 000,1 800,1 500,1 200,1 000,800,600,400,200,150,100,50,20,0 μmol·m-2s-1,仪器自动记录。
1.4 光合光响应曲线参数估计采用非直角双曲线方程(Herrick et al., 1999; Prioul et al., 1977),拟合刺槐叶片的光合光响应A/PAR曲线:

|
式中:表观量子效率(AQY)、最大光合速率(Pmax)、暗呼吸速率(Rd)、曲角(k)、光补偿点(LCP)由方程拟合得到,光饱和点(LSP)由A/PAR曲线的响应趋势估计得到(陈根云等,2006; 杨秀芳等,2009; 张小全等,2000)。
1.5 统计分析数据的统计分析通过SPSS 13.0完成,文中图形在Origin 7.5科技绘图软件中完成。所有数据由平均值±标准误(SE)表示。
2 结果与分析 2.1 刺槐光合生理生态参数在晴天和阴天的差异为探讨晴天和阴天对渭北地区刺槐光合作用的影响,分别在6和8月的典型晴朗无云和阴天多云条件下,比较分析刺槐的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)、水汽压亏缺(VPD)、光合有效辐射(PAR)、空气温度(Ta)、空气CO2浓度(Ca)、空气相对湿度(RH)、光能利用率(LUE)等光合生理生态因子的差异。
2.1.1 刺槐光合生理生态参数日进程在晴天和阴天的对比从刺槐光合生理生态参数的日进程结果可知:无论在6月还是8月,虽然各参数在晴天和阴天的日动态趋势相似,但天气情况对它们有着显著的影响(图 1)。刺槐的Pn在晴天和阴天都呈单峰曲线,在晴天的10: 00到达峰值,而在阴天的12:00达到最大值(图 1a,b)。这是由于晴天的早晨自太阳升起,Pn随时间快速上升,10:00达到全天最大值,PAR也几乎达到当天的最大值,并且由于此时大气温湿度适宜,气孔充分开启,刺槐体内的水分经过一夜的补充也比较充足,影响Pn的环境因子和刺槐自身的生理因子达到全天的最佳组合状态,所以晴天刺槐的Pn在10: 00达到最大值。但12:00—14:00,由于过强的光照和温度,影响了叶肉相关酶的活性,并导致水分代谢失调,引起气孔关闭,进而引发Pn急剧下降。而在阴天条件下,全天处于较低水平的PAR和Ta在12:00—14:00期间相对较高,并且因为刺槐具有极强的光合适应性,促使其在此时间段的光合作用显著提高。因此,晴天刺槐的Pn在上午10:00以前显著高于其在阴天的Pn,但于午间12:00和14:00却低于阴天刺槐的Pn。
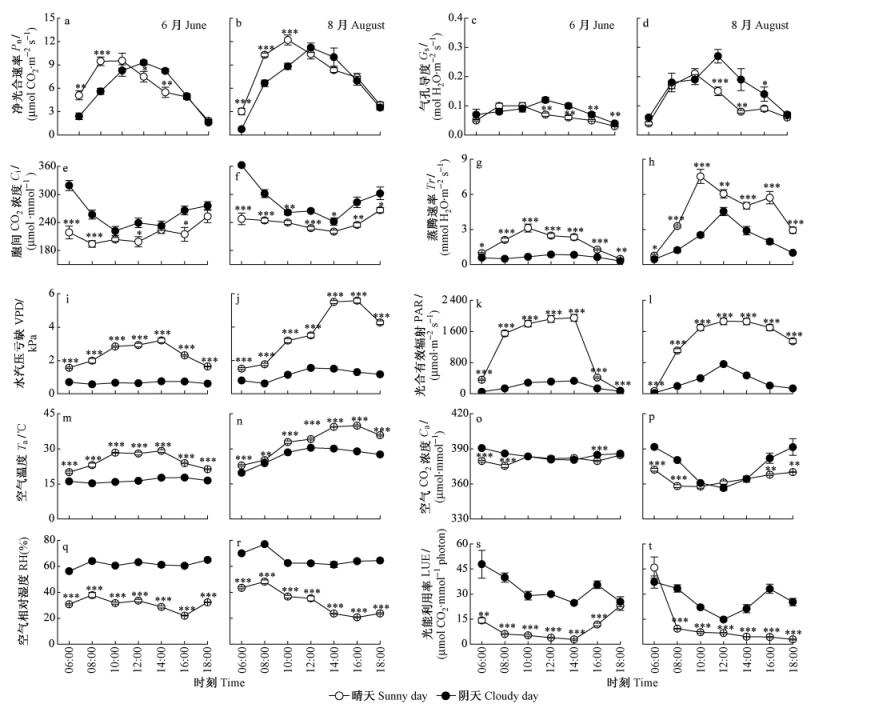
|
图 1 刺槐光合生理生态参数日进程在晴天和阴天的对比 Figure 1 Contrasts of diurnal course of photosynthetic ecophysiological parameters in the Black Locust under sunny and cloudy days |
刺槐的Gs日进程及在不同天气条件下的对比与Pn基本一致,这也体现了刺槐的Pn对Gs具有反馈调节作用,在有利于叶肉细胞的光合时Gs增大,不利于光合时Gs则减小。晴天刺槐的Gs表现出在上午高于阴天、下午又显著低于阴天的规律(图 1c,d)。刺槐的Ci在晴天的大部分时间显著低于阴天(图 1e,f),Ca,RH,LUE也呈现相似的结果(图 1o~t)。相反,在晴天一直处于高水平的VPD,PAR,Ta的共同作用下,刺槐的蒸腾作用加剧,致使Tr在每个测量时间点都显著高于阴天(图 1g~n)。
2.1.2 刺槐光合生理生态参数日均值在晴天和阴天的对比对刺槐所有光合生理生态参数在日进程中各实测点的观测值分别取平均值,通过统计分析它们日均值的差异结果,了解这些参数在全天的总体对比情况。在6月的晴天条件下,刺槐Pn的日均值略微大于阴天的Pn日均值,而8月晴天刺槐的Pn显著高于阴天(图 2a)。刺槐Gs的日均值在6月的晴天略小于阴天,到了8月则显著小于阴天(图 2b)。在晴天条件下,刺槐的Ci,Ca,RH,LUE日均值无论于6月还是8月都显著低于阴天(图 2c,h,i,j)。相比之下,晴天刺槐的Tr,VPD,PAR,Ta在6月和8月则显著高于阴天(图 2d~g)。此外,由图 2可知:刺槐的大多数光合作用参数(除Ca和LUE外)在8月份都不同程度地高于6月份,这也验证了渭北地区的刺槐在全年生长旺盛期(8月)的光合生理生态因子之间,相对于年生长初期(6月),达到更加均衡互利的促进状态,有利其更好地生长发育。
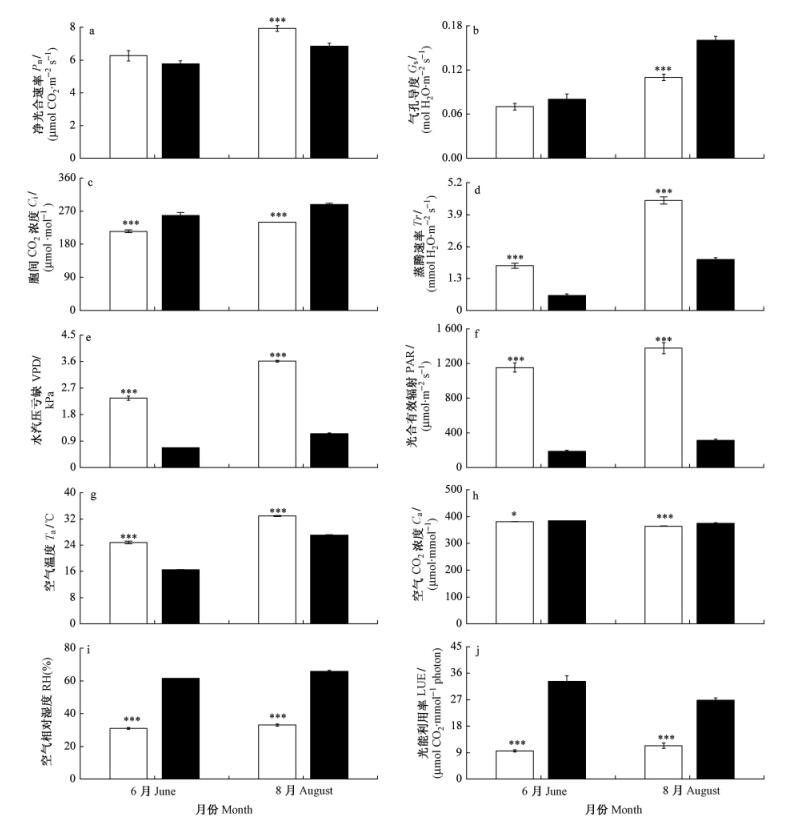
|
图 2 刺槐光合生理生态参数日均值在晴天与阴天的对比 Figure 2 Contrasts of daily mean values of photosynthetic ecophysiological parameters in the Black Locust under sunny and cloudy days |
在比较晴天和阴天条件对渭北地区刺槐光合参数影响的基础上,为了进一步分析刺槐光合潜力对天气的响应程度,测定对比光合光响应(A/PAR)曲线在晴天和阴天的异同。无论在6月还是8月,晴天和阴天条件下刺槐的Pn对PAR的响应趋势一致(图 3a,b),但其光合特征参数的表现却各不相同(图 3,表 2)。虽然刺槐的表观量子效率(AQY)在晴天略微大于阴天,但是晴天刺槐的最大光合速率(Pmax)小于阴天刺槐(表 2),可能是由于在阴天条件下,刺槐的生理代谢和呼吸作用减弱,而且其吸收利用弱光的能力得到增强,又因为刺槐具有很强的光合适应性,从而促进光合反应进程,并表现为刺槐在阴天的暗呼吸速率(Rd)和光补偿点(LCP)都显著低于晴天(表 2)。光饱和点(LSP)能够反映植物对强光的喜好程度,刺槐的LSP在晴天和阴天情况下表现相同(表 2),说明刺槐即使在阴天也保持与晴天一致的光强适应范围,以维持其光合器官的稳定。

|
图 3 刺槐光合光响应曲线在晴天和阴天的对比 Figure 3 Contrasts of light response curves of photosynthesis in the Black Locust under sunny and cloudy days |
|
|
在6—8月期间,渭北地区刺槐的净光合速率(Pn)在晴天和阴天表现出不同的日变化趋势,Pn在晴天于10:00达到最大峰值(图 1a),而在阴天推迟至12: 00达到全天最大值(图 1b)。这是由于在此时节的晴天中午,过高的光强远超过刺槐的LSP(图 1k,l; 表 2),抑制光反应中的光物理和光化学过程的正常进行。而过高的温度严重影响和制约了暗反应中的一系列酶促反应。光合作用关键酶Rubisco的最适活化温度在25~30 ℃(Salvucci et al., 1986),当温度高于光合作用的最适温度时,刺槐的Pn明显地表现出随温度上升而下降(图 1m,n),这是由于高温引起催化暗反应的酶钝化、变性甚至遭到破坏,同时高温还会导致叶绿体结构发生变化和受损。在高温下,刺槐叶片为了避免严重的蒸腾失水,调控气孔部分关闭,Gs迅速下降(图 1c,d),致使二氧化碳供应不足,这与前人对其他树种的报道结果相同(刘玉华等,2006; 邵玺文等,2009)。在这些因素的共同作用下,必然导致Pn的下降。而在阴天的情况下,全天都没有高光高温对刺槐光合作用的抑制发生,在午间各环境因子反而接近了刺槐光合反应的最适条件,因而刺槐的Pn在此时到达全天的最大峰值(图 1b)。需要指出的是,对于早春和晚秋等生长时节,刺槐光合作用在晴天和阴天的对比趋势,还有待于进一步研究补充。
晴天条件下,渭北黄土高原的太阳光辐射强度很大,多以直射光的形式到达林分冠层。而阴天情况下,由于天空大量云层的存在,太阳直射光的强度被减弱,以散射光的形式到达林分冠层。因此在本研究中,阴天的PAR显著降低,Ta也随之降低,RH则显著升高(图 2,表 1)。由于这些环境因子对刺槐光合作用的酶活性和膜透性、叶片的Gs和Tr、叶面的VPD、叶肉细胞的光合活性等,都有很大的直接或间接影响(于强等,1998; 郑文君等,2007),所以不同天气情况下刺槐的Pn也表现出一定的差异。Alton(2008)在分析北美洲和欧洲6种森林类型连续2~3年的碳通量数据后发现,这些森林的阴天的日固碳量比晴天少60%~80%。相反,Hollinger等(1994)的研究表明:新西兰山毛榉(Nothofagus fusca)在阴天比晴天能多固定50%的碳。而对苔草灌丛的研究结果显示:它们的固碳量不受天气的影响(Letts et al., 2005)。本研究发现,在渭北刺槐的年生长初期和旺盛期,其在晴天条件下的日均固碳量比阴天高了8%~16%。该结果即说明了刺槐在晴天具有更高的光合固碳量,也表现出它在阴天的光合固碳积累并不低,这与一些学者对其他植物的研究结论一致(彭少兵等,2007; 王广军等,2008; 郑文君等,2007)。
造成上述研究结论不一致的原因是多方面的,如:不同的人采用不同的气体交换测量方法(Gu et al., 2002)和进程模拟模型(Alton et al., 2007)来估计天气对光合作用的影响,散射光和直射光下的碳交换并没有一直处于相同的天气辐射条件下进行对比。此外,研究地域的差异和不同树种自身的特性也在很大程度上影响了光合作用对天气的响应过程。在本研究中,黄土高原渭北地区的刺槐长期遭受水分胁迫、强光照射等恶劣环境,在各种胁迫的共同作用下,刺槐不能长时间保持较高的Pn,否则将伤害自身的光合器官。同时,由于刺槐具有很强的光合适应性与抗逆性,可能通过气孔的快速调节、薄壁细胞内叶绿体的移动、CO2在细胞内的扩散、反应中心的羧化能力、光合组分的合成转换等有效方式,更好地适应黄土高原的极端生境。对于刺槐的光合作用对逆境响应过程的深层次生理机制、物质循环、光合途径等值得深入研究。
LUE可以反映植物光合过程对光辐射的利用效率,还被广泛应用于基于遥感的初级生产力(Running et al., 2004)和净初级生产力(Ahl et al., 2004)估算及全球碳循环的尺度扩展研究中。理论上,相对于太阳直射光来说,阴天的散射光可以增强林木冠层的LUE(郑文君等,2007; Roderick et al., 2001),这是因为阴天从天空中不同角度散射的光更加均匀有效地穿过林木冠层,叶片之间的光的分布更加平衡(Urban et al., 2007),增加了冠层遮阴部位叶片的同化速率(Gu et al., 2003),使冠层内部更多的叶片在LSP以下进行光合作用,从而避免过饱和光抑制带来的损失。另外,在低强度的光辐射下,蓝光/红光之比的增加使单位叶面积的Pn增强(Matsuda et al., 2004),这是由于蓝光刺激了光化学反应(Urban et al., 2007)和气孔的开张(Aphalo et al., 1993)。但也有研究认为,阴天云层使得包括散射和直射在内的太阳总的短波辐射量下降,这一结果会抵消冠层LUE增强对光合反应的促进作用(Farquhar et al., 2003; Niyogi et al., 2004)。因此,对于LUE变化的根本机制和天气对林木光合作用总的影响仍有待确定。
有研究证明作物的LUE在阴天可以提高110%(Choudhury,2001),温带森林甚至能提高110% ~180%(Gu et al., 2002)。而Alton等(2007)对2种阔叶林和一种针叶林的研究结果显示,它们在阴天的LUE仅比晴天上升了6%~33%。在本研究中,渭北刺槐的LUE在阴天比晴天大幅提高了135% ~247%,这可能与刺槐的内在因素(叶形、羧化酶含量)和外界环境的显著变化紧密相关。此外,虽然阴天的散射光较弱,但由于刺槐此时的LCP很低,能够更好地利用弱光进行光合作用,自身的Rd也显著降低,同时叶片的蒸腾作用减小,气孔充分开张,Gs显著提高,从而阴天刺槐的Pmax反而高于晴天刺槐。这也表明了渭北地区的刺槐努力发展自身的光合适应能力,以应对黄土高原变化异常的气候和侵蚀严重的土壤等逆境条件。
植物在生长季节内的不同时期表现出不尽相同的光合特性,主要与其叶片叶绿体的发育、叶绿素含量以及Rubisco酶活性的变化有关(Urban,2003),同时也受到叶片营养元素(Moreno-Sotomayor et al., 2002; Shiratsuchi et al., 2006)和外界环境因子(付为国等,2006; Staehr et al., 2006)的影响。本研究结果表明:渭北地区的刺槐在6月处于年生长初期阶段,由于周围环境与其自身生长发育条件可能尚未达到最佳状态,导致刺槐叶片的Pn和Pmax相对较低。而刺槐在8月份达到年生长旺盛期,此时的渭北黄土高原PAR,Ta,VPD等环境因子显著提高,又因为刺槐具有非常强且有效的环境适应能力和光合保护机制,所以进一步促进了其生理因子活性和新陈代谢活动,从而提高了刺槐的Pn和Pmax,这与前人的类似研究得到的结论一致(吴统贵等,2009; 2008; 张津林等,2006)。
林分的生物产量和生产力的大小,森林碳通量进程模型的模拟,林分光合生产力的评估,都不可避免地受到不同天气条件的很大影响和制约,尤其对于处在气候变化敏感区域的渭北黄土高原的植物更是如此。本研究比较分析了渭北地区晴天和阴天条件下,刺槐的净光合速率、最大光合速率、暗呼吸速率、气孔导度、蒸腾速率、光能利用率、光合有效辐射、空气温度等光合生理生态因子的差异,对于估计该区生态系统功能模型、植物生长模型、林分生产力模型,以及校正模型特征参数等方面有重要的意义。此外,研究刺槐在不同天气条件下的光合作用有助于采取适当的栽培管理措施来提高其光合生产力。本研究结果表明,虽然晴天条件下刺槐的日均光合固碳量高于阴天,但刺槐在阴天的光合潜力和光能利用率高于晴天。因此,可以通过遮阳网或其他遮阴方式管理渭北地区阳坡的刺槐林分,这样既可避免晴天的强光高温条件对刺槐的光抑制,又能显著提高其光能利用率。一段时间之后,阳坡刺槐林的光合产量和生产力有望得到提升。但是关于阴坡立地刺槐林的光合生理特性对不同天气条件的响应,仍有待于进一步研究。
陈根云, 俞冠路, 陈悦, 等. 2006. 光合作用对光和二氧化碳响应的观测方法探讨[J]. 植物生理与分子生物学学报, 32(6): 691-696. |
付为国, 李萍萍, 卞新民, 等. 2006. 镇江北固山湿地芦苇光合日变化的研究[J]. 西北植物学报, 26(3): 496-501. |
刘玉华, 史纪安, 贾志宽, 等. 2006. 旱作条件下紫花苜蓿光合蒸腾日变化与环境因子的关系[J]. 应用生态学报, 17(10): 1811-1814. DOI:10.3321/j.issn:1001-9332.2006.10.008 |
潘瑞炽. 2001. 植物生理学[M]. 4版. 北京: 高等教育出版社: 55-57, 91-95.
|
彭少兵, 郭军战. 2007. 不同树莓和黑莓品种的光合特性研究[J]. 西北农林科技大学学报:自然科学版, 35(3): 116-120. |
邵玺文, 韩梅, 韩忠明, 等. 2009. 不同生境条件下黄芩光合日变化与环境因子的关系[J]. 生态学报, 29(3): 1470-1477. |
王广军, 张彦妮, 何叶. 2008. 不同情况复叶槭(Acer negundo L)叶片净光合速率的日变化[J]. 东北林业大学学报, 36(8): 14-16. |
吴统贵, 李艳红, 吴明, 等. 2009. 芦苇光合生理特性动态变化及其影响因子分析[J]. 西北植物学报, 29(4): 789-794. |
吴统贵, 周和锋, 吴明, 等. 2008. 旱柳光合作用动态及其与环境因子的关系[J]. 生态学杂志, 27(12): 2056-2061. |
杨秀芳, 玉柱, 徐妙云, 等. 2009. 2种不同类型的尖叶胡枝子光合-光响应特性研究[J]. 草业科学, 26(7): 61-65. |
于强, 王天铎. 1998. 光合作用-蒸腾作用-气孔导度的耦合模型及C3植物叶片对环境因子的生理响应[J]. 植物学报, 40(8): 740-754. |
张津林, 张志强, 查同刚, 等. 2006. 沙地杨树人工林生理生态特性[J]. 生态学报, 26(5): 1523-1532. |
张小全, 徐德应. 2000. 杉木中龄林不同部位和叶龄针叶光合特性的日变化和季节变化[J]. 林业科学, 36(3): 19-26. DOI:10.11707/j.1001-7488.20000304 |
郑文君, 范崇辉, 韩明玉. 2007. 不同天气对苹果叶片光合特性的影响[J]. 西北农业学报, 16(6): 124-127. |
郑元, 赵忠, 周慧, 等. 2010. 刺槐树冠光合作用的空间异质性[J]. 生态学报, 30(23): 6399-6408. |
周广胜, 王玉辉. 2003. 全球生态[M]. 北京: 中国气象出版社: 82-83.
|
邹年根. 1986. 刺槐人工林[M]. 北京: 中国林业出版社: 210.
|
Ahl D E, Gower S T, Mackay D S, et al. 2004. Heterogeneity of light use efficiency in a northern Wisconsin forest: Implications for modeling net primary production with remote sensing[J]. Remote Sensing of Environment, 93(1-2): 168-178. DOI:10.1016/j.rse.2004.07.003 |
Alton P B. 2008. Reduced carbon sequestration in terrestrial ecosystems under overcast skies compared to clear skies[J]. Agricultural and Forest Meteorology, 148(10): 1641-1653. DOI:10.1016/j.agrformet.2008.05.014 |
Alton P B, North P R, Los S O. 2007. The impact of diffuse sunlight on canopy light-use efficiency, gross photosynthetic product and net ecosystem exchange in three forest biomes[J]. Global Change Biology, 13(4): 776-787. DOI:10.1111/j.1365-2486.2007.01316.x |
Aphalo P J, Jarvis P G. 1993. Separation of direct and indirect responses of stomata to light: Results from a leaf inversion experiment at constant intercellular CO2 molar fraction[J]. Journal of Experimental Botany, 44(261): 791-800. |
Cao S X, Chen L, Yu X X. 2009. Impact of China's Grain for Green Project on the landscape of vulnerable arid and semi-arid agricultural regions: a case study in northern Shaanxi Province[J]. Journal of Applied Ecology, 46(3): 536-543. DOI:10.1111/jpe.2009.46.issue-3 |
Choudhury B J. 2001. Estimating gross photosynthesis using satellite and ancillary data: approach and preliminary results[J]. Remote Sensing of the Environment, 75(1): 1-21. DOI:10.1016/S0034-4257(00)00151-6 |
Farquhar G D, Roderick M L. 2003. Atmospheric science: Pinatubo, diffuse light and the carbon cycle[J]. Science, 299(5615): 1997-1998. DOI:10.1126/science.1080681 |
Feldhake C M. 2001. Microclimate of a natural pasture under planted Robinia pseudoacacia in central Appalachia, West Virginia[J]. Agroforestry Systems, 53(3): 297-303. DOI:10.1023/A:1013331628494 |
Gu L H, Baldocchi D, Verma S B, et al. 2002. Advantages of diffuse radiation for terrestrial ecosystem productivity[J]. Journal of Geophysical Research, 107(4050): ACL 2-1. |
Gu L H, Baldocchi D D, Wofsy S C, et al. 2003. Response of a deciduous forest to the Mount Pinatubo eruption: enhanced photosynthesis[J]. Science, 299(5615): 2035-2038. DOI:10.1126/science.1078366 |
Herrick J D, Thomas R B. 1999. Effects of CO2 enrichment on the photosynthetic light response of sun and shade leaves of canopy sweet gum trees(Liquidambar styraciflua)in a forest ecosystem[J]. Tree Physiology, 19(12): 779-786. DOI:10.1093/treephys/19.12.779 |
Hollinger D Y, Kelliher F M, Byers J N, et al. 1994. Carbon dioxide exchange between an undisturbed old-growth temperate forest and the atmosphere[J]. Ecology, 75(1): 134-150. DOI:10.2307/1939390 |
Letts M G, Lafleur P M, Roulet N T. 2005. On the relationship between cloudiness and net ecosystem carbon dioxide exchange in a peatland ecosystem[J]. Ecoscience, 12(1): 53-59. DOI:10.2980/i1195-6860-12-1-53.1 |
Matsuda R, Ohashi-Kaneko K, Fujiwara K, et al. 2004. Photosynthetic characteristics of rice leaves grown under red light with or without supplemental blue light[J]. Plant and Cell Physiology, 45(12): 1870-1874. DOI:10.1093/pcp/pch203 |
Moreno-Sotomayor A, Weiss A, Paparozzi E T, et al. 2002. Stability of leaf anatomy and light response curves of field grown maize as a fu nction of age and nitrogen status[J]. Journal of Plant Physiology, 159(8): 819-826. DOI:10.1078/0176-1617-00809 |
Niyogi D, Chang H I, Saxena V K, et al. 2004. Direct observations of the effects of aerosol loading on net ecosystem CO2 exchanges over different landscapes[J]. Geophysical Research Letters, 31(20): L20506. DOI:10.1029/2004GL020915 |
Penuelas J, Filella I, Llusia J, et al. 1998. Comparative field study of spring and summer leaf gas exchange and photobiology of the Mediterranean trees Quercus ilex and Phillyrea latifolia[J]. Journal of Experimental Botany, 49(319): 229-238. |
Prioul J L, Chartier P. 1977. Partitioning of transfer and carboxylation components of intracellular resistance to photosynthetic CO2 fixation: A critical analysis of the methods used[J]. Annals of Botany, 41(174): 789-800. |
Roderick M L, Farquhar G D, Berry S L, et al. 2001. On the direct effect of clouds and atmospheric particles on the productivity and structure of vegetation[J]. Oecologia, 129(1): 21-30. DOI:10.1007/s004420100760 |
Running S W, Nemani R R, Heinsch F A, et al. 2004. A continuous satellite-derived measure of global terrestrial primary production[J]. BioScience, 54(6): 547-560. DOI:10.1641/0006-3568(2004)054[0547:ACSMOG]2.0.CO;2 |
Salvucci M E, Portis A R J, Ogren W L. 1986. Purification of ribulose-1, 5-bisphosphate carboxylase/oxygenase with high specific activity by fast protein liquid chromatography[J]. Analytical Biochemistry, 153(1): 97-101. DOI:10.1016/0003-2697(86)90066-7 |
Shiratsuchi H, Yamagishi T, Ishii R. 2006. Leaf nitrogen distribution to maximize the canopy photosynthesis in rice[J]. Field Crops Research, 95(2-3): 291-304. DOI:10.1016/j.fcr.2005.04.005 |
Staehr P A, Sand-Jensen K. 2006. Seasonal changes in temperature and nutrient control of photosynthesis, respiration and growth of natural phytoplankton communities[J]. Fresh Water Biology, 51(2): 249-262. DOI:10.1111/fwb.2006.51.issue-2 |
Tuittila E S, Vasander H, Laine J. 2004. Sensitivity of C sequestration in reintroduced Sphagnum to water-level variation in a Cutaway peatland[J]. Restoration Ecology, 12(4): 483-493. DOI:10.1111/rec.2004.12.issue-4 |
Urban O. 2003. Physiological impacts of elevated CO2 concentration ranging from molecular to whole plant responses[J]. Photosynthetica, 41(1): 9-20. DOI:10.1023/A:1025891825050 |
Urban O, Janous D, Acosta M, et al. 2007. Ecophysiological controls over the net ecosystem exchange of mountain spruce stand[J]. Comparison of the response in direct vs.diffuse solar radiation.Global Change Biology, 13(1): 157-168. |
Wu Y Y, Liu C Q, Li P P, et al. 2009. Photosynthetic characteristics involved in adaptability to Karst soil and alien invasion of paper mulberry(Broussonetia papyrifera(L.)Vent.)in comparison with mulberry(Morus alba L.)[J]. Photosynthetica, 47(1): 155-160. DOI:10.1007/s11099-009-0026-3 |
 2011, Vol. 47
2011, Vol. 47



