文章信息
- 魏晓雪, 于景华, 李德文, 佟璐, 庞海河, 祖元刚
- Wei Xiaoxue, Yu Jinghua, Li Dewen, Tong Lu, Pang Haihe, Zu Yuangang
- UV-B辐射增强对红松幼苗针叶脂质过氧化及抗氧化系统的影响
- Effects of Elevated UV-B Radiation on Lipid Peroxidation and Antioxidant System in Needles of Pinus koraiensis seedling
- 林业科学, 2011, 47(5): 54-59.
- Scientia Silvae Sinicae, 2011, 47(5): 54-59.
-
文章历史
- 收稿日期:2010-08-07
- 修回日期:2010-11-15
-
作者相关文章
随着大气平流层臭氧层变薄,到达地表的中波紫外线(UV-B,280~320 nm)量日渐增强,将对地球生物产生严重影响(Sancar et al., 2004)。国内外学者在UV-B辐射增强对植物生长发育的影响方面已作了大量的研究,涉及达上百种不同的植物种类,在UV-B辐射对植物的生长、形态结构、光合作用、紫外线吸收物质、抗氧化系统、内源激素调节以及产量等方面影响的研究中均取得较多的成果(Kakani et al., 2003; Zu et al., 2010; 梁婵娟等,2004; 张新永等,2009)。国内外已有UV-B胁迫试验研究多以草本植物为对象,尤其是对农作物研究较多,对森林木本植物的研究较少(黄梅玲等,2010)。
UV-B对植物的伤害其中一条重要的途径就是通过产生活性氧,对植物细胞产生氧化胁迫(Yannarellietal et al., 2006),进而导致植物生长发育和生理生化过程发生一系列的变化。高等植物由于长期的进化适应,对于UV-B辐射的增强有一定的保护性适应机制(刘敏等,2007)。为了抵抗活性氧对植物的毒害作用,植物可通过酶类或非酶类系统对自由基进行清除,它们相互协同作用,可把细胞内活性氧直接或间接地清除,防止了活性氧的级联放大,从而保障植物细胞内各种生命代谢活动的正常进行(Gao et al., 2008; 魏金凤等,2009)。
红松(Pinus koraiensis)为我国东北部地区重要的松属(Pinus)树种,也是中国温带针阔混交林自然森林群落重要树种之一(Wang,2006)。本试验选择3年生人工种植的红松幼苗为材料,对不同剂量的UV-B胁迫条件下红松幼苗针叶中自由基含量、保护酶活性、抗氧化物质含量等指标做测定,以期从自由基的产生及清除的角度,探讨红松适应UV-B胁迫逆境的生理机制。
1 材料与方法 1.1 试验设计试验于2009年9月3日至10月13日,在东北林业大学森林植物生态学重点试验室温室内进行。将3年生红松幼苗随机分为4组,每组60株。在自然光照基础上,根据试验要求,人工增加0(CK),0.46(T1),3.25(T2)及9.76 μW·cm-2(T3)4个不同辐射强度的UV-B处理。UV-B(280~320 nm)辐射处理通过悬在植株上方的UV-B辐射灯管产生(40 W,北京电光源研究所),发射的紫外线用0.08 mm醋酸纤维膜过滤,以消除UV-C的影响,并每2周进行滤膜更换。UV-B辐射处理时间为每天12 h(6: 00—18: 00)。UV-B辐射强度通过光谱仪AvaSpec 2048-2(Avantes BV,Netherlands)进行测定。处理期间通过调整灯管与植株冠层的高度以保证植株接受稳定剂量的UV-B辐射强度。处理40天后选取植株顶端已完全展开的生长状况及叶龄和叶位一致的针叶,测定各项生理指标,每个处理均随机取样,3次重复。
1.2 试验方法 1.2.1 羟基自由基(·OH)含量测定采用DMSO分子探针法,使DMSO与· OH反应形成稳定的甲基亚磺酸(MSA),以坚牢蓝BB盐染色后测定420 nm处的吸光值,以OD420·g-1 FW表示· OH水平(Steiner et al., 1990)。
1.2.2 过氧化氢(H2O2)自由基含量测定H2O2与硫酸钛(或氯化钛)生成过氧化物-钛复合物黄色沉淀,可被H2SO4溶解后,在415 nm波长下比色测定。在一定范围内,其颜色深浅与H2O2浓度呈线性关系(Patterson et al., 1984)。
1.2.3 丙二醛(MDA)含量测定参照高俊凤(2000)的方法测定。
1.2.4 类胡萝卜素含量测定参照李合生(2001)的方法测定。
1.2.5 可溶性蛋白含量测定采用考马斯亮蓝比色法(李合生,2001)。
1.2.6 类黄酮含量测定称取新鲜叶片0.5 g,加10 mL酸性甲醇溶液(甲醇、水、盐酸体积比为79 :20: 1),室温下研磨; 于55 ℃水浴中提取30 min。3 000 r·min-1离心10 min,定容至10 mL,用紫外-可见光分光光度计在波长300 nm处比色测定类黄酮含量,单位OD300·g-1 FW(Kinnunen et al., 1999)。
1.2.7 保护酶活性的测定抗氧化酶活性测定参考Jiang(2002)的方法:取0.5 g叶片在液氮中充分研磨后,迅速转入含有1 mL 50 mmol·L-1磷酸缓冲液(pH 7.0,含1 mmol·L-1 EDTA和1% PVP)的离心管中,10 000 r·min-1 4 ℃离心15 min,取上清液弃沉淀,再10 000 r·min-1 4 ℃离心5 min,上清液即为粗酶液,80 ℃保存备用。过氧化氢酶(CAT)活性,以每分钟A240的变化值表示酶活性大小; 抗坏血酸过氧化物酶(APX)的活性以每分钟A290的变化值表示酶活性大小; 过氧化物酶(POD)活性,以每分钟A470变化值表示酶活性大小; 超氧化物歧化酶(SOD)活性以单位时间内抑制氮蓝四唑光化还原50%为1个酶活性单位(U)。
1.3 数据分析每个生理指标重复测定3次(类胡萝卜素重复测定6次),取平均值并求标准误(平均值±标准误)。不同UV-B处理间的差异显著性和生理指标相关分析均采用SPSS16.0软件进行计算。
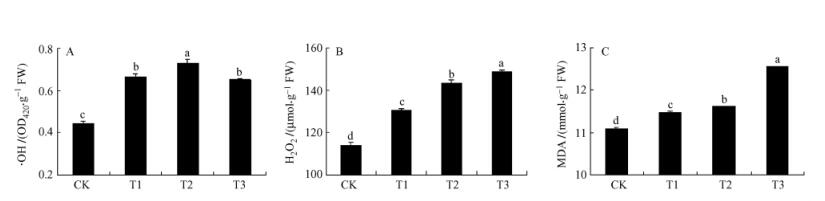
2 结果与分析 2.1 自由基和MDA含量变化UV-B胁迫处理40天时,环境UV-B辐射增强显著提高活性氧自由基(·OH和H2O2)和MDA含量(图 1),H2O2和MDA含量随UV-B辐射强度的加强而显著增加(P<0.05),均表现为T3>T2>T1>CK。T3处理下,红松针叶内H2O2和MDA含量分别为149.05 mmol·g-1和12.56 μmol·g-1。T2处理下,红松体内·OH含量最高,较CK处理增加了65.91%。
|
图 1 增强UV-B辐射对红松针叶·OH,H2O2和MDA含量的影响 Figure 1 Effects of UV-B radiation on·OH, H2O2 and MDA concentrations in needles of Pinus koraiensis UV-B处理间的差异显著性以不同的字母标注,有一个字母相同即为差异不显著(P<0. 05)。Bars with any letter in common are not significantly different at P<0. 05.数值为平均值± SE Means ± SE (n= 3). |
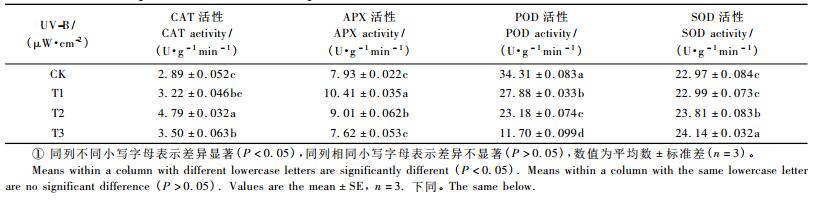
从表 1可知: UV-B胁迫处理对保护酶活性产生显著的影响(P<0.05),随着UV-B胁迫程度的加强,4种抗氧化酶(CAT,APX,POD和SOD)活性变化规律不同。与CK相比,UV-B胁迫处理导致CAT,APX,SOD 3种保护酶活性增强,而POD活性则显著下降(P<0.05),其中T3处理条件下红松POD活性降为11.70 U·g-1 min-1。UV-B胁迫处理40天时,SOD活性表现为T3>T2>T1>CK; POD活性表现为T3<T2<T1<CK。
|
|
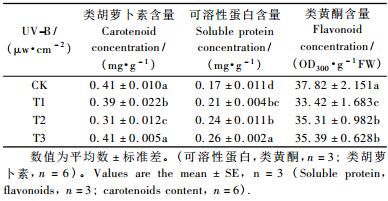
由表 2可知:各UV-B辐射处理条件下,红松针叶内类胡萝卜素和类黄酮含量均低于CK组,其中,T2处理条件下红松针叶内类胡萝卜素含量最低,为0.31 mg·g-1,和CK相比下降了24.26%。类黄酮物质的含量随UV-B处理剂量的增强而增加(表 2),表现为CK>T3>T2>T1(P<0.05)。UV-B处理显著影响植物可溶性蛋白质的含量(P<0.05),表现为UV-B处理显著促进红松针叶中可溶性蛋白质的积累(P<0.05),且随UV-B辐射强度的增强而增加(表 2)。T3处理下叶片可溶性蛋白质含量最高,达0.26 mg·g-1,与CK相比增加了55.02%。
|
|
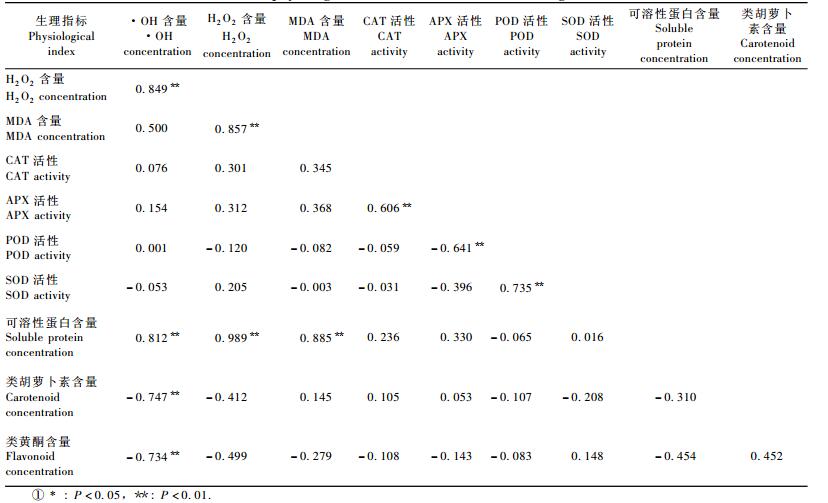
由表 3可知:在UV-B胁迫条件下,红松针叶内可溶性蛋白、自由基及MDA含量之间存在极显著的正相关关系(P<0.01),相关系数r>0.8。抗氧化酶之间APX和CAT间存在极显著的正相关关系(P<0.01)(r=0.606),POD和SOD间存在极显著的正相关关系(P<0.01)(r=0.735)。类胡萝卜素、类黄酮和·OH含量间存在极显著的负相关关系(P<0.01)(r=-0.747和r=-0.734)。
|
|
增强UV-B辐射对许多物种都有不同程度的影响。在本试验中人工增强UV-B辐射显著增加了红松针叶内自由基和MDA含量,这与以前的很多报道一致(Prasad et al., 2005; 任红玉等,2009)。UV-B辐射增强导致植物体内活性氧大量积累,引发膜脂过氧化(表 3),膜脂组分发生变化,导致细胞结构和功能的破坏。为了抵抗活性氧对植物的毒害作用,植物可通过酶类或非酶类系统对自由基进行清除,从而引起抗氧化酶(CAT,APX,SOD和POD)活性和抗氧化物质含量的变化(Gao et al., 2008)。
在保护酶系统中,SOD将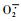
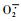
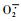
可溶性蛋白质、类胡萝卜素和类黄酮都是植物体内重要的活性氧清除剂,但不同强度的UV-B辐射对它们的影响却各不相同(表 2,3)。增强UV-B处理增加红松针叶中可溶性蛋白质的含量,这与牛传坡等(2007)试验结果一致。蛋白质作为生物有机体的重要组成部分和生物催化剂,在各种生理功能中起重要作用。蛋白质的最大吸收波长正好在UV-B辐射的波长范围内,因此,增强的UV-B辐射将会对蛋白质产生较大影响(Quaite et al., 1992)。UV-B辐射增加植物可溶性蛋白质含量,可能是UVB辐射诱导一些抗性相关的基因表达有关,导致一些新的与抗性有关的蛋白质产生(刘敏等,2007)。
类胡萝卜素是光系统的重要组成部分,是非常重要的结合于生物膜上的抗氧化剂(Tracewell et al., 2001)。与CK相比,UV-B辐射使红松幼苗针叶类胡萝卜素含量降低,这一结果与张新永等(2009)结果一致。UV-B辐射增强产生大量的活性氧自由基和MDA物质造成膜脂过氧化程度加剧,膜脂不饱和度降低,膜流动性下降,从而对叶绿体膜结构、类囊体及叶绿体基粒造成严重的破坏,对叶绿素合成代谢产生一定的抑制作用(Asada,1999),导致类胡萝卜素含量降低(表 3)。
在植物体内,类黄酮作为滤除UV-B辐射的“过滤剂”和清除UV-B辐射诱发的活性氧自由基的“淬灭剂”(Palmer et al., 2002; Ryan et al., 2002),其含量增加,已被认为是植物响应增强UV-B辐射的普遍特征(Flint et al., 2004)。在笔者的试验中,UV-B辐射增强导致类黄酮含量显著降低,这一结果与Petropoulou等(1995)报道一致。近年来,越来越多的试验证实UV-B辐射并不总是导致黄酮类化合物含量增加(Kinnunen et al., 2001; 董新纯等,2006; 何丽莲等,2006)。这可能与UV-B对植物细胞造成的不可逆伤害有关,这种伤害可以导致细胞类黄酮降解加速而合成困难(董新纯等,2006)。此外,UVB辐射增强导致植物光合作用下降,同化产物积累减少,可能改变了有机合成中碳素的流向与流量,从而使植物次生代谢生物合成系统效率降低,以致减少了类黄酮的合成与积累(Zhao et al., 2003)。因此,环境UV-B辐射增强对植物次生代谢产物的影响与作用机制还不清楚,需要进一步深入研究。
在环境UV-B辐射增强条件下,红松针叶中的·OH,H2O2和MDA含量明显升高,并且与辐射强度成正比,同时自由基大量积累导致抗氧化酶(SOD,CAT,APX)活性增高。UV-B辐射胁迫影响红松幼苗体内活性氧代谢系统的平衡,破坏和降低活性氧清除剂(类胡萝卜素和类黄酮)的活性及含量水平,对红松幼苗造成了一定的伤害。在处理后期,植株已经表现出不同程度的衰老迹象,特别是接受大剂量的UV-B处理的植株衰老迹象更为明显,这也反映出在一定程度上POD活性的减弱和抗氧化物质含量的降低与植株的衰老也有一定的关系。综上所述,长时间大剂量的UV-B辐射对红松幼苗的生理生化活动具有一定的抑制作用。植物对UV-B辐射增强的响应反馈存在着明显的种内和种间差异,各种植物对UV-B辐射响应具有复杂性,而产生这种差异的分子机理有待于进一步研究。
董新纯, 赵世杰, 郭珊珊, 等. 2006. 增强UV-B条件下类黄酮与苦荞逆境伤害和抗氧化酶的关系术[J]. 山东农业大学学报:自然科学版, 37(2): 157-162. |
高俊凤. 2000. 植物生理学实验技术[M]. 西安: 世界图书出版社.
|
何丽莲, 祖艳群, 李元, 等. 2006. 不同小麦品种对UV-B辐射增强响应的生理特性差异[J]. 应用生态学报, 17(1): 163-165. |
黄梅玲, 江洪, 金清, 等. 2010. UV-B辐射胁迫下不同起源时期的3种木本植物幼苗的生长及光合特性[J]. 生态学报, 30(8): 1998-2009. |
黄少白, 戴秋杰, 刘晓忠, 等. 1998. 水稻对紫外光B辐射增强的生化适应机制[J]. 作物学报, 24(4): 464-469. |
柯世省, 金则新. 2007. 干旱胁迫对夏腊梅叶片脂质过氧化及抗氧化系统的影响[J]. 林业科学, 43(10): 28-33. DOI:10.3321/j.issn:1001-7488.2007.10.005 |
李合生. 2001. 植物生理生化实验理论与技术[M]. 北京: 高等教育出版社.
|
梁婵娟, 陶文沂, 周青. 2004. UV-B辐射增强的环境植物学效应研究[J]. 中国生态农业学报, 12(4): 40-42. |
刘敏, 李荣贵, 范海, 等. 2007. UV-B辐射对烟草光合色素和几种酶的影响[J]. 西北植物学报, 27(2): 291-296. |
牛传坡, 蒋静艳, 黄耀. 2007. UV-B辐射对土壤-冬小麦系统碳氮转化的影响[J]. 矿物岩石地球化学通报, 26(z1): 470-471. DOI:10.3969/j.issn.1007-2802.2007.z1.221 |
任红玉, 李东, 吴志光, 等. 2009. 在紫外辐射B胁迫下钙对大豆幼苗若干生物学特性的影响[J]. 东北农业大学学报, 40(7): 5-9. |
魏金凤, 郭敬功, 张清德, 等. 2009. UV辐射对拟南芥叶片抗氧化酶系统和膜系统的影响[J]. 河南大学学报:自然科学版, 39(5): 500-504. |
吴楚, 王政权. 2002. 冰冻条件下外源SA对水曲柳幼苗叶片内抗氧化酶的影响[J]. 林业科学, 38(5): 54-59. DOI:10.11707/j.1001-7488.20020509 |
吴业飞, 吴鲁阳, 张振文. 2008. 紫外线-B辐射增强对葡萄叶片抗氧化系统的影响[J]. 西北农林科技大学学报:自然科学版, 36(12): 161-166. |
张新永, 郭华春, 戴华峰. 2009. 增强UV-B辐射对彩色马铃薯叶片中相关保护酶活性的影响[J]. 西北植物学报, 29(5): 867-873. |
Asada K. 1999. The water-water cycle in chloroplasts: scavenging of active oxygens and dissipation of excess photons[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 50: 601-639. DOI:10.1146/annurev.arplant.50.1.601 |
Flint S D, Searles P S, Caldwell M M. 2004. Field testing of biological spectral weighting functions for induction of UV-absorbing compounds in higher plants[J]. Photochemistry and Photobiology, 79(5): 399-403. DOI:10.1562/0031-8655(2004)79<399:SFTOBS>2.0.CO;2 |
Gao Q, Zhang L X. 2008. Ultraviolet-B-induced oxidative stress and antioxidant defense system responses in ascorbate-deficient vtcl mutants of Arabidopsis thaliana[J]. Journal of Plant Physiology, 165(2): 138-148. DOI:10.1016/j.jplph.2007.04.002 |
Jiang M Y, Zhang J H. 2002. Water stress-induced abscisic acid accumulation triggers the increased generation of reactive oxygen species and up-regulates the activities of antioxidant enzymes in maize leaves[J]. Journal of Experimental Botany, 53(379): 2401-2410. DOI:10.1093/jxb/erf090 |
Kakani V G, Reddy K R, Zhao D, et al. 2003. Field crop responses to ultraviolet-B radiation: a review[J]. Agricultural and Forest Meteorology, 120(1-4): 191-218. DOI:10.1016/j.agrformet.2003.08.015 |
Kinnunen H, Huttunen S, Laakso K. 2001. UV-absorbing compounds and waxes of Scots pine needles during a third growing season of supplemental UV-B[J]. Environmental Pollution, 112(2): 215-220. DOI:10.1016/S0269-7491(00)00113-5 |
Kinnunen H, Laakso K, Huttunen S. 1999. Methanol-extractable UV-Babsorbing compounds in Scots pine needles[J]. Chemosphere-Global Change Science, 1(4): 455-460. DOI:10.1016/S1465-9972(99)00040-9 |
Palmer H, Ohta M, Watanabe M, et al. 2002. Oxidative stress-induced cellular damage caused by UV and methyl viologen in Euglena gracilis and its suppression with rutin[J]. Journal of Photochemistry and Photobiology B: Biology, 67(2): 116-129. DOI:10.1016/S1011-1344(02)00271-3 |
Patterson B D, MacRae E A, Ferguson I B. 1984. Estimation of hydrogen peroxide in plant extract using titanium(Ⅳ)[J]. Analytical Biochemistry, 139(2): 487-492. DOI:10.1016/0003-2697(84)90039-3 |
Petropoulou Y, Kyparissis A, Nikopoulos D, et al. 1995. Enhanced UV-B radiation alleviates the adverse effects of summer drought in two Mediterranean pines under field conditions[J]. Physiologia Plantarum, 94(1): 37-44. DOI:10.1111/ppl.1995.94.issue-1 |
Prasad S M, Kumar D, Zeeshan M. 2005. Growth, photosynthesis, active oxygen species and antioxidants responses of paddy field cyanobacterium Plectonema boryanum to endosulfan stress[J]. The Journal of General and Applied Microbiology, 51(2): 115-123. DOI:10.2323/jgam.51.115 |
Quaite F E, Sutherland B M, Sutherland J C. 1992. Action spectrum for DNA damage in alfalfa lowers predicted impact of ozone depletion[J]. Nature, 358(6387): 576-578. DOI:10.1038/358576a0 |
Ryan K G, Swinny E E, Markham K R, et al. 2002. Flavonoid gene expression and UV photoprotection in transgenic and mutant Petunia leaves[J]. Phytochemistry, 59(1): 23-32. DOI:10.1016/S0031-9422(01)00404-6 |
Sancar A, Lindsey-Boltz L A, Unsal-Kacmaz K, et al. 2004. Molecular mechanisms of mammalian DNA repair and the DNA damage checkpoints[J]. Annual Review of Biochemistry, 73: 39-85. DOI:10.1146/annurev.biochem.73.011303.073723 |
Steiner M G, Babbs C F. 1990. Quantitation of the hydroxyl radical by reaction with dimethyl sulfoxide[J]. Archives Biochemistry and Biophysics, 278(2): 478-481. DOI:10.1016/0003-9861(90)90288-A |
Tracewell C A, Vrettos J S, Bautista J A, et al. 2001. Carotenoid photooxidation in photosystem Ⅱ[J]. Archives of Biochemistry and Biophysics, 385(1): 61-69. DOI:10.1006/abbi.2000.2150 |
Wang C K. 2006. Biomass allometric equations for 10 co-occurring tree species in Chinese temperate forests[J]. Forest Ecology and Management, 222(1): 9-16. |
Yannarelli G G, Noriega G U, Batlle A, et al. 2006. Heme oxygenase upregulation in ultraviolet-B irradiation soybean plants involves reactive oxygen species[J]. Planta, 224(5): 1154-1162. DOI:10.1007/s00425-006-0297-x |
Zhao D, Reddy K R, Kakani V G, et al. 2003. Growth and physiological responses of cotton(Gossypium hirsutum L)to elevate carbon dioxide and ultraviolet-B radiation under controlled environmental conditions[J]. Plant, Cell and Environment, 26(5): 771-782. DOI:10.1046/j.1365-3040.2003.01019.x |
Zu Y G, Pang H H, Yu J H, et al. 2010. Responses in the morphology, physiology and biochemistry of Taxus chinensis var.mairei grown under supplementary UV-B radiation[J]. Journal of Photochemistry and Photobiology B: Biology, 98(2): 152-158. DOI:10.1016/j.jphotobiol.2009.12.001 |
 2011, Vol. 47
2011, Vol. 47