文章信息
- 孙守家, 孟平, 张劲松, 万贤崇
- Sun Shoujia, Meng Ping, Zhang Jinsong, Wan Xianchong
- 利用氘同位素研究太行山南麓枣树水分利用的季节性变化
- Seasonal Variation in Water Use of Ziziphus jujuba in the South Aspect of Taihang Mountains with Deuterium Isotope Signature
- 林业科学, 2011, 47(5): 46-53.
- Scientia Silvae Sinicae, 2011, 47(5): 46-53.
-
文章历史
- 收稿日期:2010-06-08
- 修回日期:2010-07-12
-
作者相关文章
2. 中国林业科学研究院林业新技术研究所 北京 100091
2. Institute of New Forest Technology, CAF Beijing 100091
太行山南麓山区属于半干旱地区,其降水时空分布不均,水资源欠缺是限制当地林业生产和生态恢复的主要因素。国内学者曾对太行山区植物的蒸腾耗水、森林水文和植被恢复作了大量的工作(张劲松等,2007; 王鹤松等,2007)。在半干旱地区,植物如何适应和利用变化的水源尚不清楚,一定程度上阻碍了生态恢复过程中植物最佳的选择和配置。氢氧稳定同位素被认为是水的“指纹”,近年来在植物生态学领域已有广泛运用(Rose et al., 2003; Snyder et al., 2000)。尽管少数盐生或旱生植物(Lin et al., 1993; Ellsworth et al., 2007)在吸水过程中氢氧同位素可能会分馏,但是大部分植物根系在吸收水分(Gonfiantini et al., 1965; Wershaw et al., 1966)和木质部运输(石辉等,2003)过程中水分均没有发生氢氧稳定同位素的分馏现象,因此大部分植物木质部导管内水分的同位素保持与来源水分相同的同位素组成。通过对比植物木质部水分与各种水源的同位素组成,利用二项或三项分隔线性混合模型(White et al., 1985),可以判断出植物对不同水源的相对使用量。利用氢、氧同位素技术可以分析降水的水汽来源和分配比例(王锐等,2008; 徐振等,2007),也可以追踪物种在不同环境条件下水分来源(Zencichs et al., 2002; February et al., 2007; Sekiya et al., 2004; McCole et al., 2007),但同位素信息不能提供水分绝对含量以及植物受水分胁迫的程度。为探索在干旱及变化的水源条件下植物利用水分的策略和适应性,有必要研究树木吸取的水源和树体水分生理生态响应的关系。
枣树(Ziziphus jujuba)是重要的栽培经济树种,其根系发达,分布深广,能固结土壤,是生态恢复、保持水土的优良树种,在太行山区广泛种植。本研究测定和比较旱季和雨季枣树枝条、土壤不同层次氘同位素比值以及各层土壤水分含量的动态变化,并结合根系生长状况分析不同季节枣树体内的水分的来源。通过测定叶片水势、蒸腾速率、光合速率和栓塞程度等生理生态指标,确定枣树在不同旱、雨季节对水分条件的响应与利用,为进一步研究枣树农林复合系统水肥利用提供参考。
1 试验区概况试验地位于河南省济源市境内的黄河小浪底森林生态系统定位研究站(35°01' N,112°28' E),海拔310 m。试验区地处太行山南段南麓,黄河流域北缘,属温带大陆性季风气候。全年日照时数为2 367.7 h,年日照率为54%,多年来日均气温>0 ℃的平均积温为5 282 ℃。历年平均降水量641.7 mm,但受季风气候影响,年内季节性分布不均匀,6—9月平均降水量为438.0 mm,占全年的68.3%。2009年4月开始试验区干旱少雨,持续到8月中旬,干旱程度较重。
2 材料与方法 2.1 试验材料试验材料是水平梯田枣树人工林,梯田南北宽20 m、东西长170 m,土壤以石灰岩风化母质淋溶性褐色土为主,土层厚度80~100 cm,pH6.9~8.4,石砾含量为15%~26%,有机质含量大约为10.5 g· kg-1,速效氮含量2 280~7 950 mg·kg-1,速效磷含量504~638 mg·kg-1,速效钾含量70 ~121 mg·kg-1。枣树8年生,平均株高3.7 m,南北冠幅3.1 m,东西冠幅2.8 cm,2006年3月栽植,株行距3 m×4 m,带行向为东西行。每木检尺平均地径为8.1 cm,以平均地径为依据在试验地中部选择6株树作为试验材料。
2.2 试验方法试验在2009年进行,分别在旱季中的7月1日、8月14日和雨季中的8月26日、10月5日对枣树进行生理生态指标和同位素测定。
2.2.1 气象因子及土壤水分观测在枣树地旁设定自动气象站,连续观测空气温度、相对湿度、太阳辐射和降雨量,所采用的传感器分别为05103(RM Young公司,美国)、HMP45C(Campbell公司,美国)、LI190SB(LI-COR公司,美国)、TE525M(Texas公司,美国),数据采集器为CR10X(Campbell公司,美国)。设定每2 min采集1次,每10 min输出1组平均值,以每天144组数据的平均值代表每天的温度、湿度、太阳辐射和降水量。2008年4月在距离枣树树干100 cm处埋设长100 cm的Minirhizotrons管,土壤水分体积含量使用TRIME-T3(IMKO公司,德国)土壤水分测定系统分20,40,60,80,100 cm 5层测定。
2.2.2 根系分布及根系生长状况测定根系生长状况用美国PELICAN公司的ET-100根系生态监测系统测定,2008年4月在距枣树100 cm处垂直埋设深度为100 cm的透明Minirhizotrons管,Minirhizotrons管内径5 cm,外径5.8 cm,3次重复。2009年7—10月分3次用BTC Minirhizotrons digitalImage Capture system v4.2进行图像采集,观测面积为1.4 cm×1.8 cm,WinRHIZO Tron MF 2005软件(Régent公司,加拿大)对根系进行分析,根据Hendrick等(1992)方法,白色根定义为新根,褐色根定义为老根,黑色根系定义为死根,新根和老根总称为活根,建立根系数据库以便数据分析。
2.2.3 蒸腾和光合指标测定选择树冠中上部长势一致1年生枝条编号,贴好标签,于8:00—9:00,使用Li-6400(LI-COR公司,美国)测定1年生枝条距顶端第5~6个二次枝上成熟叶片的蒸腾速率、气孔导度和光合速率,外加红光LED光源,光照强度为1 000 μmol·m-2s-1,每株树测定5片,测定6株。
2.2.4 枝条气穴栓塞程度和叶片水势测定在6:00左右,剪取贴有标签编号的1年生枝条,剪取部分枝条用于同位素测定,剩余部分置于黑色塑料袋中密封带回实验室,温度控制在20~25 ℃,水中剪成5~6 cm长枝段,根据Sperry等(1988)冲洗方法进行改进,冲洗液为50 mmol·L-1 KCl溶液,0.4 μm微孔过滤,先用5 kPa水压推动冲洗液流过枝条,用放置在0.000 1 g天平上的50 mL玻璃瓶收集冲洗液,天平连接电脑后用LDFM软件获得枝条的初始导水率Ki,然后用100 kPa水压冲洗10~15 min,清除枝条导管内气泡,再用5 kPa水压冲洗,获得最大导水率Kmax,气穴栓塞程度用导水率损失百分数(percentage loss of hydraulic conductance,PLC)表示,PLC=(1-Ki/Kmax)×100。
取贴有标签编号的1年生枝条上第4~5轮叶片打孔,在C-52样品室20~25 ℃下平衡20 min采用美国Wescor公司的PSYPRO露点水势仪测定。
2.2.5 同位素测定及贡献率计算剪取带有标签编号的1年生枝条,剥去树皮,同时在同一株枣树下进行土壤取样,取样时参照Snyder等(2000)的方法分表层(0~30 cm)和深层(30~100 cm)进行,表层分别取(5±1)cm,(15±1)cm,(25±1)cm深土壤,深层将30~100 cm的土壤混匀,装入带聚乙烯盖子的8 mL的EPA瓶中密封。防止水分蒸发分馏,使用防水胶带对瓶口进一步密封,0~5 ℃储藏在便携式冷藏包内,带回到中国林业科学研究院稳定同位素比率质谱实验室,使用同位素比率质谱仪(Finnigan MAT Delta V advantage)测定氘同位素比值。氘同位素比值是以相对于V-SMOW(ViennaStandard Mean Ocean Water)的千分率(‰)给出,精度分别为±2‰,分析方程为:
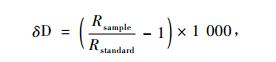
|
(1) |
其中Rsample和Rstandard分别表示样品和标准物D/H的摩尔比率。
当植物具有2种水分来源时,将具有较大δD值的水源作为富集端,具有较小δD值的水源作为贫化端,使用简单的两端线性混合模型来确定不同来源所占的比例(White et al., 1985),公式如下:
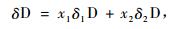
|
(2) |
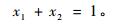
|
(3) |
式中,x1,x2是表层和深层土壤水分对植物所利用水分的贡献率。δD为木质部水分稳定氢同位素组成,δ1D和δ2D是表层和深层土壤水分中氘比值,因表层土壤含水量和δD值变化较大,所以δ1D是5,15,25 cm深土壤δD值的加权平均数,权重为各层土壤含水量占总含水量的百分比。
2.3 数据分析使用SPSS 13.0和Excel软件进行数据处理和图表制作,对不同时间之间的测定指标采用Oneway ANOVA分析并用最小显著差数法(LSD)进行多重比较,统计显著性水平为P<0.05。
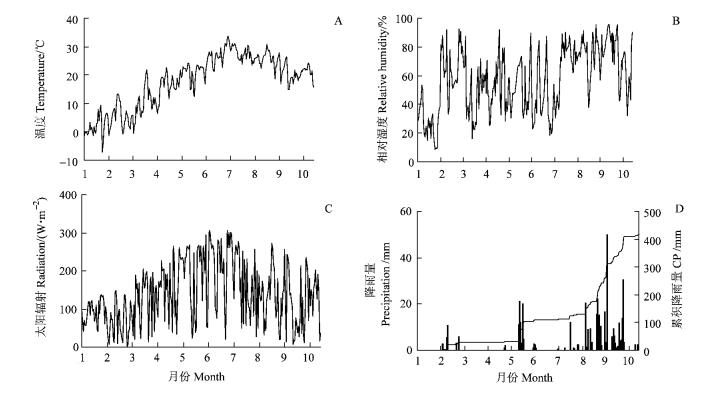
3 结果与分析 3.1 气象因子及土壤水分气象数据表明5—10月温度较高,日均气温均在10 ℃以上(图 1A)。相对湿度日变化较大,最小值出现在1月,最大值在9月。日均太阳辐射易受天气影响,变化较大,3—8月均值在100 W·m-2以上。1—10月试验地共降雨415.7 mm,只有往年降雨的三分之二。其中,1—7月份累积降雨量仅131.20 mm,仅为往年降雨的四分之一,从8月16日开始降雨迅速增加,到10月6日共降雨224 mm(图 1D)。
|
图 1 气温(A)、相对湿度(B)、太阳辐射(C)和降水(D)变化(2009年1—10月) Figure 1 Variation of temperature(A), relative humidity(B), radiation (C) and precipitation(D) (from Jan. to Oct. in 2009) |
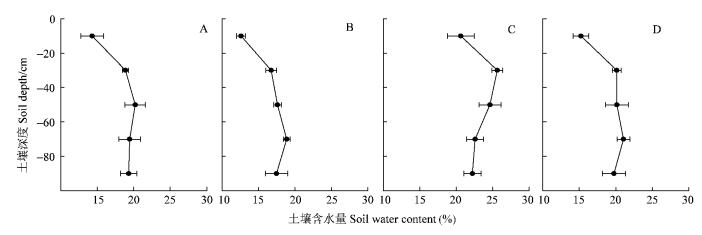
土壤水分含量受到降水影响较大。图 2结果显示:在7月1日和8月14日,土壤含水量较低,尤其是0~20 cm土壤,含水量仅为13.30%和11.60%,8月16日进入雨季后,含水量迅速增加,8月26日和10月5日含水量分别为20.63%和16.23%,旱季与雨季之间差别明显。7月1日和8月14日20~80 cm土壤水分含量均低于20%,变化相对较小,8月26日和10月5日土壤水分含量均大于20%,尤其是8月26日20~40 cm土壤含水量高达25.63%,表明雨季中土壤水分状况明显好于旱季。80~100 cm土壤由于风化程度降低,含水量比20~80 cm土壤有所降低。
|
图 2 7月1日(A)、8月14日(B)、8月26日(C)和10月5日(D)的土壤体积含水量变化 Figure 2 Variation of soil volume water content at 1 July (A), 14 August (B), 26 August (C) and 5 October (D) |
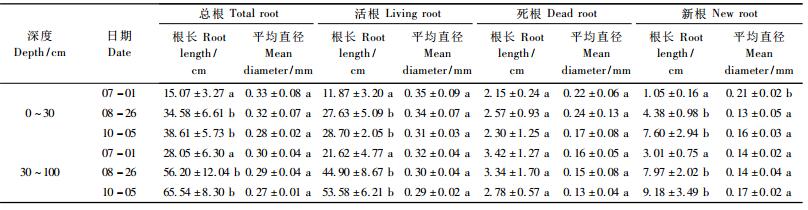
8月26日和10月5日总根长分别为90.78和104.15 cm,比7月1日增加了110.55%和141.55%,其中0~30 cm土壤中根系长度分别增加了129.55%和156.27%,30~100 cm土壤根系长度增加了100.35%和133.64%,表层土壤根长增加量明显高于深层土壤(表 1)。无论表层土壤还是深层土壤,旱季与雨季的死根根长差异都不显著,造成总根长变化的主要是已有活根和新根。雨季中新根根长比旱季显著增加。其中,8月26日和10月5日表层土壤的新根根长比7月1日分别增加315.34%和621.46%,而深层土壤的新根根长分别增加165.18%和205.43%,远远低于表层土壤新根根长增长量。表层与深层土壤的总根系、活根和死根的平均直径之间差异不显著,但表层土壤的新根平均直径变化较大,8月26日和10月5日的平均直径仅为0.13和0.16 mm,低于7月1日的0.21 mm,且差异显著,深层土壤新根平均直径差异不显著。
|
|
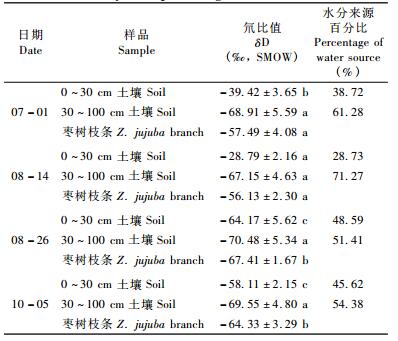
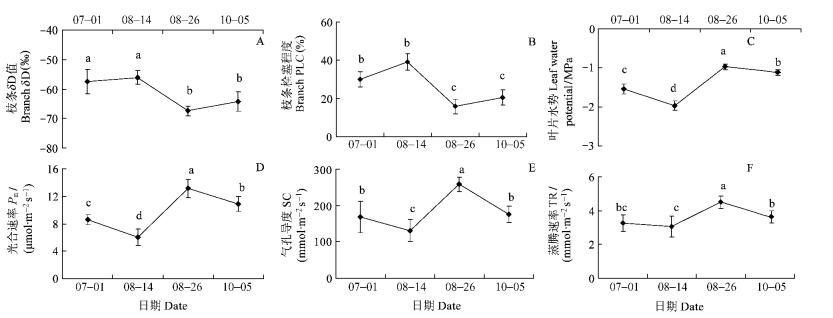
土壤δD值变化存在时空变化。在空间上,0 ~30 cm表层土壤水分受到蒸发分馏影响,土壤水分δD值较高,尤其是在比较干旱的8月14日,δD值高达-28.79,深层土壤δD值较低,保持在-67.15 ~-70.48。在时间看,7月1日和8月14日的0~30 cm土壤δD值显著高于8月26日和10月5日,但30~100 cm土壤δD值之间不存在显著差异。8月16日进入雨季后3场较大降水的δD值分别为-67.35,-69.38和-65.68,表层土壤受到降雨因素影响,δD值显著低于旱季。枣树枝条水分来自于表层和深层土壤,随土壤δD值变化而变化。7月1日和8月14日枣树枝条δD值分别为-57.49和-56.13,高于8月26日和10月5日的-67.41和-64.33,旱季和雨季差异显著(图 3A)。
|
图 3 不同测定时间枝条δD值(A)、栓塞程度(B)、黎明叶片水势(C)、叶片光合速率(D)、气孔导度(E)和蒸腾速率(F)变化 Figure 3 Variation of δD value (A), branch PLC (B), predawn water potential (C), photosynthesis rate (D), stomatal conductance (E) and transpiration rate (F) at different measurement time |
利用White两端线性混合模型计算枣树水分来源于表层和深层土壤的比例,表 2结果显示7月1日和8月14日,枣树利用表层土壤水分分别为38.72%和28.73%,明显低于8月26日和10月5日的48.59%和45.62%,表明旱季枣树利用表层土壤水分较少。无论旱季还是雨季,枣树吸收的深层土壤水分均超过50%,说明枣树主要利用的还是深层土壤水分。
|
|
枝条栓塞能反映树体内水分的传输效率和存储功能。7月1日和8月14日黎明枣树枝条栓塞程度分别为29.95%和39.13%,显著高于8月26日和10月5日的15.80%和20.61%。旱季黎明叶片水势较低,7月1日水势-1.54 MPa,随干旱加剧到8月15日达到最低点-1.96 MPa(图 3B),进入雨季后黎明叶片水势显著上升,8月27日和10月6日叶片水势分别为-0.97和-1.12 MPa(图 3C),这表明即使在黎明,干旱季节枣树叶片水分还是比雨季缺乏。
3.5 枣树叶片光合和蒸腾变化8月14日枣树叶片光合速率最小8月26日最大,分别为6.03和13.14 μmol·m-2s-1(图 3D),7月1日和8月14日光合速率显著低于8月26日和10月5日。8月15日叶片气孔导度和蒸腾速率分别为130.30和3.03 mmol·m-2s-1,8月26日气孔导度和蒸腾速率分别为258.04和4.50 mmol·m-2s-1(图 3E,F),二者差异显著,7月1日和10月5日的气孔导度和蒸腾速率差异不显著。
4 讨论 4.1 土壤水分变化与氘同位素关联表层土壤水由于蒸发而产生氢氧同位素的分馏(Durand et al., 2007),比下层土壤水更加富集重同位素组成(Allison et al., 1982)。试验数据表明:旱季表层土壤水分含量较低,造成该土壤层内氘同位素富集,远偏离雨水或地下水中的δD值。图 4A的相关分析表明:表层土壤δD值与其含水量成极显著正相关关系(R2=0.69,P<0.01),深层土壤δD值与土壤含水量没有相关性(R2=0.002,P=0.89)。雨季来临后3场较大降水,降雨后表层土壤含水量上升,随之土壤水中的δD值很快地接近于雨水的比值。这与Yano等(2006)研究稻田中土壤的δD值变化时发现雨季δD值较低而旱季较高结果一致。相关分析表明:雨季中表层和深层土壤δD值均较低,与土壤含水量没有相关性(图 4B)。Drake等(2003)研究热带雨林水分利用策略时也发现土壤水势与δ18O值在旱季呈现显著相关关系但雨季这种关系不显著。旱季表层土壤氘同位素与土壤含水量密切相关,可以用于追踪植物水分利用与表层土壤含水量之间的关系。
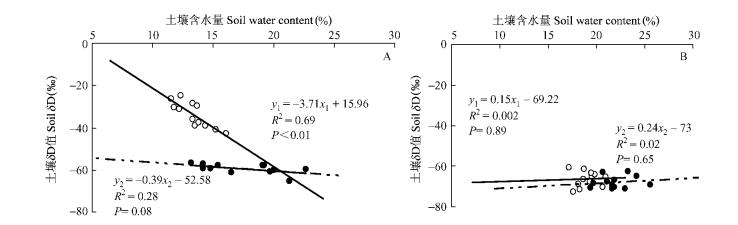
|
图 4 旱季(A)和雨季(B)的土壤δD值与含水量之间的相关关系 Figure 4 Relationship between δD value and soil volume water content in dry (A) and wet(B) season 空心点、y1和x1代表浅层土壤,实心点、y2和x2代表深层土壤。 Circle, y1 and x1 represent shallow soil, solid circle, y2 and x2 represen deep soil. |
植物体内氢稳定同位素信息来源于植物利用的不同环境水分。Šantruček等(2007)研究干旱和湿润环境下桉树叶片中氘同位素分布时也发现干旱环境中叶片的δD值均比湿润环境中的高。Brande等(2007)研究发现:生长季节的树体木质部中的δ18O和δD值通常与2~20 cm的土壤水分中的同位素比值相似,认为同位素信号能有效地分辨木质部水分来源及其动态变化。图 5结果显示:枝条δD值与表层土壤δD值成极显著的正相关关系(R2=0.75,P<0.01),与深层土壤δD值没有相关性,表明表层土壤水分能显著地影响到枝条同位素比值变化。类似的研究结果还出现在对Edwards高原的灌木丛的研究中,灌木在干旱夏季的水分来源较深,湿润的冬季则主要利用地下10 cm左右的土壤水分(McCole et al., 2007)。
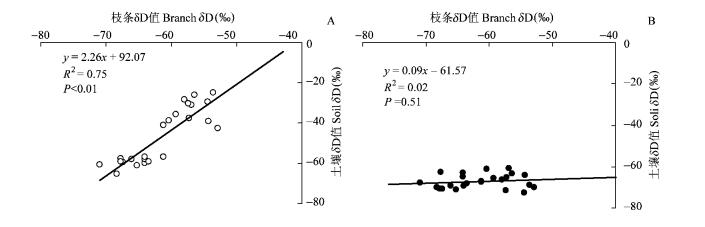
|
图 5 土壤δD值与枝条δD值之间的相关关系 Figure 5 Relationship between soil δD value and branch δD value 空心点代表浅层土壤,实心点代表深层土壤。 Circle represents shallow soil and solid circle represents deep soil. |
枣树水分利用来源与枣树根系的分布和活性密切相关。试验结果表明:雨季表层根系吸水比例比旱季有显著地提高,表层根系吸水能力迅速增加的原因可能来源于2个方面。一是土壤水分有效性,旱季枣树地表层水分仅有11.50%~16.10%,而雨季高达22.70%,可利用水分增多。二是表层活根数量增加,试验表明: 0~30 cm土壤中根系长度增加了129.55%,30~100 cm土壤根系长度增加了100.35%,表层土壤根长增加量显著高于深层土壤。雨季表层根系活根根长比旱季增加了141.92%,活根增多增加水分吸收能力。有研究表明:在旱季多数植物的表层根系的活性下降(Meinzer et al., 2001),降雨量达到一定阈值后,表层根系水力学导度增加(Dawson et al., 1996),新长出细根具有较强水分和养分吸收能力(张志山等,2006),10月5日细根根长比7月1日增加621.46%,从而增加了对表层土壤水分的吸收。
4.3 氘同位素与树体水分生理指标关联凌晨的叶片水势非常接近土壤水势,是土壤水分状况的一个很好的指标(Ryel et al., 2003; Sala et al., 1981)。土壤干旱和高热气温会普遍引起木质部产生气穴栓塞,气穴栓塞的忍耐程度反映植物的抗旱能力(Tyree et al., 2002)。另外,植物干旱之后气穴栓塞的修复能力也是重要的抗旱指标(Tyree et al., 1996)。木质部的气穴栓塞通常有昼夜变化。白天气孔开放,蒸腾使木质部产生张力,从而引起气穴栓塞,而夜晚气孔关闭,气温下降,蒸腾减少使植物有机会修复栓塞(Tyree et al., 2002)。凌晨的枝条气穴栓塞情况反映植物的抗旱能力。在旱季,凌晨的叶片水势、气穴栓塞较严重,以致光合速率和气孔导度均低于雨季,反映了植物的水分状态及对环境的反应。枝条δD值有着类似的变化,在旱季逐渐上升,雨季后迅速下降,表明枝条δD值与枣树水分胁迫可能存在关联。图 6相关分析表明:黎明枝条中的δD值与枝条栓塞程度存在极显著的正相关关系(R2=0.70,P<0.01),枝条δD值与叶片水势负相关,相关系数是0.73,达到极显著水平。可能是表层土壤中水分容易蒸发分馏,造成表层土壤水分中氘同位素富集,枣树吸收表层水分后导致枝条中δD值升高。表层土壤水分含量低,枣树吸水困难,吸收水分不能完全补充白天的蒸腾耗水,从而造成黎明枝条栓塞程度增加和叶片水势下降。Korol等(1999)对辐射松(Pinus radiata)水分状况与C同位素的研究结果表明δ13C与植物水分胁迫的不同参数相关,尤其是黎明的水势。枣树枝条δD值与叶片光合速率相关关系显著,表明枝条水分状况会影响到枣树对光能的利用。不过,枝条δD值与黎明叶片的气孔导度相关性并不强(R2=0.17,P=0.06),相关系数只有0.17,可能气孔运动除了受栓塞造成的水力信号控制还受化学信号控制(Davis et al.,1991),表层根系在干旱胁迫下产生的ABA等化学物质运输到叶片,限制了气孔的蒸腾。枝条δD值与枝条栓塞程度、叶片水势、光合速率等存在相关关系,对其进一步研究可能会为植物水分欠缺程度提供一个量化指标,从而解决研究植物长期水分利用效率的困难(段德玉等2007)。
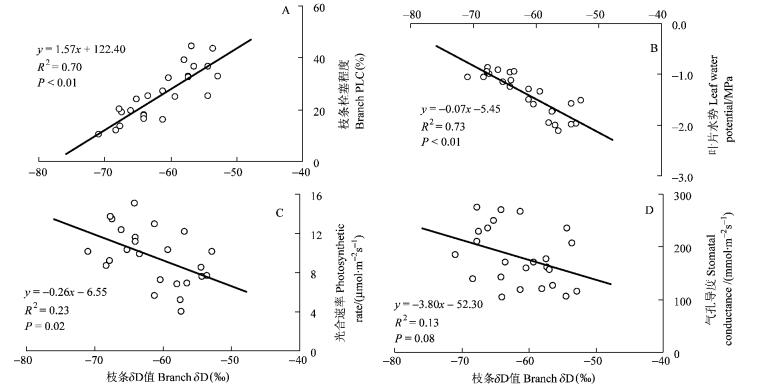
|
图 6 枝条栓塞程度(A)、叶片水势(B)、蒸腾速率(C)、气孔导度(D)与枝条δD值关系 Figure 6 Relationship of branch PLC(A), leaf water potential(B), transpiration rate(C), stomatal conductivity(D) and δD of branch |
此外,枣树根系是否具有二态性,是否在雨季改变功能根的深度,旱季中枣树是否将深层水分提升到表层干燥土壤层,需要通过控制试验进一步研究。
段德玉, 欧阳华. 2007. 氢氧稳定同位素在定量区分植物水分利用来源中的应用[J]. 生态环境, 16(2): 655-660. |
石辉, 刘世荣, 赵晓广. 2003. 稳定性氢氧同位素在水分循环中的应用[J]. 水土保持学报, 17(2): 163-166. |
王鹤松, 孟平, 张劲松, 等. 2007. 华北石质山区山茱萸人工林蒸腾特征及水分供求关系[J]. 林业科学, 43(10): 14-18. DOI:10.3321/j.issn:1001-7488.2007.10.003 |
王锐, 刘文兆, 宋献芳. 2008. 长武塬区大气降水中氢氧同位素特征分析[J]. 水土保持学报, 22(3): 56-59. |
徐振, 安树青, 王中生, 等. 2007. 川滇高山栎灌丛冠层穿透水及其稳定同位素组成变化特征[J]. 资源科学, 29(5): 129-136. |
张劲松, 孟平, 王鹤松, 等. 2007. 华北石质山区苹果树蒸腾规律及水分供求关系[J]. 辽宁工程技术大学学报, 26(5): 783-786. |
张志山, 李新荣, 张景光, 等. 2006. 用Minirhizotrons观测柠条根系生长动态[J]. 植物生态学报, 30(3): 457-464. DOI:10.17521/cjpe.2006.0061 |
Allison G B, Leaney F W. 1982. Estimation of isotopic exchange parameters, using constant-feed pans[J]. Journal of Hydrology, 55(1/4): 151-161. |
Brandes E, Wenninger J, Koeniger P, et al. 2007. Assessing environmental and physiological controls over water relations in a Scots pine(Pinus sylvestris L.)[J]. stand through analyses of stable isotope composition of water and organic matter.Plant, Cell and Environment, 30(1): 113-127. |
Davies W J, Zhang J. 1991. Root signals and the regulation of growth and development of plants in drying soil[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 42(1): 55-76. DOI:10.1146/annurev.pp.42.060191.000415 |
Dawson T E, Pate J S. 1996. Seasonal water uptake and movement in root systems of Australian phreatophytic plants of dimorphic root morphology: a stable isotope investigation[J]. Oecologia, 107(1): 13-20. DOI:10.1007/BF00582230 |
Drake P L, Franks P J. 2003. Water resource partitioning, stem xylem hydraulic properties, and plant water use strategies in a seasonally dry riparian tropical rainforest[J]. Oecologia, 137(3): 321-329. DOI:10.1007/s00442-003-1352-y |
Durand J L, Bariac T, Ghesquière M, et al. 2007. Ranking of the depth of water extraction by individual grass plants, using natural 18 O isotope abundance[J]. Environmental and Experimental Botany, 60(1): 137-144. DOI:10.1016/j.envexpbot.2006.09.004 |
Ellsworth P Z, Williams D G. 2007. Hydrogen isotope fractionation during water uptake by woody xerophytes[J]. Plant and Soil, 291(1): 93-107. |
February E, Higgins S, Bond W J. 2007. Using stable water isotopes to determine the depth of water used by different sizes of savanna trees[J]. South African Journal of Botany, 73(2): 287-292. |
Gonfiantini R, Gratziu S, Tongiorgi E. 1965. Oxygen isotopic composition of water in leaves//IAEA.Isotopes and Radiation in Soil-Plant Nutrition Studies[J]. International Atomic Energy Agency, Vienna: 405-410. |
Korol R L, Kirschbaum M U F, Farquhar G D, et al. 1999. Effects of water status and soil fertility on the C-isotope signature in Pinus radiata[J]. Tree Physiology, 19(9): 551-562. DOI:10.1093/treephys/19.9.551 |
Lin G H, Sternberg L da S L. 1993. Hydrogen isotopic fractionation during water uptake in coastal wetland plants//Ehleringer J, Hall A, Farquhar G.Stable Isotopes and Plant Carbon-Water Relations[J]. Academic Press, San Diego: 497-510. |
McCole A A, Stern L A. 2007. Seasonal water use patterns of Juniperus ashei on the Edwards Plateau, Texas, based on stable isotopes in water[J]. Journal of Hydrology, 342(3): 238-248. |
Meinzer F C, Brooks J R, Gartner B L, et al. 2006. Dynamics of water transport and storage in conifers studied with deuterium and heat tracing techniques[J]. Plant, Cell and Environment, 29(1): 105-114. DOI:10.1111/PCE.2006.29.issue-1 |
Rose K L, Graham R C, Parker D R. 2003. Water source utilization by Pinus jeffreyi and Arctostaphylos patula on thin soils over bedrock[J]. Oecologia, 134(1): 46-54. DOI:10.1007/s00442-002-1084-4 |
Ryel R J, Leffler A J, Peek M S, et al. 2003. Water conservation in Artemisia tridentata through redistribution of precipitation[J]. Oecologia, 141(2): 335-345. |
Sala O E, Lauenroth W K, Parton W J, et al. 1981. Water status of soil and vegetation in a short grass steppe[J]. Oecologia, 48(3): 327-331. DOI:10.1007/BF00346489 |
ŠantručekJ, KvětoňJ, ŠetlíkJ, 等. 2007. Spatial variation of deuterium enrichment in bulk water of snowgum Leaves[J]. Plant Physiology, 143(1): 88-97. |
Sekiya N, Yano K. 2004. Do pigeon pea and sesbania supply groundwater to intercropped maize through hydraulic lift? -Hydrogen stable isotope investigation of xylem waters[J]. Field Crops Research, 86(2): 167-173. |
Snyder K A, Williams D G. 2000. Water sources used by riparian trees varies among stream types on the San Pedro River, Arizona[J]. Agricultural and Forest Meteorology, 105(2): 227-240. |
Tyree M T, Cochard H. 1996. Summer and winter embolism oak: impact on water relations[J]. Annals of Forest Science, 53: 173-180. DOI:10.1051/forest:19960201 |
Tyree M T, Zimmermann M H. 2002. Xylem structure and the ascent of sap[J]. 2nd ed.Springer-Verlag, Berlin: 278. |
Wershaw R L, Friedman I, Heller S J. 1966. Hydrogen isotope fractionation of water passing through trees//Hobson F, Speers M.Advances in Organic Geochemistry.[J]. New York: Pergmon: 55-67. |
White J W, Cooker E R, Lawernce J R. 1985. The D/H ratios of sap in trees: implications of water sources and tree ring D/H ratios[J]. Geochimicaet Cosmochimica Acta, 49(1): 237-246. DOI:10.1016/0016-7037(85)90207-8 |
Yano K, Sekiya N, Samson B K, et al. 2006. Hydrogen isotope composition of soil water above and below the hardpan in a rainfed lowland rice field[J]. Field Crops Research, 96(3): 477-480. |
Zencichs S J, Froend R H, Turner J V, et al. 2002. Influence of groundwater depth on the seasonal sources of water accessed by Banksia tree species on a shallow, sandy coastal aquifer[J]. Oecologia, 131(1): 8-19. DOI:10.1007/s00442-001-0855-7 |
 2011, Vol. 47
2011, Vol. 47