文章信息
- 王占军, 陈金慧, 施季森
- Wang Zhanjun, Chen Jinhui, Shi Jisen
- 植物干细胞中WUS/CLV反馈调控机制的研究进展
- Progress on WUS/CLV Feedback Regulatory Mechanisms in Plant Stem Cells
- 林业科学, 2011, 47(4): 159-165.
- Scientia Silvae Sinicae, 2011, 47(4): 159-165.
-
文章历史
- 收稿日期:2010-10-26
- 修回日期:2011-01-06
-
作者相关文章
近10多年以来,有关人体干细胞研究和鼠(Mus musculus)等模式动物的理论取得显著的进展(Thomson et al., 1998; Shamblott et al., 1998; Gokhale et al., 2009),不仅引起了科学家甚至是社会公众的广泛兴趣,而且从事植物研究的科学家也开始关注植物干细胞研究的重要性及其可能的应用价值。1908年在人类和模式动物上开始应用干细胞的概念(Townsend, 2008)。人体和模式动物的干细胞,在受精卵开始发育的瞬间开始,胚胎(或称胚性)干细胞(embryonic stem cells)迅速向多能干细胞(pluripotent或multipotent stem cells)和单能干细胞(unipotent or monopotential stem cells)分化。且在一般情况下,动物的干细胞命运,伴随着动物生命体的发育和生长过程,反复演绎着生命规律中设计好的一系列不可逆转(单一极性方向的发育模式)的细胞凋亡事件,直到生命的终结(Kaur et al., 2009)。但在植物的生命过程中,有关干细胞的生物学特征和发育命运,又与动物有着明显的区别。从植物开始萌发形成植株的瞬间开始,受精卵形成的合子胚向着形成顶端、根端和侧生干细胞区方向发育,同时始终保持着胚性干细胞的特点。这点在多年生木本植物上尤为明显。Scheres(2007)指出世界上最高大的绿色植物北美红杉(Sequoia sempervirens)在地球上生活2 000多年后,仍能通过古老干细胞的活动实现自身的生长。植物干细胞(plant stem cell)具有自我更新和无限分化潜能(Maryer et al., 1998)。在植物发育过程中,根据干细胞增殖和分化能力的差异,可分为全能干细胞(totipotent stem cells)、多能干细胞和单能干细胞(Verdeil et al., 2007)。与全能干细胞不同,多能干细胞分化后产生一种或多种特定类型(一般情况下不可逆)的子细胞,产生的部分子细胞是仍保持分化潜能的单能干细胞,单能干细胞最终分化为成熟组织中特定功能的细胞(Scheres, 2007),整个分化过程是基因表达变化引起细胞表型质变的过程。近年来,以模式植物拟南芥(Arabidopsis thaliana)为首的植物干细胞的研究引起了众多学者的广泛关注。
高等植物的整个生命周期包括胚胎发育和胚后发育。胚后发育过程中,植物的主要组织器官源于初生分生组织[又称为顶端分生组织,包括茎端分生组织(shoot apical meristem, SAM)和根端分生组织(root apical meristem, RAM)]和次生分生组织[或称为侧生分生组织,包括维管形成层组织(vascular cambium, VCAM)等]。SAM,RAM和VCAM都具有自我更新和无限分化潜能,能够通过其组织内干细胞的活动实现自身的增殖和形成其他组织及器官,但通常条件下仅能分化和发育成某些组织和器官,因此视为具有多能干细胞活性的组织(Baucher et al., 2007)。开花植物胚后发育过程中,茎端分生组织产生植物体地上主体结构,根端分生组织则形成植物体地下主体结构(Kerstettera et al., 1997)。木本植物通过维管形成层细胞产生木质部和韧皮部组织,引起形成木材的次生生长(Iqbal et al., 1990)。
本文就植物干细胞研究进展和SAM中WUS/CLV(WUSCHEL/CLAVATA)以及RAM中的WOX5/CLE40反馈调控机制进行评述,针对VCAM维管中WUS/CLV反馈调控机制对于树木次生生长的影响等重要科学问题进行了展望。
1 茎端分生组织(SAM) 1.1 SAM的结构植物体茎端分生组织(SAM)的大小、形状及在叶原基的形成模式差别较大,但是大多数植物顶端组织的内部结构差异很小(Kerstettera et al., 1997)。茎端分生组织位于植物茎的最顶端,形态上呈中间突起的拱形结构,结构上具有典型的分层和分区等特点(Stewart et al., 1970)。通过SAM细胞的分裂产生终末分化的侧生和基部组织器官(Maryer et al., 1998)。根据组织和基因表达模式研究,由外至内可将拟南芥的SAM分为L1,L2和L3三个细胞层(图 1)(Xie et al., 2009; Stewart et al., 1970)。通过垂周分裂的方式,L1层细胞产生外表皮组织,L2层细胞产生表皮下组织及配子; 内部基本组织由进行随机分裂的L3层细胞产生(Stahl et al., 2005)。3个细胞层中都含有1~3个干细胞,由这些干细胞产生各细胞层的所有细胞(Schoof et al., 2000),最终在SAM的两侧形成拱形结构并发育成不同的器官,因此3个细胞层间遗传信息的交流和协调是实现器官形成的关键(Clark, 2001)。根据细胞组织化学研究表明,又可将SAM分为最顶端的中心区(central zone, CZ)、中心区下方的带状区(rib zone, RZ)和两侧的外周区(peripheral zone, PZ),中心区包括其上部的干细胞区和下方靠近带状区的组织中心(organizing centre, OC) (图 1)(Xie et al., 2009)。虽然3个区的边界还存在争议,但各区的细胞具有典型的结构特征。与其RZ和OC区细胞相比,CZ区细胞大且高度液泡化,细胞分裂频率减慢,不直接参与器官发生,但是它们先分裂产生过渡型的增殖细胞(transit amplifying cells, 简称TA细胞),再由过渡型增殖细胞转变为PZ区细胞,以维持叶原基或茎等侧生器官中细胞的数量,间接为侧生器官的生长和分化提供细胞学基础(Stahl et al., 2005),所以将这些干细胞称为侧生器官的基细胞。器官原基启动后,细胞便进入到分化途径,进入最终形成外周组织的过程(Hohm et al., 2010)。PZ区细胞的细胞质致密且分裂活跃,直接为侧生器官的生长和分化提供前期细胞(Kerstettera et al., 1997; Kwiatkowska, 2008)。

|
图 1 拟南芥SAM中WUS/CLV负反馈调节环(引自Xie et al., 2009) Figure 1 WUS/CLV feedback regulatory loop in the Arabidopsis thaliana SAM(According to Xie et al., 2009) P1:外周组织1 Peripheral 1; P2:外周组织2 Peripheral 2; PZ:外周区Peripheral zone; CZ:中心区Central zone; OC:组织中心Organizing centre; RZ:带状区Rib zone. |
绿色植物为保持自身持续不断的生长潜能,须有效地保持和控制器官形成和分生组织之间的长期平衡(Nieuwland et al., 2009)。自20世纪90年代起,在拟南芥上已有许多关于SAM中维持两者平衡的WUS/CLV反馈调控机制的报道。
Laux等(1996)利用甲基磺酸乙酯(EMS)诱变模式植物拟南芥,发现拟南芥wus突变体出现顶端优势丧失,花数量明显减少且提前脱落,花雌蕊缺失、多数情况仅形成1个雄蕊和基部多分枝的现象。在拟南芥胚胎发育和胚后发育过程中,WUS并不在SAM的干细胞区表达,而是在干细胞区下方的OC区表达(Mayer et al., 1998);通过WUS合成的内源信号分子维持紧贴其上部的多能干细胞的增殖和控制干细胞的数量,促进干细胞产生,同时抑制干细胞分化,WUS缺失时干细胞分化加速(Laux et al., 1996)。继WUS基因报道后,Haecker等(2003)又确定了其他14个开放阅读框(open reading frames, ORF),与拟南芥WUS基因的homeodomain(HD)区比较,这14个ORF编码概念蛋白的HD区存在38%~67%的一致性和67%~87%的相似性,因此将这些基因称为WUS HOMEOBOX(WOX)。
与WUS基因抑制干细胞分化和维持干细胞数量的功能相反,CLAVATA(包括CLV1,CLV2和CLV3)基因具有促进干细胞分化和器官形成的功能(Mayer et al., 1998)。CLV编码一个受体蛋白激酶信号通路,包括编码2个跨膜蛋白激酶异构体的CLV1和CLV2,以及编码信号肽的CLV3。CLV1编码受体蛋白激酶(receptor-like kinase, RLK),该激酶具有胞外富含亮氨酸的串联重复序列(leucine-rich repeats, LRRs)、单个跨膜结构域和胞内丝氨酸蛋白激酶结构域(Clark et al., 1997)。CLV1蛋白存在分子量185 ku无活性和450 ku有活性2种状态的蛋白复合物。起初CLV1蛋白为185 ku无活性的复合物,当与CLV3分泌信号蛋白配体结合时,促进CLV1蛋白发生磷酸化,与蛋白磷酸酶(kinase-associated protein phosphatase, KAPP)及Rho GTP酶相关蛋白(Rho GTPase-related protein, ROP)等结合形成450 ku有活性的蛋白复合物(Trotochauda et al., 1999; Jeonga et al., 1999)。CLV2编码介导跨膜信号复合物的受体类辅助蛋白,由胞外区的富含亮氨酸重复序列和胞内的短尾结构组成,但缺少胞内激酶结构域。CLV3编码的多肽形成一个小的分泌蛋白配体。合成受体激酶的CORYNE (CRN)基因也参与干细胞的调控过程(Müller et al., 2008)。CLV3配体存在3种与受体结合的方式:CLV3与CLV1,CLV3与CLV2/CRN,及CLV3与由CLV1和CLV2/CRN组成的复合体的结合(Bleckmann et al., 2010)。当WUS基因表达量增加时促进SAM中干细胞的分裂,此时干细胞分泌的CLV3信号蛋白数量会相应增加,通过上述3种方式与其下方细胞中受体结合,释放限制OC区WUS基因表达的跨膜信号,抑制下游WUS基因的表达和造成干细胞的缺失; 表达量降低的WUS基因仅能维持少量干细胞的活性,少量的干细胞发出微弱的CLV3负反馈信号,结果WUS的表达量再次增加,高表达量的WUS促进其上部的干细胞分裂,形成一个维持SAM中干细胞数量的WUS信号增加和CLV抑制加强共存的负反馈调节环(图 1) (Xie et al., 2009; Brand et al., 2000)。CLV1,CLV2,CLV3和CRN中每个基因突变时都促进WUS的表达,造成拟南芥SAM和花分生组织中未分化的干细胞增多,表现为顶端、花和其他器官膨大(Müller et al., 2008);过度表达CLV3则引起WUS表达丧失,造成顶端和花分生组织停止发育(Clark et al., 1997)。
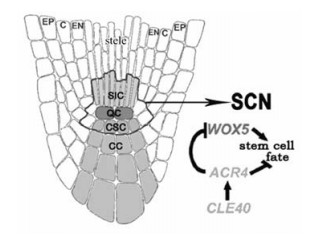
2 根端分生组织(RAM) 2.1 RAM的结构根端分生组织(RAM)位于SAM极性对应的近地端,由RAM中干细胞分化产生根远端和近端的细胞。拟南芥RAM细胞重复的横向分裂形成了连续的细胞层结构,导致RAM细胞系间容易区分,但也正因为其横向结构源自中柱鞘(pericycle),所以不具有SAM典型的3细胞层(L1, L2和L3)嵌套结构。在拟南芥根冠的上部,存在3个明显差异且彼此重叠的区域,由下而上分别是分生区(meristematic zone, MZ),伸长区(elongation zone, EZ)和分化区(differentiation zone, DZ)(又称根毛区)(Dolan et al., 1993)。分生区中存在静止中心(quiescent centre, QC)细胞及其周围细胞组成的干细胞龛(stem cell niche, SCN)(图 2)(Stahl et al., 2009)。很少进行分裂的QC细胞调控着周围中柱原始细胞(即干细胞,stele initial cell, SIC)和柱状干细胞(columella stem cell, CSC)的命运,当干细胞分裂后,产生的子细胞仍与QC细胞紧密联系以维持其干细胞的本性,否则子细胞便转化为TA细胞,进一步分裂延展为伸长区和分化区细胞(Stahl et al., 2005)。解剖发现,中柱鞘位于RAM正中央中柱(central cylinder)的外侧,呈环形结构, 该结构平均由12个细胞组成。中柱鞘的外侧依次是8个细胞组成的内皮层(endodermis, EN)、8细胞单环结构组成的皮层(cortex, C)和最外的表皮(epidermis, EP)结构(图 2)(Stahl et al., 2009)。
|
图 2 拟南芥RAM中WOX5/CLE40负反馈调节环(引自Stahl et al., 2009) Figure 2 WOX5/CLE40 feedback regulatory loop in Arabidopsis thaliana RAM (According to Stahl et al., 2009) SIC:中柱原始细胞Stele initials cell; QC:静止中心Quiescent center;CSC:柱状干细胞Columella stem cell; CC:柱状细胞Columella cell. |
RAM中同样存在WUS/CLV类反馈调控机制。WOX家族的WOX5基因仅在QC细胞中表达,以维持末端干细胞的数量。在拟南芥和其他植物中已经发现40种编码CLV3-like(CLE)蛋白,这些基因都具有N末端分泌信号肽和CLE基元,在靠近C末端都有一小段14个氨基酸组成的结构(Cock et al., 2001)。CLE40基因具有控制RAM干细胞增殖的功能,它由已分化的柱状细胞(columella cells, CC)分泌产生,并通过RAM柱状干细胞中表达的受体ARABIDOPSIS CRINKLY4 (ACR4)抑制WOX5的表达。WOX5维持干细胞的数量、抑制干细胞的分化,CLE40促进干细胞分化、减少干细胞数量,在ACR4的介导下,形成调控RAM中干细胞的WOX5/CLE40负反馈调节环(图 2)(Stahl et al., 2009),维持根末端干细胞分裂与其他组织形成间的平衡。wox5突变体表现为RAM末端干细胞分化,而再获得WOX5基因功能时则阻止了RAM末端干细胞的分化(Sarkar et al., 2007)。cle40和acr4植株中富集了大量的柱状干细胞(De Smet et al., 2008; Stahl et al., 2009; 2010)。近来研究发现,CLV3和多数CLE基因(包括CLE8~40和CLE45)都具有促进RAM中干细胞分化的功能(Stahl et al., 2009)。
3 维管形成层组织(VCAM) 3.1 VCAM的结构木材是造纸、建筑等重要的原材料和可再生能源,具有重要的经济价值和生态学意义(Baucher et al., 2007)。木材形成是植物发育和维管植物进化过程中的关键阶段(Groover, 2005),通过维管形成层细胞的增殖活动产生木材,同时木材品质的改良也可以通过调控形成层细胞的活动来实现(Elo et al., 2009),所以木本植物中维管形成层活动调控机制的研究一直备受关注。
植物维管组织不仅具有组成植物体物理结构和支撑2种主要功能,同时还承担着运输水分、营养物质和其他生长、防御必需物质的功能(Elo et al., 2009)。在裸子植物和双子叶被子植物中,存在初生生长和次生生长2种截然不同的发育阶段,一般而言,单子叶植物仅存在初生生长阶段。原形成层(procambium)和维管形成层(vascular cambium)分别在初生和次生生长2个发育阶段中扮演着重要的角色。作为次生分生组织,维管形成层具备组织生长轴方向维管束结构发育的功能,同时也具有干细胞的功能(Sehr et al., 2010)。在茎和根维管组织的初生发育过程中,顶端分生组织分化产生原形成层和束间薄壁细胞(Guo et al., 2009),再通过介导原形成层干细胞向外产生初生韧皮部和向内产生初生木质部,由初生韧皮部、原形成层和初生木质部共同组成维管束结构(Ye, 2002);次生发育阶段,原形成层细胞和一些薄壁细胞(如茎的束间薄壁细胞和根部中柱鞘细胞)转变为维管形成层干细胞(Guo et al., 2009),并由形成层干细胞通过平周分裂分化出次生木质部和次生韧皮部,最终形成以木质部为中心的木质部、形成层和韧皮部同心环结构,维管形成层在次生生长阶段发挥着关键的作用(Elo et al., 2009)。形成层细胞存在纺锤形原始细胞(fusiform initials)和射线形原始细胞(ray initials)。纺锤形原始细胞产生构成木材的径向结构:导管、木纤维、管胞、径向薄壁细胞、筛胞和伴胞; 射线形原始细胞则形成木材的横向结构即射线形薄壁细胞(Ye, 2002; Wang et al., 2010)。相比之下,射线形原始细胞在植物次生生长形成木材过程中发挥着更重要的作用(Iqbal et al., 1990)。
尽管拟南芥在发育过程中主要进行初生生长,但拟南芥的花序茎和根经历了次生生长(Ye, 2002),短日照处理后拟南芥的下胚轴出现与杨树相似的木质部组织(Chaffey et al., 2002),结合重力和短日照处理后拟南芥的茎产生了明显的次生木质部(Ko et al., 2004),所以拟南芥可以作为研究木材形成的重要模式植物材料之一。百日草(Zinnia elegans)叶肉细胞培养系统是另一个研究木材形成的重要模式系统,在一定配比的激素处理条件下,百日草叶肉细胞可以分化为次生壁加厚的导管分子(tracheary element, TE)(Fukuda et al., 1980)。
3.2 VCAM中反馈调控机制与研究较为透彻的拟南芥顶端分生组织遗传调控机制相比,植物尤其是多年生木本植物维管形成层的遗传调控机制的研究却处于起步阶段。造成多年生木本植物形成层研究较少的主要原因:一是用于形成层研究的遗传材料分离困难,研究积累较少; 其次是多年生木本植物的形成层组织细胞的层数在季节之间变异较大,仅从细胞形态上不易区分和分离。
Hirakawa等(2010a)发现原形成层细胞通过与韧皮部和木质部细胞相邻的导管分子分化抑制因子(tracheary element differentiation inhibitory factor, TDIF)的受体(TDIF receptor/phloem intercalated with xylem, TDR/PXY), 接收韧皮部细胞产生和释放的导管分子分化抑制因子的配体信号分子,配体受体共同调控促进原形成层细胞分裂增殖和抑制木质部细胞分化(图 3);Etchells等(2010)也发现拟南芥原形成层细胞中表达的PXY基因和韧皮部细胞中表达的CLE41基因间存在调控维管形成层细胞分裂的反馈调控机制。TDIF是介导维管细胞形成维管组织的CLE基因家族产物(例如CLE41和CLE44),百日草叶肉细胞培养系统中发现TDIF是由12个氨基酸组成的一个多肽,该多肽第1和第2位脯氨酸残基发生羟基化(HEVHypSGHypNPISN)。从韧皮部向木质部,TDIF的浓度逐渐降低(Hirakawa et al., 2010a)。WOX家族的WOX4是TDIF信号通路中的关键目标基因,当植物采用依赖于TDR方式的TDIF通路时,WOX4的表达上调; 遗传分析发现WOX4具有促进原形成层或形成层干细胞增殖的功能,但不具有应答TDIF信号的抑制形成层干细胞分化为木质部细胞的功能。突变体研究发现,TDIF-TDR-WOX4信号在拟南芥次生生长维管分生组织的维持中扮演着重要角色(Hirakawa et al., 2010b)。虽然至今尚未在VCAM中发现调控形成层干细胞的WUS/CLV反馈调控机制,但是杨树VCAM中基因转录水平研究发现,杨树形成层干细胞中存在可能参与形成层细胞调控的PttCLV1及其高度相似的PttRLK2, PttRLK3和WUS相关基因PttHB2, PttHB3,其中PttRLK3与PttHB3表达区重叠(Schrader et al., 2004),表明VCAM中同样可能存在WUS/CLV反馈调控机制; 有关拟南芥VCAM的分子调控机制研究也发现,SAM和VCAM中可能存在一些相近的干细胞调控机制(Groover, 2005)。

|
图 3 VCAM中TDIF配体与TDR/PXY受体信号通路(引自Hirakawa et al., 2010a) Figure 3 The signaling pathway between TDIF ligand and TDR/PXY receptor in the VCAM(According to Hirakawa et al., 2010a) Conc.:浓度Concentration. |
深入理解植物体正常的发育过程和精准地确定由于突变而造成的缺失,应该分析有关发育的细节和系统的结构,例如细胞的形态、数目和空间结构等,为有关形态发生的遗传发育生物学研究奠定基础(Dolan et al., 1993)。与SAM和RAM具有长期启动分裂、分化的活性和定位于植物近地端和远地端的特点相比,VCAM具有相似的长期潜在的维持启动状态功能的机制,而叶等侧生分生组织维持启动分裂和分化状态的时间较短。SAM的CZ区细胞和RAM的QC细胞都具有分裂频率低的特点(Veit, 2006),VCAM区细胞也有相似的特点。OC和QC细胞通过信号转导调控与两者相邻的干细胞的活动,研究发现VCAM区能被再分为形成层干细胞区及其两侧的韧皮部母细胞区和木质部母细胞区(Schrader et al., 2004),预示3种分生组织中可能都存在调控相邻干细胞分裂、分化的细胞区。尽管植物形成层细胞的层数尚存争议,但是同样作为多能干细胞组织,VCAM与SAM,RAM 3种器官发生模式的比较研究,将有助于理解林木干细胞维持和调控更多组织器官命运的机制。
RAM中WOX5/CLE40与SAM中WUS/CLV调控机制相似,由QC和OC细胞分别合成维持干细胞数量的WOX5和WUS基因,通过CLE40和CLV基因分别抑制WOX5和WUS的表达,抑制干细胞的分裂同时促进干细胞的分化,表现为维持干细胞的分裂与其他组织形成间平衡的功能。RAM中WOX5/CLE40与SAM中WUS/CLV调控机制的主要差异是CLE40源自RAM中已分化的细胞,而CLV3则由SAM的干细胞产生(Stahl et al., 2010)。与RAM中WOX5/CLE40及SAM中的WUS/CLV调控功能相似,VCAM中的WOX4具有促进原形成层或形成层干细胞增殖的功能,但是由韧皮部细胞产生的TDIF(CLE41和CLE44)具有促进原形成层细胞分裂增殖和/或抑制原形成层区细胞转化为木质部细胞的双重功能,而不具有促进原形成层区细胞分化的功能,WOX4不能应答TDIF抑制干细胞分化为木质部细胞的信号(Hirakawa et al., 2010a;2010b)。杨树VCAM中基因转录分析结果表明,SAM,RAM与VCAM可能存在相同的干细胞调控机制(Schrader et al., 2004)。PttCLV1,PttRLK3和PttHB3等基因的深入研究将有利于揭示VCAM中WUS/CLV反馈调控机制。
5 展望目前,已有许多SAM和RAM中WUS/CLV反馈调控机制的报道,结构研究较为透彻和易于取材等优点使2种组织取得了诸多研究成果。虽然还未在VCAM中发现存在调控形成层干细胞的WUS/CLV反馈调控机制,但已有的关于VCAM与SAM和RAM解剖结构和组织化学相似性的特点,以及杨树VCAM的基因转录表达分析结果与SAM和RAM中干细胞调控机制比较的结果,将有利于深入研究VCAM中也可能存在的一类促进形成层干细胞分化的CLV或CLE类基因,以及在TDIF调控过程中的1个或2个尚未阐明的下游信号通路,该信号通路具有调控TDIF促进原形成层细胞分裂和抑制木质部细胞分化的双重功能,同时韧皮部通过TDIF调控木质部的发育。有关木质部中是否存在调控韧皮部发育的信号(Hirakawa et al., 2010a),在形成层中是否还存在调控木质部和韧皮部发育的信号等重要问题均有待进一步深入研究。以期能借鉴SAM中WUS/CLV和RAM中WOX5/CLE40反馈调控机制的研究,揭示VCAM中WUS/CLV的反馈调控机制,了解调控形成层干细胞分裂和分化形成子细胞的过程,最终实现从遗传和环境2个层面上调控形成层干细胞行为和增加木材生物质产量的理想目标。
Baucher M, El Jaziri M, Vandeputte O. 2007. From primary to secondary growth: origin and development of the vascular system[J]. J Exp Bot, 58(13): 3485-3501. DOI:10.1093/jxb/erm185 |
Bleckmann A, Weidtkamp-Peters S, Seidel C A, et al. 2010. Stem cell signaling in Arabidopsis requires CRN to localize CLV2 to the plasma membrane[J]. Plant Physiol, 152(1): 166-176. DOI:10.1104/pp.109.149930 |
Brand U, Fletcher J C, Hobe M, et al. 2000. Dependence of stem cell fate in Arabidopsis on a feedback loop regulated by CLV3 activity[J]. Science, 289(5479): 617-619. DOI:10.1126/science.289.5479.617 |
Chaffey N, Cholewa E, Regan S, et al. 2002. Secondary xylem development in Arabidopsis: a model for wood formation[J]. Physiol Plant, 114(4): 594-600. DOI:10.1034/j.1399-3054.2002.1140413.x |
Clark S E, Williams R W, Meyerowitz E M. 1997. The CLAVATA1 gene encodes a putative receptor kinase that controls shoot and floral meristem size in Arabidopsis[J]. Cell, 89(4): 575-585. DOI:10.1016/S0092-8674(00)80239-1 |
Clark S E. 2001. Cell signalling at the shoot meristem[J]. Nat Rev Mol Cell Biol, 2(4): 276-284. DOI:10.1038/35067079 |
Cock J M, McCormick S. 2001. A large family of genes that share homology with CLAVATA3[J]. Plant Physiol, 126(3): 939-942. DOI:10.1104/pp.126.3.939 |
De Smet I, Vassileva V, De Rybel B, et al. 2008. Receptor-like kinase ACR4 restricts formative cell divisions in the Arabidopsis root[J]. Science, 322(5901): 594-597. DOI:10.1126/science.1160158 |
Dolan L, Janmaat K, Willemsen V, et al. 1993. Cellular organisation of the Arabidopsis thaliana root[J]. Development, 119(1): 71-84. |
Elo A, Immanen J, Nieminen K, et al. 2009. Stem cell function during plant vascular development[J]. Semin Cell Dve Biol, 20(9): 1097-1106. DOI:10.1016/j.semcdb.2009.09.009 |
Etchells J P, Turner S R. 2010. The PXY-CLE41 receptor ligand pair defines a multifunctional pathway that controls the rate and orientation of vascular cell division[J]. Development, 137(5): 767-774. DOI:10.1242/dev.044941 |
Fukuda H, Komamine A. 1980. Establishment of an experimental system for the study of tracheary element differentiation from single cells isolated from the mesophyll of Zinnia elegans[J]. Plant Physiol, 65(1): 57-60. DOI:10.1104/pp.65.1.57 |
Gokhale P J, Andrews P W. 2009. Human embryonic stem cells: 10 years on[J]. Lab Invest, 89(3): 259-262. DOI:10.1038/labinvest.2008.162 |
Groover A T. 2005. What genes make a tree a tree?[J]. Trends Plant Sci, 10(5): 210-214. DOI:10.1016/j.tplants.2005.03.001 |
Guo Y, Qin G, Gu H, et al. 2009. Dof5.6/HCA2, a Dof transcription factor gene, regulates interfascicular cambium formation and vascular tissue development in Arabidopsis[J]. The Plant Cell, 21(11): 3518-3534. DOI:10.1105/tpc.108.064139 |
Haecker A, Gross-Hardt R, Geiges B, et al. 2003. Expression dynamics of WOX genes mark cell fate decisions during early embryonic patterning in Arabidopsis thaliana[J]. Development, 131(3): 657-668. |
Hirakawa Y, Kondo Y, Fukuda H. 2010a. Regulation of vascular development by CLE peptide-receptor systems[J]. J Integr Plant Biol, 52(1): 8-16. DOI:10.1111/jipb.2010.52.issue-1 |
Hirakawa Y, Kondo Y, Fukuda H. 2010b. TDIF peptide signaling regulates vascular stem cell proliferation via the WOX4 homeobox gene in Arabidopsis[J]. The Plant Cell, 22(8): 2618-2629. DOI:10.1105/tpc.110.076083 |
Hohm T, Zitzler E, Simon R. 2010. A dynamic model for stem cell homeostasis and patterning in Arabidopsis meristems[J]. PLoS One, 5(2): e9189. DOI:10.1371/journal.pone.0009189 |
Iqbal M, Ghouse A K M. 1990. Cambial concept and organization//Iqbal M. The vascular cambium. Taunton, UK: Research Studies, Press: 1-36.
|
Jeonga S, Trotochauda A E, Clark S E. 1999. The Arabidopsis CLAVATA2 gene encodes a receptor-like protein required for the stability of the CLAVATA1 receptor-like kinase[J]. The Plant Cell, 11(10): 1925-1934. DOI:10.1105/tpc.11.10.1925 |
Kaur S, Kartha C C. 2009. Stem cells: Concepts and prospects. Current Trends in Science, Platinum Jubilee Special: 437-452.
|
Kerstettera R A, Hake S. 1997. Shoot meristem formation in vegetative development[J]. The Plant Cell, 9(7): 1001-1010. DOI:10.1105/tpc.9.7.1001 |
Ko J H, Han K H, Park S, et al. 2004. Plant body weight-induced secondary growth in Arabidopsis and its transcription phenotype revealed by whole-transcriptome profiling[J]. Plant Physiol, 135(2): 1069-1083. DOI:10.1104/pp.104.038844 |
Kwiatkowska D. 2008. Flowering and apical meristem growth dynamics[J]. J Exp Bot, 59(2): 187-201. DOI:10.1093/jxb/erm290 |
Laux T, Mayer K F, Berger J, et al. 1996. The WUSCHEL gene is required for shoot and floral meristem integrity in Arabidopsis[J]. Development, 122(1): 87-96. |
Mayer K F, Schoof H, Haecker A, et al. 1998. Role of WUSCHEL in regulating stem cell fate in the Arabidopsis shoot meristem[J]. Cell, 95(6): 805-815. DOI:10.1016/S0092-8674(00)81703-1 |
Müller R, Bleckmann A, Simon R. 2008. The receptor kinase CORYNE of Arabidopsis transmits the stem cell-limiting signal CLAVATA3 independently of CLAVATA1[J]. The Plant Cell, 20(4): 934-946. DOI:10.1105/tpc.107.057547 |
Nieuwland J, Scofield S, Murray J A. 2009. Control of division and differentiation of plant stem cells and their derivatives[J]. Semin Cell Dev Biol, 20(9): 1134-1142. DOI:10.1016/j.semcdb.2009.09.011 |
Sarkar A K, Luijten M, Miyashima S, et al. 2007. Conserved factors regulate signalling in Arabidopsis thaliana shoot and root stem cell organizers[J]. Nature, 446(7137): 811-814. DOI:10.1038/nature05703 |
Scheres B. 2007. Stem-cell niches: nursery rhymes across kingdoms[J]. Nat Rev Mol Cell Biol, 8(5): 345-354. DOI:10.1038/nrm2164 |
Schoof H, Lenhard M, Haecker A, et al. 2000. The stem cell population of Arabidopsis shoot meristems is maintained by a regulatory loop between the CLAVATA and WUSCHEL genes[J]. Cell, 100(6): 635-644. DOI:10.1016/S0092-8674(00)80700-X |
Schrader J, Nilsson J, Mellerowicz E, et al. 2004. A high-resolution transcript profile across the wood-forming meristem of poplar identifies potential regulators of cambial stem cell identity[J]. The Plant Cell, 16(9): 2278-2292. DOI:10.1105/tpc.104.024190 |
Sehr E M, Agusti J, Lehner R, et al. 2010. Analysis of secondary growth in the Arabidopsis shoot reveals a positive role of jasmonate signalling in cambium formation[J]. The Plant Journal, 63(5): 811-822. DOI:10.1111/tpj.2010.63.issue-5 |
Shamblott M J, Axelman J, Wang S, et al. 1998. Derivation of pluripotent stem cells from cultured human primordial germ cells[J]. PNAS, 95(23): 13726-13731. DOI:10.1073/pnas.95.23.13726 |
Stahl Y, Simon R. 2005. Plant stem cell niches[J]. Int J Dev Biol, 49(5/6): 479-489. |
Stahl Y, Wink R H, Ingram G C, et al. 2009. A signaling module controlling the stem cell niche in Arabidopsis root meristems[J]. Curr Biol, 19(11): 909-914. DOI:10.1016/j.cub.2009.03.060 |
Stahl Y, Simon R. 2010. Plant primary meristems: shared functions and regulatory mechanisms[J]. Curr Opin Plant Biol, 13(1): 53-58. DOI:10.1016/j.pbi.2009.09.008 |
Stewart R N, Dermen H. 1970. Determination of number and mitotic activity of shoot apical initial cells by analysis of mericlinal chimeras[J]. Am J Bo, 57(7): 816-826. DOI:10.2307/2441339 |
Thomson J A, Itskovitz-Eldor J, Shapiro S S, et al. 1998. Embryonic stem cell lines derived from human blastocysts[J]. Science, 282(5391): 1145-1147. DOI:10.1126/science.282.5391.1145 |
Townsend L. 2008. A re-energized debate on stem cells[J]. MLO Med Lab Obs, 40(12): 36. |
Trotochauda A E, Hao T, Wu G, et al. 1999. The CLAVATA1 receptor-like kinase requires CLAVATA3 for its assembly into a signaling complex that includes KAPP and a Rho-related protein[J]. The Plant Cell, 11(3): 393-406. DOI:10.1105/tpc.11.3.393 |
Veit B. 2006. Stem cell signalling networks in plants[J]. Plant Mol Biol, 60(6): 793-810. DOI:10.1007/s11103-006-0033-8 |
Verdeil J L, Alemanno L, Niemenak N, et al. 2007. Pluripotent versus totipotent plant stem cells: dependence versus autonomy?[J]. Trends Plant Sci, 12(6): 245-252. DOI:10.1016/j.tplants.2007.04.002 |
Wang Z Z, Xie Y L, Zhang H W, et al. 2010. Expression pattern of cell cycle genes suggests the developmental arrangement of vascular cells in sugarcane strand[J]. Plant Growth Regul, 61(1): 85-95. DOI:10.1007/s10725-010-9453-1 |
Xie M, Tataw M, Venugopala Reddy G. 2009. Towards a functional understanding of cell growth dynamics in shoot meristem stem-cell niche[J]. Semin Cell Dev Biol, 20(9): 1126-1133. DOI:10.1016/j.semcdb.2009.09.014 |
Ye Z H. 2002. Vascular tissue differentiation and pattern formation in plants[J]. Annu Rev Plant Biol, 53: 183-202. DOI:10.1146/annurev.arplant.53.100301.135245 |
 2011, Vol. 47
2011, Vol. 47

