文章信息
- 汪志辉, 熊碧玲, 刘燕, 赵瑾, 范娜娜, 蒋黎黎
- Wang Zhihui, Xiong Biling, Liu Yan, Zhao Jin, Fan Nana, Jiang Lili
- 树形对鲜黄梨果实糖积累及山梨醇转化相关酶活性的影响
- Effects of Tree Shape on the Sugar Accumulation and Activity of Sorbitol-Invertase of Pyrus pyrifolia 'Sunhwang'
- 林业科学, 2011, 47(4): 27-32.
- Scientia Silvae Sinicae, 2011, 47(4): 27-32.
-
文章历史
- 收稿日期:2010-07-13
- 修回日期:2010-10-28
-
作者相关文章
糖是影响果实品质的主导因素, 不仅决定果实风味的好坏, 而且是类胡萝卜素、维生素、色素和芳香物质等合成的基础原料(Smeekens, 2000)。探讨梨(Pyrus spp.)果实中糖积累及其组分变化的机制对改善梨品质具有重要意义。山梨醇是蔷薇科(Rosaceae)木本果树的主要光合产物(白宝璋等, 1995), 经过韧皮部运输到果实中转化成其他糖类物质, 其含量的变化直接影响果实中糖积累过程。关于山梨醇代谢相关酶活性在糖的运输、代谢和积累中所起的重要作用, 在一些果树上已有报道, 如桃(Amygdlus persica)(杨爱珍等, 2009)、苹果(Malus pumila)(徐迎春等, 2001)、甜樱桃(Cerasus pseudocerasus)(王婷等, 2008)等。梨果实发育过程中糖组分及其含量变化的研究报道也较多(吕金海等, 2004; 胡红菊等, 2007; 李春英等, 1999)。但关于树形对梨果实中糖积累及其组分变化影响的研究却少见报道。梨树生产中, 采用的V字形(李仁芳等, 2004)、棚架形(崔惠英等, 2007)等树形, 树体结构, 树冠内光照分布及光合能力不同, 导致田间产量和果实品质的差异。笔者以鲜黄梨果实为试材, 研究不同树形对其果实糖积累及山梨醇转化为糖变化的影响, 探讨树形对果实品质的影响机制, 筛选出四川盆地少日照地区梨优质高产的最佳树形, 同时为提高梨果实品质提供理论依据。
1 材料与方法 1.1 讨论材料试验在四川绵竹市遵道镇梨园进行。园地为丘陵地带, 年平均气温15.7 ℃, 最冷月(1月)平均气温4.0~10.0 ℃, 最热月(7月)平均气温25 ℃; 年平均降水量1 053.2 mm, 年日照时数平均为1 011.3 h, 年平均无霜期为285天。
供试材料为鲜黄梨(Pyrus pyrifolia‘Sunhwang’)果实, 6年生树。3种树形分别为V字形(树体与水平地面的夹角为60°~75°, 树高2.0~2.5 m)、平棚形(棚架高2.0~2.5 m, 主枝分枝点高1.0~1.2 m), 疏散分层形(树高2.5~3.0 m, 干高0.5 m), 株行距为2.5 m×5 m。每种树形选30株, 双行视为一小区, 每行5株, 每个小区10株, 一个小区为一次重复, 3次重复。3种树形均南北行向, 栽培在同一果园, 管理方法一致。
1.2 冠层分析和光合测定冠层图片拍摄和光合测定于2009年7月进行。冠层图片拍摄在梨树冠冠层稳定后, 利用冠层分析仪(WinsCanopy2005a)对树冠进行拍摄, 每株树从距离干基部20 cm的东、南、西、北4个位点进行观测, 拍摄高度0.5 m, 每个方位拍摄3次, 采集图像。图像采用WinSCANOPY2005a专业分析软件, 分析冠层开度, 树冠下直射、散射和总光合光量子通量密度等冠层特征参数。
光合测定采用Li-6400便携式光合测定仪。
1.3 糖含量和相关酶活性的测定采样方法:花谢后一周(2009年4月20日)至果实成熟(2009年7月20日)进行采样, 每15天取样1次。V字形栽培的每一个小区视为一个个体, 从小区东西2个架面的上、中、下(沿树体结果区域垂直方向平均分层)3个层面上随机采果; 平棚形选择2大主枝, 每个主枝水平方向距中心干基部(距中心干小于1.0 m)、中部(距中心干1.0~2.0 m)和外围(距中心干大于2.0 m)3部分采样; 疏散分层形采用水平和垂直2个方向取样, 水平方向选2个伸向行间方向的主枝, 参照平棚形取样。垂直方向沿中心干的结果枝组上取样, 分为下(距地面0.5~1.0 m)、中(距地面1.0~2.0 m)和上(距地面2.0 m以上), 各部位随机采果7个。样品置于-70 ℃低温保存。
糖测定方法:每个样随机取5~6个梨果实, 切取不同部位果肉, 混匀后称取2 g样品, 3次重复。用10 mL双蒸水研磨, 80 ℃水浴15 min, 冷却后在10 000 r·min-1离心15 min, 残渣加入8 mL双蒸水再提取, 合并上清液, 定容至25 mL, 用一次性注射器抽取提取样液, 用0.45 μm滤膜过滤。取20 μL滤液用高效液相色谱法(HPLC)测定葡萄糖、果糖、蔗糖、山梨醇。色谱柱采用Rezex RCM-Monosaccharede Ca2+(8%), 规格为150 mm×7.8 mm。工作条件:柱温85 ℃, 流动相为脱气后的重蒸水, LC-6A示差检测器, 泵为LC-6A, 流速为0.6 mL·min-1。可溶性总糖的测定采用蒽酮比色法(熊庆娥, 2003)。可溶性淀粉含量测定采用高氯酸法(Wang et al., 1993), 将提取可溶性糖后剩余的残渣用高氯酸水解后采用蒽酮比色法测定。
酶测定方法:山梨醇转化为糖相关酶的提取参照王惠聪等(2003)的方法, 每个样本取1 g果肉, 加入5 mL预冷的提取缓冲液[0.1 mol·L-1磷酸缓冲液(pH7.5), 0.475 g·L-1 MgCl2, 0.292 g·L-1 EDTA, 0.1%巯基乙醇, 0.1%Trition-100]冰浴下匀浆后, 在10 000 r·min-1离心15 min, 上清液转入10 mL刻度试管中, 沉淀用4 mL提取液再提取1次, 合并上清液定容至10 mL, 作为酶提取液, 3次重复。参考Yamaguchi等(1994)的方法测定山梨醇脱氢酶活性。参照Yamaki(1980)的方法测定山梨醇氧化酶活性。
采用SAS软件进行统计分析; 采用Excel软件进行示图制作。
2 结果与分析 2.1 冠层特征指标对鲜黄梨3种树形主要冠层结构特征进行比较可知:在3种树形中, 平棚形冠层开度最大, 其次为V字形, 疏散分层形冠层开度最小, 且之间差异达到极显著水平。同时, 平棚形树冠下直射光合光量子通量密度和散射光合光量子通量密度最大, 其总光合光量子通量密度也最大, 与V字形和疏散分层形差异极显著(表 1), 这说明平棚形冠层透光情况较V字形和疏散分层形好。
|
|
由表 2可以看出:3种不同树形树冠内不同层次、不同方位光合有效辐射有明显的规律性, 总体趋势为从内膛到外围, 从垂直下部到上部, 逐渐增大。叶片净光合速率并随着光合有效辐射的增大而增大。平棚形树冠内不同方位光合有效辐射的平均值为813.47 μmol·m-2s-1, 显著高于V字形的702.17 μmol·m-2s-1和疏散分层形的691.82 μmol·m-2s-1。且平棚形的叶片净光合速率总体也高于V字形和疏散分层形。可见, 平棚形树体的光合能力较V字形和疏散分层形强。
|
|
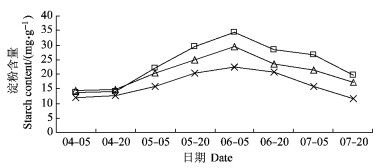
对不同发育时期的果实中可溶性总糖和淀粉测定结果表明:可溶性总糖含量在果实发育过程一直处于上升趋势, 变化较大, 果实发育初期平均值仅为7.08%, 采收时已达56.46%。果实发育中后期, V字形和平棚形的可溶性总糖增加量较疏散分层形(对照)大, 采收时平棚形和V字形已达65.79%, 57.50%, 显著高于疏散分层形(46.08%)。淀粉含量呈“低—高—低”的变化趋势, 前期淀粉含量逐渐增加, 并在6月5日达到最大值, 此时平棚形为34.36 mg·g-1, V字形为29.45 mg·g-1, 都显著高于疏散分层形的22.42 mg·g-1。6月5日后, 淀粉含量急剧下降, 采收时含量较低。上述可知:相对于疏散分层形来说, 平棚形和V字形均提高果实中可溶性糖含量和淀粉含量(图 1, 2)。

|
图 1 果实发育过程中可溶性总糖含量的变化 Figure 1 The changes of total sugar content during fruit development |
|
图 2 果实发育过程中淀粉含量的变化 Figure 2 The changes of starch content during fruit development |
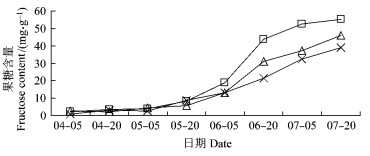
果实中葡萄糖、果糖、蔗糖含量变化分别见图 3~5。果实中葡萄糖含量呈持续上升的趋势, 采收时达到最大值。相对于果糖变化量来说, 其果实发育初期与后期之间含量差异较小, 在果实发育前期, 其含量不稳定, 呈波动性变化, 5月5日后其含量逐渐增加, 采收时平棚形的葡萄糖含量最大(14.39 mg·g-1), 其次为V字形(13.05 mg·g-1), 疏散分层形(11.58 mg·g-1)最低, 但之间差异不显著(P>0.05)。

|
图 3 果实发育过程中葡萄糖含量的变化 Figure 3 The changes of glucose content during fruit development |
|
图 4 果实发育过程中果糖含量的变化 Figure 4 The changes of fructose content during fruit development |
|
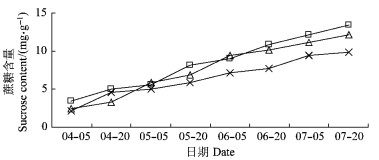
图 5 果实发育过程中蔗糖含量的变化 Figure 5 The changes of sucrose content during fruit development |
果糖含量呈S型增长曲线。从4月5日至5月5日, 果糖含量变化较小, 5月20日后, 其含量急剧增加, 采收时平棚形的果糖含量达到55.31 mg·g-1, 显著高于V字形和疏散分层形; V字形则为45.95 mg·g-1, 高于疏散分层形, 并达到显著水平(P<0.05)。
果实在整个发育过程中蔗糖含量总体呈直线上升, 且在采收时达到最大值, 但就单位含量来说, 小于果糖。在4月5日时, 3种树形的蔗糖含量平均值仅为2.69 mg·g-1, 7月20日时其平均值达到11.84 mg·g-1, 其含量提高4倍多。在采收时, 平棚形果实中蔗糖含量最大, V字形第二, 疏散分层形最低。
鲜黄梨果实在发育过程中葡萄糖、果糖、蔗糖含量随着果实的生长而逐渐增加, 但增长的趋势和增长量有所不同, 其中果糖增长量最大, 其次是蔗糖, 再次为葡萄糖。平棚形和V字形相对于疏散分层形均提高了果实中葡萄糖、果糖、蔗糖含量。
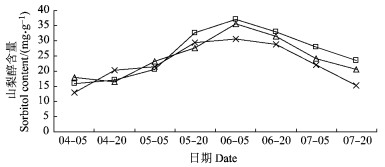
2.5 不同树形对鲜黄梨果实中山梨醇含量变化的影响对果实中山梨醇含量测定结果表明:山梨醇含量呈“低-高-低”的趋势变化。果实发育早中期, 山梨醇含量逐渐增加, 在6月5日达到最大值, V字形和平棚形最大值分别为35.62, 37.20 mg·g-1, 均显著高于疏散分层形; 随着果实的发育, 山梨醇含量逐渐下降, 采收时平棚形的山梨醇含量为23.45 mg·g-1, 显著高于其他2种树形; 疏散分层形仅为15.17 mg·g-1, 显著低于V字形的20.52 mg·g-1。不同树形的山梨醇含量在果实整个发育过程中变化趋势一致, 但在果实的同一发育时期其含量有差异, 其中平棚形含量最高, V字形其次, 疏散分层形最低(图 6)。
|
图 6 果实发育过程中山梨醇含量的变化 Figure 6 The changes of sorbitol content during fruit development |
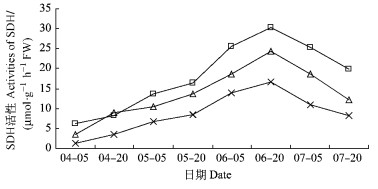
在果实中, 催化山梨醇转化成单糖的酶主要是山梨醇脱氢酶(SDH), 此酶催化山梨醇转化成果糖。本试验通过测定SDH活性可知:果实生长发育过程中, 山梨醇脱氢酶活性呈先增加后减小的变化趋势。果实发育初期, SDH活性较低, 随果实的生长逐渐增加, 并在6月20日达到最大值, 这可能是果糖在后期急剧增长的原因之一。此时, 平棚形的SDH活性最高, 达到30.29 μmol·g-1·h-1FW, 显著高于其他2种树形; V字形为24.27 μmol·g-1h-1FW, 显著高于疏散分层形的16.74 μmol·g-1h-1FW。6月20日后, 果实中SDH活性逐渐降低, 但仍保持较高水平, 较初期高, 但比中期低。总之, 在果实由小到大的发育过程中, 山梨醇脱氢酶活性整体变化趋势为“弱-强-弱”, 相对于疏散分层来说, 平棚形和V字形都增强了SDH活性, 且平棚形最为显著(图 7)。
|
图 7 果实发育过程中山梨醇脱氢酶活性变化 Figure 7 The changes of activities of SDH during fruit development |
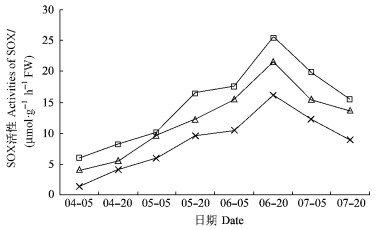
山梨醇氧化酶(SOX)在果实中主要催化山梨醇转化成葡萄糖。通过测定果实中SOX活性结果表明(图 8), 随着果实的生长发育, 山梨醇氧化酶的活性呈先增加后减小的变化趋势, 但总体比SDH低。从果实发育早期至6月20日, SOX活性逐渐增大, 且在6月20日达到最大值。此时, 平棚形为25.73 μmol·g-1h-1FW, 显著高于其他2种树形, V字形为21.57 μmol·g-1h-1FW, 显著高于疏散分层形(16.26 μmol·g-1h-1FW)。随着果实的进一步发育, SOX活性逐渐降低, 但在采收时平棚形仍是最高, V字形第二, 疏散分层形最低。果实发育后期SOX活性较前期高, 平棚形和V字形均提高果实中山梨醇氧化酶活性, 其中平棚形最为明显, V字形次之。
|
图 8 果实发育过程中山梨醇氧化酶活性变化 Figure 8 The changes of activities of SOX during fruit development |
果实品质在很大程度上取决于糖的种类和含量(Teixeira et al., 2005)。光在果树树冠内的合理分布, 能有效提高果树产量和果实品质(Ruban et al., 1994), 而不同的树形结构, 树冠内光分布有很大差异(魏钦平等, 1997), 树体对光的利用率不同, 光合产物含量不同, 果品质量则会出现较大差异。本试验结果表明:果实发育前中期葡萄糖、果糖、蔗糖含量较低, 淀粉和山梨醇含量较其他糖分高, 果实中以积累淀粉和山梨醇为主。果实发育后期, 果糖迅速增加, 高于其他糖分, 此时以积累果糖为主。果实成熟期3种树形间各糖分含量差异明显, 且树形对具体糖分的积累影响不尽相同, 对果糖影响较大, 对葡萄糖影响较小。采收时, 平棚形和V字形果实中各种糖分含量相对于疏散分层形来说有明显提高, 平棚形增加量最大, V字形次之。这是因为平棚形树冠内的光合有效辐射、叶片净光合速率较V字形和疏散分层形大, 光合能力强, 因此运输到果实中的蔗糖和山梨醇多, 从而积累的各种糖分多。V字形主枝有倾斜度, 各叶片之间重叠面积小, 但树冠上部叶片对下部叶片仍有遮挡, 其光合有效辐射和叶片净光合速率较平棚形低, 因而糖积累比平棚形少。平棚形和V字形没有明显中心干, 抑制树体的顶端优势, 减少树体枝干生长的营养消耗, 让营养能够更多地运向果实。疏散分层形有明显主干, 且枝条之间相互交叉程度较大, 其总光合光量子通量密度、光合有效辐射、叶片净光合速率较低, 因此含糖量较前2种树形低。
蔷薇科果树中, 同化物的主要运输形式是山梨醇, 其与改善果实品质有重要关系(周睿等, 1993)。山梨醇脱氢酶(SDH)和山梨醇氧化酶(SOX)是蔷薇科果实内转化的关键酶, 它们将山梨醇转化成果糖和葡萄糖, 是蔷薇科果树的果实形成优良品质不可缺少的酶类(张永平等, 2008)。研究山梨醇积累和代谢的相关因子是改善果实品质的一个有效途径(Teo et al., 2006)。本试验中, 果实发育早中期, SDH和SOX活性不断增强, 但果糖和葡萄糖含量未见有明显增加, 且山梨醇仍在积累, 这是因为幼果的细胞分裂活跃、新陈代谢旺盛, 山梨醇转化的果糖和葡萄糖大部分用于细胞呼吸作用、形态建成等, 因此积累较少。而叶片中合成的山梨醇运输到果实中的量大于其在果实中分解量, 因此山梨醇不断积累。果实发育后期, SDH和SOX活力有所下降, 但仍保持较高水平, 且后期淀粉水解, 果实中的糖除用于生理消耗, 更多的进入细胞液泡中贮藏, 致使果糖和葡萄糖在后期急剧增加。3种树形中, 平棚形的SDH和SOX活性最高, V字形第二, 疏散分层形最低。这是也导致平棚形和V字形含糖量较疏散分层形高的原因之一, SDH和SOX活力越高, 转化成的果糖和葡萄糖越多, 从而积累的糖分就越多。四川地区湿度大, 日照较少, 而平棚形和V字形的树体平面化, 叶幕层厚度小, 二者的冠层开度较大, 增加了冠内空气流通。由上述可知:二者树冠下的直射光合光量子通量密度和散射光合光量子通量密度较疏散分层形大, 透光性较疏散分层好, 改善了树冠内光照、温度、湿度等条件, 形成更利于糖代谢的冠内环境, 致使代谢相关酶活性较疏散分层形高。
综合比较3种不同树形的冠层结构特征、光合能力和果实中糖积累情况可知:相对于V字形和疏散分层形来说, 平棚形的树体结构增强叶片光合能力, 改善了糖代谢环境, 从而增加了糖分积累, 提高果实品质。因此, 笔者认为平棚形为四川盆地梨优质高产的最佳树形, 适宜在四川地区大面积推广栽植。
果实的糖代谢是一个复杂的生理生化过程, 树形通过影响树冠的透光性、叶片的光合利用等, 从而影响果实中糖分积累及糖代谢相关酶活性的变化, 而树冠内气体、温度、湿度等如何影响此生理过程, 以及各因子对相关酶的综合影响有待于进一步的研究。
白宝璋, 孙存华, 田文勋, 等. 1995. 蔷薇科果树中山梨醉的研究概况[J]. 吉林农业大学学报, 17(增刊): 57-62. |
崔惠英, 李炬. 2007. 梨树主要树形及结构特点[J]. 河北林业, (2): 37. |
李春英, 薛桂新, 李永勋. 1999. 客发梨果实生长期间山梨糖醇及其它糖变化规律的研究[J]. 北方果树, (6): 6-7, 26. |
李仁芳, 刘文兰, 张艳春, 等. 2004. 日韩梨的架式与树形初探[J]. 烟台果树, (3): 23-24. |
吕金海, 伍贤进, 周书伟, 等. 2004. 金秋梨果实发育中生长速率及主要营养成分的变化[J]. 中国农学通报, 20(5): 35-36. |
胡红菊, 陈启亮, 王友平, 等. 2007. 4个砂梨品种果实发育过程中主要糖酸含量的变化[J]. 华中农业大学学报, 26(2): 251-255. |
王惠聪, 黄辉白, 黄旭明, 等. 2003. 荔枝果实的糖积累与相关酶活性[J]. 园艺学报, 30(1): 1-5. |
王婷, 王永章, 刘更森, 等. 2008. 红灯甜樱桃果实发育过程中糖代谢规律及相关酶活性变化[J]. 落叶果树, (4): 15-17. |
魏钦平, 王丽琴, 杨德勋, 等. 1997. 相对光照强度对富士苹果品质的影响[J]. 中国农业气象, 18(5): 12-14. |
熊庆娥. 2003. 植物生理学实验教程[M]. 成都: 四川科学技术出版社.
|
徐迎春, 李绍华, 柴成林, 等. 2001. 水分胁迫期间及胁迫解除后苹果树源叶碳同化物代谢规律的研究[J]. 果树学报, 18(1): 1-6. |
杨爱珍, 张志毅, 孟海玲, 等. 2009. 桃果实发育过程中山梨醇及酶活性变化[J]. 林业科学, 45(5): 143-147. DOI:10.11707/j.1001-7488.20090522 |
张永平, 乔永旭, 喻景权, 等. 2008. 园艺植物果实糖积累的研究进展[J]. 中国农业科学, 41(4): 1151-1157. |
周睿, 束怀瑞. 1993. 高等植物中的山梨醇及其代谢[J]. 植物生理学通讯, 29(5): 384-390. |
Ruban A V, Young A J, Pascal A A, et al. 1994. The effects of illumination on the xanthophyll composition of the photosystem Ⅱ light-harvesting complexes of spinach thylakoid membranes[J]. Plant Physiol, 104(1): 227-234. DOI:10.1104/pp.104.1.227 |
Smeekens S. 2000. Sugar-induced signal transduction in plants[J]. Annu Rev Plant Physiol Plant Mol Biol, 51: 49-81. DOI:10.1146/annurev.arplant.51.1.49 |
Teo G, Suzuki Y, Uratsu S L, et al. 2006. Silencing leaf sorbitol synthesis alters long-distance partitioning and apple fruit quality[J]. Plant Physiology, 103(49): 18842-18847. |
Teixeira R T, Knorpp C, Glimelius K. 2005. Modified sucrose, starch, and ATP levels in two alloplasmic male—sterile lines of B.napus[J]. Journalof Experimental Botany, 56(414): 1245-1253. DOI:10.1093/jxb/eri120 |
Wang F, Sanz A, Brenner M L, et al. 1993. Sucrose synthasestarch accumulation and tomato fruit sink strength[J]. Plant Physiol, 101(1): 321-327. DOI:10.1104/pp.101.1.321 |
Yamaguchi H, Kanayama Y, Yamaki S. 1994. Purification and properties of NAD-dependent sorbitol dehydrogenase from apple fruit[J]. Plant Cell Physiol, 35(6): 887-892. |
Yamaki S. 1980. A sorbitol oxidase that converting sorbitol to glucose in apple leaf[J]. Plant Cell Physiol, 21(4): 591-599. DOI:10.1093/oxfordjournals.pcp.a076034 |
 2011, Vol. 47
2011, Vol. 47


