文章信息
- 冯发堂, 荣丽, 李贤伟, 赖元长, 周义贵, 范川
- Feng Fatang, Rong Li, Li Xianwei, Lai Yuanchang, Zhou Yigui, Fan Chuan
- 实验室不同温度下添加细根(草根)对土壤活性有机碳的影响
- Effect of Fine Root (Grass Root) Added to Soil on Soil Active Qrganic Carbon Under Different Temperature Condition in the Laboratory Microcosm
- 林业科学, 2011, 47(4): 1-6.
- Scientia Silvae Sinicae, 2011, 47(4): 1-6.
-
文章历史
- 收稿日期:2010-03-12
- 修回日期:2011-03-04
-
作者相关文章
2. 长江上游林业生态工程四川省重点实验室 雅安 625014;
3. 云南大学亚洲国际河流中心 昆明 650091;
4. 中国水电顾问集团西北勘测设计研究院 西安 710065
2. Key Laboratory of Forestry Ecological Engineering in Upper Reaches of Yangtze River, Sichuan Province Ya'an 625014;
3. Asia International Rivers Center, Yunnan University Kunming 650091;
4. Hydrochina Xibei Engineering Corporation Xi'an 710065
细根占林木总生物量比例虽然只有5%左右, 但每年通过细根枯死、细根分泌物及根共生菌周转而向土壤归还大量的根源有机碳, 成为森林生态系统中一个重要的、潜在的碳汇(陈光水等, 2005)。随着森林生物地球化学循环过程研究的不断深入, 细根在土壤生态系统中的作用与功能逐渐受到重视。土壤活性有机碳是土壤有机质中具有较高有效性的那部分物质, 来源于植物凋落物和土壤有机质的分解、根系分泌物和土壤微生物本身及其代谢产物。近年来土壤活性有机碳已成为土壤、环境和生态科学领域关注的焦点。虽然土壤活性有机碳只占土壤有机碳总量的较小部分, 但由于它可以在土壤全碳变化之前反映土壤碳含量微小的变化, 是土壤微生物活动能源和土壤养分转化的驱动因子, 直接参与土壤微生物化学转化过程, 因而它对土壤碳平衡和土壤肥力保持具有重要意义。
华西雨屏区是我国降雨最丰富的区域之一, 在整个长江上游生态屏障建设中占有重要地位。2000年以来, 该区构建了多种退耕模式, 以林草复合模式最为广泛。近年来, 许多学者对该区不同退耕模式开展了细根(草根)的分解及养分动态特征、水稳性团聚体变化与细根生物量的关系及土壤微生物特性研究(范冰等, 2005; 董慧霞等, 2007; 荣丽等, 2009a; 2009b), 为探索该区植被恢复地下生态过程奠定了基础。土壤活性有机碳可用土壤微生物量碳、可溶性有机碳和易氧化有机碳来表征。本研究在3个不同温度梯度下, 分析该区4种退耕模式的土壤活性有机碳, 以进一步揭示人工林地力自我培肥能力及其调控机制, 对调控森林碳汇能力也具有重要意义。
1 材料与方法供试材料取自于四川农业大学退耕还林工程定位研究站洪雅县柳江镇苦竹岗(103°38′E, 29°95′N), 该区海拔600~700 m, 属中亚热带湿润山地季风气候, 最高气温36.8 ℃, 最低气温-3.3 ℃, 年平均气温14~16 ℃, 年日照时数1 080 h。地貌以低山丘陵为主, 土壤类型为酸性紫色土, 土层平均厚50 cm, pH值4.9~5.6。采样地为坡改梯形成的水平台状旱地, 退耕前以种植玉米(Zea mays)、红薯(Lpomoea batatas)和蔬菜为主。2000年1月退耕后, 2月完成光皮桦(Betula luminifera)、柳杉(Crytomeria fortunei)造林工作, 株行距分别为3 m×2 m和3 m×3 m。2004年9月上旬在光皮桦林地上采用压茎插条法建植多年生扁穗牛鞭草(Hemarthria compressa), 同时, 在相邻地带选取空地采用人工播种的方法种植扁穗牛鞭草, 株行距均为为5 cm×30 cm。
2007年8月初, 收集研究区光皮桦-扁穗牛鞭草复合模式、人工播种扁穗牛鞭草草地、光皮桦人工林和柳杉人工林4种退耕模式0~15 cm土层新鲜细根(直径<2 mm)和扁穗牛鞭草草根。将采集到的细根冲洗, 分为0~1和1~2 mm径级风干, 然后将这2个径级的部分细根按质量比1:1混合成径级为0~2 mm的细根样(王巧等, 2007); 草根不分级, 剪成2 cm左右的小段。取根样同时, 在光皮桦-扁穗牛鞭草模式样地内按S形法多点采取0~15 cm土层土样混合放入布袋, 带回实验室, 过2 mm筛备用。设置以下4个处理:处理1:光皮桦细根4.5 g+扁穗牛鞭草草根13 g+土壤200 g; 处理2:光皮桦细根4.5 g+土壤200 g; 处理3:扁穗牛鞭草13 g+土壤200 g; 处理4:柳杉细根4.5 g+土壤200 g。设无细根(草根)添加的土壤200 g作为对照。将各处理称量好的样品分别装100 mL烧杯中, 每种处理(含对照)装36个烧杯, 共180个烧杯。首先将土壤平铺于烧杯中, 然后将各处理细根样品放置于土壤表面。分别在10, 20和30 ℃人工气候箱中培养, 每个温度下每个处理(含对照)放12个烧杯, 每周用灭菌水补充失去的水分, 使烧杯内土壤水分保持试验地田间持水量的60%~80%。分别在培养30, 60, 90和120天后取样, 每次每个温度下各处理(含对照)均取3次重复, 每次共取出45个烧杯。迅速捡出每个烧杯土壤表面的细根(草根), 烧杯内土壤用于测定土壤活性有机碳。
采用氯仿熏蒸-K2SO4提取法测定土壤微生物量碳含量(Vance et al., 1987; 吕国红等, 2006); 采用水土比色法测定土壤水溶性有机碳含量(姜培坤, 2005); 采用KMnO4氧化法测定土壤易氧化碳含量(沈宏等, 2000); 采用K2Cr2O7氧化外加热法测定土壤总有机碳含量(中国林业科学研究院林业研究所森林土壤研究室, 1999)。
数据分析采用Office Excel 2003和DPS 6.55统计软件。
2 结果与分析 2.1 添加细根(草根)对土壤微生物量碳含量的影响由图 1可以看出, 不同温度和不同处理时间下各处理土壤微生物量碳含量均显著高于对照(P<0.05), 添加光皮桦细根和扁穗牛鞭草草根混合根处理1土壤微生物量碳含量显著高于其他处理(P<0.05)。除单独添加柳杉细根的处理4外, 3个温度下土壤微生物量碳含量都表现为在处理120天时最高。但在10 ℃时, 培养60和90天时, 添加光皮桦细根和扁穗牛鞭草草根的处理1与单独添加扁穗牛鞭草草根的处理3土壤微生物量碳含量无显著差异(P=0.464 4, 0.052 9)。在20和30 ℃条件下, 光皮桦细根与扁穗牛鞭草草根混合处理、光皮桦细根处理、扁穗牛鞭草草根处理的土壤微生物量碳含量随培养时间的延长呈增加趋势, 培养天数对土壤微生物量碳含量的影响表现为:120天>90天>60天>30天(P<0.05), 而在10 ℃条件下这个规律不明显。4种处理的土壤微生物量碳含量都随温度的升高而增加, 培养温度对土壤微生物量碳含量的影响表现为30 ℃>20 ℃>10 ℃(P<0.05)。120天后, 各温度条件下添加混合细根处理1的土壤微生物量碳含量显著大于其他处理(P<0.05)。
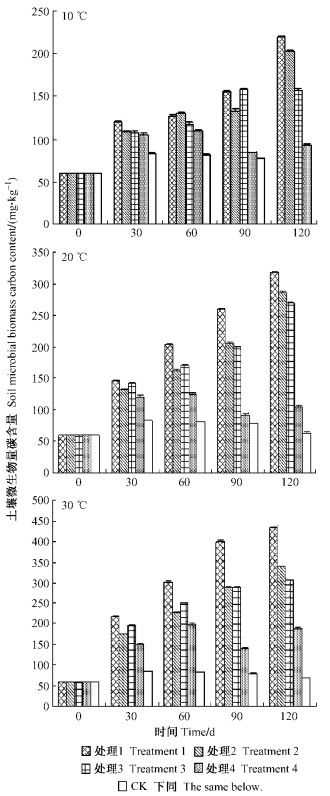
|
图 1 不同天数及温度下土壤微生物量碳含量 Figure 1 Soil microbial biomass carbon content under different days and temperatures |
由图 2可知:不同温度和不同处理时间下各处理土壤水溶性有机碳含量均显著高于对照(P<0.05), 处理1土壤水溶性有机碳含量显著高于其他处理(P<0.05), 其次是添加扁穗牛鞭草草根的处理(处理3);除单独添加柳杉细根处理4外, 3个温度下土壤水溶性有机碳含量都表现为随时间的增加而增加(P<0.05);各个温度条件下, 添加柳杉细根的处理4在60天时, 土壤水溶性有机碳含量显著大于其他培养天数, 这可能与柳杉细根含水溶性物质较少, 含较难分解的纤维素、木质素较多有关(荣丽等, 2011)。各处理土壤水溶性有机碳含量也随培养温度的升高逐渐增加, 温度对其影响表现为30 ℃>20 ℃>10 ℃(P<0.05)。120天后, 在各培养温度下添加光皮桦细根和扁穗牛鞭草草根的处理1的土壤水溶性有机碳含量均显著大于其他处理(P<0.05)。
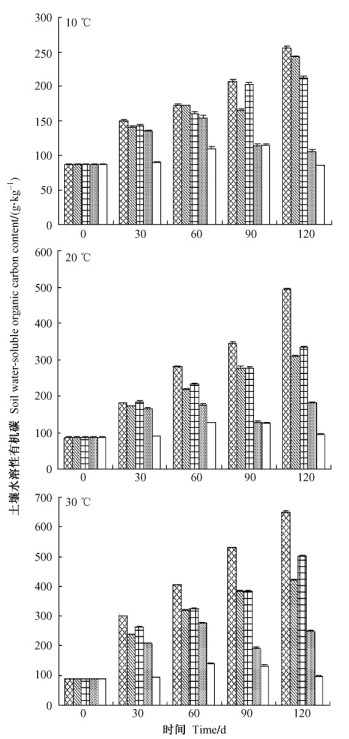
|
图 2 不同天数及温度下土壤水溶性碳含量 Figure 2 Soil water-soluble organic carbon content under different days and temperatures |
由图 3可得, 除培养的第30天外, 各温度条件下各处理的土壤易氧化有机碳含量显著大于对照(P<0.01)。添加光皮桦细根和扁穗牛鞭草草根混合根的处理1, 其土壤易氧化有机碳含量都显著大于其他处理(P<0.05), 但在30 ℃条件下的第60天添加单一扁穗牛鞭草草根处理3的土壤易氧化有机碳含量最大。随着培养时间延续, 各温度条件下各处理的土壤易氧化有机碳含量也显著增加(P<0.05);培养天数对土壤易氧化有机碳含量的影响表现为120天>90天>60天>30天。在120天的培养时间内, 10 ℃下的各处理土壤易氧化有机碳含量显著大于20和30 ℃。
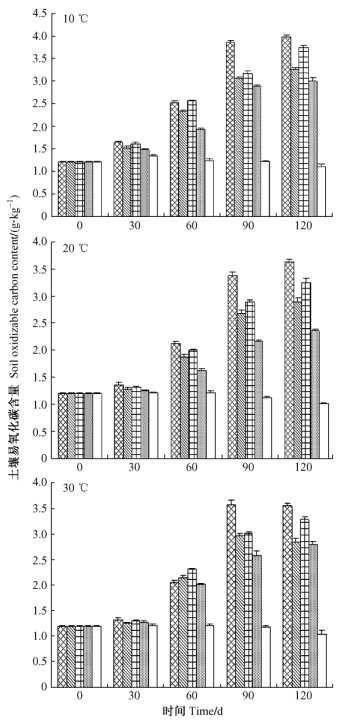
|
图 3 不同天数及温度下土壤易氧化碳含量 Figure 3 Soil oxidizable carbon content under different days and temperatures |
由图 4可知, 添加细根处理的总有机碳含量都显著大于对照, 20 ℃的第30天和各温度条件下60天添加光皮桦细根和扁穗牛鞭草草根的处理1显著大于其他处理(P<0.05), 而在10和30 ℃培养条件下的第30天时各处理总有机碳含量之间没有显著差异。各处理下总有机碳含量随时间的增加而增加, 120天时达最大值。温度对各处理以及对照土壤总有机碳的影响强度表现为10 ℃>20 ℃>30 ℃, 但与30 ℃条件下土壤总有机碳含量差异不显著, 说明温度升高会影响土壤总有机碳的含量。
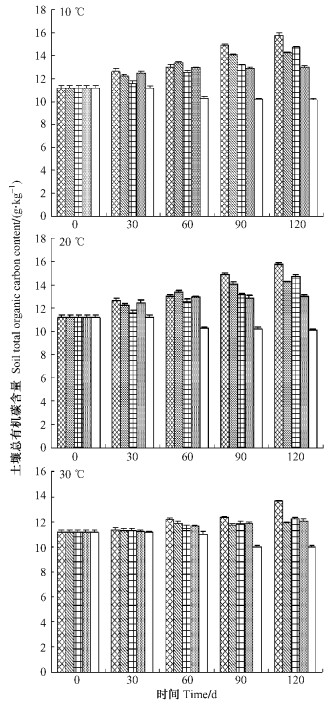
|
图 4 不同天数及温度下土壤总有机碳含量 Figure 4 Soil total organic carbon content under different days and temperatures |
添加细根的各处理其土壤微生物量碳、土壤水溶性碳、土壤易氧化碳含量都显著大于对照土壤(P<0.05), 宋日等(2002)的研究也表明玉米根茬留田可显著提高土壤微生物碳含量。可见, 外源有机物的添加可以显著提高土壤活性有机碳含量。添加光皮桦细根与扁穗牛鞭草草根混合根的处理1在培养期间以及各培养温度下其土壤微生物量碳、水溶性碳、易氧化碳含量基本上显著大于其他处理, 这可能是因为扁穗牛鞭草草根含有较多的可溶性物质, 与光皮桦细根混合后2者之间可能产生积极作用, 促进细根的分解, 供给土壤微生物充足的能源和营养物质, 使土壤微生物旺盛繁殖。Robinson等(1999)对几种高寒地区植物根系混合分解研究也表明根系混合对分解有促进作用。
温度直接影响微生物的活性, 进而对细根分解产生影响, 但根系分解的温度敏感性随根系类型以及分解程度的不同而异(朱志建等, 2006)。培养温度对各处理土壤微生物量碳、土壤水溶性有机碳含量的影响表现为30 ℃>20 ℃>10 ℃, 随着培养温度的升高各处理中添加的细根释放的简单有机化合物增多, 土壤微生物数量增加, 因此土壤微生量碳与土壤水溶性碳随着培养天数的增加而增加。但刘艳等(2007)对火力楠(Michelia macclurel)、杉木(Cunninghamia lanceolata)的研究表明, 中等温度培养下的细根分解对应着较高的土壤微生物量碳和水溶性有机碳含量, 这可能与细根类型和土壤微生物群落组成有关(荣丽等, 2009b)。林滨等(1997)研究了土壤和沉积物中土壤水溶性碳释放的动力学过程, 结果表明, 草甸沼泽土中水溶性有机物在20 ℃时释放最快, 温度降低与升高均导致释放速率下降。但本研究表明, 当培养温度达到30 ℃水溶性有机碳含量还增加。尽管水溶性碳释放最多的温度不一样, 但都说明温度对土壤水溶性碳含量的影响很大。
温度对各处理易氧化有机碳和总有机碳含量的影响表现为10 ℃>20 ℃>30 ℃, 即在低温(10 ℃)培养条件下, 添加细根各处理土壤含量较高, 当温度升高时其含量呈下降趋势。许多田间实验也表明了这一点(Krischbaum, 1995; Trumbore et al., 1996)。Zhou等(2003)基于2 473个土壤剖面数据, 用GIS技术分析了中国土壤有机碳的分布特征, 发现无论在中国的东部还是西部地区, 纬度低的区域温度总是对应着高的碳密度。本研究结果证实了随着温度上升土壤易氧化有机碳和总有机碳的分解作用加剧, 土壤碳含量下降。
本研究中土壤活性有机碳各组分含量随时间的变化表现出了不同的变化规律, 其原因除各组分本身的动态改变以及周转时间不同外(宇万太等, 2007), 室内模拟的时间短也是一个重要因素。在室内模拟细根分解试验的同时, 在同一研究区开展的野外原状土芯细根分解试验结果表明, 细根(草根)分解90天后进入缓慢阶段(荣丽等, 2009c), 细根(草根)N化合物分解微生物生理类群数量也在90天以后表现出下降或平稳的趋势(荣丽等, 2009b)。但本研究表明在120天时土壤微生物量碳含量还呈增加趋势, 这可能与微生物群落重新定居后, 种群数量重组在时间上具有滞后性有关(亚历山大, 1983)。当易分解的简单有机物被微生物利用后, 剩下的是难分解物质如半纤维素、纤维素和木质素等, 这些物质影响了微生物的增殖和活动, 120天后土壤微生物量碳含量可能有下降的趋势。因此, 应当根据细根化学成分变化的过程确定室内模拟培养时间, 考虑到野外实际状况, 本研究建议室内模拟培养的时间最好延长至180天。
外源有机物料进入土壤后, 常引起土壤矿化高峰的出现(黄文昭等, 2007)。土壤活性有机碳的变化并非完全由细根本身的分解所致, 还包括土壤中原有有机碳的矿化。为了降低细根添加至土壤可能产生“激发效应”, 本研究在室内模拟时, 将细根添加至土壤表面, 避免了因外源有机物料添加后而激发原有土壤有机质的分解, 能够判断土壤活性有机碳的增加是由添加细根所致, 但是该方法不能将细根分解对土壤活性有机碳的贡献量化。另外室内培养试验与野外实际情况存在一定差异, 如室内试验用的是过筛土壤, 排除了土壤动物的影响以及温度、降雨等自然因子的影响, 而这些客观的因素会影响土壤微生物群落, 从而影响微生物量碳以及水溶性碳的含量。室内培养与自然条件下细根分解和土壤活性有机碳含量变化存在差异, 有必要在此基础上开展不同退耕模式细根(草根)分解对土壤活性有机碳以及土壤有机碳库影响的长期生态定位观察, 以便于更加深入地研究细根分解对土壤活性有机碳的长期效应。
陈光水, 杨玉盛, 高人, 等. 2005. 林木根源有机C对大气CO2浓度升高的响应[J]. 福建师范大学学报:自然科学版, 21(3): 70-77. |
董慧霞, 李贤伟, 张健, 等. 2007. 退耕地三倍体毛白杨林地细根生物量及其与土壤水稳性团聚体的关系[J]. 林业科学, 43(5): 24-29. |
范冰, 李贤伟, 张健, 等. 2005. 三倍体毛白杨-黑麦草复合生态系统林木细根与草根的分解及养分动态[J]. 应用生态学报, 16(11): 2030-2034. DOI:10.3321/j.issn:1001-9332.2005.11.005 |
黄文昭, 赵秀兰, 朱建国, 等. 2007. 土壤碳库激发效应研究[J]. 土壤通报, 38(1): 350-351. |
姜培坤. 2005. 不同林分下土壤活性有机碳库研究[J]. 林业科学, 41(1): 10-13. DOI:10.11707/j.1001-7488.20050103 |
林滨, 陶澍, 刘晓航. 1997. 土壤与沉积物中水溶性有机物释放动力学研究[J]. 环境科学学报, 17(1): 8-13. |
刘艳, 汪思龙, 王晓伟, 等. 2007. 不同温度条件下杉木、桤木和火力楠细根分解对土壤活性有机碳的影响[J]. 应用生态学报, 18(3): 481-486. |
吕国红, 周广胜, 周莉, 等. 2006. 土壤溶解性有机碳测定方法与应用[J]. 气象与环境学报, 22(2): 51-55. |
荣丽, 李贤伟, 朱天辉, 等. 2009a. 光皮桦细根与扁穗牛鞭草草根分解的土壤微生物数量及优势类群[J]. 草业学报, 18(4): 117-124. |
荣丽, 李贤伟, 张健, 等. 2009b. 华西玉屏区不同退耕模式细根、草根分解及主要土壤微生物功能群动态[J]. 自然资源学报, 24(6): 1069-1079. |
荣丽, 李贤伟, 张健, 等. 2009c. 4种退耕模式细根(草根)分解及N动态[J]. 林业科学, 45(8): 21-26. |
荣丽, 李守剑, 李贤伟, 等. 2011. 不同退耕模式细根(草根)分解过程中C动态及土壤活性有机碳的变化[J]. 生态学报, 31(1): 137-144. |
沈宏, 曹志洪. 2000. 施肥对土壤不同碳形态及碳库管理指数的影响[J]. 土壤学报, 37(2): 166-173. DOI:10.11766/trxb199810030203 |
宋日, 吴春胜, 牟金明, 等. 2002. 玉米根茬留田对土壤微生物量碳和酶活性动态变化特征的影响[J]. 应用生态学报, 13(3): 303-306. |
亚历山大. 1983. 土壤微生物学[M]. 北京: 科学出版社.
|
王巧, 李贤伟, 杨渺, 等. 2007. 光皮桦—扁穗牛鞭草复合模式细根草根生物量及空间分布[J]. 四川农业大学学报, 25(4): 430-435. |
宇万太, 马强. 2007. 不同土地利用类型下土壤活性有机碳库的变化[J]. 生态学杂志, 26(12): 2013-2016. |
中国林业科学研究院林业研究所森林土壤研究室. 1999. 森林土壤分析方法[M]. 北京: 中国标准出版社.
|
朱志建, 姜培坤, 徐秋芳. 2006. 不同森林植被下土壤微生物量碳和易氧化态碳的比较[J]. 林业科学研究, 19(4): 523-526. |
Kirschbaum M U. 1995. The temperature dependence of soil organic matter decomposition and the effect of global warming on soil organic C storage[J]. Soil Biology and Biochemistry, 27(6): 753-760. DOI:10.1016/0038-0717(94)00242-S |
Robinson C H, Kirkham J B, Littlewood R. 1999. Decomposition of root mixtures from high arctic plants:a microcosm study[J]. Soil Biology & Biochemistry, 31(8): 1101-1108. |
Trumbore S E, Chadwick O A, Amundson R. 1996. Rapid exchange between soil carbon and atmospheric carbon dioxide driven by temperature change[J]. Science, 272(5260): 393-396. DOI:10.1126/science.272.5260.393 |
Uselaman S M, Qualls R G, Lilienfein J. 2007. Contribution of root vs[J]. leaf litter to dissolved organic carbon leaching through soil.Soil Science Society of America, 71(5): 1555-1563. |
Vance E D, Brookes P C, Jenkinson D S. 1987. An extraction method for measuring soil microbial biomass C[J]. Soil Biol Biochem, 19(6): 703-707. DOI:10.1016/0038-0717(87)90052-6 |
Zhou C H, Zhou Q M, Wang S Q. 2003. Estimating and analyzing the spatial distribution of soil organic carbon in China[J]. Ambio, 32(1): 6-12. DOI:10.1579/0044-7447-32.1.6 |
 2011, Vol. 47
2011, Vol. 47

