文章信息
- 尚旭岚, 徐锡增, 方升佐
- Shang Xulan, Xu Xizeng, Fang Shengzuo
- 青钱柳种子休眠机制
- Seed Dormancy Mechanism of Cyclocarya paliurus
- 林业科学, 2011, 47(3): 68-74.
- Scientia Silvae Sinicae, 2011, 47(3): 68-74.
-
文章历史
- 收稿日期:2010-01-06
- 修回日期:2010-05-10
-
作者相关文章
青钱柳(Cyclocarya paliurus),又名青钱李、摇钱树等,系胡桃科(Juglandaceae)青钱柳属植物,是我国特有的单种属植物,也是国家重点保护的濒危植物之一。青钱柳广泛分布于江西、浙江、江苏、安徽、福建、湖北、湖南、四川和贵州等地海拔420 ~2 500 m的山区、溪谷或石灰岩山地(谢明勇等,2001; 方升佐等,2007)。青钱柳集药用、保健、材用和观赏等多种价值于一身,是一种很有发展和开发利用前景的珍贵树种。青钱柳种子具有深休眠特性,一般在常规播种条件下,需隔年甚至2年后才萌发; 同时,种子发育差,更新能力较弱,这些都严重影响了青钱柳树种的开发利用和迁地保护。为此,国内多位学者对其休眠原因进行了一些探索。史晓华等(2002)研究表明,青钱柳种子坚硬骨质的种壳是导致强迫休眠的主要原因,而且还存在着生理休眠,属综合休眠类型。杨万霞等(2005a; 2005b)研究也表明,其种皮结构可能对胚的萌发特别是胚根的生长和伸长起到严重的机械阻力,而且其种皮浸提液中可能含有抑制萌发的物质。Fang等(2006)也认为青钱柳种子存在外源性和内源性休眠。由上可知,前人已从不同的角度对青钱柳种子休眠的原因做了初步的探索,但至今其休眠机制仍不完全清楚。因此,系统研究青钱柳种子的休眠原因,并从理论上阐明其休眠本质,可为生产上采取配套技术措施提供理论依据。
1 材料与方法 1.1 材料无菌条件下的萌发测定所用青钱柳种子于2005年11月采自云南昆明植物园(25°10′N,102°44′E; 海拔1 943 m),千粒质量为85.25 g,饱满率为41%。种子去翅后采用40%乙醇分选,取下沉种子晾干,饱满率达到90%。其余试验所用青钱柳种子于2005年12月采自贵州黎平(26°13′N,109°18′E; 海拔750m),千粒质量149.81 g,饱满率为50%。种子去翅后采用150 g·L-1 NaCl溶液分选,取下沉种子晾干,饱满率达到90%。种子晾干后用透气的塑料篮子盛装后置于实验室阴凉避光处。离体胚及种子萌发测定于2006年3月进行,其他各项试验随后展开。
种子浸提液及其他待测液生物活性测定所用材料为不结球白菜(Brassica campestris ssp.chinensis)种子,发芽率大于85%,净度大于85%。
1.2 方法 1.2.1 无菌条件下的种子萌发测定先将浸泡96 h的种子进行消毒,然后在无菌条件下按试验设计对种壳进行不同的处理。共设7个处理,分别为:完整种子(CK); 酸蚀4 h的种子; 夹裂果皮的种子; 除去一半果皮的种子; 除去全部果皮(只保留种皮)的种子; 离体胚(除去果皮和种皮的种子)。各处理的萌发测定材料均按胚根朝下方式接种到只加琼脂的空白培养基上,然后放置在人工气候箱中(23 ± 2) ℃恒温培养,光照时间为12 h·d-1,光强为1 500 ~ 2 000 lx。每个处理接种50个材料,重复3次。
定期观察萌发率和生长情况,30天时统计萌发率。种胚萌发的标准是指幼根超过该胚长度。萌发率是指未受污染的萌发胚数占未污染总胚数的百分比。
1.2.2 种壳透水性的测定取完整种子、夹裂种子各30粒分别称质量,放入烧杯中,加蒸馏水浸泡,在25 ℃恒温条件下吸胀。另取酸蚀2.5 h种子和酸蚀5 h种子各30粒分别称质量,流水冲洗24 h后继续浸泡。流水冲洗过程中每2 h称量1次,之后每6 h称量1次,36 h后每12 h称量1次,直至恒重。分别计算各个处理的吸水率,每个处理设3个重复,计算其平均值。吸水率(%) = (浸种后质量-浸种前质量)/浸种前质量× 100。
1.2.3 种壳透气性的测定取种壳透水性测定所用的完整种子、酸蚀5 h种子和夹裂种子,采用小篮子法(黄学林等,1990)定时测定3种处理种子浸泡0 ~ 120 h的呼吸速率变化,以每h每g干种子所释放的CO2的mg数来表示(mg CO2·g-1 h-1)。
1.2.4 生物测定及GC-MS鉴定1) 青钱柳种子不同部分甲醇浸提液生物活性测定将青钱柳种子分成果皮、种皮和种胚3部分,33 ~ 35 ℃烘干,分别取磨碎后过1 mm筛的完整种子粉末和果皮粉末各10g,以及研碎的种胚粉末10 g和种皮粉末2 g,各加入4 ~ 10倍体积80%甲醇,在1 ~ 4 ℃的恒温条件下密闭浸提,24 h后过滤,重复浸提2次,混合3次所得的浸提液,减压浓缩后用甲醇溶解并定容,浓度均为1 g·mL-1。分别取完整种子、果皮和种胚浸提浓缩液1 mL和2 mL,待甲醇挥发完后用0.1 mL甲醇溶解并用蒸馏水定容至10 mL,即为0.1 g·mL-1和0.2 g·mL-1 2个浓度的待测液,以1%甲醇水溶液为对照(甲醇CK)进行生物测定。在φ9 cm的培养皿中放入φ7 cm的滤纸,加入3 mL待测液。取种皮浸提浓缩液0.5 mL和1 mL,将甲醇挥发完后用0.05 mL甲醇溶解并用蒸馏水定容至5 mL制成0.1 g·mL-1和0.2 g·mL-1待测液,在φ6 cm的培养皿中放入φ4 cm的滤纸,加入1 mL待测溶液。不结球白菜种子置床前先在始温为45 ~ 50 ℃的水中浸泡10 min,取25粒均匀摆放在滤纸中上部,培养皿放置时倾斜45°,(28 ± 1) ℃恒温黑暗培养。72 h测量幼根长,3次重复,并进行差异显著性检验。
2) 青钱柳种子果皮各溶剂相生物测定按系统溶剂法(肖崇厚,1997; 黄耀阁等,1994),将果皮甲醇提取液分离为石油醚相、乙醚相、乙酸乙酯相、甲醇相和水相,对各分离相进行生物活性测定,测定方法同1)。
3) 青钱柳果皮乙醚相的GC-MS鉴定对抑制作用较强的果皮甲醇浸提液的乙醚相进行GC-MS鉴定,测定在中国林业科学研究院林产化工研究所仪器分析室进行。仪器型号为美国Agelient 6890N /5973N。气谱条件: PEG-20M石英毛细管柱φ0.32mm × 25 m; 柱温50 ~ 160 ℃; 程序升温5 ℃/min; 载气为氦气; 气化室温度260 ℃。质谱条件:离子源EI; 源温200 ℃; 电离电压70 eV; 收集电流300μA; 发射电流1 mA; 仪器分离率600;质量范围m/z 10 ~ 500。由计算机控制的库存信号检查各色谱峰的质谱图并与标准库谱图核对,以面积归一化法计算出各成分的相对百分含量。
4) 香草酸标准品生物活性测定参考韩东等(2001)方法进行香草酸标准品生物活性的测定和半抑制浓度的确定。首先将香草酸标准品以适量乙醇溶解后用蒸馏水配制如下浓度待测液: 10 000,1 000,100,10,1 mg·L-1,待测液中乙醇的浓度均控制为1%。以1%乙醇水溶液为对照进行生物活性测定,测定方法同1)。72 h测量幼根长,并计算不同浓度香草酸对不结球白菜种子幼根生长的抑制率: I = (C-T) /C × 100 %。式中,I为抑制率,C为72 h后对照组平均幼根长度,T为72 h后处理组平均幼根长度。以待测液中香草酸浓度的对数值为X,以不结球白菜种子幼根生长的抑制率为Y计算拟合方程,利用拟合方程经反对数求出半抑制浓度(50% inhibitory concentration,IC50),即幼根生长抑制率达到50%时标准品的浓度,由此可判断香草酸的抑制活性强弱。
1.2.5 数据处理采用SPSS软件进行单因素方差分析,并用Duncan法检验其差异显著性。结果以平均数±标准偏差(Mean ± SD)表示。
2 结果与分析 2.1 不同种壳处理对种子萌发的影响观察发现,离体胚在空白培养基上,3 ~ 5天开始萌动(图 1A),培养30天即可成苗(图 1B)。这表明青钱柳种子的胚在形态上是发育完全的,其本身基本无休眠现象,当满足萌发条件时即可萌发。
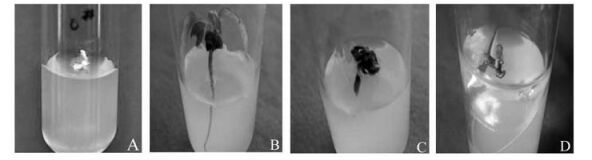
|
图 1 不同种壳处理对种胚和种子萌发的影响 Figure 1 Effects of different husk treatments on germination of embryos and seeds A.离体胚培养5天; B.离体胚培养30天; C.除去一半果皮的种子培养30天; D.除去全部果皮的种子培养30天。 A.Embryo cultured for 5 days; B.Embryo cultured for 30 days; C.Seed removed half pericarp cultured for 30 days; D.Seed removed all pericarp cultured for 30 days. |
由表 1可知,离体胚培养30天萌发率为90%,而完整种子萌发率为0,说明被覆物是导致种胚处于休眠状态而不能萌发的原因。不同种壳处理方式对青钱柳种子萌发有明显影响。浓硫酸处理4 h后的种子接种培养30天仍然不能萌发; 夹裂种子的萌发率也仅为2%;除去一半果皮和除去全部果皮(只保留种皮)的种胚萌发率分别提高到27%和73% (表 1),但萌发速度明显不及离体胚,长势较差甚至枯死(图 1C,D)。综合上述结果可推断,青钱柳果皮和种皮可能存在一定的机械束缚和透性障碍,但这不是抑制萌发的主要原因,果皮和种皮中含有一些活性较强的抑制萌发和生长的内源抑制物质,可能是导致青钱柳种子休眠的主要原因之一。
|
|
从图 2可以看出,完整种子、酸蚀和夹裂种子在开始吸水的12 h内,吸水速度都很快,尤以夹裂种子的吸水速度最快,12 h时吸水率达到29.16%,而后各处理种子的吸水速度均有所放慢。夹裂种子在吸水24 h后,吸水率逐渐趋向稳定,此时吸水率为31.12%,说明24 h就已基本吸水饱和。完整种子和其他各处理种子,在60 h时吸水率趋于一致,维持在28%左右。由此表明,青钱柳完整种子能透水,但与夹裂种子吸水率相比,完整的果皮和种皮结构(酸蚀后果皮虽变薄,但结构仍较完整)存在一定的透水障碍。
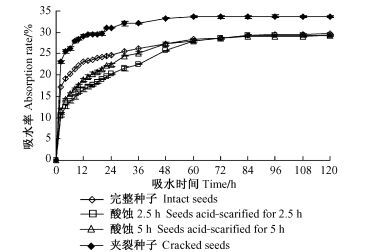
|
图 2 不同种壳处理对青钱柳种子吸水率的影响 Figure 2 Effects of different husk treatments on water absorption rate of Cyclocarya paliurus seeds |
由图 3可知,青钱柳完整干种子的呼吸速率很低,仅为0.063 2 mgCO2·g-1 h-1,吸水后呼吸速率有所增强,但酸蚀5 h的种子和完整种子在24 h后就进入呼吸停滞期,到吸水饱和时分别只是干种子的4.1倍和3.2倍。而夹裂种子的呼吸速率随着吸水时间延长不断增强,到72 h达到高峰,为干种子的16.2倍。这说明青钱柳种子存在一定的透气性障碍,破坏种壳结构可明显改善其透气状况。至于夹裂种子的呼吸速率在达到高峰后有下降趋势(图 3),这可能是由于夹裂种子的完整种皮结构遭到破坏,种胚直接暴露于有菌的环境中,在吸水过程中容易染菌劣变所致。
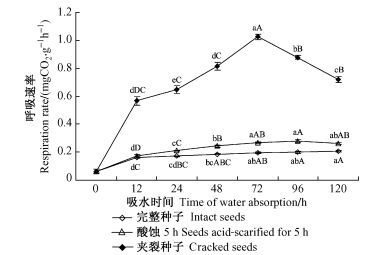
|
图 3 青钱柳种子透气性变化 Figure 3 Respiration rate of of Cyclocarya paliurus seeds 图中不同小写字母表示不同处理间差异显著(P<0.05),不同大写字母表示不同处理间差异极显著(P<0.01)。下同。The different small letters indicate significant difference at P<0.05 among treatments,and the different capital letters indicate significant difference at P<0.01among treatments.The same below. |
青钱柳种胚萌发测定结果已表明,果皮和种皮都可能含有抑制物质。由图 4可知,青钱柳种子各部分甲醇浸提液对不结球白菜幼根的生长都造成一定的抑制,其中以果皮的抑制作用最强,浓度为0.1g·mL-1和0.2 g·mL-1的浸提液抑制率分别达到65.58%和71.95%,而以种胚浸提液的抑制活性最弱,仅为31%和41.88%。据此可以初步证实青钱柳果皮、种皮及种胚均含有内源抑制物质,而且各部分浸提液的活性表现出从种子外部(果皮)向种子中心(种胚)呈逐渐减弱的变化趋势。方差分析结果表明,各部分浸提液对不结球白菜种子幼根生长的抑制均达到极显著差异水平(0.1 g·mL-1时F =19.681,P<0.01; 0.2 g·mL-1时F = 31.959,P<0.01)。多重比较结果显示,果皮抑制作用最强,其浸提液对不结球白菜幼根生长的抵制作用显著高于对照和其他部分,各部分浸提液的抑制强度依次为:果皮>种皮>完整种子>种胚。
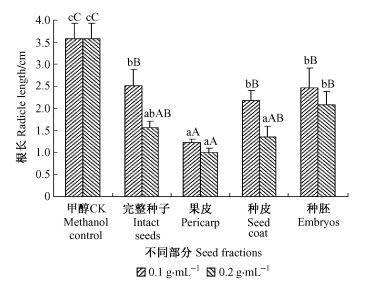
|
图 4 青钱柳种子不同部分甲醇浸提液对不结球白菜根长的影响 Figure 4 Effects of methanol extract from different Cyclocarya paliurus seed tissues on Brassica campestris ssp.chinensis radicle length |
从图 5可看出,青钱柳果皮各分离相对不结球白菜种子幼根生长的抑制作用差异达到极显著水平,各有机相基本上是随浓度的提高抑制作用增强。0.5 g·mL-1时各组分抑制强度分别为:乙醚相>石油醚相>甲醇相>乙酸乙酯相,此时乙醚相和石油醚相的抑制率分别达到52.03%和45.72%。方差分析和多重比较结果表明,乙醚相和石油醚相之间差异不显著,与其他各相均达极显著水平(0.5 g·mL-1时F = 26.831,P<0.01; 1.0 g·mL-1时F = 61.397,P<0.01),由此说明果皮中内源抑制物质主要集中于乙醚相和石油醚相中,即青钱柳果皮的抑制物质可能是一些极性较小的组分。
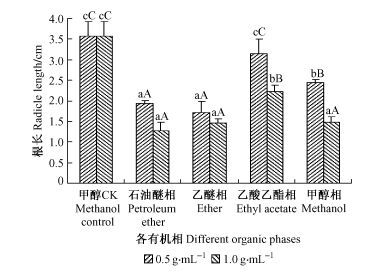
|
图 5 果皮各有机相对不结球白菜根长的影响 Figure 5 Effects of different organic phases from Cyclocarya paliurus pericarp on Brassica campestris ssp.chinensis radicle length |
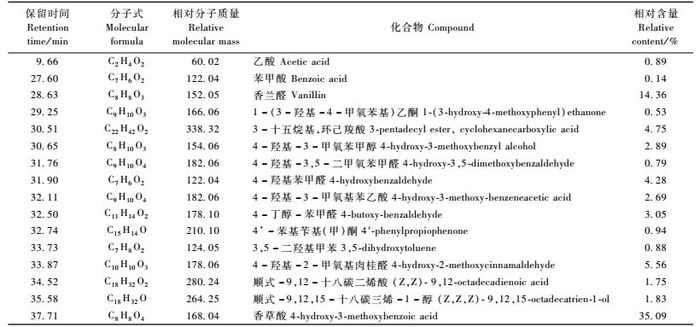
青钱柳果皮乙醚相经GC-MS鉴定,总离子流见图 6。具有发芽抑制作用的有机化合物的种类及相对含量列于表 2。
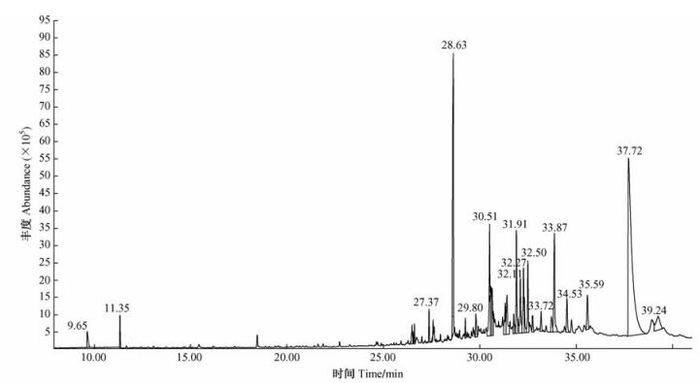
|
图 6 青钱柳果皮甲醇浸提液乙醚相总离子流图 Figure 6 Total ion chromatogram of ether phase from methanol extract of Cyclocarya paliurus pericarp |
|
|
从表 2可看出,果皮乙醚相中可能具抑制作用的物质种类较多,主要为有机酸类物质,且多为苯甲酸类及其衍生物。很多研究表明这些有机化合物都是种子中分布较多的且抑制作用很强的物质。其中相对含量最大的组分为香草酸,达35.09%。
2.4.4 香草酸标准品生物测定从图 7可以看出,香草酸浓度为10 000 mg·L-1时对不结球白菜种子的幼根生长抑制率为100%,说明高浓度的香草酸能完全抑制幼根的伸长。通过计算得出拟合方程为y = 24.974x + 4.910 1,利用方程经反对数求出IC50 = 63.90 mg·L-1,即不结球白菜幼根生长抑制率达到50%时香草酸的浓度为63.90 mg·L-1。

|
图 7 不同浓度香草酸对不结球白菜根长的抑制作用 Figure 7 Inhibitory effects of different concentrations of vanillic acid on Brassica campestris ssp.chinensis radicle length |
通过种胚离体培养试验可以确定种子休眠是种胚自身存在的休眠还是因种皮机械束缚、气体交换、透水性及存在内源抑制物质等引起的休眠。Morris等(2000)对银桦属(Grevillea) 2个种的种胚离体培养研究认为,G.linearifolia的休眠是由种皮引起的,而G.wilsonii则是种胚和种皮双重休眠类型。Sari等(2006)的研究认为,月桂(Laurus nobilis)的果皮和种皮中可能含有抑制物质是导致种子休眠的主要因素。Cooke等(2002)研究表明,火炬松(Pinus taeda)种子离体胚萌发率为100%,但是微微夹裂种皮的种子萌发率仅为10%,进一步的试验表明导致种子休眠的原因不仅在于种皮的物理障碍,而且火炬松种皮中可能存在有抑制萌发的物质。智信(2008)对6种松树的研究也表明,白皮松(Pinus bungeana)和红松(Pinus koraiensis)等种子的胚均不休眠,果皮所含的萌发抑制物对种子休眠起主要作用。对花楸树(Sorbus pohuashanensis)种子的研究结果显示,完整种子的萌发率为3%,去皮种子的萌发率也仅为6%,而去2片子叶和断胚根处理可以略微提高胚的萌发率,说明在子叶和胚根中可能存在抑制物质(沈海龙等,2006)。本试验结果表明,青钱柳种子离体胚能很快萌发,而对种壳进行各种处理后的种子或种胚萌发都受到不同程度的抑制,说明青钱柳种子成熟后胚体发育完整、充实,已达到生理成熟,其离体胚本身基本上不存在休眠现象; 果皮和种皮存在一定的机械束缚和透性障碍,但不是抑制萌发的主要原因; 果皮和种皮中含有一些活性较强的抑制萌发和生长的物质,这可能是导致种胚休眠的主要原因。
本研究中种壳的透水透气性试验结果表明:青钱柳果皮和种皮能透水,只是存在着一定程度的障碍,这与杨万霞等(2005a)的研究结果较一致。进一步的呼吸速率测定结果表明:青钱柳种子还存在一定的透气性障碍,酸蚀或直接夹裂种皮等破坏种壳结构的处理可明显改善其透气状况。已有研究表明,青钱柳种皮中含有一些造成种子休眠和抑制种子萌发的化学成分,这些内源抑制成分可能是导致青钱柳种子休眠的原因之一(杨万霞等,2005b)。本文通过进一步的研究表明,青钱柳种子各部分均含有内源抑制物质,但不同部分浸提液抑制作用差异很明显,其中以果皮的抑制作用最强,表现出从种子外部向种子中心逐渐减弱趋势,这与叉子圆柏(Sabina vulgaris) (张国盛等,2001)、白皮松(王小平等,1998)和珙桐(Davidia involucrata) (雷泞菲等,2003)等种子各部分的抑制活性较一致。经系统溶剂法分离所获得的各有机相的生物测定结果表明,青钱柳果皮甲醇浸提液各分离有机相的抑制强度分别为:乙醚相>石油醚相>乙酸乙酯相>甲醇相,说明果皮中内源抑制物质主要集中于石油醚相和乙醚相中,即青钱柳果皮的抑制物质是一些极性较小的组分。GC-MS鉴定结果也可看出,乙醚相抑制活性很强的原因就在于其含有的发芽抑制物质种类较多,其中相对含量高达35.09%的组分为香草酸。很多研究表明,香草酸是种子中普遍存在且抑制作用很强的一种内源抑制物质(Kushimal et al., 1998; Gallagher et al., 2010)。本试验对香草酸标准品进行了生物活性测定,结果显示香草酸对不结球白菜种子幼根生长有较强的抑制作用,半抑制浓度(IC50)为63.90 mg·L-1。由此推测青钱柳果皮中含有香草酸等抑制物质是导致青钱柳种子休眠的主要原因。
对于种皮存在机械障碍、透性障碍及含有抑制物质的种子,生产上常单独采用砂纸磨擦(Sadeghi et al., 2009)、切开种子(Ashley et al., 2009)等机械手段,用浓硫酸、GA3、KNO3或H2 O2等化学药剂处理(Oda et al., 2009; Yang et al., 2007),流水冲洗(Çirak et al., 2007)或热水浸种(Sadeghi et al., 2009),以及低温层积(Zhou et al., 2009)等方法来破除其休眠。生产上也常使用2种或2种以上的方法来破除种子休眠,如将柚木(Tectona grandis)种子珠孔端切开后酸蚀再用赤霉素浸种可使萌发率提高到16% (Jatt et al., 2007); 对青钱柳种子采用浓硫酸腐蚀后赤霉素浸种和拌砂低温层积的综合处理措施可有效解除其休眠(Fang et al., 2006)。作者另外对综合层积处理后解除休眠的青钱柳种子进行了研究,结果发现其果皮中不含香草酸等抑制作用较强的酚酸类化合物。这从另一个侧面证实了上述关于青钱柳种子休眠原因的推断,并可为生产上采取配套技术措施提供理论依据。
方升佐, 洑香香. 2007. 青钱柳资源培育与开发利用的研究进展[J]. 南京林业大学学报:自然科学版, 31(1): 95-100. |
韩东, 黄耀阁, 李向高. 2001. 西洋参果实中发芽抑制物质———二苯胺的分离鉴定[J]. 吉林农业大学学报, 23(4): 60-63, 6. |
黄学林, 陈润政. 1990. 种子生理实验手册[M]. 北京: 农业出版社: 99-100.
|
黄耀阁, 崔树玉, 鲁岐, 等. 1994. 西洋参种子抑制物质的初步研究[J]. 吉林农业大学学报, 16(2): 9-14. |
雷泞菲, 苏智先, 陈劲松, 等. 2003. 珍稀濒危植物珙桐果实中的萌发抑制物质[J]. 应用与环境生物学报, 9(6): 607-610. |
沈海龙, 杨玲, 张建瑛, 等. 2006. 花楸树种子休眠影响因素与萌发特性研究[J]. 林业科学, 42(10): 133-138. DOI:10.3321/j.issn:1001-7488.2006.10.024 |
史晓华, 徐本美, 黎念林, 等. 2002. 青钱柳种子休眠与萌发的研究[J]. 种子, 21(5): 5-7. |
王小平, 王九龄. 1998. 白皮松种子内含物的提取、分离及生物测定[J]. 种子, 17(5): 19-22, 28. |
肖崇厚. 1997. 中药化学[M]. 上海: 上海科学技术出版社: 19.
|
谢明勇, 李磊. 2001. 青钱柳化学成分和生物活性研究概况[J]. 中草药, 32(4): 365-366. |
杨万霞, 洑香香, 方升佐. 2005a. 青钱柳种子的种皮结构及其对透水透气性的影响[J]. 南京林业大学学报:自然科学版, 29(5): 25-28. |
杨万霞, 方升佐. 2005b. 青钱柳种皮甲醇浸提液的生物测定[J]. 植物资源与环境学报, 14(4): 11-14. |
张国盛, 王林和, 魏宏, 等. 2001. 臭柏果实浸泡液萌发抑制作用及种子吸水特性研究[J]. 内蒙古农业大学学报, 22(6): 1-6. |
智信. 2008. 6种松树种子休眠原因研究[J]. 西南林学院学报, 28(2): 5-9. |
Ashley J A, Preece J E. 2009. Seed cutting treatments stimulate germination and elucidate a dormancy gradient in dormant Fraxinus americana L. and Fraxinus pennsylvanica Marsh[J]. Propagation of Ornamental Plants, 9(3): 122-128. |
Çirak C, Kevseroglu K, Ayan A K. 2007. Breaking of seed dormancy in a Turkish endemic Hypericum species: Hypericum aviculariifolium subsp. depilatum var. depilatum by light and some pre-soaking treatments[J]. Journal of Arid Environments, 68(1): 159-164. |
Cooke J, Cooke B, Gifford D. 2002. Loblolly pine seed dormancy: constraints to germination[J]. New Forests, 23(3): 239-256. DOI:10.1023/A:1020306816009 |
Fang Shengzuo, Wang Jiayuan, Wei Zhaoyang, et al. 2006. Methods to break seed dormancy in Cyclocarya paliurus (Batal.) Iljinskaja[J]. Scientia Horticulturae, 110(3): 305-309. DOI:10.1016/j.scienta.2006.06.031 |
Gallagher R S, Ananth R, Granger K, et al. 2010. Phenolic and shortchained aliphatic organic acid constituents of wild oat (Avena fatua L.) seeds[J]. Journal of Agricultural and Food Chemistry, 58(13): 218-225. |
Jatt T, Suhail M, Abro H, et al. 2007. Alleviating seed dormancy of Tectona grandis L. by temperature, plant growth regulators and inorganic salts[J]. Pakistan Journal of Botany, 39(7): 2581-2583. |
Kushima1 M, Kakuta H, Kosemura S, et al. 1998. An allelopathic substance exuded from germinating watermelon seeds[J]. Plant Growth Regulation, 25(1): 1-4. DOI:10.1023/A:1005907101778 |
Morris E C, Tieu A, Dixon K. 2000. Seed coat dormancy in two species of Grevillea(Proteaceae)[J]. Annals of Botany, 86(4): 771-775. DOI:10.1006/anbo.2000.1249 |
Oda A, Kenzo T, Fukuda K. 2009. Optimal germination condition by sulfuric acid pretreatment to improve seed germination of Sabina vulgaris Ant[J]. Journal of Forest Research, 14(4): 251-256. DOI:10.1007/s10310-009-0129-5 |
Sadeghi S, Ashrafi Z Y, Tabatabai M F, et al. 2009. Study methods of dormancy breaking and germination of common madder (Rubia tinctorum L.) seed in laboratory conditions[J]. Botany Research International, 2(1): 7-10. |
Sari A O, Oguz B, Bilgic A. 2006. Breaking seed dormancy of laurel (Laurus nobilis L.)[J]. New Forests, 31(3): 403-408. DOI:10.1007/s11056-005-8678-8 |
Yang Qihe, Ye Wanhui, Yin Xiaojuan. 2007. Dormancy and germination of Areca triandra seeds[J]. Scientia Horticulturae, 113(1): 107-111. DOI:10.1016/j.scienta.2007.01.028 |
Zhou Zhiqiong, Bao Weikai, Wu Ning. 2009. Dormancy and germination in Rosa multibracteata Hemsl. & E. H. Wilson[J]. Scientia Horticulturae, 119(4): 434-441. DOI:10.1016/j.scienta.2008.08.017 |
 2011, Vol. 47
2011, Vol. 47