文章信息
- 孙红梅, 安晶, 王春夏, 谢佳, 陶承光
- Sun Hongmei, An Jing, Wang Chunxia, Xie Jia, Tao Chengguang
- 激素和变温处理对百合鳞片扦插繁殖的影响
- Effects of Plant Regulators and Alternating Temperature Treatment on Propagation during Lily Scale Cutting
- 林业科学, 2011, 47(3): 39-45.
- Scientia Silvae Sinicae, 2011, 47(3): 39-45.
-
文章历史
- 收稿日期:2009-12-15
- 修回日期:2011-01-26
-
作者相关文章
2. 辽宁省农业科学院 沈阳 110161
2. Liaoning Academy of Agricultural Science Shenyang 110161
作为国内外生产百合(Lilium)籽球的主要方法,鳞片扦插繁殖是百合种球繁育的重要研究方向之一(Pablo et al., 2003)。迄今我国尚未实现优质百合种球自给,有关百合鳞片繁殖技术及相关生理机制研究仍不够完善。植物生长调节剂和培养温度是影响鳞片扦插的2个重要因素。笔者课题组已就GA3和IBA对不同种类百合的鳞片扦插繁殖效应进行了探讨,初步明确了提高小鳞茎繁殖系数和个体质量的植物生长调节剂浓度范围和最佳培养时间。目前,有关鳞片扦插繁殖过程中温度处理的研究仍不够系统,一般认为20~25 ℃为百合鳞片繁殖的适宜温度(赵宇等,2007; 杨利平等,2001)。黄作喜等(2001)研究表明:种球经2~4 ℃的低温处理后再取其鳞片扦插可显著提高繁殖率和结球率。陈爱葵等(2005)和王祥宁等(2008)分别对鳞片繁殖后期的低温处理效应进行研究,探讨培养后期低温处理对已经形成的小鳞茎休眠状态和籽球抽茎率的影响,而有关直接对鳞片进行低温预处理的报道尚少。
淀粉是百合鳞片内碳水化合物的主要贮藏形式(郑慧俊等,2006; Shin et al., 2002),小鳞茎的形成、发育与淀粉代谢密切相关(孙红梅等,2005),关于淀粉代谢在唐菖蒲(Gladiolus hybridus) (钱树林,2007; 苑智华等,2008)和郁金香(Tulipa gesneriana) (夏宜平等,2005)等有所报道,但对于百合鳞片扦插繁殖过程中母鳞片及小鳞茎淀粉代谢的研究尚少,生理机制不明确导致生产技术缺乏理论指导。本试验在前期工作基础上,进一步系统研究并优化了GA3和IBA在百合鳞片扦插繁殖过程中的使用浓度和处理时间,并根据小鳞茎的形成发育状况,初步探讨变温和植物生长调节剂处理与母鳞片淀粉降解及其与小鳞茎的形成发育的关系,以期为进一步探究鳞片繁殖过程中小鳞茎的发育与碳水化合物积累的生理机制,确定种球生产的调控技术提供理论依据。
1 材料与方法 1.1 试验材料试验于2008年11月至2009年11月进行。以亚洲系百合‘精粹’(Lilium Asiatic hybrid ‘Elite’)为试材,种球由荷兰进口。选取饱满、无病虫害、大小一致(周径12~14 cm,重30.0 ± 1.0 g)的鳞茎,从基部剥取健壮的中外层鳞片,用清水冲洗干净后,于0.1%高锰酸钾溶液中浸泡20 min,淋干表面水分备用。以锯木屑为保湿基质,用500倍多菌灵及0.2%高锰酸钾溶液消毒,培养过程中保持基质含水量在50%~60%左右。
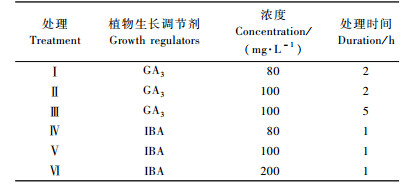
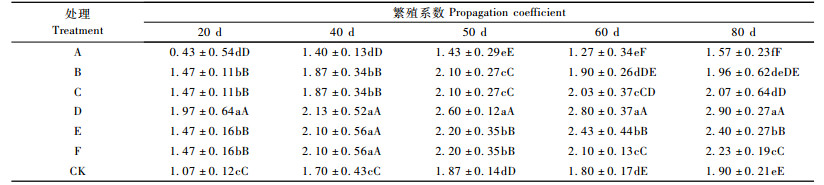
1.2 试验设计 1.2.1 不同植物生长调节剂处理对鳞片繁殖的影响在前期研究基础上,选用不同浓度GA3,IBA溶液,对鳞片进行不同时间浸泡处理,试验设计见表 1,以清水处理2 h为对照(CK)。采用锯木屑埋片法,每处理48枚鳞片,3次重复,在平均室温22 ℃下保湿培养。分别在鳞片培养的第20,40,60和80天调查统计小鳞茎的形成和发育情况。鳞茎发生率、繁殖系数、平均级数的统计以及分级标准参照孙红梅等(2008)的方法。
|
|
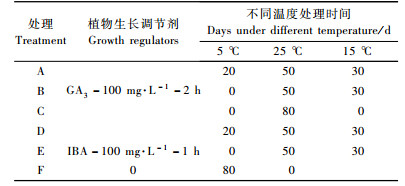
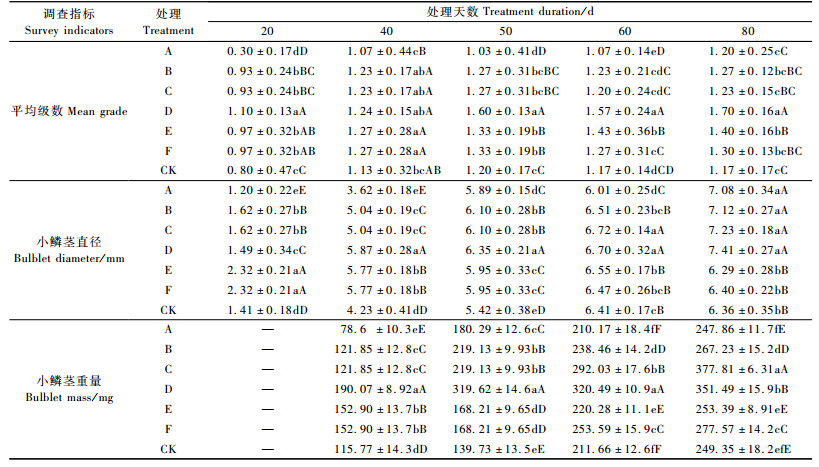
根据筛选出的最适植物生长调节剂处理,设置不同温度和包埋时间6个处理(表 2),对照同上。每处理150枚鳞片,3次重复,均从25 ℃培养开始的第20,40,50,60,80天取样调查。
|
|
取1.2.2中的母鳞片和小鳞茎进行淀粉、总可溶性糖含量测定。从25 ℃培养开始的第20,40,50,60,80天取样调查,每次取鳞片20枚。小鳞茎从25 ℃培养的第40天开始取样。取样后迅速置于液氮中速冻,于-80 ℃超低温冰箱中保存。母鳞片分为鳞片上部、中部和基部分别测定。淀粉采用碘比色法(门福义等,1995)测定; 总可溶性糖采用蒽酮法(李合生,2000)测定。
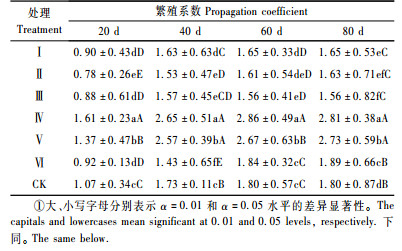
2 结果与分析 2.1 不同植物生长调节剂处理对鳞片繁殖的影响 2.1.1 不同植物生长调节剂对小鳞茎数量的影响较高浓度的IBA导致小鳞茎的诱导率降低,在80天的培养期内显著低于其他各处理,室温培养40天后,除处理Ⅵ(IBA-200 mg·L-1-1 h)之外,其余各处理及CK的小鳞茎发生率均达98%以上。
从表 3可知:处理初期(20~40天),除处理Ⅵ (IBA-200 mg·L-1-1 h)的繁殖系数显著低于其他处理以及CK外,其余2个IBA处理(Ⅳ,Ⅴ)的繁殖系数显著高于GA3处理及CK。到培养中后期(60~80天)时,IBA处理的繁殖系数依次显著高于CK和GA3处理。其中处理Ⅳ(IBA-80 mg·L-1-1 h)最高,培养至80天时,繁殖系数达2.81。由此可见,在本试验条件下,低浓度的IBA处理显著促进小鳞茎的形成。
|
|
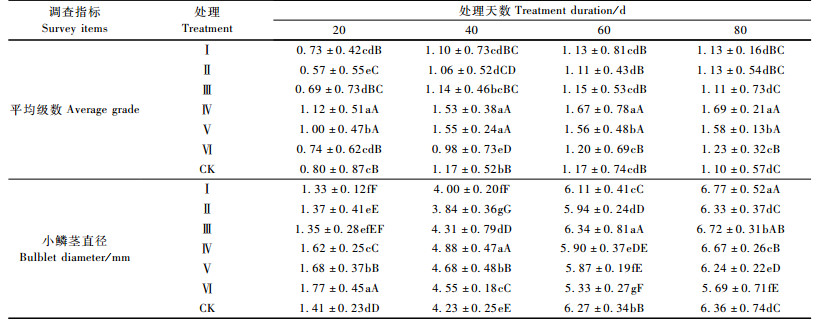
平均级数表明了鳞片形成小鳞茎的整齐度。表 4可见:处理初期,处理Ⅵ(IBA-200 mg·L-1-1h)的鳞茎发生率较低,整齐度较差; 培养60天以后,IBA各处理的平均级数显著高于GA3处理和CK,其中处理Ⅳ(IBA-80 mg·L-1-1 h)最高,说明低浓度IBA处理与GA3处理以及CK相比,不仅促进了小鳞茎数量的增加,也提高了鳞片形成小鳞茎的整齐度。
|
|
从表 4可以看出:培养初期(20,40天),IBA处理的小鳞茎直径显著高于GA3处理和CK; 60天以后GA3处理的小鳞茎直径显著高于IBA处理,至培养80天,处理Ⅰ(GA3-80 mg·L-1-2 h)的小鳞茎显著大于CK和其他各处理的小鳞茎。由此可知: IBA处理可在相对较短的时间内促使小鳞茎膨大,但随着培养时间的增加,GA3更有利于形成个体较大的鳞茎。因此,随着鳞片着生小鳞茎个数的增多,小鳞茎数量与小鳞茎直径成反比,生产中应注意数量与质量的平衡。
2.2 不同温度处理对鳞片扦插繁殖的影响 2.2.1 不同温度处理对小鳞茎数量的影响培养20天时,处理E,F小鳞茎发生率达93%,极显著高于其他处理; 40天发生率保持不变,且在0.01水平与其他处理无显著差异,仅在0.05水平与A,D和CK有显著差异。说明IBA结合不同温度处理均能快速诱导小鳞茎的发生,随着培养时间延长,各处理的鳞茎发生率均可达到100%。
从不同处理的繁殖系数可知:整个培养期内除处理A的繁殖系数显著低于CK外,其余各处理均高于CK,处理D繁殖系数最高,表明5 ℃预处理提高IBA处理的繁殖系数,但抑制了GA3处理鳞片小鳞茎的形成。培养后期(60~80天),GA3处理B与处理C的繁殖系数无显著差异,而IBA处理的繁殖系数为处理E显著高于处理F(表 5)。由此可见: 25 ℃与15 ℃变温处理比25 ℃恒温处理更有利于提高小鳞茎的数量。
|
|
培养初期,GA3处理由于鳞茎发生率较低,整齐度较差,平均级数较低(表 6); 培养50天后,IBA处理的平均级数显著高于GA3处理和CK,其中处理D最高,极显著高于其余各处理,说明IBA结合低温预处理不仅促进小鳞茎数量的增加,也提高鳞片形成小鳞茎的整齐度。
|
|
培养初期(20~40天),除处理A外,其余各处理小鳞茎直径均高于CK,可见低温处理抑制GA3处理培养前期小鳞茎的膨大。培养至40天时,IBA处理小鳞茎直径显著高于GA3各处理,而培养50天以后,GA3处理的小鳞茎直径显著增大,至培养80天时,处理D小鳞茎直径最大,与GA3各处理相近。由此可见: 5 ℃预处理提高了IBA处理小鳞茎的直径,但抑制GA3处理培养前期小鳞茎的膨大; 变温处理的小鳞茎直径与恒温处理的小鳞茎直径无显著差异。
整个培养期内除处理A外,其余各处理小鳞茎重量均大于CK (表 6)。培养前期至40天时,IBA处理小鳞茎重量极显著高于GA3处理,其中处理D小鳞茎重量最大,极显著高于其余各处理。培养50天后,GA3处理的小鳞茎重量显著增大,至80天时,处理C小鳞茎重量最大,极显著高于其他各处理,其次为处理D。由此可见: IBA处理较早启动小鳞茎内干物质的积累,但后期变温处理使小鳞茎增重减慢,随培养时间延长至80天时,GA3恒温处理小鳞茎最重; 同时5 ℃低温处理促进了IBA处理小鳞茎增重。
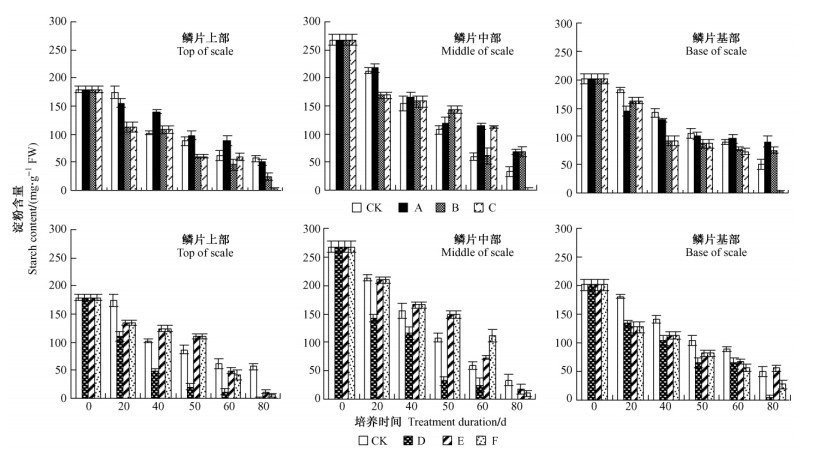
2.3 不同温度处理鳞片扦插繁殖过程中淀粉含量的变化百合鳞片扦插繁殖过程中,各处理母鳞片不同部位淀粉含量总体呈下降趋势,以鳞片中部下降幅度最大(图 1)。培养中后期60~80天,各处理鳞片上部含量相对于鳞片中部和下部而言均较低,说明鳞片繁殖过程存在碳水化合物由上至下转移并利用的现象。GA3处理鳞片基部的淀粉含量以处理C (GA3-25 ℃ 80天)下降幅度最大,该处理小鳞茎重量最大,说明小鳞茎的发育膨大需要分解淀粉提供营养和能量。处理A淀粉含量下降比较缓慢,由此可见: GA3结合5 ℃低温预处理延缓了鳞片中淀粉的降解,致使该处理繁殖系数和小鳞茎个体较小。
|
图 1 鳞片扦插繁殖过程中母鳞片各部位淀粉含量的变化 Figure 1 Change of starch content in different parts of mother scale during scale cutting propagation |
鳞片培养过程中,IBA处理D鳞片各部位的淀粉含量显著低于CK和其他处理,由此可见: IBA结合5 ℃低温预处理之所以获得最大繁殖系数和小鳞茎个体,是由于该处理母鳞片淀粉降解进程更早、更充分的缘故。
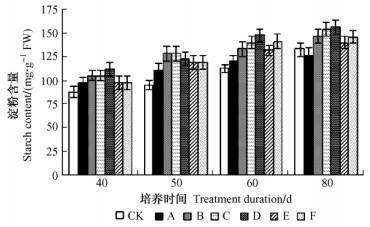
随培养时间延长各处理小鳞茎的淀粉含量逐渐升高(图 2)。培养至80天时,IBA处理的E和F由于小鳞茎直径和重量较小,淀粉含量低于GA3处理的B和C。处理D小鳞茎淀粉含量最高,可见IBA结合低温预处理促进小鳞茎中淀粉的积累,使其膨大发育。GA3处理对于低温的反应不同,经低温预处理而获得的小鳞茎淀粉含量最低,因此其质量最小。
|
图 2 鳞片扦插繁殖过程小鳞茎淀粉含量的变化 Figure 2 Change of starch content in bulblet during scale cutting propagation |
整个培养期内,母鳞片不同部位总可溶性糖含量呈下降趋势(图 3),尤其在培养初期的20天内,各处理鳞片基部与上部的总糖含量显著降低,小鳞茎的生长消耗了母鳞片内大量的糖类物质,即便淀粉大量降解,总糖含量并未增加。GA3处理较IBA处理鳞片各部位可溶性糖下降较为缓慢,其中处理A鳞片各部位的总可溶性糖含量显著高于CK及其他处理,且该处理淀粉下降也较为缓慢,由此可见: GA3结合5 ℃低温预处理抑制小鳞茎对可溶性糖的吸收,使其在母鳞片中大量积累,阻碍小鳞茎的生长发育,导致其繁殖系数和个体较小。
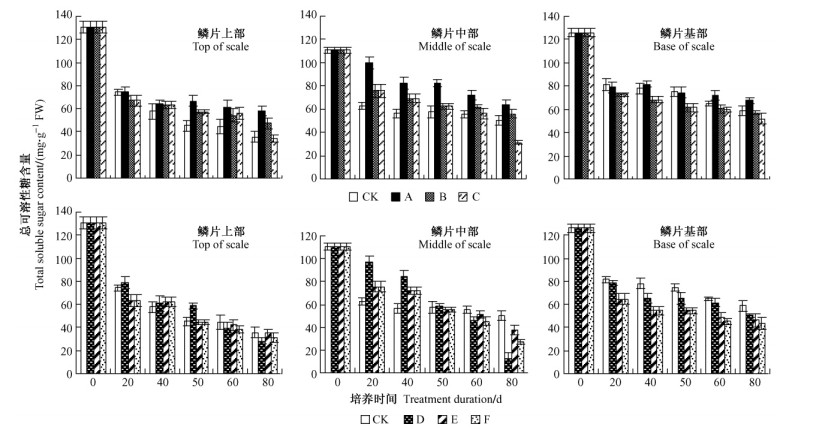
|
图 3 鳞片扦插繁殖过程中母鳞片各部位总可溶性糖含量的变化 Figure 3 Change of total soluble sugar content in different parts of mother scale during scale cutting propag |
IBA处理鳞片上部和中部总可溶性糖下降幅度较大,其中处理D鳞片下降幅度最大,且该处理繁殖系数最高,所获得小鳞茎个体最大,淀粉含量最低,说明小鳞茎个体的膨大发育需要大量消耗母鳞片中可溶性糖,5 ℃低温预处理促进母鳞片淀粉充分降解为可溶性糖,为小鳞茎生长发育提供给能量。
小鳞茎中总可溶性糖含量随培养时间延长呈上升趋势(图 4),60天之后变化幅度不大,GA3各处理在培养前期总可溶性糖含量增长较快,IBA处理则缓慢上升。GA3处理B总可溶性糖含量在60天后略有下降,因此推测当小鳞茎发育膨大到一定程度之后,体内的还原糖合成淀粉,总可溶性糖不再升高。
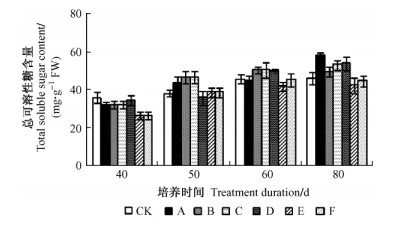
|
图 4 鳞片扦插繁殖过程小鳞茎总可溶性糖含量变化 Figure 4 Change of total soluble content in bulblet during scale cutting propagation |
本试验前期研究表明:GA3处理有利于获得个体较大、形状周正的健壮鳞茎,IBA则促进了小鳞茎数量的增加,明确了IBA和GA3在100~200 mg·L-1浓度范围内的使用效应(孙红梅等,2008)。本研究在此基础上缩短了植物生长调节剂处理鳞片的时间,并增加了80 mg·L-1的处理浓度,结果表明:植物生长调节剂种类对形成小鳞茎的影响效力较大,低浓度IBA处理(IBA-80 mg·L-1-1 h)促进小鳞茎数量的增加,提高小鳞茎形成的整齐度,IBA处理可在相对较短时间内促使小鳞茎膨大,但随着培养时间的增加,GA3更有利于形成个体较大的鳞茎,培养至80天时,80 mg·L-1的GA3浸泡鳞片2 h处理所形成的小鳞茎直径显著高于其他处理。由此可见:激素处理浓度和处理时间共同影响了鳞片繁殖的效果。罗凤霞等(2000)用IBA浸泡亚洲杂种百合的5个品种鳞片4 h进行扦插繁殖研究也发现,IBA处理显著提高鳞片的生籽球数。因此,生产中应根据不同培养目标选择适宜的IBA或GA3浓度。另外,进一步降低以上2种植物生长调节剂的使用浓度或缩短处理时间,是否可以获得更佳处理效果有待进一步系统研究。
3.2 不同温度处理对鳞片繁殖的影响温度影响植物生理活动的强度及植物内部的物质转化与输导,是影响百合鳞片繁殖的重要因素。经过低温处理的百合鳞茎内物质代谢较为活跃(罗丽兰等,2007; Xu et al., 2006; De Hertogh,2004; Sun et al., 2007)。鳞片扦插前,对种球进行2~5 ℃的低温处理可显著提高繁殖系数和成球率(吴学尉等,2003)。黄作喜等(2001)研究发现亚洲百合‘Toro’和东方百合‘Siberia’种球经2~4 ℃低温培养1个月后,鳞片扦插的结球率均略有提高。但低温时间不易过长,超过30天这种促进作用会消失,鳞茎膨大速度减慢,并且表现出明显的抑制作用(李益锋等,2006)。本试验中相同IBA浓度与处理时间条件下,经5 ℃低温预处理的鳞片繁殖系数显著提高,低温培养促进小鳞茎的诱导发生,加速了母鳞片营养物质的分解转化,这与前人在低温培养试管鳞茎繁殖中的研究结果一致(Merel et al., 2003)。有研究者认为25 ℃有利于小鳞茎增殖(Qrunfleh,1997; 赵宇等,2007; 杨利平等,2001),本试验中GA3处理25 ℃恒温培养可获得鲜质量较大的小鳞茎。不同温度处理对鳞片繁殖影响的差异是否由于鳞片内源激素的变化所引起,还有待于进一步探究。
3.3 关于植物生长调节剂与温度的协同作用在小鳞茎发育过程中,新的结构不断形成,需要母鳞片淀粉降解为其提供营养和能量,本试验分别采用变温和恒温处理,探讨温度对鳞片繁殖的影响以及与植物生长调节剂的协同效应,结果表明: IBA和GA3对低温的反应不同: IBA处理的鳞片先经5 ℃低温培养20天,在鳞片扦插过程中促进小鳞茎数量增加并且所得小鳞茎个体较大; 但GA3处理经同样的低温预处理所得的小鳞茎个体较小,数量也较其他处理少; GA3处理后采用25 ℃恒温培养,经60天可获得直径和重量都较大的小鳞茎。研究证明:百合鳞茎在低温作用下,鳞茎中发生着复杂的生理生化变化。陈爱葵等(2005)分别以东方百合‘Stargazer’、亚洲百合‘Nove Cento’和麝香百合(Lilium formolongii)鳞片为试材研究发现,4 ℃低温冷库取出的鳞片扦插控温成球过程中,母鳞片淀粉及总糖含量在25 ℃处理阶段呈明显下降趋势,该阶段是小鳞茎形成和发育时期,大量的淀粉、总糖、还原糖、蛋白质参与了小鳞茎的形态构建活动。本试验碳水化合物检测结果表明:5 ℃低温预处理与IBA处理相结合,母鳞片的淀粉和总可溶性糖含量下降最为迅速,低温促进IBA处理鳞片中淀粉尽早尽快降解和可溶性糖的利用,为小鳞茎的生长发育提供营养源和碳源,促进小鳞茎的形态建成,是其产生小鳞茎数量最多的原因; GA3处理与5 ℃低温预处理相结合,母鳞片淀粉和总可溶性糖含量下降与对照和其他处理相比都较为缓慢,低温延缓GA3处理母鳞片中淀粉的降解,抑制小鳞茎对可溶性糖的吸收,是该处理繁殖系数低和小鳞茎个体小的原因。因此鳞片扦插繁殖过程中应选择适当的植物生长调节剂再配合低温或者恒温处理以获得数量较多或个体较大的小鳞茎。鳞片扦插繁殖过程中,低温对IBA和GA3处理鳞片内淀粉降解影响不同的生理机制还需从分子生物学角度深入研究。
陈爱葵, 江如兰, 周厚高. 2005. 百合扦插鳞片控温成球过程中4种物质含量的动态变化[J]. 武汉植物学研究, 23(4): 351-354. |
黄作喜, 王祥宁, 李克, 等. 2001. 百合鳞片扦插繁殖措施研究[J]. 天津农业科学, 7(4): 34-36. |
李合生. 2000. 植物生理生化试验原理和技术[M]. 北京: 高等教育出版社: 169-172.
|
李益锋, 肖君泽, 黄益鸿. 2006. 低温冷藏与NAA对龙牙百合鳞片繁殖的影响[J]. 作物研究, 20(1): 75-79. |
罗凤霞, 徐贵华, 金丽丽, 等. 2000. 亚洲杂种百合鳞片扦插繁殖研究[J]. 辽宁农业科学, (3): 10-12. |
罗丽兰, 石雷, 张金政. 2007. 低温对解除百合鳞茎休眠和促进开花的作用[J]. 园艺学报, 34(2): 517-524. |
门福义, 刘梦芸. 1995. 马铃薯栽培生理[M]. 北京: 中国农业出版社: 318-320.
|
钱树林, 何秀丽, 义鸣放. 2007. 唐菖蒲籽球发育特点及其碳水化合物代谢变化[J]. 中国农业大学学报, 12(2): 34-39. |
孙红梅, 贾子坤, 王春夏. 2008. GA3、IBA以及不同基质对精粹百合鳞片扦插繁殖的影响[J]. 林业科学, 44(12): 62-67. DOI:10.3321/j.issn:1001-7488.2008.12.011 |
孙红梅, 李天来, 李云飞. 2005. 百合鳞茎发育过程中碳水化合物含量及淀粉酶活性变化[J]. 植物研究, 25(1): 59-63. |
王祥宁, 蹇洪英, 汪国鲜, 等. 2008. 百合鳞片籽球抽茎与变温处理的相关效应[J]. 华北农学报, 23(增刊): 51-54. |
吴学尉, 王其刚, 熊丽, 等. 2003. 百合鳞片扦插繁殖研究[J]. 云南农业科技, (增刊): 131-134. |
夏宜平, 杨玉爱, 杨肖娥. 2005. 郁金香更新鳞茎发育的碳同化物积累与内源激素变化研究[J]. 园艺学报, 32(2): 278-283. |
杨利平, 孙晓玉, 卞慧媛, 等. 2001. 细叶百合无性繁殖条件的选择[J]. 植物研究, 21(3): 398-402. |
苑智华, 何秀丽, 徐哲, 等. 2008. 唐菖蒲球茎形成期蔗糖和淀粉代谢及其相关酶活性[J]. 林业科学, 44(8): 47-51. DOI:10.11707/j.1001-7488.20080808 |
赵宇, 刘庆华, 王奎玲, 等. 2007. 青岛百合鳞片扦插繁殖技术的研究[J]. 山东林业科技, (3): 16-18. |
郑慧俊, 夏宜平, 黄春辉, 等. 2006. 东方百合鳞茎的山地膨大发育与养分积累研究[J]. 浙江大学学报, 32(5): 535-540. |
De Hertogh A. 2004. Holland bulb forcer's guide The International Flower Bulb Centre and the Dutch Bulb Exporters Association, 95-100.
|
Merel M, Langens-Gerrits, William B M, et al. 2003. Effect of low temperature on dormancy breaking and growth after planting in lily bulblets regenerated in vitro[J]. Plant Grow Regulation, 40(3): 267-275. DOI:10.1023/A:1025018728178 |
Pablo A M, Luis F H, Cecilia P P, et al. 2003. Bulblet differentiation after scale propagation of Lilium longiflorum[J]. Journal of the American Society for Horticultural Science, 128(3): 324-329. |
Xu R Y, Yoshiji Niimi, Han D S. 2006. Changes in endogenous abscisic acid and soluble sugars levels during dormancy-release in bulbs of Lilium rubellum[J]. Scientia Horticulturae, 111(1): 68-72. DOI:10.1016/j.scienta.2006.08.004 |
Qrunfleh I M. 1997. Propagation of Easter lily (Lilium longiflorum Thunb.)'White American' by scaly leaves[J]. Amman, 6: 44. |
Shin K S, Chakrabarty D, Paek K Y. 2002. Sprouting rate, change of carbohydrate contents and related enzymes during cold treatment of lily bulblets regenerated in vitro[J]. Scientia Horticulturae, 96(1/4): 195-204. |
Sun H M, Jaime A T S, Li Y F, et al. 2007. Effects of low temperature on dormancy release in lily bulbs[J]. Floriculture and Ornamental Biotechnology, 1: 41-46. |
 2011, Vol. 47
2011, Vol. 47