文章信息
- 苏建荣, 刘万德, 张炜银, 罗建, 张志均, 郎学东, 李帅锋
- Su Jianrong, Liu Wande, Zhang Weiyin, Luo Jian, Zhang Zhijun, Lang Xuedong, Li Shuaifeng
- 西藏色季拉山西坡种子植物多样性垂直分布
- Species Diversity of Plant Communities along an Altitudinal Gradient on the West Slope of Sejila Mountains, Tibet
- 林业科学, 2011, 47(3): 12-19.
- Scientia Silvae Sinicae, 2011, 47(3): 12-19.
-
文章历史
- 收稿日期:2010-08-16
- 修回日期:2011-01-18
-
作者相关文章
2. 中国林业科学研究院森林生态环境与保护研究所 北京 100091;
3. 西藏农牧学院资源与环境系 林芝 860100
2. Institute of Forest Ecology, Environment and Protection, the Chinese Academy of Forestry Beijing 100091;
3. Department of Natural Resources and Environment, Tibet Agriculture and Animal Husbandry College Linzhi 860100
物种多样性的海拔梯度格局及其影响因子是物种多样性保护的基本问题,一直备受生态学家关注(Aiba et al., 1999)。国内外学者对物种多样性的海拔梯度格局进行了大量研究(Rahbek,1995; Kessler,2000; 沈泽昊等,2001; Bachman et al., 2004; 唐志尧等,2004; 赵淑清等,2004; Brehm et al., 2007; Naniwadekar et al., 2007),结果表明,不同研究区、不同山体、不同海拔范围物种多样性的海拔梯度格局变化较大,驱动因子也不尽相同(Sanders et al., 2003; Rahbek,2005)。常见的物种多样性海拔梯度格局有:1)物种多样性随海拔的升高而降低(Rahbek,2005); 2)物种多样性随海拔的升高而升高(Sanders et al., 2003); 3)单峰曲线(Whittaker,1960); 4)没有明显的相关性(Zhao et al., 2005)。研究各个地域的物种丰富度海拔梯度格局是探索全球物种丰富度海拔梯度分布规律的重要手段。
色季拉山属东喜马拉雅北翼山地森林及高山生态系统的典型代表地区,发育了完整的原始山地垂直生态系统,孕育了丰富的野生动植物资源。较轻的人为干扰使得该地区森林生态系统基本保持原始状态。独特的地理、气候及植被条件使色季拉山成为山地植物多样性垂直分布格局研究的理想场所。到目前为止,有关色季拉山的研究主要集中于色季拉山区土壤性状(方江平,1997)、森林植被类型(徐凤翔,1992)及其分布、植被类型的性质以及植物区系(柴勇等,2004; 罗建等,2006)、植物种质资源评价(鲍隆友等,2003)、急尖长苞冷杉(Abies georgei var.smithii)林的种群结构与动态(任青山等,2007)、森林生态系统的养分循环(钟国辉等,2004)等,而关于色季拉山物种多样性垂直分布的研究未见报道。本研究对色季拉山西坡不同海拔范围做群落调查,探讨色季拉山西坡物种多样性的垂直分布规律,并通过环境因子解释其成因。本研究可为物种多样性的海拔梯度格局研究积累基础资料。
1 研究区概况色季拉山位于藏东南林区腹心地带(94°25′— 94°45′E,29°35′—29°57′N),南北长约41 km,东西宽约32 km。山脉走向西北至东南。该区22年平均气温8.5 ℃,7月平均气温15.5 ℃,1月平均气温0.2 ℃,极端最高气温30.2 ℃,极端最低气温-15.3 ℃。年降雨量由西南、西、东和东南逐渐增加,分别为500,600~800,800~1 000和1 000~1 200 mm,平均相对湿度63%,年平均风速1.7 m·s-1,最大风速20 m·s-1,年日照2 022.2 h,日照率为46%。色季拉山垂直气候带明显,森林分布线4 300~4 500 m以上为高山(高原)寒带,3 000~4 300 m处为亚高山(高原)寒温半湿润区,西坡海拔2 800~3 000 m处河谷为山地温带半干旱半湿润区,东坡海拔2 500~3 000 m处及西坡3 000 m以下的湿润支沟为山地温带半湿润区,在东坡海拔2 100~2 500 m处沟谷属于山地暖温带半湿润区。土壤垂直带随气候带变化也极为明显:海拔4 000 m以上主要为高山荒漠土,缓坡和积水洼地有高山草甸土分布; 海拔3 300~4 000 m处为酸性棕壤; 海拔2 500~3 300 m处为山地棕壤。
2 研究方法在色季拉山西坡,以海拔3 000 m为起点、4 800 m为终点,沿海拔梯度每间隔100 m设置3块20 m×20 m样地,共计57块样地。在每块样地中利用网格样方法将其分割成4个10 m×10 m的小样地,在小样地内对树高> 1.3 m的所有乔木和灌木进行每木检尺,乔木记录内容包括物种名称、树高、胸径,灌木记录内容包括物种名称、树高、胸径及盖度。草本则在小样地内记录所有物种,同时估测每个物种的相对多度、平均高度及盖度。在群落调查的同时,记录样地所在的生境条件,如海拔、郁闭度、坡向、坡位、坡度、经纬度及群落名称等。
以样地为单位分别计算物种的重要值,利用TWINSPAN进行群落分类; 以样地为单位统计每种植物的个体多度,建立样地-物种矩阵,同时选取海拔、郁闭度、坡向、坡位及坡度为环境因子,建立样地-环境因子矩阵,应用除趋势对应分析(detrended correspondence analysis,DCA)法排序各群落的相对多度在不同生境中的分布和相关性,分析它们与环境因子之间的关系。
选择物种丰富度、Shannon-Wiener指数(H′)、Simpson指数(D)及β多样性指数(β)作为多样性指标:

|
式中:s为样地中的物种数目,pi为物种i的重要值,a和b分别为2个小样地各自的物种数,c为2个小样地的共有物种数。
选择立木株数、胸高断面积、最大树高及最大胸径作为群落生长特征指标,统计各项指标随海拔梯度的变化。
做环境因子之间及其与物种丰富度之间的相关性分析,将与物种丰富度具有相关性的环境因子与物种丰富度进行回归分析。
群落的分类与排序利用PC-ORD5.0软件进行分析,Shannon-Wiener指数及Simpson指数则利用EstimateS800软件进行计算,群落的相关性分析及回归分析则在SPSS13.0中运行。文中所有数据的统计分析均在SPSS13.0中进行,显著性水平为P < 0.05。
3 结果与分析 3.1 物种组成在2.28 hm2样地中,共调查到植物288种,分属58科163属,其中乔木19种分属9科14属,灌木61种分属18科32属,草本206种分属46科125属,藤本1种为毛茛科(Ranunculaceae)铁线莲属(Clematis)绣球藤(Clematis montana),竹类1种为禾本科(Gramineae)箭竹属(Fargesia)西藏箭竹(Fargesia setosa)。乔木优势种包括急尖长苞冷杉、林芝云杉(Picea likiangensis var. linzhiensis)、绣毛西南花楸(Sorbus rehderiana var. cupreonitens)、西藏红杉(Larix griffithiana)和川滇高山栎(Quercus aquifolioides); 灌木优势种为紫斑杜鹃(Rhododendron strigillosum var. monosematum)、杯萼忍冬(Lonicera inconspicua)、冰川茶藨子(Ribes glaciale)、海绵杜鹃(Rhododendron pingianum)和柳叶忍冬(Lonicera lanceolata); 草本优势种为长尖莎草(Cyperus cuspidatus)、西南草莓(Fragaria moupinensis)、高山露珠草(Circaea alpina)、五裂蟹甲草(Parasenecio quinquelobus)和双花堇菜(Viola biflora)。物种数最多的前10个科分别为菊科(Compositae)、蔷薇科(Rosaceae)、杜鹃花科(Ericaceae)、蓼科(Polygonaceae)、毛茛科、虎耳草科(Saxifragaceae)、伞形科(Umbelliferae)、百合科(Liliaceae)、报春花科(Primulaceae)和忍冬科(Caprifoliaceae),各科物种数分别为43,24,14,14,14,13,11,10,9和9;包含物种数最多的前10个属分别为杜鹃属(Rhododendron)、蓼属(Polygonum)、报春花属(Primula)、忍冬属(Lonicera)、蒿属(Artemisia)、柳属(Salix)、铁线莲属、委陵菜属(Potentilla)、党参属(Codonopsis)和堇菜属(Viola),各属物种数分别为11,11,7,7,6,5,5,5,4和4;包含属数最多的前10个科分别为菊科、虎耳草科、蔷薇科、百合科、毛茛科、伞形科、豆科(Leguminosae)、唇形科(Labiatae)、兰科(Orchidaceae)和蓼科,各科属数分别为20,11,11,8,8,7,6,5,5和4。
3.2 植被TWINSPAN分类结果与排序色季拉山西坡植被TWINSPAN分类结果表明所调查样地共划分为Ⅰ,Ⅱ,Ⅲ和Ⅳ4组。
Ⅰ组:包括9个样地(样地1~9),植被属针叶林,主要分布在海拔3 000~3 200 m,平均坡度23°,坡向东、西均有,主要分布于山体的下方。林分平均郁闭度为83.9%。以急尖长苞冷杉和西藏红杉为优势种。林缘及林下主要阔叶树种有绣毛西南花楸和白桦(Betula platyphylla)等,林下灌木有紫斑杜鹃和杯萼忍冬等,草本则以长尖莎草和固沙草(Orinus thoroldii)等为主。
Ⅱ组:包括30个样地(样地10~39),植被属暗针叶林,主要分布在海拔3 300~4 200 m处,平均坡度30.8°,坡向东、西均有,主要分布于山体的中间及中上部。林分平均郁闭度为85%。以林芝云杉和高山松(Pinus densata)为优势种。林缘及林下主要阔叶树种有绣毛西南花楸和糙皮桦(Betula utilis)等,林下灌木有紫斑杜鹃和杯萼忍冬等,草本则以高山露珠草和五裂蟹甲草等为主。
Ⅲ组:包括6个样地(样地40~45),植被属疏林及灌丛,主要分布在海拔4 300~4 400 m处,平均坡度22.5°,坡向主要为西坡,主要分布于山体的中上部。以灌木为主,灌木平均盖度为79.1%。主要灌木包括紫斑杜鹃、海绵杜鹃、林芝杜鹃(Rhododendron nyingchiense)、雪层杜鹃(Rhododendron nivale)和高山绣线菊(Spiraea alpina)等,草本则以长尖莎草和双花堇菜(Viola biflora)等为主。
Ⅳ组:包括12个样地(样地46~57),植被属高山草甸,主要分布在海拔4 500~4 800 m处,平均坡度30°,坡向主要为西坡,主要分布于山体的上部。以草本为主,草本平均盖度为69.6%。主要草本包括丛生荽叶委陵菜(Potentilla coriandrifolia var. dumosa)、矮棱子芹(Pleurospermum nanum)和展毛银莲花(Anemone demissa)等,灌木有雪层杜鹃和高山绣线菊等。
DCA前2轴累积贡献率达到86.97%。一般情况下,累积贡献率在70%以上,事物的基本面貌就可以得到反映。因此,以DCA的前2轴为坐标轴做群落排序值的散点图(图 1A),利用TWINSPAN分类结果划分排序空间,可以看出,在DCA中4个组的界限均较明显,各有自己的分布中心和范围。DCA排序图较好地反映了各组在排序空间的分布关系。
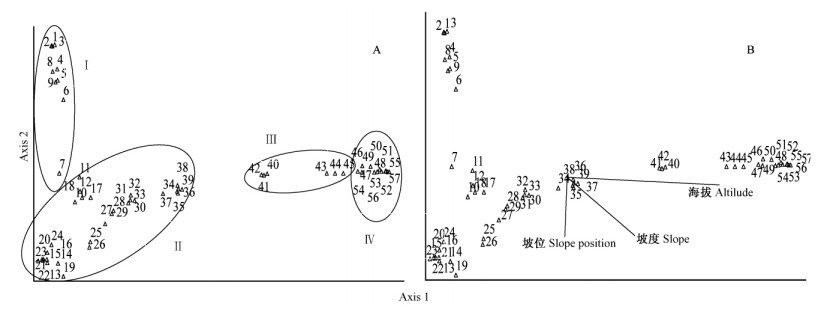
|
图 1 色季拉山西坡植被DCA排序(A)及植物群落与环境因子的关系(B) Figure 1 DCA ordination graph(A) and the relationships between plant and environments(B) on the west slope of Sejila Mountains |
DCA排序图也较好地反映了植物群落与环境因子之间的相互关系(图 1B) :DCA第1轴贡献率达到了49.19%,主要反映了海拔梯度,即热量及水分梯度。样地40~57与海拔呈正相关,样地1~39则恰恰相反,与海拔呈负相关。DCA第2轴贡献率达到了37.78%,主要反映了坡度梯度。
3.3 物种多样性随海拔梯度的变化在色季拉山西坡,植物科数、属数和种数的垂直梯度格局相似(图 2A):科数、属数和种数均在海拔3 500 m处最高,海拔4 200 m处最低,海拔4 300 m处出现次峰值,海拔4 400 m以后随海拔升高而降低。

|
图 2 物种丰富度垂直梯度 Figure 2 The altitudinal gradient of plant richness of species, genus and family |
不同生长型物种丰富度随海拔的变化格局略有不同(图 2B) :乔木物种丰富度呈现单峰曲线,在海拔3 300 m处达到峰值,海拔4 500 m以后没有乔木物种出现; 灌木和草本物种丰富度均为双峰曲线,灌木2个峰值分别出现在海拔3 300和4 300 m处,而草本最高值出现在海拔3 500 m处,海拔4 300,4 500和4 600 m处也均较高。
由图 3可见:Shannon-Wiener多样性指数的高峰值出现在海拔3 300 m处,而在海拔3 500和4 300 m处出现次峰值,低值出现在海拔3 000,3 700及4 800 m; Simpson多样性指数的最高值出现在海拔3 300 m处,次峰值则出现在海拔3 500 m处,最低值出现在海拔3 700 m; β多样性指数在海拔低于3 600 m处较高,在海拔3 600~4 100 m处较低,在海拔4 200~4 300 m处出现次高峰,随后降低。
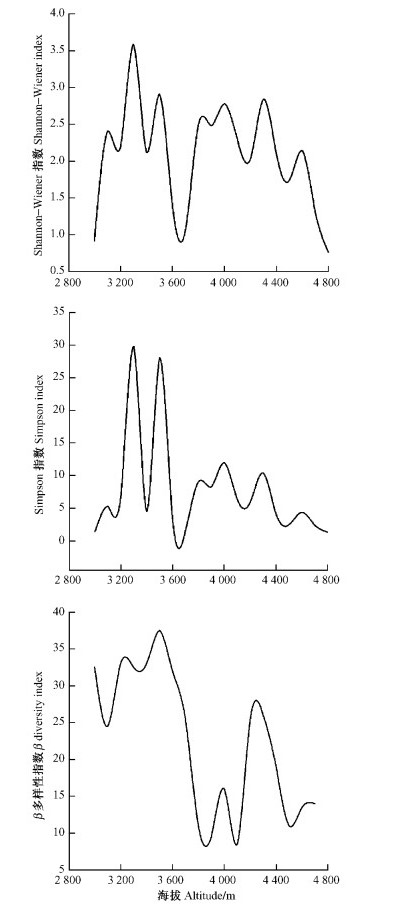
|
图 3 物种多样性垂直梯度 Figure 3 Altitudinal gradient of species diversity |
种数/属数、种数/科数和属数/科数的比值是对植物区系分化强度的反应:其值低则区系的古老和残遗性强; 其值高则区系的物种分化强烈。由图 4可见:种数/属数与属数/科数2个指数分别于海拔3 300和4 600 m处出现明显峰值,在海拔4 300 m处出现次峰值,在海拔3 800 m处最低; 种数/科数指数则在海拔4 500 m处最高,海拔3 400,4 700和4 300 m处较高,海拔3 000 m处最低,整体曲线呈现出随海拔升高增大的趋势。
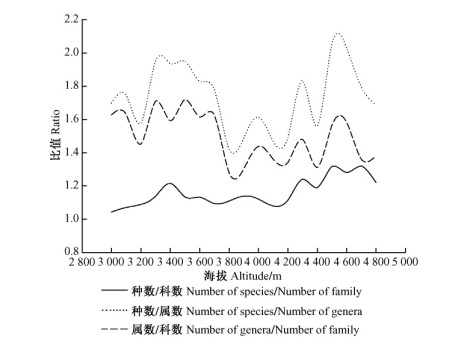
|
图 4 植物区系分化度的垂直梯度 Figure 4 Altitudinal gradient of flora differentiation |
群落的生长特征代表群落的生产潜力。由图 5可见:色季拉山西坡立木株数随海拔升高而降低,海拔3 000 m处最高,海拔4 500 m以后则没有乔木物种出现; 胸高断面积则在海拔3 900 m处达到最高值,海拔3 200 m处最低; 最大树高则在海拔3 600 m处最大,海拔3 200 m处最低; 最大胸径出现在海拔3 900 m处,海拔3 400 m处最低。
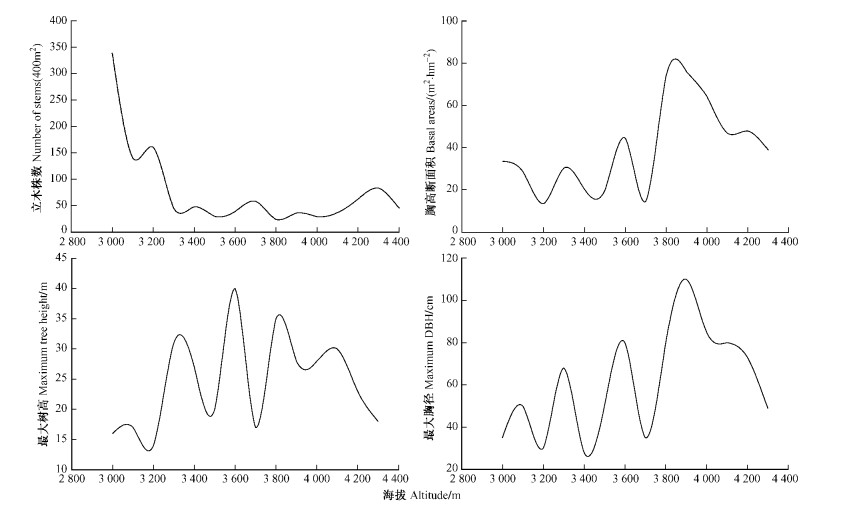
|
图 5 立木株数、胸高断面积、最大树高和最大胸径的垂直梯度 Figure 5 Altitudinal gradient of number of stems, basal area, maximum tree height and maximum DBH |
由表 1可见:物种丰富度与海拔、坡向存在显著的相关性(P < 0.01),而与郁闭度、坡度及坡位无显著相关性(P > 0.05);海拔与坡向、坡位存在显著相关性(P < 0.01);坡度和坡位存在显著正相关性(P < 0.05),郁闭度与海拔、坡位显著负相关(P < 0.01)。
|
|
表 2表明:物种丰富度与海拔之间存在曲线回归关系,其回归方程为y=4 069+23.544 7 x-1.198 7x2+0.010 3x3 (R=0.430 4,P=0.012);物种丰富度与坡向之间也存在曲线回归关系,其回归方程为y=10.272 2+18.238 9x (R=0.600 7,P < 0.000 1)。
物种丰富度与环境因子之间的逐步回归分析显示,模型中存在海拔(A)和坡向(S) 2个环境因子,模型为Y=35.53+15.623S-0.006A (R=0.645,P < 0.000 1)。
|
|
海拔作为影响物种丰富度格局的主要环境因子已经被众多的生态学家和生物地理学家所关注(Bhattarai et al., 2004; Kluge et al., 2006; Naniwadekar et al., 2007)。探索物种丰富度格局随着海拔梯度的变化一直都是生态学的中心内容(Pimm et al., 2004)。Stevens(1992)认为,物种丰富度随海拔的升高逐渐降低,Kessler(2002)对厄瓜多尔维管植物的研究也得到了相同的结论,这一结论也得到了其他众多科学家的支持(Vázquez et al., 1998; Odland et al., 1999; Grytnes,2003; Fosaa,2004)。但Naniwadekar等(2007)则认为,物种丰富度随海拔的升高而升高。对坦桑尼亚东部大陆森林乔木的调查结果表明,20个乔木样地中物种数量随海拔的变化保持恒定(Lovett et al., 2006)。Lovettt (1999)对坦桑尼亚乔木物种多样性与海拔之间关系的研究中也没有发现乔木物种多样性随海拔的明显变化趋势。但近年来,单峰曲线在物种丰富度沿海拔梯度变化中出现的几率较高。Grytnes等(2002)在对尼泊尔喜马拉雅山脉物种丰富度随海拔变化的研究中发现,物种丰富度高值出现在海拔1 500~2 500 m处,而在低海拔及高海拔均较低。在墨西哥内华达山脉2 800~4 100 m海拔范围内,物种丰富度最高值出现在2 950~3 200 m,为明显的单峰曲线(Sánchez-González et al., 2005)。哥斯达黎加老龄林中维管附生植物物种丰富度海拔梯度格局也表现出明显的单峰曲线,物种丰富度的峰值出现在海拔1 000 m处(研究范围为海拔30~3 000 m) (Cardelús et al., 2006)。马来西亚的基纳巴卢山维管植物物种丰富度海拔梯度格局也表现出明显的单峰曲线(最高值出现在海拔900~1 200 m) (Grytnes et al., 2006)。Zhao等(2005)对中国神农架海拔470~3 080 m处物种丰富度的研究表明,物种丰富度最高值出现在海拔1 200 m处,也为明显的单峰曲线。本研究中乔木物种丰富度也表现出明显的单峰曲线,这与以往多数研究结论相同。
物种丰富度在海拔梯度上的格局可能与不同学者研究的海拔范围有关。海拔范围不同,研究所包括的植被类型和生境(随海拔变化)也不相同。一般来讲,海拔范围越大,研究所包括的植被类型和不同的生境越多,由此所导致的物种丰富度的变化也将更加多样。如Vázquez等(1998)对墨西哥哈利斯科州物种多样性海拔梯度格局的研究是在海拔1 500~2 500 m范围进行的,海拔跨度为1 000 m,得出的结论是物种丰富度随海拔的升高而降低,而Naniwadekar等(2007)在印度南部的研究范围则是海拔40~1 260 m,海拔跨度为1 220 m,得出的结论是物种丰富度随海拔的升高而升高,Brehm等(2007)在哥斯达黎加研究的海拔范围是40~2 730 m,海拔跨度超过了2 600 m,认为物种丰富度海拔梯度格局为单峰曲线,Cardelús等(2006)以哥斯达黎加海拔30~2 600 m范围的附生维管植物为研究对象,海拔跨度为2 570 m,也得出了物种丰富度海拔梯度格局为单峰曲线的结论。本研究的海拔范围是3 000~4 800 m,海拔跨度达到了1 800 m,乔木物种丰富度也表现出明显的单峰曲线形式。可见,研究区域海拔跨度的大小影响物种丰富度海拔梯度格局。
生境条件影响生态位的多样性,是控制物种丰富度的重要因子(Plotkin et al., 2002)。气温的高低直接影响物种的定植、生长、衰老与死亡。气温过高或过低都不利于物种的定植与生长。全球范围平均海拔每升高100 m,温度降低0.5 ℃,但在色季拉山西坡海拔3 000~4 000 m,平均海拔每升高100 m,温度降低0.9 ℃。较低的温度是高海拔物种丰富度低的主要原因之一(Sánchez-González et al., 2005; Beck et al., 2008)。较低的温度降低了土壤中微生物的活性,减缓了凋落物分解速度,减少了回归土壤的养分数量; 较低的温度降低了水分的传导性,导致养分传递速度降低(Sánchez-González et al., 2005)。土壤中养分条件是生境条件的又一重要组成部分。由于高海拔处凋落物分解速率慢,导致土壤中养分含量低,限制了一些植物的生长。方江平(1997)对色季拉山西坡土壤有机质含量的研究结果表明,该区有机质含量峰值出现在海拔3 500 m左右,而本研究中乔木物种丰富度最高值出现在海拔3 300 m,这可能与土壤中有机质的分布存在某种相关性。物种多样性海拔梯度格局也受水分控制(Zhao et al., 2005)。一般来讲,降水量在中海拔处最大(Kitayama,1992; Nor,2001)。地形特征也是引起物种丰富度沿海拔梯度变化的重要影响因子(Sánchez-González et al., 2005)。生境异质性如坡度、坡向和坡位是不可避免的自然因素。一些生境如山脊、陡坡、岩石区域,由于土壤限制,总是有较低的生物多样性(Zhao et al., 2005)。地形特征的不同会导致土壤水分空间的变化,形成一些局部旱区,如山脊、陡坡及岩石区域等,影响了物种的生存,改变了物种的分布。此外,某些影响了生境条件的人为干扰也被认为是影响物种丰富度海拔梯度格局的因子之一(Zhao et al., 2005)。
本研究中乔木物种丰富度海拔梯度格局呈单峰型,而其他物种多样性指标(如科数、属数、种数、灌木物种丰富度、草本特种丰富度、Shannon-Wiener指数、Simpson指数及β多样性指数)海拔梯度格局为双峰或多峰曲线。物种丰富度海拔梯度格局在不同功能群中各不相同(Grytnes et al., 2006)。Whittaker于1960年便认为不同生长型如乔木、灌木或草本有不同的多样性海拔梯度格局(Whittaker,1960)。
本研究根据TWINSPAN和DCA将色季拉山西坡植被共划分为4个植被带,各个植被带交接处海拔分别为3 200~3 300,4 200~4 300和4 400~4 500 m,而物种多样性的峰值绝大多数也出现在这些海拔段。在各个植被带交接处即群落交错区可能存在2个相邻植被带中物种均能生存的生境,从而导致群落之间的交接处维持高的物种丰富度(McCain,2005)。群落交错区所在海拔范围也是影响物种丰富度垂直梯度格局的重要因子。
鲍隆友, 周杰, 刘玉军. 2003. 西藏色季拉山主要野生药用植物资源评价[J]. 中国野生植物资源, 22(6): 34-38. |
柴勇, 樊国盛, 李乡旺, 等. 2004. 西藏色季拉山种子植物垂直带谱的划分与分布特点研究[J]. 广西植物, 24(2): 107-112. |
方江平. 1997. 西藏色季拉山土壤的形状与垂直分布[J]. 山地研究, 15(4): 228-233. |
罗建, 郑维列, 潘刚, 等. 2006. 色季拉山区高山寒带种子植物区系研究[J]. 武汉植物学研究, 24(3): 215-219. |
任青山, 杨小林, 崔国发, 等. 2007. 西藏色季拉山林线冷杉种群结构与动态[J]. 生态学报, 27(7): 2669-2677. |
沈泽昊, 方精云, 刘增力, 等. 2001. 贡嘎山东坡植被垂直带谱的物种多样性格局分析[J]. 植物生态学报, 25(6): 721-732. |
唐志尧, 方精云. 2004. 植物物种多样性的垂直分布格局[J]. 生物多样性, 12(1): 20-28. |
徐凤翔. 1992. 西藏色季拉山东西坡不同海拔带的生境与森林类型研究[J]. 西藏科技, (1): 21-41. |
赵淑清, 方精云, 宗占江, 等. 2004. 长白山北坡植物群落组成、结构及物种多样性的垂直分布[J]. 生物多样性, 12(1): 164-173. |
钟国辉, 辛学兵. 2004. 西藏色季拉山暗针叶林凋落物层化学性质研究[J]. 应用生态学报, 15(1): 167-169. |
Aiba S I, Kitayama K. 1999. Structure, composition and species diversity in an altitude-substrate matrix of rain forest tree communities on Mount Kinabalu, Borneo[J]. Plant Ecology, 140(2): 139-157. DOI:10.1023/A:1009710618040 |
Bachman S, Baker W J, Brummitt N, et al. 2004. Elevational gradients, area and tropical island diversity: an example from the palms of New Guinea[J]. Ecography, 27(3): 299-310. DOI:10.1111/eco.2004.27.issue-3 |
Beck J, Chey V K. 2008. Explaining the elevational diversity pattern of geometrid moths from Borneo: a test of five hypotheses[J]. Journal of Biogeography, 35(8): 1452-1464. DOI:10.1111/jbi.2008.35.issue-8 |
Bhattarai K R, Vetaas O R, Grytnes J A. 2004. Fern species richness along a central Himalayan elevational gradient, Nepal[J]. Journal of Biogeography, 31(3): 389-400. DOI:10.1046/j.0305-0270.2003.01013.x |
Brehm G, Colwell R K, Kluge J. 2007. The role of environment and middomain effect on moth species richness along a tropical elevational gradient[J]. Global Ecology and Biogeography, 16(2): 205-219. DOI:10.1111/geb.2007.16.issue-2 |
Cardelús C L, Colwell R K, Watkins J E. 2006. Vascular epiphyte distribution patterns: explaining the mid-elevation richness peak[J]. Journal of Ecology, 94(1): 144-156. DOI:10.1111/jec.2006.94.issue-1 |
Fosaa A M. 2004. Biodiversity patterns of vascular plant species in mountain vegetation in the Faroe Islands[J]. Diversity & Distributions, 10(3): 217-223. |
Grytnes J A. 2003. Species richness patterns of vascular plants along seven altitudinal transects in Norway[J]. Ecography, 26(3): 291-300. DOI:10.1034/j.1600-0587.2003.03358.x |
Grytnes J A, Beaman J H. 2006. Elevational species richness patterns for vascular plants on Mount Kinabalu, Borneo[J]. Journal of Biogeography, 33(10): 1838-1849. DOI:10.1111/jbi.2006.33.issue-10 |
Grytnes J A, Vetaas O R. 2002. Species richness and altitude: a comparison between null models and interpolated plant species richness along the Himalayan altitudinal gradient, Nepal[J]. The American Naturalist, 159(3): 294-304. DOI:10.1086/338542 |
Kessler M. 2000. Upslope-directed mass effect in palms along an Andean elevational gradient: a cause for high diversity at midelevations?[J]. Biotropica, 32(4): 756-759. DOI:10.1646/0006-3606(2000)032[0756:UDMEIP]2.0.CO;2 |
Kessler M. 2002. The elevational gradient of Andean plant endemism: varying influences of taxon-specific traits and topography at different taxonomic levels[J]. Journal of Biogeography, 29(9): 1159-1165. DOI:10.1046/j.1365-2699.2002.00773.x |
Kitayama K. 1992. An altitudinal transect study of the vegetation on Mount Kinabalu, Borneo[J]. Plant Ecology, 102(2): 149-171. DOI:10.1007/BF00044731 |
Kluge J, Kessler M, Dunn R R. 2006. What drives elevational patterns of diversity? A test of geometric constraints, climate and species pool effects for pteridophytes on an elevational gradient in Costa Rica[J]. Global Ecology and Biogeography, 15(4): 358-371. DOI:10.1111/geb.2006.15.issue-4 |
Lovett J C. 1999. Tanzanian forest tree plot diversity and elevation[J]. Journal of Tropical Ecology, 15(5): 689-694. DOI:10.1017/S0266467499001108 |
Lovett J C, Marshall A R, Carr J. 2006. Changes in tropical forest vegetation along an altitudinal gradient in the Udzungwa Mountains National Park, Tanzania[J]. African Journal of Ecology, 44(4): 478-490. DOI:10.1111/aje.2006.44.issue-4 |
McCain C M. 2005. Elevational gradients in diversity of small mammals[J]. Ecology, 86(2): 366-372. DOI:10.1890/03-3147 |
Nor S M. 2001. Elevational diversity patterns of small mammals on Mount Kinabalu, Sabah, Malaysia[J]. Global Ecology & Biogeography, 10(1): 41-62. |
Naniwadekar R, Vasudevan K. 2007. Patterns in diversity of anurans along an elevational gradient in the Western Ghats, South India[J]. Journal of Biogeography, 34(5): 842-853. |
Odland A, Birks H J B. 1999. The altitudinal gradient of vascular plant richness in Aurland, Western Norway[J]. Ecography, 22(5): 548-566. DOI:10.1111/eco.1999.22.issue-5 |
Pimm S L, Brown J H. 2004. Domains of diversity[J]. Science, 304(5672): 831-833. DOI:10.1126/science.1095332 |
Plotkin J B, Muller-Landau H. 2002. Sampling the species composition of a landscape[J]. Ecology, 83(12): 3344-3356. DOI:10.1890/0012-9658(2002)083[3344:STSCOA]2.0.CO;2 |
Rahbek C. 1995. The elevational gradient of species richness: a uniform pattern[J]. Ecography, 18(2): 200-205. DOI:10.1111/eco.1995.18.issue-2 |
Rahbek C. 2005. The role of spatial scale and the perception of large-scale species-richness patterns[J]. Ecology Letters, 8(2): 224-239. |
Sánchez-González A, López-Mata L. 2005. Plant species richness and diversity along an altitudinal gradient in the Sierra Nevada, Mexico[J]. Diversity and Distributions, 11(6): 567-575. DOI:10.1111/ddi.2005.11.issue-6 |
Sanders N J, Moss J, Wagner D. 2003. Patterns of ant species richness along elevational gradients in an arid ecosystem[J]. Global Ecology & Biogeography, 12(2): 93-102. |
Stevens G C. 1992. The elevational gradient in altitudinal range: an extension of rapoport ' s latitudinal rule to altitude[J]. American Naturalist, 140(6): 893-911. DOI:10.1086/285447 |
Vázquez G J A, Givnish T J. 1998. Altitudinal gradients in tropical forest composition, structure, and diversity in the Sierra de Manantlán[J]. Journal of Ecology, 86(6): 999-1020. DOI:10.1046/j.1365-2745.1998.00325.x |
Whittaker R H. 1960. Vegetation of the Siskiyou Mountains, Oregon and California[J]. Ecological Monographs, 30(3): 279-338. DOI:10.2307/1943563 |
Zhao C M, Chen W L, Tian Z Q, et al. 2005. Altitudinal pattern of plant species diversity in Shennongjia Mountains, Central China[J]. Journal of Integrative Plant Biology, 47(12): 1431-1449. DOI:10.1111/jipb.2005.47.issue-12 |
 2011, Vol. 47
2011, Vol. 47


